Способ определения агрегационной активности тромбоцитов и устройство для его осуществления
Иллюстрации
Показать всеГруппа изобретений относится к медицине, точнее к диагностическим методам оценки состояния тромбоцитарного звена гемостаза. Предложен способ определения агрегационной активности тромбоцитов, включающий получение обогащенной тромбоцитами плазмы из крови, разбавление плазмы солевой средой не менее чем в 10 раз с последующей регистрацией интенсивности светорассеяния в малых углах в условиях однократного светорассеяния. При этом определяют параметры агрегационной активности тромбоцитов, включая начальную скорость агрегации, определяемую по начальной скорости уменьшения светорассеяния отдельными тромбоцитами и увеличения светорассеяния их димерами после действия агонистов, степень прохождения агрегации, определяемую по величине максимальной амплитуды интенсивности рассеяния, и концентрацию клеток, определяемую по разнице сигналов интенсивности светорассеяния, полученных при фотометрировании кюветы со средой до и после добавления обогащенной тромбоцитами плазмы. Предложено устройство, создающее гидродинамический режим с развитой турбулентностью без образования пузырей воздуха, которое обеспечивает при концентрации тромбоцитов в диапазоне 1·105-5·107 кл/мл и их полной активации прохождение полной агрегации в течение не более 20 минут. Изобретение позволяет повысить достоверность и диагностическую ценность тромбоцитарного анализа. 2 н. и 3 з.п. ф-лы, 14 ил., 2 табл.
Реферат
Изобретение относится к способам оценки функциональной активности тромбоцитов, конкретно к количественной оценке агрегации этих клеток, и может быть использовано клинико-диагностическими лабораториями медицинских учреждений для выполнения диагностики предтромбоза и тромботических состояний, фармацевтическими предприятиями для тестирования действия фарм-препаратов и научными лабораториями для исследования молекулярных механизмов функционирования тромбоцитов и принципов организации сигнальных систем.
Анализ агрегации тромбоцитов относится к важнейшим задачам гематологии, поскольку диагностика тромбозов широко распространена в клинической практике и играет важную роль в оценке патогенеза многих заболеваний. Летальность от ишемической болезни сердца и тромбозов сосудов головного мозга составляет в развитых странах 40-50% от общей летальности взрослого населения.
Микроскопический метод оценки форм тромбоцитов, обладая простотой и доступностью в клинической практике (А.С.Шитикова "Изменение формы тромбоцитов как показатель их внутрисосудистой активации". В сб. "Клинико-лабораторная диагностика предтромбоза и тромботических состояний", С-Петербург, 1991, с.38-52), является трудоемким в исполнении, не реализуется в автоматизированном апаратурном исполнении и не позволяет проводить кинетических исследований.
Основным клиническим способом оценки функциональной активности тромбоцитов является регистрация агрегации тромбоцитов по изменению пропускания - метод Борна (G.V.Born, V.J.Cross The aggregation of blood platelet. // J.Physiol. 1963, v.16. P.178-195). В этом методе при регистрации используется обогащенная тромбоцитами плазма (PRP - platelets rich plasma) с низким содержанием ионов кальция в среде. Существенным недостатком этого метода является трудность регистрации активации тромбоцитов по пропусканию в плазме, поскольку доля активационного сигнала составляет несколько процентов от общего сигнала (Born G.V.R. Observations on the change in shape of blood platelets brought about by adenosine diphosphate. // J.Physiol. - 1970. - V.209. P487-511) и невозможностью проводить оценку при физиологической концентрации ионов кальция в среде (около 1 mM) и значений рН, т.к. в обогащенной тромбоцитами плазме такие концентрации ионов кальция немедленно вызывает активацию плазменного звена гемостаза и как следствие свертывание плазмы.
Более широкими возможностями в регистрации активации и агрегации обладают рео-оптические методы, связанные или с изменением величины светопропускания при изменении скорости перемешивания (Latimer P., Born G.V.R., Michal F. Application of light-scattering theory to the optical effects associated with the morphology of blood platelets. // Arch. Biochem. Biophys. - 1977. - V.180. P.151-159. Hoime S.,Murphy S. Quantative measurement of platelet shape by light transmission studies application to storage of platelets for transfusion. // J.Lab.Clin.Med. - 1978. - V.92(1). P.53-64) или анализом флюктуации интенсивности прошедшего света (В.А.Габбасов, Е.Г.Попов, И.Ю.Гаврилов, Е.Я.Позин, Р.А.Маркосян Новый методический подход к исследованию агрегации тромбоцитов in vitro. // Бюл. экспер. биол. - 1989. - N 10, с.437-440). Последний метод позволил авторам разработать новый способ определения индивидуальной чувствительности к нифедипину у больных сердечно-сосудистых заболеваний (авт. свид. СССР №1642385. кл. G01N 33/49, 1989 г.). Возможности этих методов ограничены тем, что полученные результаты сильно зависят от гидродинамических характеристик измерительного прибора. Позволяя получить хорошее разрешение активационного и агрегационного процесса (в отличие от метода Борна), эти методы не позволяют различать активационные стадии (сферизация и образование псевдоподий). Недостатком этих методов также как и в методе Борна, является то, что, все они реализованы в условиях плазмы с низким нефизиологическим значением концентрации ионов кальция в среде.
Использование техники светорассеивания при исследовании тромбоцитов дает лучшую возможность в кинетической идентификации активных форм и агрегатов по сравнению с вышеперечисленными методами. Амлитудно-частотный анализ флюктуаций интенсивности рассеянного света в угле 90±23 градуса позволил получить распределение по размерам образующихся агрегатов, но не дает возможности регистрировать активацию тромбоцитов (Ozaki Y; Satoh K; Yatomi Y; Yamamoto T; Shirasawa Y; Kume S. Detection of platelet aggregates with a particle counting method using light scattering. // Anal Biochem. - 1994. - V.218(2). P 284-94).
Другим примером использования техники светорассеивания является способ, включающий получение обогащенной тромбоцитами плазмы (PRP) из крови, разбавление обогащенной тромбоцитами плазмы обедненной тромбоцитами плазмой, помещение разбавленной тромбоцитной плазмы в кюветное отделение фотометра, снабженного перемешивающим устройством, и измерение амплитудно-частотной характеристики интенсивности светорассеяния в 40 градусном угле, который позволяет независимо регистрировать активацию (не разделяя ее по стадиям) и агрегацию тромбоцитов (Affolter.H., Pletscher.A. Rheo-optical shape analysis of human blood platelets. Thromb. Haemostas. - 1982. - V.48(2) - P.204-207).
К сожалению, данному способу присущи те же недостатки, что и вышеперечисленным, а именно невозможность проводить измерения при значениях ионов кальция в среде, близким к физиологическим (около 1 mM) и невозможность использовать интенсивность светорассеяния для идентификации активационных стадий. Указанные недостатки обусловлены тем, что для разбавления обогащенной тромбоцитами плазмы использована обедненная тромбоцитами плазма.
Использование светорассеивающих характеристик тромбоцитов и изменение методологии оценки, достигнутое в патенте RU 2108579 (Деркачев Э.Ф., Миндукшев И.В., Кривченко А.И., Крашенниников А.А. "Способ исследования активации и агрегации тромбоцитов") позволило не только проводить оценку функциональной активности тромбоцитов в условиях, близких к физиологическим, но регистрировать две стадии активации этих клеток. Этот патент выбран в качестве прототипа к предлагаемому изобретению. Данный способ включает получение обогащенной тромбоцитами плазмы из крови, помещение солевой физиологической среды в кювету, находящуюся в кюветном отделении прибора, снабженного перемешивающим устройством, с последующим добавлением обогащенной тромбоцитами плазмы, таким образом, что эта плазма разбавляется солевой средой в 20-100 раз, пропускание светового луча через кювету, и измерение интенсивности светорассеяния в углах от 0 до 20 градусов после действия агонистов.
Недостатком данного способа является, то что, при таком разбавлении обогащенной тромбоцитами плазмы стандартные перемешивающие устройства, которые используются в агрегометрах, не могут обеспечить прохождение агрегации в течение 10-15 минут в течение промежутка времени, не превосходящего 20 минут. В стандартных агрегометрах применяется магнитная мешалка, в которой используется волчок в виде небольшого стержня с защищенной поверхностью. Данная конструкция волчка при скорости оборотов мешалки около 1500 об/мин позволяет обеспечить прохождение агрегации при использовании обогащенной тромбоцитами плазмы (ОТП) (platelet-rich plasma - PRP) с концентрацией клеток в диапазоне 1·109-7·109 кл/мл. Но при разбавлении плазмы в 20-100 раз данная конструкция не позволяет внести достаточную мощность, чтобы обеспечить высокую вероятность столкновения клеток, что является необходимым условием прохождения агрегации. Существенное увеличение скорости оборотов мешалки в этих условиях приводит как к образованию газовых пузырей, так и повреждению клеток. Кроме того, данный метод плохо адаптирован для клинической практики, для которой требуется введение количественных параметров, имеющих диагностическую ценность.
Устройства лазерных анализаторов частиц достаточно хорошо представлены рядом патентов (патент USA №3,563,660, 1971 г., патент USA №4,348,111, 1982 г., патент USA №4,387,993, 1983 г., патент USA №4,842,406, 1989 г., патент USA №4,957,363, 1990 г., патент USA №5,426,501, 1995 г., патент USA №6,999,171, 2006 г.).
В качестве прототипа устройства выбран патент Y.Shirasawa, T.Yamamoto (Патент USA №5,907,399, 1999 г.). В качестве источника излучения в прототипе используется полупроводниковый лазер (40 мВТ), луч света фокусируется в коллиматоре и проходит через кювету, в которую помещена суспензия тромбоцитов или других клеток крови. Кювета снабжена перемешивающим устройством, состоящая из перемешивающего волчка (stirring bar) и магнитной мешалки, обеспечивающей перемешивание со скоростью 1000 об/мин. Кювета также термостатируется при температуре 37°С. Рассеянный тромбоцитами (или другими клетками), свет регистрируется множеством фотодиодов, электрический сигнал с которых усиливается и преобразовывается в АЦП, и далее поступает на компьютер. Данный патент реализует регистрацию размеров отдельных агрегатов в условиях, когда агрегация проходит в обогащенной тромбоцитами плазме.
Недостатком прототипа является то, что данное устройство не позволяет регистрировать агрегацию тромбоцитов в условиях концентрации клеток в диапазоне 1·105-5·107 кл/мл.
Задачей настоящего изобретения является определение параметров агрегационной активности тромбоцитов, позволяющих количественно определять агрегационный статус тромбоцитов при физиологической концентрации ионов кальция и рН в среде. Это позволяет расширить информационную ценность клинических, фармакологических и научных работ в этой области.
Для решения поставленной задачи предлагается способ определения агрегационной активности тромбоцитов, включающий получение обогащенной тромбоцитами плазмы из крови, помещение солевой физиологической среды в кювету, находящуюся в кюветном отделении прибора, снабженного перемешивающим устройством, с последующим получением клеточной суспензии путем добавления обогащенной тромбоцитами плазмы в солевую физиологическую среду в кювете, причем плазма разбавляется солевой средой не менее чем в 10 раз, пропускание светового луча через кювету, измерение интенсивности светорассеяния солевой физиологической среды и полученной клеточной суспензии в кювете, добавку агонистов в клеточную суспензию, измерение динамики изменения интенсивности светорассеяния после добавки агонистов, определение кинетики агрегации тромбоцитов по уменьшению светорассеяния отдельными клетками тромбоцитов и увеличению светорассеяния их димерами, причем при измерении интенсивности светорассеяния в кювете производят вихревое перемешивание клеточной суспензии, а интенсивность перемешивания выбирают в диапазоне, нижний предел которого обеспечивает в течение не более 20 минут после добавки насыщающей дозы агониста образование не менее чем 90% димеров тромбоцитов при концентрации тромбоцитов в диапазоне 1·105-5·107 кл/мл и при температуре не более 38°С, а верхний предел не превосходит интенсивности перемешивания, при которой происходит образование газовых пузырей в перемешиваемой среде, причем по динамике изменения интенсивности светорассеяния под углом, предпочтительно выбранном в диапазоне 0.5-6 градусов, определяют параметры агрегационной активности тромбоцитов, включая начальную скорость агрегации, определяемую по начальной скорости уменьшения светорассеяния отдельными тромбоцитами, и увеличения светорассеяния их димерами после действия агонистов, степень прохождения агрегации, определяемую по величине максимальной амплитуды интенсивности рассеяния и концетрацию, определямую по разнице сигналов интенсивности светорассеяния, полученных при фотометрировании кюветы со средой до и после добавления обогащенной тромбоцитами плазмы.
Для реализации указанного способа предлагается устройство, содержащее источник излучения, измерительную кювету, средства перемешивания, приемник излучения, электронный блок, включающий плату усилителей и аналого-цифровой преобразователь, причем средства перемешивания выполнены с возможностью перемешивания в кювете солевой физиологической среды с тромбоцитами с заданной интенсивностью перемешивания в диапазоне, нижний предел которого обеспечивает образование не менее чем 90% димеров тромбоцитов в течение не более 20 минут после добавки насыщающей дозы агониста и при начальной концентрации тромбоцитов в диапазоне 1·105-5·107 кл/мл и при температуре не более 38°С, а верхний предел не превосходит интенсивности перемешивания, при которой происходит образование газовых пузырей в перемешиваемой среде.
Указанная совокупность позволяет регистрировать агрегацию тромбоцитов в условиях разбавления обогащенной плазмы тромбоцитов более чем в 10 раз солевой средой, что позволяет определять параметры агрегационной активности тромбоцитов при физиологической концентрации ионов кальция и значения рН в среде.
Сущность предлагаемого изобретения поясняется чертежами, где
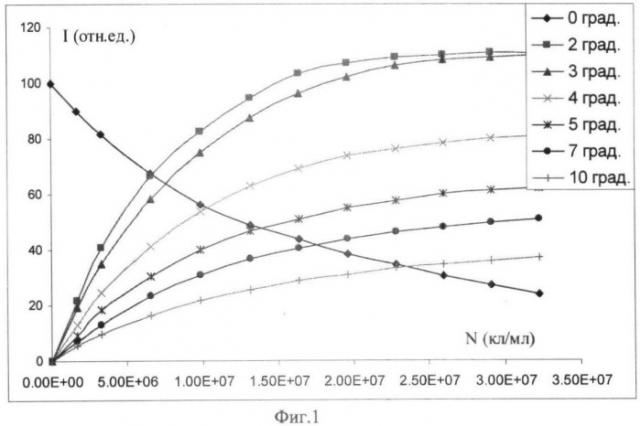
фиг.1. Представляет зависимость интенсивности света в диапазоне углов 0-10 градусов (I) от концентрации тромбоцитов человека в NaCl-среде. Значения по оси абсцисс даны в научном формате числа (2Е+06→2·106);
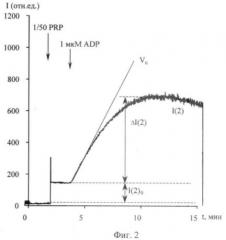
фиг.2. Приведена графическая оценка параметров агрегации и активации тромбоцитов, регистрируемой по динамике интенсивности светорассеяния в 2 градусном углу;
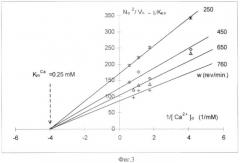
фиг.3. Приведена зависимость в двойных обратных координатах константы второго порядка агрегации (~Vn/N2) от концентрации ионов кальция в среде при разной скорости оборотов мешалки (АДФ - 0,6 µМ);
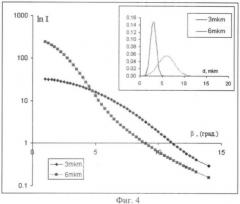
фиг.4. Даны теоретические индикатрисы для ансамбля частиц 3 и 6 мкм с заданным характером распределения частиц по размерам;
фиг.5. Приведена зависимость величины Amax от величины угла;
фиг.6. Приведен характер зависимости начальной скорости агрегации от концентрации АДФ. Показаны записи в двух углах 2 и 12 градусов;
фиг.7. Приведен стандартный протокол количественной оценки статуса тромбоцитов. Определение величин EC50 и Umax сделано компьютерными (Excel) и графическими средствами;
фиг.8. Приведен протокол исследования функциональной активности тромбоцитов;
фиг.9. Приведена полная динамика трансформации тромбоцитов. Наблюдается первичная агрегация, дезагрегация, вторичная агрегация и процесс свертывания. Показана динамика при 2, 4, 6, 8 и 12 градусах; для удобства представления значения сигналов при 8 и 12 градусах увеличены в несколько раз;
фиг.10. Приведена компьютерная обработка динамики сигнала в 2 градусном угле. Графически показано определение величины времени наступления процесса свертывания;
фиг.11.а) представлена зависимость нормированной начальной скорости агрегации тромбоцитов (Un) от концентрации АДФ для здорового пациента (контроль) и для больного ишемической болезнью сердца (ИБС); б) представлена зависимость в двойных обратных координатах;
фиг.12. Приведена зависимость нормированной начальной скорости агрегации тромбоцитов (Umax) от концентрации АДФ для здорового донора (контроль) и для больного с искусственным сердечным клапаном;
фиг.13. Представлена структурная схема используемого в патенте устройства;
фиг.14. Представлены варианты кюветы со средствами перемешивания.
Для корректного применения метода малоуглового светорассеяния необходимо, чтобы проходящий через измерительную кювету свет только один раз рассеивался на частице (клетке) и вторично не рассеивался на другой частице (многократное рассеяние). Это достигается ограничением создаваемой концентрации частиц. Критерием однократности рассеяния является сохранение близкое к линейной зависимости между интенсивностью светорассеяния и концентрацией частиц (Ван де Хюлст Г., 1961). На фиг.1 показана зависимость интенсивности светорассеяния в разных углах от концентрации тромбоцитов. Видно, что это условие соблюдается при концентрациях клеток не выше 107 кл/мл. Ограничение создаваемой концентрации клеток для соблюдения однократности рассеяния зависит от их размера, чем крупнее клетки, тем меньше этот порог концентрации.
В условиях однократного рассеяния величина сигнала интенсивности рассеяния от концентрации тромбоцитов в суспензии хорошо описывается линейным трендом. Таким образом, сделав калибровку добавками обогащенной тромбоцитами плазмы с известной концентрацией клеток по сигналу одного из датчиков (например, используя датчик, расположенный в 2 градусном угле), в дальнейшем определяют концентрацию тромбоцитов по этой калибровке. Соответственно, введя коэффициент разбавления обогащенной тромбоцитами плазмы (ОТП) физиологической средой рассчитывают концентрацию тромбоцитов в ОТП.
Соблюдение принципа однократного рассеяния приводит к тому, что обогащенная тромбоцитами плазма разбавляется в 20-100 раз, при этом концентрация тромбоцитов в кювете находится в диапазоне от 1·105 до 2·107 кл/мл. При такой концентрации вероятность соударения частиц, и соответственно скорость образования агрегатов, согласно уравнению Смолуховского, уменьшается в 100-10000 раз. Соответственно, необходимо многократно увеличить мощность, вносимую системой перемешивания. Вызванная агонистами агрегация происходит при активации тромбоцитов, при которой происходит сборка гликопротеинового комплекса GPIIb/IIIa (интегринового рецептора αIIbβ3). Причем активированные тромбоциты не могут пребывать в этом статусе долго. Они либо образуют агрегаты (связь через фибриноген интегриновых рецепторов), либо переходят в рефракторное состояние в течение 10-20 минут (Сакаев М.Р., Миндукшев И.В., Лесиовская Е.Е., Петрищев Н.Н., Кривченко А.И. Оценка эффективности действия пуриновых нукпеотидов на Р2-рецепторы тромбоцитов методом малоуглового светорассеяния. // Экспериментальная и клиническая фармакология. - 2000. - Т.63(3), с.65-69). Таким образом, средства перемешивания должны обеспечить прохождение агрегации тромбоцитов в течение не более 20 минут после добавки агониста. Ясно, что вносимая мощность при перемешивании имеет и верхний предел. Основным ограничивающим фактором является образование пузырей, или за счет образования воронки на поверхности жидкости, или за счет кавитационного эффекта. Подробное описание средств перемешивания приведено при описании устройства.
В солевой среде (140 мМ NaCl, pH 7.4 Трис-буфер, [Са2+]0-1 мМ, при концентрации тромбоцитов около 106 кл/мл) агрегация, регистрируемая по интенсивности светорассеянию в 2 градусном угле, носит близкий к экспоненциальному от времени характер во всем диапазоне концентрации АДФ. Такой характер дает возможность характеризовать агрегацию следующими величинами (см. фиг.2): начальной величиной сигнала I(2)0 - пропорциональной концентрации клеток No, начальной скоростью агрегации (Vn), и конечной величиной сигнала ΔI(2).
Предлагается математический алгоритм, который реализован в компьютерной программе, позволяющей адекватно определять параметры, обозначенные на фиг.2. Алгоритм реализуется по следующей схеме:
Предварительно производим медианную фильтрацию исходного сигнала для удаления случайных выбросов и линейное сглаживание для уменьшения шума сигнала. На выделенном маркерами диапазоне определяется фоновый участок, как участок линейности, начиная с начала выбранного диапазона. Начиная с точки окончания фонового участка, определяется участок скачка в сторону увеличения сигнала. Находится точка максимума скорости роста экспериментальной зависимости. Поиск производится на диапазоне заданной продолжительности, начиная с точки окончания участка линейности. Точка максимума сигнала находится методом перебора на участке от конца участка линейности до конца, выбранного для анализа диапазона. Помимо абсолютного значения сигнала в данной точке рассчитывается значение сигнала относительно участка линейности, как разность сигнала в точке максимума и значения функции регрессии участка линейности, экстраполированной в данную точку. Так же рассчитывается разность сигнала в точке максимума и значения сигнала на фоновом участке, как значения сигнала в точке максимума относительно фона.
Кинетика агрегации (и/или коагуляции) описывается теорией столкновений (Смолуховский цит. по Дерягину Б.В., 1987, Frisch H.L, 1956), в рамках которой, скорость реакции (агрегации) определяется вероятностью и эффективностью столкновения клеток. Теория предсказывает, что кинетика агрегации является реакцией второго порядка относительно концентрации клеток, и первоначально образовавшие агрегаты представлены преимущественно димерами.
Ранее было показано, что реакция агрегации является реакцией второго порядка относительно концентрации клеток (No) (Деркачев Э.Ф., Миндукшев И.В., Кривченко А.И., Крашенниников А.А. "Способ исследования активации и агрегации тромбоцитов". Патент RU 2108579 С1, 6 G01N 33/49. 1998. Бюллетень Изобретений №10 (II). С.298.
Константа второго порядка kex реакции определяется уравнением:
с единицами размерности (мин·кл/мл)-1. Или в относительных единицах:
Известно, что величина kex зависит от вероятности и эффективности столкновения. Поэтому влияние скорости оборотов мешалки (W) (фактор вероятности столкновения) и концентрации ионов кальция в среде ([Ca2+]o) (фактор эффективности соударения) на агрегацию оценивается относительно величины .
На фиг.3 представлена в двойных обратных координатах зависимость величины от концентрации ионов кальция в среде ([Са2+]o) при разных оборотах мешалки. Константа полунасыщения концентрации свободного кальция в среде (K0,5) графически определяется ~0,25 мМ (0,24±0,7 мМ по 5 животным).
Зависимость величины от скорости оборотов мешалки (W) при разных концентрациях кальция в среде определяется степенной функцией с показателем m<1.
На основании этих данных уравнение начальной скорости агрегации в солевой среде при максимальной активации тромбоцитов в условиях развитой турбулентности имеет вид:
Из уравнения видно, что между факторами, определяющими скорость агрегации (концентрация клеток, концентрация ионов кальция в среде, обороты мешалки), существует определенная эквивалентность, и их можно взаимно заменять. Но в то же время изменение оборотов мешалки и концентрации ионов кальция в среде не меняет порядок реакции.
Скорость агрегации максимальна при рН среды 7.8, и уменьшается при закислении среды. При рНо 6.0 агрегация отсутствует.
Экспериментально найдены условия по минимальной концентрации клеток , когда агрегация не будет наблюдаться. Она была оценена около 105 кл/мл, причем и Сао, и рНо, и W меняют эту величину. (Миндукшев И.В. Исследование кинетики активации и агрегации тромбоцитов методом малоуглового светорассеяния. Диссертация на соискание ученой степени. СПбГУ, 1996. 103 с.).
Кроме начальной скорости агрегации, другой важной характеристикой является полнота прохождения агрегации (An). В традиционном методе Борна за 100% принимается начальный сигнал, и амплитуда уменьшения сигнала (просветление) характеризует полноту прохождения агрегации. В предлагаемом методе агрегация характеризуется повышением сигнала. Соответственно, эта величина соотносится с начальным значением сигнала и вычисляется по следующему уравнению (см. фиг.2):
По существу эта величина характеризует образование димеров из одиночных клеток. По нашим экспериментальным данным эта величина достигает величины AMAX ~ 5-6.
Теоретический расчет индикатрис одиночных клеток и димеров устанавливает, что эта величина зависит от начального распределения клеток по размерам и распределения димеров от размеров.
При используемой длине волны лазера (0.67 мкм) индикатриса светорассеяния частицами размером до 10 мкм удовлетворительно описываются приближением Релея-Ганса (Шифрин К.С. (1951), Ван де Хюлст Г. (1961), Борен К. (1986). На фиг.4 показаны зависимости логарифма интенсивности (In I) от угла рассеяния (β), рассчитанные по уравнению Релея-Ганса, для частиц диаметром d=3 мкм (как приближенную модель тромбоцита), и частиц диаметром d=6 мкм (приближение для агрегата, образованного двумя частицами), с заданными Гаусовским характером распределения частиц по размерам. Абсолютные значения интенсивности света для 6 мкм частиц в 2 раза ниже, что обусловлено уменьшением концентрации частиц при образовании из мономеров димеров. Эти расчетные зависимости представлены для частиц с заданными функциями распределения частиц по размерам (показаны на фиг.4), что приводит к сглаживанию дифракционной картины.
На фиг.5 представлена рассчитанная по представленным индикатрисам (фиг.4) величины Amax от величины угла. Если использовать в качестве оценки агрегации динамику сигнала в 2 градусном углу, то рассчитанная величина Amax=5.4. Тогда степень прохождения агрегации А% определяется по формуле (реализация патента по п.3):
Для агрегации, оцененной по динамике 2 градусного угла, расчет величины А% проводиться по следующей формуле:
Степень прохождения агрегации можно рассчитывать по любому углу в диапазоне углов 0.5-6 градусов, т.к. в этом диапазоне величина монотонно убывает (фиг.4), например для 1 градусного угла величина Amax=7.37.
Приведенные расчетные характеристики позволяют предсказать динамику агрегационного ответа, в ближних углах (до 5 градусов) при агрегации интенсивность будет увеличиваться, тогда как в дальних углах (около 10 градусов) интенсивность сигнала будет снижаться, соответственно дезагрегационный процесс будет давать обратную картину.
Исследования действия АДФ на тромбоциты показали, что агрегация вызывается большими дозами агониста, чем активация тромбоцитов. Активация связана только с повышением внутриклеточной концентрации кальция. Необходимым условием агрегации является образование гликопротеинового комплекса GPIIb/IIIa (интегринового рецептора αIIbβ3). Для этого процесса мобилизация внутриклеточного кальция является необходимым, но не достаточным звеном, и требуется активация ряда киназных систем.
Метод малоуглового светорассеяния позволяет стандартизовать условия исследования по солевому составу (тоничности, рН, ионов кальция). В этих условиях во всех экспериментах наблюдается дозовая зависимость начальной скорости агрегации от концентрации АДФ (V=f([АДФ]) (фиг.6). Эта зависимость носит насыщающий характер (Ленгмюровского типа), и количественно характеризуется двумя величинами: ЕС50 - концентрация вещества, необходимая для достижения половины максимального эффекта и Vmax - максимальная скорость реакции при насыщающей дозе вещества. Удобно то, что можно использовать как графическую оценку этих величин в координатах Лайнуивера-Берка, так и применять статистический метод линейного тренда. Обе получаемые величины (ЕС50 и Umax) отражают функциональный статус тромбоцитов, где ЕС50 - характеризует чувствительность действия АДФ, a Umax - отражает максимально возможное количество мест связывания на поверхности клетки при действии насыщающей дозы АДФ (коррелирует с количеством фибриногеновых рецепторов на одной клетке).
Методическая последовательность экспериментальных определений величин ЕС50 и Umax следующая:
- Проводится регистрация начальной скорости агрегации, вызванная разными дозами АДФ. 4-6 доз АДФ в области концентраций 100-1000 нМ (При различных нарушениях статуса тромбоцитов диапазон концентраций может варьироваться). Проводится оценка начальных скоростей агрегации.
- Начальные скорости нормируются (см. уравнение 2) согласно уравнению:
- Приводятся таблица данных зависимости нормированных скоростей Un от концентрации АДФ.
- Вычисляются обратные величины (1/Un и 1/[АДФ]).
- Статистическими методами проводится оценка величин ЕС50 и Umax, на основании уравнения:
Реализация этого алгоритма представлена на фиг.7.
Применяемая дозо-зависимая оценка более точно характеризует агрегационную активность тромбоцитов, чем оценка по одной дозе в методе Борна, что повышает достоверность этого тромбоцитарного анализа. Это особенно важно в условиях, когда фармакологические препараты или патологические условия привели к трансформации внутриклеточного статуса тромбоцитов, при котором низкие дозы агониста вызывают повышенную агрегацию, а высокие - пониженную (смешанный тип действия), и в этих условиях оценка по одной дозе ошибочно характеризует агрегационную активность клеток.
Представленный метод позволяет качественно и количественно характеризовать функциональный статус тромбоцитов, что особенно важно для исследования сложных патологий, связанных с нарушением тромбоцитарного звена гемостаза.
| Таблица 1. | ||
| Сравнительные характеристики методов оценки тромбоцитарной активности. | ||
| Характеристик и методов | Метод светорассеяния | Метод Борна |
| Среда | 140 мМ NaCl, | Platelet rich plasma |
| 10 мМ Tris-HCl (or HEPES) buffer, | (PRP) | |
| pH 7.4 | [Ca2+]0- | |
| 1 мМ CaCl2 | Неопределен | |
| рН - неопределен | ||
| Возможность регистрации стадий трансформации | Активация (сферизация и | Активация (<5%) |
| образование псевдоподий) до 50% | Агрегация | |
| Агрегация | Дезагрегация | |
| Дезагрегация | ||
| Коагуляция | ||
| Концентрация тромбоцитов | 106-107 кл/мл | >108 кл/мл |
| Экспериментальные состояния | Физиологические значения рН и концентрации ионов кальция в среде | Нефизиологические концентрации ионов кальция в среде |
| Концентрация | 5-200 нМ | 2-10 mkM |
| АДФ, используемая приТестировании | (физиологическая) | (нефизиологическая) |
В таблице 1 приведены сравнительные характеристики традиционного метода, и метода, основанного на технике малоуглового светорассеяния. Существенное достоинство предлагаемого метода - это возможность физиологической концентрации ионов кальция, существенно влияющего на скорость протекания ряда ферментативных/рецепторных процессов.
Следует отметить, что метод может быть применен для тестирования других (отличных от АДФ) агонистов, таких как, - тромбин, PAV, адреналин, коллаген, фибриноген, фактор Вилебранта и др. При таких клинических анализах достаточно выполнение метода по п.1, где определяется степень прохождения агрегации при предъявлении разных агонистов с выбранной дозой. На Фиг.8 представлен протокол такого исследования нарушения гемостаза у пациентки, выполненный в Новосибирской Медицинской Академии, демонстрирующий возможности разработанного способа по п.1. На основании этих исследований тромбоцитарного звена гемостаза (представленным способом) и параллельных исследований плазменного звена гемостаза врачом-гемостазиологом делается развернутое клиническое заключение.
В предыдущих примерах определение агрегационной активности тромбоцитов основывалось на оценке начальной агрегации тромбоцитов. Реально кинетика трансформации тромбоцитов более сложная. На фиг.9 представлена полная динамика трансформации клеток. Можно выделить несколько процессов: первичная агрегация, дезагрегация, вторичная агрегация и процесс свертывания (образование фибринового сгустка). Одновременная регистрация этих процессов в разных углах регистрации позволяет их хорошо идентифицировать. Отличительной особенностью прохождение процесса свертывания от агрегации (или дезагрегации), является то, что сигналы во всех углах убывают. При агрегации сигналы в ближних углах увеличиваются, а в дальних углах убывают, а при дезагрегации, наоборот, в ближних углах увеличиваются, а в дальних - убывают. Такой характер динамики предсказывается и теоретическими расчетами (фиг.4).
Для определения времени наступления процесса свертывания проводится дифференцирование кинетической кривой, отражающей динамику изменения интенсивности светорассеяния. Предпочтительно использовать динамику в 2 градусном угле. На фиг.15 показана динамика сигнала в 2 градусном угле, и дифференцированный вид этой кривой. Время наступления процесса свертывания Тсвер определяется после прохождения первичной агрегации по скачку первой производной изменения интенсивности рассеяния. На фиг.10 показан пример графической оценки параметра Тсвер.
Структурная схема устройства представлена на фиг.13.
Устройство содержит источник излучения 1, включающий лазер, драйвер лазера и коллиматор; измерительную кювету 2 с волчком; средства перемешивания 3, содержащее кюветное отделение и магнитную мешалку; приемник излучения 4 (например, в виде линейки фотодиодов), электронный блок 5, включающий плату усилителей, аналого-цифровой преобразователь и микроконтроллер; панели управления 6, блока питания 7 и выход на компьютер 8.
Лазерный луч, испускаемый источником излучения 1, направлен перпендикулярно к стенкам прямоугольной кюветы 2 и сфокусирован на первый фотодиод приемника излучения 4. Проходящий через кювету свет рассеивается клеточной суспензией, которая помещена в кювету 2 и непрерывно перемешивается с помощью соответствующего устройства 3. Прошедший и рассеянный свет поступает на приемник излучения 4, в котором происходит преобразование световых сигналов в электрические. Эти электрические сигналы передаются на электронный блок 5, в котором усиливаются, преобразовываются в цифровой вид и через микроконтроллер поступают на порт компьютера 8. Через панель управления 6 осуществляется управление электронным блоком 5, устройствами перемешивания 2 и источником излучения 1. Все эти модули снабжены электрическим питанием через блок питания 7.
Полученная из крови обогащенная тромбоцитами плазма разбавляется более чем в 10 раз, для того чтобы обеспечить прохождение агрегации в течение не более 20 минут после добавки агониста при начальной концентрации тромбоцитов в диапазоне 1·105-5·107 кл/мл необходимо новое перемешивающее устройство.
На фиг.14 представлены варианты средств перемешивания. Для того чтобы использовать овальный по профилю волчок (фиг.14В) и исключить образование воронки и захват пузырей, создается закрытое пространство, целиком заполненное жидкостью. При этом можно увеличивать достаточно сильно скорость оборотов мешалки. Для облегчения обслуживания и уменьшения травмирующего воздействия на клетки предлагается исполнение перемешивающего устройства, при котором перемешивание достигается большой поверхностью цилиндрического волчка. Причем его можно размещать сверху (фиг.14С), так и снизу под пучком света (фиг.14А). Большая плоская поверхность цилиндрического волчка с оборотами мешалки порядка 1200-1500 об/мин создает гидродинамический режим с развитой, однородной по всему объему кюветы турбулентностью, при которой локальные вихревые потоки равномерно распределяются в объеме жидкости. Существенно то, что при работе такого волчка не образуется большая воронка, которая приводит к образованию пузырей воздуха. Нижний вариант расположения цилиндрического волчка (фиг.14А) более удобен в обслуживании. В этом варианте, для того чтобы волчок не прецессировал, создано коническое углубление и волчок своим коническим выступом фиксируется в точке вращения и не бьет по стенкам кюветы (эффект вращающейся в углублении юлы).
Клинические примеры реализации способа определения агрегационной активности тромбоцитов
1. Исследование функциональной активности тромбоцитов у больных ишемической болезнью сердца.
Изменение функциональной активности тромбоцитов играет важную роль в патогенезе ишемических и постишемических расстройств микроциркуляции. Наблюдаются значительные изменения морфофункционального состояния тромбоцитов и их поверхностных свойств при ИБС. По данным Шитиковой А.С. и соавторов (1997 г.) при ИБС увеличивается количество акти