Композиция для стимулирования роста и регенерации клеток, (варианты), а также способ ее получения (варианты)
Иллюстрации
Показать всеИзобретение относится к вариантам фармакологической композиции, предназначенной для стимулирования роста и регенерации клеток, а также к способам ее получения. Композиция содержит лизат лейкоцитов периферической крови, стволовых и прогениторных клеток, полученных от животного, которому перед забором клеточного материала проводят биопсию тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать. Другой вариант данной композиции содержит лизат лейкоцитов периферической крови и/или стволовых и/или прогениторных клеток, полученных от животного, которому перед забором клеточного материала проводят биопсию тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать, при этом лейкоциты периферической крови и/или стволовые и/или прогениторные клетки предварительно культивировались с разрушенными клетками предварительно забранных биопсией тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать. Варианты способа получения композиции включают получение клеток и их последующее разрушение. Изобретение обеспечивает повышение процесса регенерации в поврежденном органе. 4 н. и 10 з.п. ф-лы, 2 табл., 6 ил.
Реферат
Изобретение относится к медицине и ветеринарии и может быть использовано для лечения заболеваний, требующих стимуляции регенерации клеток органов и тканей при хронических воспалительных и дегенерационных процессах внутренних органов или кожных покровов.
Предпосылками для создания данного изобретения послужило следующее.
Несмотря на постоянное совершенствование медицинских технологий, лечение больных с хроническими заболеваниями внутренних органов до настоящего времени остается актуальной задачей. Хронический воспалительный и/или дегенеративный процесс внутренних органов несмотря на усилия врачей, как правило, заканчивается декомпенсацией и смертью больного. Одним из факторов, существенно влияющим на течение хронических заболеваний, является скорость регенерации в поврежденных органах. Хроническое воспаление и гипоксия, нарушение трофики поврежденного органа приводят к угнетению его функции и развитию хронического стресса, сопровождающегося формированием функциональной недостаточности иммунорегуляторных клеток организма.
Основанием для такого предположения послужили работы G.Selye об инволюции органов иммунной системы в условиях хронического стресса, которая сопровождается снижением функциональной активности фагоцитирующих клеток крови [Hasper D., 1998; Levine Т.В. et al., 2002] и снижением морфогенетической активности лимфоидных клеток, являющихся "переносчиками регенерационной информации" в организме [Бабаева A.Г. и соавтор., 1982]. Выраженность инволюционного процесса в костном мозге как центральном органе иммуногенеза при хроническом стрессе определяется суммарной биологической дозой стресс-повреждающего фактора (тяжесть и длительность заболевания), а также генетическими (врожденными) и фенотипическими (приобретенными) резервами устойчивости клеток костного мозга (ККМ) (возраст, физические тренировки и др.)
Так, по данным литературы до 70% больных хронической сердечной недостаточностью имеют признаки вторичного иммунодефицита различной степени выраженности, что указывает на предсуществующее нарушение пролиферативной, миграционной и информационной активности как гемопоэтических клеток костного мозга, так и клеток крови.
По мере развития хронического заболевания дизрегуляция иммунной системы прогрессирует, особенно среди тех ее звеньев, которые ответственны за регенерацию поврежденных органов. В результате лечение хронических процессов становится неразрешимой задачей, т.к. сам организм, создавая иммунный дисбаланс, стремится ослабить проводимую активационную терапию, чтобы затормозить процесс износа и гибели гиперфункционирующих структур жизненно важных поврежденных органов.
Одним из методов, позволяющих повысить регенерацию поврежденного органа, является трансплантация клеток костного мозга, содержащего лимфоциты, стволовые и прогениторные клетки.
Так, известен способ лечения хронической сердечной недостаточности (Ю.Л.Шевченко. «Клеточные технологии в кардиологии», Вестник РАМН, 2003 г., №11, стр.6-10), основанный на трансплантации фетальных клеток, полученных из абортивного материала. Недостатками указанного метода являются:
1. Запрет на использование фетального материала для трансплантации человеку.
2. Риск заражения реципиента инфекциями, которые могут содержаться в трансплантате.
3. Эффективность трансплантации аллогенного материала снижается из-за иммунного отторжения.
Эффективность трансплантации аутологичного костного мозга во многом зависит от состояния иммунной системы, которая во многом определяет морфогенетические и регенерационные способности организма.
В то же время возможен и другой подход с использованием композиций, предназначенных для повышения регенерации клеток органов и тканей.
Многочисленные исследования доказали участие лимфоцитов периферической крови и клеток костного мозга в развитии регенерационных процессов после острого повреждения или резекции органов. Было выявлено по крайней мере 3 основных закономерности. Во-первых, регенерация сопровождается изменением функциональной активности лимфоцитов и клеток костного мозга. Во-вторых, в процессе развития регенерационного процесса происходит смена популяционного состава Т-лимфоцитов и ККМ, что обеспечивает начало регенерации, развитие и завершение процесса восстановления поврежденного органа. В-третьих, функциональная активность клеток иммунной системы зависит от того, какой орган поврежден и какой объем повреждения [А.Г.Бабаева, 1999], а в процессе острого повреждения в организме формируется клоны лимфоцитов, переносящих «регенерационную информацию» о том органе, который был поврежден [Бабаева А.Г., 1984; Бабаева А.Г., Шубникова, 1979; Бабаева А.Г. с соавт., 1982; Шилова Л.Я. с соавт., 1982].
При этом процесс регенерации в организме сопровождается тесной кооперацией нервной, эндокринной и иммунной системы. Выделяющиеся в процессе регенерации гуморальные ростовые и регуляторные факторы обеспечивают последовательность фаз регенерации и пролиферации [В.П.Шахов, 1996; Гольдберг Е.Д. с соавт., 1997; Дыгай A.M. с соавт., 1992; Дыгай A.M. с соавт., 1989; Дыгай A.M. с соавт., 1998].
Аналогом данного подхода является метод лечения острой и хронической дисфункции внутренних органов пептидами, полученными из спленоцитов животных (свиньи) [А.А.Макаров с соавт., 1993].
Недостатками данного метода являются:
1. Для приготовления спленоперфузата используются только клетки селезенки. Однако в литературе было показано, что при развитии острого стрессорного повреждения функциональная, а главное, секреторная активность лимфоидных клеток в разных органах различается [М.С.Бляхер с соавт., 1996; Ю.И.Зимин, 1974].
2. Забор клеток у животного проводится в состоянии функционального покоя. Как было показано, острый стресс вызывает системную перестройку функциональной активности всех регуляторных (нервная, эндокринная, иммунная) систем организма. Так, введение сыворотки, полученной от больных с острым повреждением сердца, у экспериментальных животных вызывает усиление пролиферативной активности клеток крови, костного мозга [Я.Г.Ужанский с соавт., 1974]. В одной из работ, посвященных лечению экспериментального сахарного диабета, было показано, что через 3 дня после частичной резекции поджелудочной железы из оставшейся части органа можно получить экстракт, введение которого повышает регенерацию ткани поджелудочной железы при введении в организм животного, больного сахарным диабетом [Anandwardhan A. Hardikar, Ramesh R. Bhonde, 1999].
Наиболее близким аналогом заявляемого изобретения является композиция, включающая средство для изменения скорости роста и репродукции клеток, содержащее кондиционированную клеточную культуральную среду, полученную при культивировании эукариотических клеток в трех измерениях, а также способ ее получения (Патент РФ 2280459 от 27.06.2006). Однако данная композиция не учитывает механизмов развития регенерации в ответ на действие повреждающих факторов.
В то же время заявляемые изобретения направлены на устранение перечисленных выше недостатков и достижение технического результата, заключающегося в повышении регенерационного потенциала клеток органов и тканей при хронических воспалительных и дегенерационных процессах внутренних органов и кожных покровов, что в свою очередь обеспечивает повышение эффективности лечения большого спектра хронических заболеваний.
Заявителями настоящего изобретения описаны варианты композиции: в композицию, содержащую лизат лейкоцитов периферической крови, и/или стволовых, и/или прогениторных клеток, полученных от животного, которому перед получением клеточного материала проводят забор тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать, а также композицию, полученную после того, как к лейкоцитам периферической крови, и/или стволовых, и/или прогениторных клеток, полученных от животного, которому перед получением клеточного материала проводят забор тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать, добавляют лизат клеток, предварительно забранных тканей внутренних органов или кожных покровов, совместно культивируют и разрушают. Также описаны способы получения этих композиций.
Применение данных композиций открывает новые возможности в получении продуктов для использования в различных целях, включающих регенерацию тканей, например при лечении ран и других дефектов ткани, а также при лечении хронических воспалительных и дегенерационных процессов внутренних органов и кожных покровов.
Клеточный лизат, получаемый из лейкоцитов периферической крови, и/или стволовых, и/или прогениторных клеток, полученных от животного, которому перед забором клеточного материала проводится забор тканей внутренних органов или кожных покровов, представляющий собой, например, биопсийное исследование, получается из клеток, которые разрушаются с использованием физических (ультразвук, электрический разряд, замораживание-оттаивание), химических (ферменты, химические реагенты), механических (растирание) и других факторов, а также их комбинаций, в результате чего наступает нарушение целостности клеточных структур. В процессе разрушения культивируемых клеток возможно, но не обязательно, использовать физические (снижение температуры, использование инертных газов), химические (ингибиторы протеолитических ферментов) и другие факторы, а также их комбинацию для снижения скорости процесса разрушения клеточных метаболитов протеолитическими ферментами.
Заявляемые варианты композиций могут быть использованы в любом состоянии. Физическими вариантами композиций являются, но не ограничиваются ими, жидкая или твердая среда, замороженная среда, лиофилизованная среда или среда, высушенная до порошкообразного состояния. Кроме того, эта композиция может быть приготовлена в сочетании с фармацевтически приемлемым наполнителем, используемым в качестве носителя для внутреннего введения, для введения непосредственно в пищу или пищевой продукт, для получения мази или растирания - для местного. Кроме того, указанная композиция может быть дополнительно обработана для увеличения или уменьшения концентрации одного или нескольких факторов или компонентов, содержащихся в данной композиции. Так, например, композиция может быть обогащена факторами роста с использованием иммуноаффинной хроматографии.
Подробное описание изобретения
Настоящее изобретение относится к новым композициям, а также способам их получения, содержащим лизат лейкоцитов периферической крови, и/или стволовых, и/или прогениторных клеток, полученных от животного, которому перед получением клеточного материала проводят забор тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать, а также композицию, полученную после того, как к лейкоцитам периферической крови, и/или стволовых, и/или прогениторных клеток, полученных от животного, которому перед получением клеточного материала проводят забор тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать, в которые добавляют лизат клеток, предварительно забранных тканей внутренних органов или кожных покровов, совместно культивируют и разрушают.
Фармакологические композиции будут содержать различные естественным образом секретированные белки, а также внутриклеточные метаболиты, синтезируемые клеткой и содержащиеся преимущественно в секреторных гранулах.
Основные этапы для первого варианта композиции:
1 этап: поведение забора тканей внутренних органов или кожных покровов на примере биопсийного исследования
Животному под общим наркозом под контролем УЗИ чрескожно проводится биопсия внутренних органов (нами данная манипуляция была проведена на печени, сердце, поджелудочной железе, почке), в процессе которой забирается ткань объемом от 10 до 100 мкл (в зависимости от размера животного и органа, который пунктируют). Биопсия не сопровождается сильными болевыми ощущениями. Уровень физических и моральных страданий у животного может быть сопоставим с забором периферической крови при приготовлении иммунобиологических препаратов.
Для забора кожи проводится пункционная биопсия.
2 этап: получение стволовых и/или прогениторных клеток и/или лейкоцитов периферической крови
Источником стволовых и прогениторных клеток может быть костный мозг, периферическая кровь, подкожный жир и т.д.
а) Получение клеток из костного мозга
Костный мозг забирали у животного, находящегося под общим эфирным наркозом, из бедренной кости, пунктируя кость и промывая ее раствором Хенкса. Эритроциты удаляли, добавляя к полученной суспензии лизирующий раствор в соотношении 1:10. После добавления лизирующего раствора клетки центрифугировали и полученный осадок ресуспендировали раствором Хенкса.
Из аспирата костномозговой взвеси удаляют эритроциты. Для удаления эритроцитов можно использовать градиентное центрифугирование, лизис эритроцитов лизирующим раствором или комбинацию этих методов с другими, в результате чего наступает разделение эритроцитов и ядросодержащих клеток. Данные ядросодержащие клетки содержат как стволовые клетки, так и прогениторные.
б) Получение прогениторных клеток из периферической крови
Для повышения числа стволовых и прогениторных клеток в периферической крови животному перед забором клеток вводили в течение 2 дней в/в Г-КСФ (гранулоцитарный колониестимулирующий фактор). Ведение препарата позволяет повысить уровень гемопоэтических стволовых клеток с 0,5% (контроль) до 3,5% от общего количества мононуклеарных клеток в периферической крови.
в) Получение стволовых клеток из подкожного жира
Подкожный жир после выделения обрабатывается раствором коллагеназы, расщепляющей коллаген для получения суспензии клеток. После обработки коллагеназой клетки центрифугируются и на градиенте плотности выделяют стволовые клетки, что подтверждается методом культивирования.
г) Получение лейкоцитов периферической крови
Проводят забор периферической крови любым известным способом, после чего осуществляют получение лейкоцитарной суспензии: для этого 2 мл гепаринизированной крови смешивают с 1 мл подогретого до 37°C 3% раствора желатина и инкубируют в термостате при 37°C в течение 30 мин. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, отбирают в пластиковые пробирки и отмывают 10-кратным объемом фосфатно-солевого буфера (рН 7,4). Затем лейкоциты центрифугированием в течение 10 мин при 1000 об/мин ресуспендируют в растворе Хенкса без Ca2+ и Mg2+. После подсчета числа лейкоцитов концентрацию клеток доводят до 106 кл.
3 этап: получение композиции
После получения клетки вместе с культуральной средой переносят в пробирки, в которых клетки подвергаются разрушению с использованием физических (ультразвук, замораживание-оттаивание, электрический импульс и др.), и/или химических (ферменты, химические реагенты и др.), и/или механических (растирание и др.) методов или их комбинаций, приводящих к нарушению клеточных структур. Полученную композицию, состоящую из культуральной среды и разрушенных культивированных клеток, можно использовать для приготовления инъекционных форм, таблетированных лекарственных форм, применять в виде пищевых добавок или высушивать, лиофилизировать, замораживать и т.д.
Мази готовятся, используя в качестве основы медицинский вазелин. Фармакологическую композицию помещают в фарфоровую ступку и растирают фарфоровым пестиком до мелкодисперсного состояния. Затем к полученному порошку добавляют медицинский вазелин и тщательно перетирают до получения однородной (гомогенной) субстанции. Мазь наносилась на поверхность кожи.
Инъекционные формы готовились следующим образом. Стерильную фармакологическую композицию растворяли в дистиллированной воде. Раствор вводили внутрибрюшинно, внутримышечно, внутривенно или подкожно.
Жидкие препараты для перорального введения могут быть изготовлены, например, в виде растворов, сиропов или суспензий. Такие жидкие препараты могут быть получены стандартными способами с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин или камедь акации); безводные носители (например, миндальное масло, жирные сложные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота).
Дополнительно композиция может быть получена с добавлением антибиотика, противовоспалительного агента, противовирусного агента, противогрибкового агента, гормона, противоопухолевого агента, анальгетика, анестезирующего средства или любой их комбинации. При этом добавление того или иного агента производится с учетом необходимого терапевтического эффекта, определяемого специалистом.
Основные этапы для второго этапа композиции
Этапы 1 и 2 проводятся аналогично вышеизложенному.
3 этап: Получение лизата клеток (тканеспецифического антигена) предварительно забранных тканей внутренних органов или кожных покровов, рост и регенерацию которых необходимо простимулировать.
Для получения лизата использовали полученный биопсийный материал.
Для получения лизата клетки тканей разрушают, используя физические (ультразвук, замораживание-оттаивание, электрический импульс и др.), и/или химические (ферменты, химические реагенты и др.), и/или механические (растирание и др.) методы или их комбинации, приводящие к нарушению клеточных структур. Как пример: ткань механически гомогенизируется на фрагменты не более 0,5 мм3. Полученный гомогенат заливается раствором Хенкса 1:1 и помещается в морозильную камеру на 1 час, затем ткань размораживают, данный цикл повторяют 3 раза.
При этом отмечено, что в основе метода получения тканеспецифичного антигена (ТА) лежит разрушение клеточных структур, и оно может осуществляться:
1. Механически - растирание ткани паренхиматозных органов (например, в фарфоровой ступке с использованием фарфорового пестика или в стеклянном гомогенизаторе);
2. С использованием физических методов (например, проведение циклов замораживания-оттаивания или обработка суспензии клеток ультразвуком);
3. С использованием химических методов (например, обработка клеточной суспензии детергентами, которые разрушают липидный бислой клеточных и внутриклеточных мембран);
4. Сочетанием вышеперечисленных методов (механическое перетирание ткани с последующим проведением циклов замораживания-оттаивания).
В нашей работе мы изучали разные способы приготовления ТА и остановились на сочетании механического истирания с последующим проведением циклов замораживания-оттаивания. Мы выбрали данный метод как наиболее простой и быстро выполнимый. Однако проведенные нами исследования показали, что другие (вышеперечисленные методы) позволяют добиться такого же результата (изменяется время манипуляции, ряд методов требует дополнительного оборудования). В своей работе мы определяли уровень активности внутрилизосомальных ферментов (в частности, кислой фосфатазы) после разрушения тканей различными методами. Нами не было зафиксировано достоверных отличий при использовании разных методов разрушения тканей. Таким образом, данный «тканеспецифичный антиген», по нашему мнению, может быть получен любым известным способом.
4 этап: культивирование клеток
Клеточная культуральная среда для культивирования клеток может быть любой средой для культивирования клеток, которая адекватно соответствует потребностям культивируемых клеток в питательных элементах. Примерами таких сред являются, но не ограничиваются ими, модифицированная по методу Дульбекко среда Игла (DMEM), среда Хэма F12, RPMI 1640, среда Исков, среда Маккой и другие композиции сред, известные специалистам, включая среды, описанные в работах Methods For Preparation of Media, Supplements and Substrate For Serum-Free Animal Cell Culture, Alan R.Liss, New York (1984), и Cell & Tissue Culture: Laboratory Procedures, John Wiley & Sons Ltd., Chichester, England, 1996. Указанная среда может быть дополнена любыми компонентами, необходимыми для поддержания нужной клеточной или тканевой культуры. Если это необходимо, то дополнительно может быть добавлена эмбриональная телячья сыворотка, которая представляет собой комплексный раствор альбуминов, глобулинов, стимуляторов роста и гормонов. Такая сыворотка не должна содержать патогенов и должна быть тщательно проверена на загрязнение микоплазмой, бактериями, грибками и вирусами.
Полученные клетки, а именно лейкоциты периферической крови, и/или стволовые, и/или прогениторные клетки, ресуспендируют в культуральной ростовой среде. В среду для культивирования клеток также добавляется тканеспецифический антиген, полученный из ткани того органа, регенерацию клеток которого требуется простимулировать. Клетки и тканеспецифический антиген культивируют совместно при 37°C в атмосфере, содержащей 5% CO2, и при 95% влажности в течение 1-60 суток. Гомогенат тканеспецифического антигена добавлялся в культуральную среду в соотношении в среднем 1:30 (проверялся диапазон от 1:10 до 1:80).
5 этап : получение композиции проводится аналогично этапу, изложенному для первого варианта композиции.
Примеры, подтверждающие пригодность данных композиций
Пример 1. Эффективность фармакологической композиции изучали на модели повреждения миокарда у крыс методом криодеструкции (КД).
На 30 сутки после нанесения повреждения левого желудочка (ЛЖ) сердца происходило формирование рубцовой ткани округлой формы диаметром 6-7 мм со стороны эпикарда и 3 мм со стороны эндокарда; толщина стенки ЛЖ в центре рубца не превышала 1 мм. Как видно из таблицы 1, убыль относительной массы ЛЖ (на единицу массы тела) после криодеструкции составила примерно 13%, а для свободной стенки ЛЖ этот показатель составил 17%.
Площадь некроза после криодеструкции по отношению к общей площади свободной стенки ЛЖ составила со стороны эпикарда 25.1±3.6%, со стороны эндокарда - 23.0±4.2%. Площадь трансмурального некроза после криодеструкции по отношению к общей площади свободной стенки ЛЖ составила со стороны эпикарда 11.4±0.7%, со стороны эндокарда 6.4±2.5%.
Таким образом, проведенная морфометрия макропрепаратов поврежденного сердца позволила установить достоверное снижение мышечной массы ЛЖ, что неизбежно должно было бы привести к снижению его сократительной активности.
Приготовление фармакологической композиции состояло из следующих этапов:
1) получение ткани миокарда у интактных животных методом биопсии под контролем УЗИ
У животных находящихся под эфирным наркозом под контролем УЗИ и с использованием биопсийных игл проводили забор ткани миокарда. Масса биопсийной ткани составляла от 1 до 10 мг. Забор биопсийного материала не оказывал влияния на общее состояние животного и не сопровождался их гибелью.
2) Получение клеток периферической крови и клеток костного мозга
Забор клеток костного мозга и клеток периферической крови проводили у животных, у которых проводили биопсию миокарда. Забор клеток проводится в среднем через 5 суток (от 1 до 25 суток).
а) Получение стволовых и прогениторных клеток
Костный мозг забирали у животного, находящегося под общим эфирным наркозом, из бедренной кости, пунктируя кость и промывая ее раствором Хенкса. Эритроциты удаляли, добавляя к полученной суспензии лизирующий раствор в соотношении 1:10. После добавления лизирующего раствора клетки центрифугировали и полученный клеточный осадок ресуспендировали раствором Хенкса. Выделенные клетки содержали стволовые и прогениторные клетки, что было подтверждено методом культивирования и последующей цитохимической окраской.
б) Лейкоциты периферической крови получали следующим образом. 2 мл гепаринизированной крови смешивают с 1 мл подогретого до 37°C 3% раствора желатина и инкубируют в термостате при 37°C в течение 30 мин. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, отбирают в пластиковые пробирки и отмывают 10-кратным объемом фосфатно-солевого буфера (pH 7,4). Затем лейкоциты после центрифугирования в течение 10 мин при 1000 об/мин ресуспендируют в растворе Хенкса без Ca2+ и Mg2+. После подсчета числа лейкоцитов концентрацию клеток доводят до 106 кл. Выделенные клетки являлись лейкоцитами крови и состояли из лимфоцитов, моноцитов и гранулоцитов.
3) Культивирование клеток
Полученные клетки периферической крови и клетки костного мозга культивировали в культуральной среде в среднем в течение 5 суток при 37C° при 5% содержании CO2.
4) Разрушение клеток
После культивирования клетки подвергали разрушению - 2 цикла замораживания-оттаивания и обработка ультразвуком.
5) Из полученной композиции готовили инъекционные препараты, которые вводили животному внутрибрюшинно в течение 7 дней (опытная группа).
В качестве 2-го контроля использовали композицию, состоящую из клеток, полученных от интактного животного. За дозу препарата принимали количество белка, получаемого при разрушении 106 клеток в 1 мл дистиллированной воды.
При введении животным с криодеструкцией (КД) контрольной (2-я контрольная группа) композиции, которая получалась из клеток интактных животных, нами было отмечено увеличение массы миокарда, улучшение сократительной способности сердца, однако ни в одном из проведенных опытов не было получено полного восстановления сердечной мышцы. Следует отметить, что масса левого желудочка у крыс (опытная группа) с КД, которым вводили композицию, которая получалась из лизата клеток, полученных от животного, у которого перед забором клеток проводили биопсийный забор ткани миокарда, достоверно не отличалась от массы миокарда интактных животных (таблица 1) и была достоверно выше по сравнению с 2-м контролем. Уровень митозов в опытной группе был достоверно выше по сравнению с 2-й группой.
Проведенные нами эксперименты на животных продемонстрировали, что композиция, полученная из клеток крови и/или костного мозга, взятых у животного, у которого перед забором клеточного материала биопсийно забиралась ткань миокарда, ускоряет процесс регенерации клеток в поврежденном органе.
Пример 2. Влияние фармакологической композиции на процесс регенерации кожных покровов
Эффективность использования фармакологической композиции была показана на модели ожоговой регенерации.
В данной модели животным (мини-свиньи), находящимся под эфирным наркозом, наносили ожог площадью 50 см2.
Стадии получения фармакологической композиции
1) Получение ткани кожи у интактных животных
У животных, находящихся под эфирным наркозом, выбривали участок кожи на спине. Затем пункционно из нескольких проколов кожи забирали от 50 до 150 мкг кожной ткани. Место забора обрабатывается асептической жидкостью. Данная процедура является безвредной и безопасной и при соблюдении условий содержания животных не сопровождается развитием каких-либо осложнений (повреждение кожи, нагноение на месте биопсии и т.д.).
2) Получение клеток
а) Стволовые клетки получали из подкожного жира от животных, у которых перед забором клеток проводили биопсию кожи (в среднем за 5 суток). После выделения с использованием коллагеназы клетки ресуспендировались в культуральной среде. Выделенные клетки являются преимущественно стволовыми мезинхимальными клетками, что подтверждается методом культивирования и последующей окраски на специфические внутриклеточные маркеры, а также поверхностные белки.
б) Получение лейкоцитов из периферической крови
2 мл гепаринизированной крови смешивали с 1 мл подогретого до 37°C 3% раствора желатина и инкубировали в термостате при 37°C в течение 30 мин. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, отбирали в пластиковые пробирки и отмывали 10-кратным объемом фосфатно-солевого буфера (pH 7,4). Затем лейкоциты после центрифугирования в течение 10 мин при 1000 об/мин ресуспендировали в растворе Хенкса без Ca2+ и Mg2+. После подсчета числа лейкоцитов концентрацию клеток доводили до 106 кл.
3) Получение тканеспецифического антигена
Для получения тканеспецифического антигена использовали биопсийный материал, полученный из кожи. Ткань механически гомогенизируется. Полученный гомогенат заливается раствором Хенкса 1:1 и помещается в морозильную камеру на 1 час, затем ткань размораживают, данный цикл повторяют 3 раза. Затем гомогенат центрифугируют при 2000 об/мин 10 мин. Супернатант отбирают и фильтруют через фильтр с диаметром пор 0,22 мкм для обеспечения стерильности раствора. Концентрация белка в растворе определяется методом Лоури и должна находиться в диапазоне от 0,5 до 1 мг/мл.
4) Культивирование выделенных клеток с тканеспецифическим антигеном
Полученные клетки, а именно лейкоциты периферической крови и стволовые клетки, ресуспендируют в культуральной ростовой среде. В среду для культивирования клеток также добавляется тканеспецифический антиген, полученный из ткани кожи, взятой при биопсии. Клетки и тканеспецифический антиген культивируют совместно при 37°C в атмосфере, содержащей 5% CO2, и при 95% влажности в течение 7 суток. Супернатант тканеспецифического антигена добавлялся в культуральную среду в соотношении в среднем 1:30 (проверялся диапазон от 1:10 до 1:80).
5) Разрушение клеток
После культивирования клетки подвергались разрушению - 2 цикла замораживания-оттаивания и обработка ультразвуком. Полученный лизат клеток объединяли со средой, в которой культивировались клетки.
6) Из полученной композиции готовили инъекционные препараты, которые вводили животному внутрибрюшинно в течение 7 дней (опытная группа), а также мазь, которую наносили на раневую поверхность. В состав мази наряду с инертным наполнителем и фармакологической композицией входили антибиотики (гентамицин) и противовирусный препарат (ацикловир) для профилактики инфекции.
В качестве 2-го контроля использовали композицию, состоящую из разрушенных клеток, которые культивировались без тканеспецифического антигена, полученного из ткани кожи. За дозу препарата принимали количество белка, получаемого при разрушении 106 клеток в 1 мл дистиллированной воды.
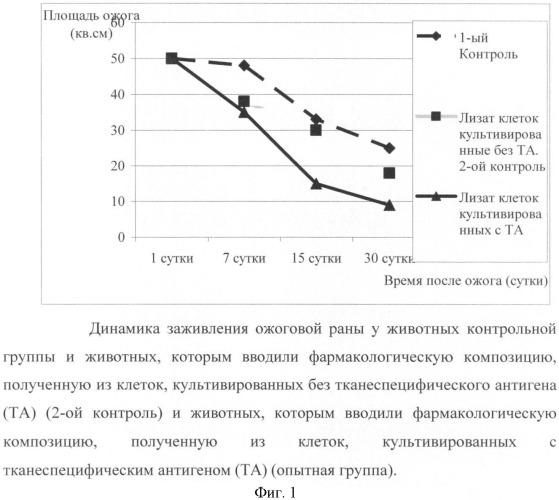
В работе оценивали площадь ожога, проводили гистологические исследования. Результаты работы представлены на фиг.1 и 2.
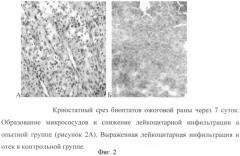
У животных, которым вводили фармакологическую композицию, полученную из клеток, которые культивировались без тканеспецифического антигена, на 3-4 сутки наблюдается выраженная регенерация поврежденных кожных покровов. Это сопровождается снижением отека, уменьшением воспаления, ростом грануляций и развитием микрососудов. Однако у животных, которым вводили композицию, полученную из клеток животного, которые культивировались совместно с тканеспецифическим антигеном, начиная с 7 суток наблюдается достоверно более быстрое закрытие раны и уменьшение времени эпителизации по сравнению с 1-м и 2-м контролем. Время закрытия раны у таких животных полностью коррелирует с количеством микрососудов, что определялась на гистологических срезах тканей, которые забирались при биопсиях (фиг.2)
Таким образом, фармакологическая композиция, полученная из клеток животного, которые культивировались с тканеспецифическим антигеном, способствует ускорению регенерации поврежденных органов и тканей.
Пример 3
Эффективность применения композиции полученной из лимфоидных и прогениторных клеток, полученных из периферической крови животных, для лечения токсического гепатита
В работе использовали морских свинок с моделью токсического гепатита (введение п/кожно 0,1 мл 40% масляного раствора CCL4 в течение 14 дней).
1) Получение клеток
Фармакологическую композицию готовили из культивированных лимфоидных и прогениторных клеток, полученных из периферической крови. Для повышения числа прогениторных клеток в периферической крови животному перед забором клеток вводили в течение 2 дней в/в Г-КСФ (гранулоцитарный колониестимулирующий фактор). Ведение препарата позволило повысить уровень гемопоэтических стволовых клеток с 0,5% (контроль) до 3,5% от общего количества мононуклеарных клеток в периферической крови. За 7 дней до забора клеток животному под контролем УЗИ в состоянии наркоза проводили биопсийный забор ткани печени.
Выделенные клетки состояли из лейкоцитов периферической крови и прогениторных клеток, что было подтверждено методом проточной цитофлюориметрии.
2) Получение тканеспецифического антигена
Для получения тканеспецифического антигена использовали биопсийный материал, полученный из ткани печени. Ткань механически гомогенизируется. Полученный гомогенат заливается раствором Хенкса 1:1 и помещается в морозильную камеру на 1 час, затем ткань размораживают, данный цикл повторяют 3 раза. Затем гомогенат центрифугируют при 2000 об/мин 10 мин. Супернатант отбирают и фильтруют через фильтр с диаметром пор 0,22 мкм для обеспечения стерильности раствора. Концентрация белка в растворе определяется методом Лоури и должна находиться в диапазоне от 0,5 до 1 мг/мл.
3) Культивирование выделенных клеток с тканеспецифическим антигеном
Полученные клетки, а именно лейкоциты периферической крови и прогениторные клетки, ресуспендируют в культуральной ростовой среде. В среду для культивирования клеток также добавляется тканеспецифический антиген, полученный из ткани печени при биопсии. Клетки и тканеспецифический антиген культивируют совместно при 37°C в атмосфере, содержащей 5% CO2, и при 95% влажности в течение 5-7 суток (проверяли от 1 до 15 суток). Супернатант тканеспецифического антигена добавлялся в культуральную среду в соотношении в среднем 1:30 (проверялся диапазон от 1:10 до 1:80).
5) Разрушение клеток
После культивирования клетки подвергались разрушению - 2 цикла замораживания-оттаивания и обработка ультразвуком. Полученный лизат клеток объединяли со средой, в которой культивировались клетки.
6) Полученную фармакологическую композицию вводили животным подкожно ежедневно в течение 7 дней.
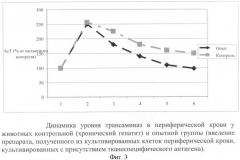
Эффективность лечения оценивали по данным биохимии крови (фиг.3).
Как видно из данных, представленных на фиг.3, через 1 неделю после начала введения CCL4 в крови животных наблюдается резкий (в 2,5 раза) подъем уровня трансаминаз (АсТ), что свидетельствует о цитолитическом действии токсина. Ведение композиции, полученной из разрушенных культивированных клеток и культуральной среды, в которой эти клетки культивировались, приводит к выраженному и достоверному лечебному эффекту, который проявляется нормализацией уровня трансаминаз. (За 100% процентов принят уровень фермента в крови интактных животных.)
Пример 4
Эффективность применения субстрата, полученного из культивированных клеток костного мозга, была изучена в опытах с моделированием дислипидемического повреждения печени у кроликов.
У кроликов с хронической дислипидемией в течение 4 месяцев развивается жировая дистрофия печени и резко нарушается морфометрическая характеристика гепатоцитов (таблица 1).
1) Получение клеток
Клетки получали из костного мозга по описанной выше методике. Выделенные клетки содержали стволовые и прогениторные клетки, что подтверждалось при культивировании и методом проточной цитометрии.
За 7 дней до забора клеток костного мозга у животного, находящегося в состоянии наркоза, под контролем УЗИ проводилась биопсия печени с забором ткани печени (от 50 до 200 мкг).
2) Тканеспецифический антиген готовили по описанной выше методике. Для получения тканеспецифического антигена использовали биопсийный материал, полученный из ткани печени. Ткань механически гомогенизируется. Полученный гомогенат заливается раствором Хенкса 1:1 и помещается в морозильную камеру на 1 час, затем ткань размораживают, данный цикл повторяют 3 раза. Затем гомогенат центрифугируют при 2000 об/мин 10 мин. Супернатант отбирают и фильтруют через фильтр с диаметром пор 0,22 мкм для обеспечения стерильности раст