Способ получения рацемического небиволола
Иллюстрации
Показать всеИзобретение относится к новому способу получения рацемического[2S*[R*[R*[R*]]]] и [2R*[S*[S*[S*]]]]-(±)α,α'-[иминобис(метилен)] бис [6-фтор-3,4-дигидро-2Н-1-бензопиран-2-метанола] формулы (I) (небиволола) и его фармацевтически приемлемых солей:
включающим стадии, указанные в описании, а также к промежуточным соединениям и способам их получения. 7 н. и 99 з.п. ф-лы, 12 табл., 9 ил.
Реферат
УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому способу получения рацемического небиволола, его энантиомерных форм и к новым соединениям, полученным данным способом
2. ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Небиволол (см. фигуру 1А, на которой показан d-Небиволол, химическое название [2R*[R*[R*(S*)]]]-α,α'-[иминобис(метилен)]бис[6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанол] или альтернативно [2R*[R*[R*(S*)]]]-α,α'-[иминобис(метилен)]бис[6-фторхроман-2-метанол], и фигуру 1В, на которой показан рацемический небиволол, который представляет собой смесь l- и d-небиволола) известен как адренергический бета-антагонист, антигипертензивное средство, ингибитор агрегации тромбоцитов и сосудорасширяющее средство.
Небиволол вводят в виде таблеток (например, доза гидрохлорида небиволола 5,45 мг эквивалентна 5 мг небиволола), которые содержат небиволол в виде рацемической смеси энантиомеров: SRRR-небиволола (правовращающего d-Небиволола) и RSSS-небиволола (левовращающего l-Небиволола).
Небиволол содержит четыре асимметрических центра, и поэтому теоретически возможно существование 16 стереоизомеров. Однако из-за особенностей структуры и конфигурации стереоизомеров (например, аксиальная симметрия) могут образовываться только 10 стереоизомеров (6 диастереомеров: 4 dl-формы и 2 мезо-формы) (таблица 1).
Нестереоселективное получение этих стереоизомеров в общих чертах описано в патенте США № 4654362 Van Lommen et al. (Janssen Pharmaceutica N. V.) (и его аналог EP 0145067). Стереоселективный синтез [2R,αS,2'S,α'S]-изомера α,α'-[иминобис(метилен)]бис[6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанола] описан в патенте США № 6545040 (Janssen Pharmaceutica N. V.) (и его аналоге EP 0334429).
Методика разделения диастереомерной смеси, состоящей из(±)-[2R*[1S*,5S*(S*)]]+[2R*[1S*[5R*(S*)]]]-α,α'-[иминобис(метилен)]бис[6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанолов] фракционной кристаллизацией соответствующих гидрохлоридных солей описана в патенте США № 5759580 (Janssen Pharmaceutica N. V.) (и его аналоге EP 0744946). Гидрохлорид небиволола может быть получен только с очень низким выходом 6,6%.
Публикация PCT-патентной заявки WO 2004/041805 (Egis Gyogyszergyar RT.) описывает новый способ получения рацемического [2S[2R*[R[R*]]]] и [2R[2S*[S[S*]]]]-(±)α,α'-[иминобис(метилен)]бис[6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанола] и его чистых [2S[2R*[R[R*]]]] и [2R[2S*[S[S*]]]] энантиомеров.
Альтернативные и энантиоселективные синтезы d-небиволола описаны в статьях (J. Am. Chem. Soc. 1998, 120, 8340-8347 и Tetrahedron 56, 2000, 6339-6344).
| Taблица 1.Стереоизомеры небиволола | ||||
| общая формула изомеров небиволола | ||||
| SRRSСтереоизомер 1 | SRRRСтереоизомер 2 d-небиволол | SRSRСтереоизомер 3мезо-форма 1 | SRSSСтереоизомер 4 | |
| RRRSСтереоизомер 2 d-небиволол | RRRRСтереоизомер 5 | RRSRСтереоизомер 6 | RRSSСтереоизомер 7мезо-форма 2 | |
| RSRSСтереоизомер 3мезо-форма 1 | RSRRСтереоизомер 6 | RSSRСтереоизомер 8 | RSSSСтереоизомер 9 l-небиволол | |
| SSRSСтереоизомер 4 | SSRRСтереоизомер 7мезо-форма 2 | SSSRСтереоизомер 9 l-небиволол | SSSSСтереоизомер 10 |
Способы получения небиволола, описанные в вышеупомянутых ссылках, кратко обобщены ниже.
а. Патент США № 4654362 (и его аналог EP 0145067 U.S) (Janssen Pharmaceutica N. V.)
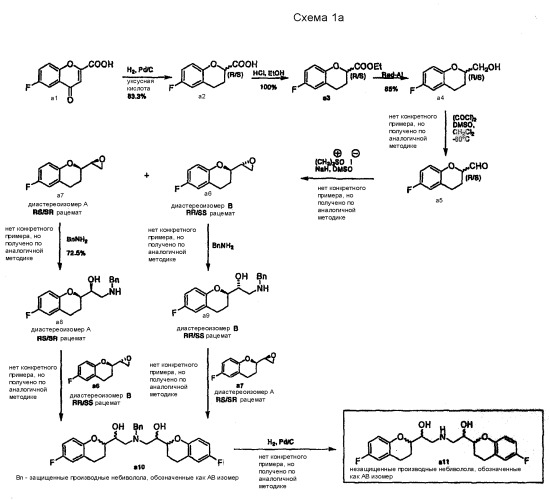
Синтетический путь нестереоселективного получения небиволола описан, исходя из 6-фтор-4-oксo-4H-1-бензопиран-2-карбоновой кислоты a1 (Схема 1a).
Для получения небиволола по Схеме 1а в патенте США № 4654362 и его аналоге EP 0145067 содержатся подробные примеры синтеза только компонентов a1, a2, a3, a4 и a8. Все другие примеры представляют собой аналоги методик, которые описывают получение родственных производных (например, производных без фторного заместителя в ароматическом кольце). Общая стратегия получения небиволола или его соответствующих производных основана на синтезе 2-оксиранилхроманов (a6 и a7) в качестве ключевых интермедиатов для конечных стадий сочетания. Вследствие наличия двух асимметрических атомов углерода, эти соединения могут образовываться из рацемических альдегидов a5 в виде двух диастереомерных рацематов ("А формы" a7 = RS/SR и "В формы"a6 = SS/RR), которые можно разделять с помощью хроматографии. В рассмотренной ссылке для желательных промежуточных продуктов не приводятся описания методик обработки, кристаллизации и очистки или разделения стереоизомеров, выходы и т.п.
Рацематы a6 или a7 могут быть превращены в соответствующие бензилированные аминоспирты а8 и а9 взаимодействием с бензиламином. Защищенная бензилом АВ смесь небивололов а10 может быть получена взаимодействием рацемата a8 (RS/SR) с рацематом эпоксида a6 (RR/SS) или взаимодействием рацемата a9 (RR/SS) с рацематом эпоксида a7 (RS/SR). Защитная группа может быть удалена на последней стадии каталитическим гидрированием, которое приводит к образованию АВ смеси небивололов a11.
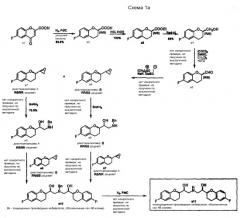
Схема 1b показывает дополнительные способы синтеза аналогичных 2-хроманилальдегидов (a14) и 2-оксиранилхроманов (a16) в качестве ключевых интермедиатов для синтеза производных небиволола, содержащих различные заместители в ароматической группе.
Альдегид a14 может быть получен низкотемпературным восстановлением имидазолида a12 или таким же восстановлением сложного эфира a13. Альдегид a14 затем превращают в 2-оксиранилхроманы a16 взаимодействием с гидридом натрия и йодидом триметилсульфоксония в диметилсульфоксиде по реакции, аналогичной описанной выше. Еще одной возможностью синтеза 2-оксиранилхроманов a16 является окисление 2-винилхромана a15 3-хлорпероксибензойной кислотой (источник 2-винилхромана a15 не указан в этих патентах, но согласно EP 0334429 (см. также ниже) соединение a14 можно превратить в соединение а15 реакцией Виттига).
На схеме 1c показано, что диастереомерные смеси, состоящие из желательных и нежелательных диастереомеров (т.e. RSSS/SRRR и RSRR/SRSS), могут быть получены, способом, представленны на схеме 1a.
Стратегия синтеза, описанная в патенте США № 4654362 и его аналоге EP 0145067, имеет следующие недостатки:
1. Синтез альдегидов a6 и a14 требует очень низких температур и поэтому требует специального оборудования, что усложняет и удорожает способ.
2. Альдегид а5 представляет собой очень нестабильное соединение, как указано в публикации РСТ-заявки WO 2004/041805.
3. Синтез a6/a7 из a5 может быть опасным, так как известно, что использование гидрида натрия в растворителях, подобных ДМСО, диметилформамиду (ДМФА), диметилацетамиду (DMA) и DMI, может вызвать экзотермическую реакцию и, следовательно, может вызвать неконтролируемую реакцию (см. UK Chemical Reaction Hazards Forum: "Sodium Hydride/DMF process stopped").
4. Соединения a6 и a7 были охарактеризованы как маслообразные вещества (см. публикацию РСТ-заявки WO 2004/041805). Так как получение в соответствии с описанной методикой приводит к образованию диастереомерной смеси a6 и a7, может потребоваться хроматографическая очистка, которая коммерчески нерентабельна.
5. Соединения а10 и а11 могут быть получены реакцией рацемического интермедиата а8 ("изомер A") с рацематом a6 ("изомер B") или альтернативно реакцией рацемического интермедиата a9 ("изомер B") с рацематом а7 ("изомер A") с последующим снятием защиты. В патенте США № 4654362 и его аналоге EP 0145067 не содержится четко сформулированного описания того, являются ли индивидуальными изомерами или смесью изомеров соединения а10 и а11 (охарактеризованы только как "AB" изомерная форма). Не представлено никаких соображений по разделению таких смесей. Очевидно, что такие методики могут приводить к образованию диастереомерных смесей, состоящих из желательного RSSS/SRRR диастереомера и нежелательного RSRR/SRSS диастереомера (схема 1c; ср. также таблицу 1, демонстрирующую комбинацию различных фрагментов, которая дает все возможные диастереомеры). Кроме того, из предшествующего уровня техники известно (см. WO 2004/041805), что рацемический небиволол, полученный способом, описанным в патенте США № 4654362 (и его аналоге EP 0145067) (схемы 1a и 1c) в виде диастереомерного рацемата с SRSS/RSRR конфигурацией не удалось успешно разделить фракционной кристаллизацией; и
6. Потери дорогостоящих веществ из-за образования нежелательных изомеров небиволола, особенно во время последних стадий способа.
b. Публикация европейкой патентной заявки EP 0334429 и патент США № 6545040 (Xhonneux et al., Janssen Pharmaceutica N.V.)
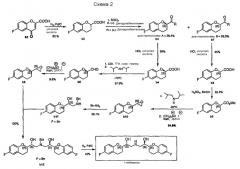
Аналогичная стратегия синтеза небиволола описана в EP 0334429 и патенте США № 6545040, но отличие состоит в том, что l-небиволол получают энантиоселективным синтезом, в котором в качестве ключевых интермедиатов используют энантиочистые фрагменты b6 и b11 (Схема 2).
Для этой методики необходимо разделить рацемическую 6-фторхроман-2-илкарбоновую кислоту b2 путем образования диастереомерного амида b3 с (+)-дегидроабиетиламином с последующей фракционной кристаллизацией диастереомеров и гидролизом амидов. Следующие стадии синтеза фрагментов b6 и b11 осуществляют конвергентными путями, используя (S)-форму и (R)-форму 6-фторхроман-2-илкарбоновых кислот b4 и b8. Сначала (S)-6- фторхроман-2-илкарбоновую кислоту b4 превращают в альдегид b5 по методике, уже упомянутой в схеме 1b. Затем можно получить эпоксид b6 взаимодействием b5 с гидридом натрия и йодидом триметилсульфоксония в диметилсульфоксиде. В случае второго пути (R)-6-фторхроман-2-илкарбоновую кислоту b8 сначала этерифицируют с образованием b9. Эпоксид b10 синтезируют по методике “без выделения” восстановлением b9 в соответствующий альдегид с последующей реакцией с гидридом натрия и йодидом триметилсульфоксония в диметилсульфоксиде. Кольцо эпоксида b10 раскрывают реакцией замещения бензиламином, которая дает второй ключевой фрагмент b11, последний затем подвергают взаимодействию с эпоксидом b6 и получают защищенный бензилом l-небиволол b12. Последняя стадия снятия защиты каталитическим гидрированием b12 дает l-небиволол.
Стратегия, описанная в EP 0334429 и патенте США № 6545040, имеет следующие недостатки:
1. Стадии получения соединений b5 из b4 и b10 из b9 требуют очень низких температур для восстановления диизобутилалюминийгидридом (DIBAH), что более усложняет и удорожает способ из-за потребности в специальном холодильном оборудовании.
2. Стадии получения соединений b6 из b5 и b10 из b9 могут представлять угрозу безопасности, так как известно, что использование гидрида натрия в растворителях, подобных ДМСО, ДМФА, DMA и DMI, может привести к экзотермической реакции и, следовательно, может вызвать неконтролируемую реакцию (см. UK Chemical Reaction Hazards Forum: "Sodium Hydride/DMF process stopped").
3. Соединения b5, b6, b9 и b10 представляют собой маслообразные вещества и поэтому их трудно очищать; в вероятном случае, когда соединения b6 и b10 загрязнены нежелательными диастереомерами, может потребоваться их разделение колоночной хроматографией, которая не является коммерчески рентабельным методом.
4. Низкие выходы, особенно выходы на стадиях получения соединений b2-b3-b4, b2-b7-b8 и b5-b6, b9-b10, в результате приводят к очень низкому общему выходу (меньше 0,5%) для синтеза l-небиволола, что делает рассматриваемую методику нерентабельной.
5. Так как получается только l-небиволол, а для получения небиволола требуется рацемическая смесь, необходимы дополнительные стадии для синтеза соответствующей d-формы (т.e., d-небиволола); и
6. При взаимодействии интермедиата b2 образуются диастереомеры b3 и b7, которые затем приходится разделять и обрабатывать по отдельности, получая b6 и b11, затем объединять для получения b12, следовательно, для способа требуется множество дополнительных стадий.
с. Публикация РСТ-патентной заявки WO 2004/041805 (Trinka et al., EGIS GYOGYSZERGYAR RT)
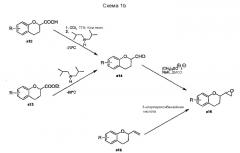
WO 2004/041805 описывает энантиоселективный синтез d- и l-небиволола (см. Схемы 3a-c).
Стратегия этого пути основана на синтезе и разделении защищенных изопропилиденовой группой изомеров (1`,2`-дигидроксиэтил)-6-фторхроман-4-она с11, c12, c13, с14 (Схема 3a). Указанные соединения синтезируют, начиная с ацилирования 4-фторанизола с1 хлорацетилхлоридом по Фриделю-Крафтсу c образованием хлорацетилпроизводного c2, которое далее трансформируется под действием трифенилфосфина с последующей обработкой слабым основанием в стабильное фосфанилиденовое производное c4. Соединение c4 затем подвергают взаимодействию или с защищенными глицериновыми альдегидами c6 (полученными из витамина C) с получением с11 и c12; или с c8 (полученным из D-маннита) с получением c13 и с14 после циклизации.
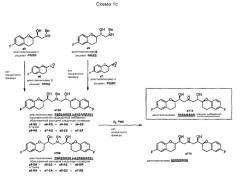
Каждый из этих изомеров был далее трансформирован четырьмя путями и аналогичным образом (Схемы 3b и 3c), в результате чего по путям 1 и 2 получают l-небиволол, используя с11 и c12 в качестве исходных соединений (Схема 3b).
Энантиомерный d-небиволол получают аналогичным образом, причем в качестве исходных веществ используют S,R-изомер c13 и R,R-изомер с14 (1`,2`-дигидроксиэтил)-6-фторхроман-4-она, защищенного изопропилиденовой группой (пути 3 и 4, Схема 3c).
Типичная последовательность реакций для каждого пути начинается со снятия защиты с11 (путь 1, Схема 3b), с12 (путь 2, Схема 3b), с13 (путь 3, Схема 3c), с14 (путь 4, Схема 3c) и получения соответствующих диолов с15, c19, c25, с29. Селективное тозилирование первичной спиртовой группы дает соединения c16, c20, c26, c30, которые можно затем превратить в эпоксиды c17, c21, c27, c31 обработкой основанием. После превращения этих эпоксидов действием бензиламина в c18, c22, c28, c32 и замещения требуемыми эпоксидами (c18+c21, c22+c17, c28+c31, c32+c27) образуются дикетопроизводные с23 и с33, защищенные бензильной группой. Снятие защиты и восстановление карбонильных групп можно проводить в одном реакторе каталитическим гидрированием и получать или l-небиволол, или d-небиволол.
Рацемический небиволол получают, приготавливая смесь (1:1) интермедиатов c23 и c33 перед проведением последней стадии гидрирования (выход 52%).
Стратегия, описанная в WO 2004/041805, имеет следующие недостатки:
1. Хотя стратегия основана на использовании всех стереоизомеров для синтеза или l-небиволола или d-небиволола, основным недостатком является то, что для получения рацемической смеси необходимо осуществить 30 стадий, используя все интермедиаты, что делает такой синтез длительным и нерентабельным; и
2. Стадии получения соединений c23 из cl8, c23 из c22, c33 из c28 и c33 из c32 проводят без применения растворителя при 145°С (преимущественно после плавления реагента). Такая методика не подходит для использования в больших масштабах.
d. Johannes et al., J. Am. Chem. Soc. (1998), 120, 8340-8347
В статье Johannes c соавторами описано энантиоселективное получение d-небиволола (Схема 4).
Стратегия основана на синтезах хиральных фрагментов хромана d12 (R,R-конфигурации) и d21 (S,S-конфигурации) в качестве ключевых интермедиатов в конвергентных путях, которые в результате соединяются и дают после снятия защиты d-небиволол. Существенно важной стадией в синтезе упомянутых хиральных хроманов является катализируемое Zr кинетическое разделение рацемических интермедиатов d7 и d16.
В соответствии с первым путем исходным веществом для получения фрагмента хромана d12 является салициловый альдегид d3, который синтезируют или формилированием соединения d1, или реакцией литиилированного соединения d2 с ДМФА при -60°С. Затем эпоксид аллильного циклогептена, который можно получать эпоксидированием циклогептадиена, подвергают взаимодействию с альдегидом d4, получая рацемическое соединение d7 путем региоселективного и стереоселективного нуклеофильного раскрытия цикла эпоксида d8. Защита гидроксильной группы d7 с использованием TBSOT с последующей обработкой 5 экв. EtMgCl и 10 мол.% (R)-(EBTHI)Zr-бифенола дает d8 с выходом 44% и >98%ee. Мо-катализируемая реакция метатезиза в атмосфере этилена с последующим окислением концевой двойной связи по Вакеру (Wacker) и последующим каталитическим гидрированием дает d10 с общим выходом 83%. Чтобы синтезировать d11 из d10 необходимо фотохимическое расщепление Норриша типа II. Следующая последовательность трех стадий: озонолитическое расщепление, реакция Мицунобу, в которой используют трибутилфосфин и фталид, и последующий гидразинолиз, для удаления фталимидильной группы дает интермедиат d12. Второй путь начинается синтезом рацемата d16 с цис-конфигурацией, который затем разделяют в присутствии циркониевого катализатора (S)-(EBTHI)Zr-бифенола. Соединение d17 превращают в соединение d18 Мо-катализируемой реакцией метатезиса. Окисление по Вакеру (Wacker) концевой двойной связи и последующее каталитическое гидрирование дают интермедиат d19, который далее фотохимическим расщеплением Норриша типа II и озонолизом превращают в альдегид d21. D-Небиволол получают затем восстановительным аминированием соединений d12 и d21 с последующим удалением силилэфирных защитных групп.
Стратегия, описанная в статье Johannes с соавторами, имеет следующие недостатки:
1. Получение альдегида d3 происходит или с низким выходом реакцией формилирования d1, использующей хлороформ в присутствии основания, или требует низкой температуры для литиилирования и формилирования производного d2. Кроме того, работа с н-BuLi в промышленном масштабе требует особых мер предосторожности.
2. Стадии получения производных d8 из d7 и d16 и d17 из d13/d14 также требуют низкой температуры (-78°С) для силилирования. Кроме того, необходима трудная стадия разделения, которая использует особый коммерчески недоступный Zr-катализатор.
3. Стадии получения соединений d10-d11 и d19-d20 требуют специального оборудования для проведения фотохимической реакции (расщепление по Норришу, тип 2).
4. Стадия получения соединения d12 из d11 требует низкой температуры (-78°C) и специального оборудования для проведения озонолиза.
5. Для синтеза одного энантиомера небиволола (d-формы) необходимо 16-20 стадий, но требуется рацемическая смесь; поэтому нужны дополнительные стадии, чтобы синтезировать соответствующую l-форму (т.e. l-небиволол).
e. Chandrasekhar et al., Tetrahedron (2000), 56, 6339-6344
В статье Chandrasekhar с соавторами описана еще одна методика энантиоселективного синтеза d-небиволола (см. схему 5).
Основой для упомянутой энантиоселективной стратегии является асимметрическое однореакторное эпоксидирование аллилового спирта e7 по Шарплессу, в котором используют (-)-DET и (+)-DET, для получения обоих энантиомерных диолов e8 и e12 после стадии циклизации.
Исходным соединением является 4-фторфенол e1, который сначала превращают в простой аллиловый эфир e2. Перегруппировка Кляйзена при 210°С с последующей защитой фенольной группы (e3) TBDMS-Cl приводит к образованию интермедиата e4. Первичный спирт e5 получают гидроборированием и последующей окислительной обработкой H2O2. Продукт e5 превращают в α,β-ненасыщенный сложный эфир e6 однореакторным окислением периоданом Десса-Мартина и олефинированием по Виттигу. Затем соединение e6 восстанавливают DIBAL-H в аллиловый спирт e7. На этой стадии путь разделяется на два пути, каждый из которых начинается с асимметрического эпоксидирования по Шарплессу и циклизации в одном реакторе. Согласно первому пути диол e8 может быть получен с выходом 65% действием (-)-DET. Селективное тозилирование первичного спирта e8 и замещение e9 азидом с последующим каталитическим восстановлением е10 дает аминоспирт е11. По второму пути синтезируют диол e12, почти аналогично диолу e8, за исключением того, что используют (+)-DET для эпоксидирования по Шарплессу, получая соответствующее энантиомерное соединение. Инверсия на атоме углерода C2 в условиях реакции Мицунобу действием п-нитробензойной кислоты приводит к образованию соединения e13, защищенного двумя PNB группами. После удаления защитных групп может быть получен диастереомерный диол e14. Селективное тозилирование e14 и обработка полученного e15 основанием дает эпоксид е16. Синтез гидрохлорида d-небиволола может быть завершен реакцией сочетания аминоспирта е11 с эпоксидом е16 с последующей трансформацией в гидрохлоридную соль.
Стратегия, описанная в статье Chandrasekhar с соавторами, имеет следующие недостатки:
1. Стадия получения соединения e3 из e2 требует высокой температуры для перегруппировки Кляйзена, которая практически недостижима в промышленных масштабах.
2. Для синтеза только одного энантиомера небиволола требуется до 16 стадий, но необходима рацемическая смесь.
3. Последняя стадия сочетания дает d-небиволол с низким выходом (20%).
4. Асимметрическое эпоксидирование по Шарплессу, как известно, не приводит к энантиочистым продуктам. Поэтому вероятны загрязнения другими стереоизомерами. Для определения таких возможных загрязнений недостаточно описанного способа измерения оптической чистоты, как уже упоминалось в WO 2004/041805.
5. Почти все интермедиаты очищают колоночной хроматографией, так как большинство интермедиатов представляют собой маслообразные соединения.
Таким образом, многочисленные стадии (более 13), низкий выход, использование необычных катализаторов, условий реакции, специального оборудования и колоночной хроматографии для очистки преимущественно маслообразных интермедиатов делают имеющиеся стратегии и большинство стадий слишком трудоемкими и экономически неприемлемыми для промышленного способа.
Несмотря на вышеописанные работы, существует потребность в новом, эффективном и практически осуществимом в промышленных масштабах способе получения рацемического небиволола с увеличенным общим выходом.
Все цитируемые здесь ссылки включены в данную заявку во всей полноте путем ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям и интермедиатам, а также к способам, которые можно использовать непосредственно для селективного синтеза небиволола или рацемического ([2S*[R*[R[R*]]]]- и ([2R*[S*[S[S*]]]]-(±)-α,α`- [иминобис(метилен)]бис[6-фторхроман-2-метанола] формулы (I)
и его чистых ([2S[2R*[R[R*]]]]- и ([2R*[S*[S[S*]]]]-энантиомерных форм и фармацевтически приемлемых солей.
Соответственно способ получения рацемического [2S*[R*[R*[R*]]]] и [2R*[S*[S*[S*]]]]-(±)α,α`-[иминобис(метилен)]бис[6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанола] и его фармацевтически приемлемых солей включает
(a) предоставление соединения формулы (VIII)
в виде диастереомерно чистого соединения, содержащего по меньшей мере 95% RS/SR конфигурации или RR/SS конфигурации, где PG представляет собой водород или аминозащитную группу, причем аминозащитная группа представляет собой по меньшей мере одну из аллильной группы или арил-C1алкильной группы;
(b) предоставление рацемического соединения формулы (V)
где LG выбрана из группы, состоящей из хлора, брома, йода, алкилсульфонилокси и арилсульфонилокси;
(c) N-алкилирование соединения формулы (VIII) соединением формулы (V), где указанное N-алкилирование проводят в инертном органическом растворителе в присутствии основания и необязательно в присутствии катализатора, с получением соединения формулы (IX),
соединения формулы (IX'), которое представляет собой циклическую полукетальную форму соединения формулы (IX),
или их смеси, где соединение формулы (IX) и соединение формулы (IX') представляют собой смеси диастереомеров;
(d) разделение диастереомеров соединения формулы (IX) или соединения формулы (IX') по меньшей мере одним из (d1) или (d2) способов, где
(d1) разделение диастереомеров соединения формулы (IX) или соединения формулы (IX') фракционной кристаллизацией после образования соли или после модификации с получением по существу чистых диастереомеров формулы (IX) или формулы (IX'), содержащих по меньшей мере 50% RSS/SRR или RRS/SSR конфигурации;
(d2) разделение диастереомеров соединения формулы (IX) или соединения формулы (IX') с получением по существу чистых диастереомеров формулы (IX) или формулы (IX'), содержащих по меньшей мере 50% RSS/SRR или RRS/SSR конфигурации, на стадии одновременной эпимеризации-кристаллизации, где стадия эпимеризации-кристаллизации включает:
(1) эпимеризацию соединения формулы (IX) или формулы (IX') RSR/SRS конфигурации с получением смеси диастереомеров формулы (IX) или формулы (IX') RSS/SRR конфигурации и RSR/SRS конфигурации или
эпимеризацию соединения формулы (IX) или (IX') RRR/SSS конфигурации с получением смеси диастереомеров формулы (IX) или формулы (IX') RRS/SSR конфигурации и RRR/SSS конфигурации, при условии, что указанную эпимеризацию проводят в присутствии основания и органического растворителя, где смесь необязательно охлаждают, используя градиент температуры и где диастереомеры RSS/SRR конфигурации или RRS/SSR конфигурации в смеси получают по меньшей мере в двукратном избытке относительно диастереомеров RSR/SRS конфигурации и RRR/SSS конфигурации; и
(2) кристаллизацию по существу чистых диастереомеров формулы (IX) или формулы (IX') с RSS/SRR конфигурацией или RRS/SSR конфигурацией по меньшей мере в двукратном избытке относительно диастереомеров RSR/SRS конфигурации и RRR/SSS конфигурации;
разделение смеси фракционной кристаллизацией необязательно после образования соли или после модификации с получением по существу чистых диастереомеров формулы (IX) или формулы (IX') с RSS/SRR или RRS/SSR конфигурацией;
(e) восстановление по существу чистых диастереомеров формулы (IX) или формулы (IX') с RSS/SRR или RRS/SSR конфигурацией с получением соединения формулы (X)
в виде RSSS/SRRR диастереомерной смеси, в которой отношение RSSS/SRRR диастереомерной конфигурации к SRSR или RRSS диастереомерной конфигурации составляет по меньшей мере 1;
(f) снятие защиты соединения формулы (X), при условии, что PG не является H (а если РG представляет собой H, тогда отменяют стадию снятия защиты) с получением соединения формулы (I) или его фармацевтически приемлемых солей; и
(g) удаление соединения формулы (I) или его фармацевтически приемлемых солей RSRS или RRSS диастереомерной конфигурации, если они имеются, перекристаллизацией или суспендированием с получением рацемического [2S*[R*[R*[R*]]]] и [2R*[S*[S*[S*]]]]-(±)[α,α'-[иминобис(метилен)]бис[6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанол] или его фармацевтически приемлемые соли.
Дополнительно предоставляется рацемический ([2S*[R*[R*[R*]]]]- и ([2R*[S*[S*[S*]]]]-(±)-α,α`-[имино-бис(метилен)]бис[6-фторхроман-2-метанол] соединения формулы (I), полученное способом, описанным выше.
Предпочтительный вариант осуществления способа показан на схеме 6а
Исходным соединением является 6-фторхроман-2-карбоновая кислота II, которую превращают соответствующими трансформациями (стадии 1, 2 и 3) в соединение V, содержащее подходящую уходящую группу (LG). Селективное восстановление соединения V с последующим образованием эпоксида и замещением защищенным амином дает соединение VIIIa после фракционной кристаллизации. В этом случае порядок трансформаций может быть изменен без необходимости образования эпоксида. Реакция сочетания соединения VIIIa с соединением V дает диастереомерную смесь соединений IXa и Xb, после чего соединение IXa селективно выделяют и почти селективно восстанавливают в смесь соединений Xa (основной продукт) и Xb (минорный продукт). Полученную смесь затем подвергают снятию защиты и после образования соли с HCl рацемический гидрохлорид небиволола I селективно кристаллизуется. Общий выход составляет 8%, однако дополнительные количества соединения V, используемые на стадии 7, не учитываются.
В предпочтительном варианте осуществления изобретения защитная группа представляет собой бензильную группу. В некоторых вариантах осуществления изобретения уходящая группа представляет собой хлор или бром.
В некоторых вариантах осуществления способа на стадии (b) соединение формулы (V) получают в количестве от около 1,0 до около 1,5 эквивалента.
В некоторых вариантах осуществления способа на стадии (c) органический растворитель представляет собой полярный апротонный растворитель, выбранный из группы, состоящей из ДМФА, DMA и NMP.
В некоторых вариантах осуществления способа на стадии (c) основание представляет собой по меньшей мере один из третичных аминов, карбонатов щелочных металлов или гидрокарбонатов щелочных металлов. Предпочтительным основанием является гидрокарбонат натрия. Предпочтительно использовать от около 1,5 до около 2,5 эквивалента основания.
В некоторых вариантах осуществления способа на стадии (c) катализатор представляет собой по меньшей мере один из бромидов щелочных металлов, йодидов щелочных металлов, бромидов тетраалкиламмония или йодидов тетраалкиламмония. Предпочтительным катализатором является бромид натрия. Предпочтительно используют от около 0,1 до около 0,25 эквивалента катализатора и наиболее предпочтительно использовать 0,15 эквивалента катализаторов.
В некоторых вариантах осуществления изобретения на стадии (c) указанное N-алкилирование проводят при температуре от около комнатной до около 80°С.
В некоторых вариантах осуществления на стадии (d) фракционную кристаллизацию проводят в растворителе. Предпочтительным растворителем является ацетонитрил. Предпочтительно использовать свободный амин для фракционной кристаллизации. В некоторых вариантах осуществления используют от около 0,4/n до около 0,6/n эквивалента силилирующего реагента и n обозначает число переносимых силильных групп, приходящихся на силилирующий реагент. Предпочтительно, чтобы силилирующий реагент представлял собой по меньшей мере один из триметилсилилхлорида, HMDS или BSU.
В некоторых вариантах осуществления изобретения на стадии (d1) силилирующий реагент используют для модификации до проведения фракционной кристаллизации из растворителя. Модификацию проводят предпочтительно в присутствии от около 1,0 до около 2,0 эквивалента основания. Предпочтительным основанием является имидазол.
В некоторых вариантах осуществления на стадии (d1) упомянутое разделение диастереомеров соединения формулы (IX) или соединения формулы (IX') проводят в ацетонитриле, метил-трет-бутиловом эфире (MTBE), циклогексане или их смесях.
В некоторых вариантах осуществления способа стадию (d2) проводят для соединения формулы (IX) или (IX`) RSR/SRS конфигурации. Конфигурацию RSS/SRR в смеси получают предпочтительно при примерно девятикратном избытке RSR/SRS.
В некоторых вариантах осуществления способа на стадии (d2) смесь охлаждают при градиенте температуры от около 70°C до около 20°C. В предпочтительном варианте осуществления изобретения градиент температуры составляет от 70° до 40°С.
В некоторых вариантах осуществления способа на стадии (d2) упомянутую эпимеризацию проводят в присутствии по меньшей мере 0,1 эквивалента основания. В некоторых вариантах осуществления упомянутую эпимеризацию проводят в присутствии по меньшей мере 0,25 эквивалентов основания.
В некоторых вариантах осуществления на стадии (d2) основание представляет собой соединение, выбранное из группы, состоящей из алкоксида, амидина, гуанидина и фосфазена. Предпочтительным основанием является амидин. В предпочтительном варианте осуществления изобретения основание представляет собой диазабициклоундецен.
В некоторых вариантах осуществления на стадии (d2) содержание воды, если она имеется, не может превышать 1,0%. В некоторых вариантах осуществления на стадии (d2) содержание воды, если она имеется, не может превышать 0,1%.
В некоторых вариантах осуществления на стадии (e), упомянутое восстановление проводят для соединения формулы (IX) или соединения формулы (IX') RSS/SRR конфигурации в растворителе действием боргидрида щелочного металла, боргидрида тетрабутиламмония, селектрида (SELECTRIDE) щелочного металла или боргидрида цинка необязательно в присутствии кислоты Льюиса. В некоторых вариантах осуществления кислота Льюиса представляет собой по меньшей мере одно вещество из Ti(OАлкил)4, ZnCl2, галогенида щелочного металла или галогенида щелочноземельного металла. Предпочтительно, чтобы растворитель представлял собой по меньшей мере один из эфира, спирта или галогенированного углеводорода. В некоторых вариантах осуществления изобретения упомянутое восстановление проводят при температурах от около -20°C до около комнатной.
В некоторых вариантах осуществления на стадии (f) упомянутое снятие защиты проводят каталитическим гидрированием.
В некоторых вариантах осуществления на стадии (g) упомянутую очистку соединения формулы (I) осуществляют суспендированием его гидрохлоридной соли в растворителе. Суспендирование проводят предпочтительно в метаноле в качестве растворителя.
В некоторых вариантах осуществления изобретения упомянутое предоставление соединения формулы (VIII) включает:
(i) восстановление рацемического соединения формулы (V) в растворителе и необязательно в присутствии кислоты Льюиса, где LG представляет собой бром или хлор, с образованием диастереомерной смеси соединений формулы (VI)
(ii) образование смеси диастереомеров соединения формулы (VII)
;
(iii) взаимодействие диастереомеров соединения формулы (VII) с NH2PG с образованием смеси диастереомеров соединения формулы (VIII)
и
(iv) разделение диастереомеров соединения формулы (VIII) смеси диастереомеров фракционной кристаллизацией необязательно после образования соли. В предпочтительном варианте осуществления изобретения PG представляет собой бензильную группу.
В некоторых вариантах осуществления изобретения выделяют по меньшей мере один из диастереомеров соединения формулы VIII, имеющий RR/SS или RS/SR конфигурацию.
Еще один аспект настоящего изобретения относится к способу рециркуляции нежелательных диастереомеров, получаемых во время способа, который уменьшает затраты и делает способ получения небиволола более эффективным. Конкретно во время селективного получения соединений VIIIa и Xa нежелательные диастереомеры образуются в качестве минорных продуктов. Поэтому рециркуляция отходов представляет собой экономическое и экологическое преимущество по сравнению с предшествующими способами получения небиволола.
Алкилирование соединения VIIIa соединением V также образует диастереомерную смесь (смесь IXa и IXb, 1:1), где стадия рециркуляции делает возможной трансформацию нежелательной формы IXb или путем селективного расщепления с образованием соединения VIIIa, или проведением подходящей стадии эпимеризации в смесь соединений IXa и IXb с последующим селективным выделением желательного диастереомера IXa.
В некоторых вариантах осуществления способа проводят рециркуляцию соединения формулы (VIII) RR/SS конфигурации, который включает:
предоставление соединения формулы (VIII) с защитной группой RR/SS конфигурации; и
инверсию конфигурации спирта с образованием соединения формулы VIII SR/RS конфигурации.
В некоторых вариантах осуществления изобретения на стадии i) восстановитель выбирают из боргидрида щелочного металла, боргидрида тетраалкиламмония, боргидрида цинка, триацетоксиборгидрида щелочного металла, SUPERHYDRIDE, RED-AL, селектрида (SELECTRIDE) щелочного металла или координационных боргидридов. В некоторых вариантах осуществления изобретения на стадии i) упомянутое восстановление проводят в условиях реакции Меервейна-Понндорфа-Верлея. В некоторых вариантах осуществления на стадии i) упомянутое восстановление проводят каталитическим гидрированием. В некоторых вариантах осуществления на стадии i) кислота Льюиса представляет собой кислоту, выбранную из группы, состоящей из хлоридов щелочных или щело