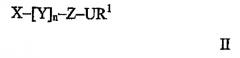Сульфатированные производные олигосахаридов
Иллюстрации
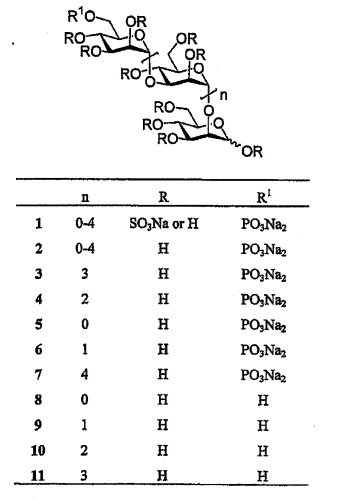
Показать всеНастоящее изобретение относится к сульфатированным олигосахаридам общей формулы X-[Y]n-Z-UR1, где X, Y и Z, каждый, представляет собой одинаковый гексозный моносахаридный фрагмент, выбранный из группы, включающей глюкозу, маннозу, алтрозу, аллозу, талозу, галактозу, идозу и галозу, при этом соседние моносахаридные фрагменты связаны 1→2, 1→3, 1→4, и/или 1→6 гликозидными связями, а к каждому атому углерода, не связывающему группы X, Y и Z, посредством одинарной связи присоединена группа UR за исключением атома углерода в положении 1 моносахарида Z, к которому посредством одинарной связи присоединена группа UR1; где n целое число и принимает значения от 0 до 6; U представляет собой атом О, или NH; каждый R независимо представляет собой С2-С6-алкенил, бензил, SO3M или Н, где М представляет собой любой фармацевтически приемлемый катион щелочного металла или органического амина, или R вместе с U представляет собой N3; R1 представляет собой С1-С12алкил, бензил, монометиловый эфир PEG или его производное, С1-С12алкилазид,
в форме сложного эфира, свободной кислоты или свободного основания, или гидрата. Изобретение относится также к фармацевтической или ветеринарной композиции на основе указанных соединений для профилактики или лечения расстройства млекопитающего субъекта, которое является пролиферативной ретинопатией, твердой опухолью и/или результатом метастаза, коагуляции/тромбоза, и/или заражения организма вирусными инфекциями. Кроме того, изобретение относится к применению указанных соединений для производства лекарственного средства для профилактики или лечения у млекопитающего субъекта расстройства, которое является результатом метастаза, коагуляции/тромбоза и/или заражения организма вирусными инфекциями. 3 н. и 8 з. п. ф-лы, 3 табл., 1 ил.
Реферат
Область техники, к которой относится изобретение
Представленное изобретение относится к соединениям, обладающим активностью в качестве ингибиторов гепарансульфат-связывающих белков и в качестве ингибиторов ферментной гепараназы. Более точно, изобретение относится к сульфатированным производным олигосахаридов, хотя область настоящего изобретения не ограничивается только ими. В частности, изобретение относится к полисульфатированным производным олигосахаридов, причем получение производных предпочтительно проводится по С-1 восстанавливающему концу и/или С-6 невосстанавливающему концу моносахаридного звена. Изобретение относится также к способам получения соединений, композициям, включающим указанные соединения, и применению соединений и их композиций для противоангиогенного, противометастазного, противовоспалительного, противомикробного, противокоагулянтного и/или противомикробного лечения млекопитающего субъекта. Соединения и их композиции могут также применяться для снижения уровня содержания триглицеридов в крови и ингибирования сердечно-сосудистого заболевания у млекопитающего субъекта. Кроме того, соединения могут также применяться для профилактики вышеуказанных расстройств при введении их млекопитающему субъекту.
Уровень техники
Было показано, что сульфатированное олигосахаридное лекарственное средство, известное как PI-88 [1, 2] (см. соединение 1 ниже), является перспективным ингибитором роста опухоли и метастаза [1, 3] и проходит II фазу клинических испытаний на пациентах, больных раком [4]. PI-88 проявляет противоангиогенные эффекты посредством ингибирования взаимодействий факторов роста кровеносных сосудов (главным образом, FGF-1, FGF-2 и VEGF) и их рецепторов с гепарансульфатом [1, 5]. Кроме того, PI-88 является сильным ингибитором ферментной гепараназы, гликозидазы, расщепляющей боковые гепарансульфатные цепи протеогликанов, которые являются основными компонентами внеклеточного матрикса (ЕСМ) и базальных мембран, окружающих опухолевые клетки [1, 2]. Гепараназа в значительной степени вовлечена в развитие кровеносных сосудов: она обладает способностью высвобождать активные гепарансульфат-связанные факторы роста кровеносных сосудов из ЕСМ и вовлечена в разложение ЕСМ и последующее трансформирование тканей, связанное с развитием новых кровеносных сосудов [6]. Разложение ЕМС гепараназой также играет важную роль в распространении опухолевых клеток (метастаз), обеспечивая возможность их поступления в кровяной поток и размещая в удаленных сайтах, где они могут образовывать вторичные опухоли [6, 7].
В дополнение к противоангиогенным эффектам PI-88 ингибирует каскад коагулирования крови через (i) ингибирование протеаз в гемокоагуляции, обусловленной эндогенными факторами, (ii) стимулирование высвобождения ингибитора пути метаболизма тканевого фактора (TFPI) и (iii) активацию ингибирования тромбина, проводимого кофактором гепарина. Однако PI-88 не взаимодействует с АТ III и, следовательно, не проявляет противодействующей активности в отношении Ха или противодействующей АТ III-проводимой активности в отношении IIa [8, 9]. Исследования, проведенные in vivo на обезьянах, показали, что применение PI-88 в низких дозах стимулирует высвобождение всех гепарансульфат-связанных TFPI из клеточной стенки сосуда [9]. Ранее было показано, что помимо влияния на коагулирование TFPI является лекарственным средством для лечения развития кровеносных сосудов [10] и ингибитором метастаза [11]. Было также показано, что PI-88 блокирует пролиферацию гладких миоцитов сосудов и начальное утолщение [12], ингибирует инфицирование клеток вирусом простого герпеса (herpes simplex virus - HSV) и распространение HSV-1 и HSV-2 от клетки к клетке [13], а также ингибирует протеинурию в пассивном нефрите Гейманна [14].
PI-88 представляет собой смесь высокосульфатированных монофосфорилированных маннозоолигосахаридов, размер которых изменяется в интервале от ди- до гексасахарида [15, 16]. PI-88 получен исчерпывающим сульфированием [2, 16] олигосахаридфосфатной фракции (2) (см. формулу I ниже), полученной в результате гидролиза фосфоманнана дрожжей Pichia (Hansenula) holstii NRRL Y-2448 в мягких условиях с использованием кислоты в качестве катализатора [17, 18]. Основными его компонентами являются пента- и тетрасахаридфосфаты 3 (~60%) и 4 (~30%) соответственно, в то время как оставшиеся 10% составляют ди-, три- и гексасахаридфосфаты (5-7), а также тетрасахариламин (не показан) [15, 16].
Формула I
Хорошо известно, что другие полисульфатированные олиго- и полисахариды и их производные также проявляют биологические активности, аналогичные активностям PI-88 [19-25]. Эти биологические активности относятся к ингибированию различных гепарансульфат(HS)-cвязывающих белков. Предметом настоящего изобретения является разработка производных PI-88, которые обладают аналогичными биологическими активностями, но характеризуются улучшенными свойствами, например улучшенными фармакокинетическим и/или ADME (абсорбция, распределение, метаболизм, экскрекция) профилями. Еще одним предметом настоящего изобретения является предоставление соединений, содержащих единый углеродный скелет для облегчения их синтеза и идентификации.
Сущность изобретения
В соответствии с первым вариантом осуществления изобретения, предоставлено соединение общей формулы
где Х, Y и Z, каждый представляет собой моносахаридный фрагмент, в котором к каждому атому углерода, не связывающему группы Х, Y и Z, посредством одинарной или кратной связи присоединена группа UR за исключением атома углерода в положении 1 моносахарида Z, к которому посредством одинарной или кратной связи присоединена группа UR1;
n представляет собой целое число и принимает значения от 0 до 6;
каждый U независимо представляет собой атомы С, N, S или О или указанные атомы с более высокой степенью окисления, включая СО, СОО, NO, NO2, S(O), S(O)O;
каждый R независимо представляет собой SO3M или Н, где М представляет собой любой фармацевтически приемлемый катион или любую алкильную, арильную, ацильную, ароильную, алкилсульфонильную, арилсульфонильную группу, группу PEG или ее производную группу, Н или группу
где независимо в каждой АВ группе А представляет собой О или NH, В представляет собой Н или М, где М принимает значения, определенные выше, или алкил, арил или любую другую подходящую группу;
R1 представляет собой SO3M, H, алкил, арил, ацил, ароил, алкилсульфонил, арилсульфонил, PEG или PEG-производное, или R1 вместе с U представляет собой N3 или замещенный триазол или его производное, замещенный тетразол или его производное, замещенный арил или его производное или замещенный гетероарил или его производное;
при условии, что когда все UR1 и UR группы представляют собой OSO3M или OH (за исключением экзоциклической метиленовой группы моносахаридного Х), экзоциклическая метиленовая группа моносахарида Х не может представлять собой OSO3M2 группу.
В соответствии со вторым вариантом осуществления изобретения, предоставлена фармацевтическая или ветеринарная композиция для профилактики или лечения расстройства у млекопитающего субъекта, которое является результатом развития кровеносных сосудов, метастаза, воспаления, коагуляции/тромбоза, повышенного уровня содержания в крови триглицеридов, заражения организма болезнетворными микроорганизмами, и/или сердечно-сосудистого заболевания, указанная композиция включает, по меньшей мере, одно соединение согласно первому варианту осуществления изобретения вместе с фармацевтически или ветеринарно приемлемым носителем или разбавителем для указанного, по меньшей мере, одного соединения.
Третий вариант осуществления настоящего изобретения включает применение соединения согласно первому варианту осуществления изобретения для производства лекарственного средства для профилактики или лечения расстройства у млекопитающего субъекта, которое является результатом развития кровеносных сосудов, метастаза, воспаления, коагуляции/тромбоза, повышенного уровня содержания в крови триглицеридов, заражения организма болезнетворными микроорганизмами, и/или сердечно-сосудистого заболевания.
В соответствии с четвертым вариантом осуществления изобретения, предоставлен способ профилактики или лечения расстройства млекопитающего субъекта, которое является результатом развития кровеносных сосудов, метастаза, воспаления, коагуляции/тромбоза, повышенных уровней содержания в крови триглицеридов, заражения организма болезнетворными микроорганизмами, и/или сердечно-сосудистого заболевания, указанный способ включает введение субъекту эффективного количества, по меньшей мере, одного соединения согласно первому варианту осуществления изобретения или композиции, включающей, по меньшей мере, одно соединение.
Дополнительный вариант осуществления изобретения включает новые промежуточные продукты и путь синтеза, который приводит к получению сульфатированных олигосахаридов согласно первому варианту осуществления изобретения.
Предпочтительные соединения согласно изобретению, в которых моносахаридные молекулы представляет собой исключительно D-маннозу, и гликозидные мостики представляют собой α(1→2) и α(1→3), представлены на следующей структуре:
где R, R1, U и n принимают значения, определенные выше.
Для простоты понимания настоящего изобретения и внедрения изобретения в практику далее будут описаны, только в качестве примеров, один или несколько предпочтительных вариантов его осуществления со ссылкой на прилагающуюся фигуру.
Краткое описание чертежей
На чертеже проиллюстрировано влияние PI-88-подобных соединений на способности заражения HSV-1 (А) и распространение HSV-2 от клетки к клетке (В). На графике А результаты представлены в виде количества колониеобразующих вирусных единиц (PFU), сформировавшихся в клетках, зараженных обработанными соединением вирионами, которое выражено в процентах от количества, полученного в контроле, обработанном имитатором. На графике В результаты представлены в виде средней площади 20 вирусных бляшек, которые сформировались при длительном присутствии соединения, выраженной в процентах от площади бляшек в клетках, обработанных в холостом опыте.
Подробное описание предпочтительных вариантов осуществления изобретения
Авторами настоящего изобретения было обнаружено, что большое количество сульфатированных производных олигосахаридов могут быть синтезированы в соответствии с рядом различных стратегий, которые в общих чертах описаны ниже и проиллюстрированы в примерах. Данные соединения могут применяться для профилактики или лечения заболевания млекопитающих субъектов, которое является результатом развития кровеносных сосудов, метастаза, воспаления, коагуляции/тромбоза, повышенного уровня содержания в крови триглицеридов, заражения организма болезнетворными микроорганизмами, и/или сердечно-сосудистого заболевания. Возможность такого применения является результатом способности соединений блокировать связывание гепарансульфат-связывающих белков с их рецепторами или ингибировать активность ферментной гепараназы.
Что касается рассматриваемых соединений формулы II, моносахаридные фрагменты Х, Y и Z могут представлять собой, например, любую гексозу или пентозу и могут являться D- или L изомером. Такие гексозы включают глюкозу, маннозу, алтрозу, аллозу, талозу, галактозу, идозу и галозу. Такие пентозы включают рибозу, арабинозу, ксилозу и ликсозу. Гликозидные мостики, связывающие моносахаридные фрагменты, по конфигурации и типу мостиковой связи могут быть исключительно одного типа или различных типов.
Фармацевтически приемлемый катион М предпочтительно представляет собой натрий.
Что касается целого числа n, его предпочтительное значение равно 3, так как оно обеспечивает соединение, которое представляет собой пентасахарид.
Предпочтительной подходящей группой R1 является н-октил.
Аномерная конфигурация при UR1 соединений формулы II, когда это применимо, может быть α- или β-конфигурацией или представлять собой аномерную α/β смесь.
Что касается заместителей, приведенных выше в определении соединений формулы II, термин «алкил», когда используется сам по себе или в сложных словах, таких как «арилалкил», относится к углеводородной группе с прямой цепью, разветвленной или циклической, предпочтительно C1-20, такой как C1-10. Например, термин «C1-C6 алкил» относится к углеводородной группе с прямой, разветвленной или циклической цепью, содержащей от 1 до 6 атомов углерода. Примеры «C1-6 алкила» включают метил, этил, изопропил, н-пропил, н-бутил, втор-бутил, трет-бутил, н-пентил, изопентил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 2,2-диметилбутил, 3-метилпентил и 2,3-диметилпропил, н-гексил, 2-метилпентил, 2,2-диметилбутил, 3-метилпентил и 2,3-диметилбутил. Примеры циклического C1-6 алкила включают циклопропил, циклобутил, циклопентил и циклогексил. Другие примеры алкила включают гептил, 5-метилгексил, 1-метилгексил, 2,2-диметилпентил, 3,3-диметилпентил, 4,4-диметилпентил, 1,2-диметилпентил, 1,3-диметилпентил, 1,4-диметилпентил, 1,2,3-триметилбутил, 1,1,2-триметилбутил, 1,1,3-триметилбутил, октил, 6-метилгептил, 1-метилгептил, 1,1,3,3-тетраметилбутил, нонил, 1-, 2-, 3-, 4-, 5-, 6- или 7-метилоктил, 1-, 2-, 3-, 4- или 5-этилгептил, 1-, 2- или 3-пропилгексил, децил, 1-, 2-, 3-, 4-, 5-, 6-, 7- и 8- метилнонил, 1-, 2-, 3-, 4-, 5- или 6-этилоктил, 1-, 2-, 3- или 4-пропилгептил, ундецил, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-метилдецил, 1-, 2-, 3-, 4-, 5-, 6- или 7-этилнонил, 1-, 2-, 3-, 4- или 5-пропилоктил, 1-, 2- или 3-бутилгептил, 1-пентилгексил, додецил, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8,- 9- или 10-метилундецил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-этилдецил, 1-, 2-, 3-, 4-, 5- или 6-пропилнонил, 1-, 2-, 3- или 4-бутилоктил, 1-2-пентилгептил и т.п. Алкильная группа может быть необязательно замещенной одним или несколькими необязательными заместителями, которые определены в описании. Необязательно, прямая разветвленная или циклическая углеводородная группа (содержащая, по меньшей мере, 2 атома углерода) может содержать ненасыщенную связь первой, второй или более высокой степени ненасыщения, что приводит к получению алкенильной или алкинильной группы, предпочтительно C2-20 алкенила, более предпочтительно C2-6 алкенила, или C2-20 алкинила, более предпочтительно C2-6 алкинила. Примеры таких групп включают углеводородный остаток, содержащий одну, две или более двойных связей или одну, две или более тройных связей. Таким образом, в данном описании подразумевается, что термин «алкил» включает алкенил и алкинил.
Термин «арил», используемый сам по себе или в сложных словах, таких как «арилалкил», означает моноциклический, полициклический, сопряженный или конденсированный остатки ароматических углеводородных или ароматических гетероциклических (гетероарильных) систем, в которых один или более атомов углерода циклического углеводородного остатка замещен гетероатомом с получением ароматического остатка. Когда замещены два или более атомов углерода, два или более гетероатомов могут быть одинаковыми или разными. Подходящие гетероатомы включают атомы О, N, S и Se.
Примеры «арила» включают фенил, бифенил, трифенил, квартфенил, нафтил, тетрагидронафтил, антраценил, дигидроантраценил, бензантраценил, дибензантраценил, фенантренил, флуоренил, пиренил, иденил, азуленил, хризенил, пиридил, 4-фенилпиридил, 3-фенилпиридил, тиенил, фурил, пирролил, индолил, пиридазинил, пиразолил, пиразинил, тиазолил, пиримидинил, хинолинил, изохинолинил, бензофуранил, бензотиенил, пуринил, хиназолинил, феназинил, акридинил, беноксазолил, бензотиазолил и т.п. Предпочтительные углеводородные арильные группы включают фенил и нафтил. Предпочтительные гетероциклические арильные группы включают пиридил, тиенил, фурил, пирролил. Арильная группа может быть необязательно замещенной одним или несколькими необязательными заместителями, которые определены в описании.
Термин «ацил» относится к группе -C(O)-R, где R представляет собой алкильную или арильную группу. Примеры ацила включают алканоил с прямой или разветвленной цепью, такой как ацетил, пропаноил, бутаноил, 2-метилпропаноил, пентаноил, 2,2-диметилпропаноил, гексаноил, гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил, октадеканоил, нонадеканоил и икозаноил; циклоалкилкарбонил, такой как циклопропилкарбонил, циклобутилкарбонил, циклопентилкарбонил и циклогексилкарбонил; ароил, такой как бензоил, толуоил и нафтоил; аралканоил, такой как фенилaлканоил (например, фенилацетил, фенилпропаноил, фенилбутаноил, фенилизобутиноил, фенилпентаноил и фенилгексаноил) и нафтилалканоил (например, нафтилацетил, нафтилпропаноил и нафтилбутаноил). Поскольку R группа может быть необязательно замещенной, как описано выше, подразумевается, что термин «ацил» включает необязательно замещенный ацил.
Необязательные заместители для алкила, арила или ацила включают галоген (бром, фтор, хлор, йод), гидроксильную группу, C1-6алкил (например, метил, этил, пропил (н- и изо-)), C1-6алкокси (например, метокси, этокси, пропокси (н- и изо-), бутокси (н-, втор- и трет-изомеры), нитрогруппу, аминогруппу, C1-6алкиламино (например, метиламино, этиламино, пропил(н- и изо-)амино), C1-6 диалкиламино (например, диметиламино, диэтиламино, диизопропиламино), гелогенметил (например, трифторметил, трибромметил, трихлорметил), гелогенметокси (например, трифторметокси, трибромметокси, трихлорметокси) и ацетил.
5-6-Членная гетероциклильная группа включает ароматические 5-6-членные гетероциклические группы (гетероарил), которые определены выше, и неароматические 5-6-членные гетероциклические группы, содержащие один или несколько гетероатомов (предпочтительно 1 или 2), независимо выбранные из О, N, S и Se. Примеры таких групп включают диоксанил, пиранил, тетрагидрофуранил, пиперидил, морфолино, пиперазинил, тиоморфолино и сахариды.
Степень сульфатации соединений согласно изобретению обычно составляет, по меньшей мере, 50%. То есть, по меньшей мере, 50% R групп производного олигосахарида включает SO3M. Обычно степень сульфатации составляет от 70 до 100%, предпочтительно, по меньшей мере, 90%.
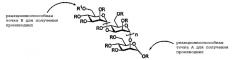
PI-88 производные формулы II могут быть получены постадийным методом синтеза или исходя из готового скелета PI-88 (с использованием легко доступных соединений 8-11; см. формулу I выше) с получением их желаемых модификаций. Заявители настоящего изобретения, изучая структуры PI-88 (1) и его предшественника (2), установили, что существуют две предпочтительные реакционноспособные точки получения его производных: на восстанавливающемся конце (A) и в концевом положении 6 на невосстанавливающемся конце (B), как показано на приведенной далее структурной формуле.
SO3Na или H, R1=PO3Na2, n=0-4
Следует отметить, что ди-, три-, тетра- и пентасахаридные (или более высокие) производные могут быть получены одинаковым химическим способом. Однако пентасахаридные производные предпочтительны, поскольку они являются наиболее биологически активными [1,2,5,8,13]. Далее из полученных производных удаляются защитные группы (обычно деацетилированием с NaOMe), и полученный полиол подвергается сульфатированию с использованием сульфатирующего реагента, такого как комплекс триоксида серы и пиридина или комплекс триоксида серы и триметиламина.
Как показано выше, соединения согласно изобретению применимы в профилактике или лечении расстройства млекопитающих субъектов, которое является результатом развития кровеносных сосудов, метастаза, воспаления, коагуляции/тромбоза, повышенных уровней содержания триглицеридов, заражения организма болезнетворными микроорганизмами, и/или сердечно-сосудистого заболевания. Соединения особенно применимы для лечения перечисленных выше расстройств у людей. Соединения обычно вводятся в виде компонента фармацевтической композиции, как описано далее. Как показано ниже, соединения проявляют активность, аналогичную или превосходящую активность PI-88.
Фармацевтические композиции для перорального введения могут быть представлены в форме таблеток, капсул, порошка или жидкости. Таблетка может включать твердый носитель, такой как желатин, или адъювант или инертный разбавитель. Жидкие фармацевтические композиции обычно включают жидкий носитель, такой как вода, нефтяные, животные или растительные масла, минеральное масло или синтетическое масло. В композиции может включаться физиологический раствор или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Такие композиции и препараты обычно будут содержать, по меньшей мере, 0,1% мас. соединения.
Парентеральное введение включает введение следующими путями: внутривенно, кожно или подкожно, назально, внутримышечно, внутриглазным путем, трансэпителиально, интраперитонеально и местным введением. Местное введение включает чрескожное, глазное, ректальное, назальное, а также введение ингаляцией или с помощью аэрозольных устройств. Для внутривенной, кожной или подкожной инъекции или инъекции в место, где желательно лечение, активный ингредиент будет находиться в форме парентерально приемлемого водного раствора, который не содержит пирогена и характеризуется подходящими рН, изотоничностью и стабильностью. Квалифицированный специалист в данной области техники будет способен приготовить подходящие растворы, используя, например, растворы рассматриваемых соединений или их производные.
Помимо, по меньшей мере, одного соединения и носителя или разбавителя композиции согласно изобретению могут дополнительно включать фармацевтически или ветеринарно приемлемый наполнитель, буферный раствор, стабилизатор, добавку, регулирующую изотоничность, консервант или антиоксидант или любой другой материал, известный специалисту в данной области техники. Квалифицированному специалисту в данной области техники будет понятно, что эти материалы должны быть нетоксичными и не должны оказывать вредного воздействия на эффективность соединения(ий). Точная природа любой добавки будет зависеть от способа введения композиции, то есть от того, перорально или парентерально вводится композиция. Что касается буферных растворов, водные композиции обычно включают такие вещества для сохранения значения рН композиции на уровне, близком к физиологическому, или, по меньшей мере, в интервале примерно от 5,0 до 8,0.
Композиции согласно изобретению помимо, по меньшей мере, одного соединения могут также включать дополнительные активные ингредиенты. Такие ингредиенты будут выбраны, главным образом, в зависимости от их эффективности в качестве лекарственных средств, обладающих противоангиогенной, противометастазной, противовоспалительной, антикоагулянтной, противомикробной и противотромботической активностью, и лекарственных средств, применяемых при повышенном уровне содержания триглицеридов в крови, а также их эффективности в качестве лекарственных средств для лечения сердечно-сосудистого заболевания, но могут быть выбраны и в зависимости от их эффективности в отношении любого состояния, связанного с указанными заболеваниями.
Фармацевтическая или ветеринарная композиция согласно изобретению будет вводиться субъекту в профилактически эффективном или терапевтически эффективном количестве, как это необходимо в конкретной рассматриваемой ситуации. Фактическое количество, по меньшей мере, одного соединения, вводимого посредством композиции, а также дозировка и схема введения будут зависеть от природы и тяжести состояния, подлежащего лечению или требующего профилактики. Назначение лечения, такое как назначение дозировки и т.д., будет определяться лечащим врачом или ветеринаром, ответственным за медицинский уход за субъектом. Однако обычно композиции, вводимые человеку, будут включать в интервале примерно от 0,01 до 100 мг соединения на кг массы тела, более предпочтительно в интервале от примерно 0,1 до 10 мг/кг массы тела.
Соединения могут быть включены в композиции в виде их фармацевтически или ветеринарно приемлемых производных. Термин «производные» соединения, используемый в описании, включает соли, координационные комплексы с ионами металлов, такими как Mn2+ и Zn2+, сложные эфиры, такие как гидролизуемые in vivo сложные эфиры, свободные кислоты или основания, гидраты или пролекарства. Соединения, содержащие кислотные группы, такие как фосфаты или сульфаты, могут образовывать соли с щелочными или щелочно-земельными металлами, такими как Na, K, Mg и Са, с органическими аминами, такими как триэтиламин и трис(2-гидроксиэтил)амин. Соли могут также образовываться между соединениями, содержащими основные группы, такие как аминогруппы, и неорганическими кислотами, такими как соляная кислота, фосфорная кислота или серная кислота, или органическими кислотами, такими как уксусная кислота, лимонная кислота, бензойная кислота, фумаровая кислота или винная кислота. Соединения, содержащие одновременно кислотные и основные группы, могут образовывать внутренние соли.
Сложные эфиры могут быть образованы между гидроксильной группой или группой карбоновой кислоты, присутствующими в соединении, и подходящей карбоновой кислотой или спиртом в качестве второго реагента с использованием методик, которые хорошо известны квалифицированному специалисту в данной области техники.
Пролекарственные производные соединений настоящего изобретения могут подвергаться превращению in vivo или in vitro в исходные соединения. Обычно, по меньшей мере, одна из биологических активностей исходного соединения может быть подавлена в форме пролекарства соединения и может активироваться превращением пролекарства в исходное соединение или его метаболит. Примерами пролекарств являются гликолипидные производные, в которых один или несколько липидных фрагментов присутствуют в виде заместителей на фрагментах, которые высвобождают свободную форму соединения после расщепления под действием фермента, обладающего фосфолипазной активностью. Пролекарства соединений настоящего изобретения включают применение защитных групп, которые могут удаляться in vivo для высвобождения активного соединения или служат для ингибирования расщепления лекарственного средства. Подходящие защитные группы хорошо известны квалифицированному специалисту данной области техники и включают ацетатную группу.
Как показано выше, соединения согласно настоящему изобретению применимы для производства лекарственного средства для профилактики или лечения у млекопитающего субъекта расстройства, которое является результатом развития кровеносных сосудов, метастаза, воспаления, коагуляции/тромбоза, повышенного уровня содержания в крови триглицеридов, заражения организма болезнетворными микроорганизмами, и/или сердечно-сосудистого заболевания. Способы производства таких лекарственных средств известны квалифицированному специалисту данной области техники и включают способы, применяемые для производства фармацевтических композиций, описанных выше.
Далее будет приведено общее описание путей синтеза соединений согласно изобретению. Для простоты во всех схемах, чертеже и таблицах, приведенных далее, за исключением особо оговоренных случаев, R1 будет представлять (1→3)-связанную Man4 тетрасахаридную часть (с концевой 6-О-фосфогруппой или без нее).
Общие методики
Гликозид-производные PI-88 (O-, S- и С-гликозиды)
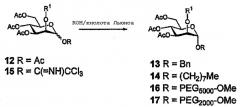
Гликозид-производные могут быть легко получены активацией олигосахарида (с концевой 6-О-фосфогруппой или без нее) для гликозилирования и конденсацией его с подходящим спиртом. Подходящим способом является реакция перацетилированного сахара, например, 12, катализируемая или ускоряемая кислотой Льюиса, со спиртовым акцептором с получением, например, 13 или 14.
Схема 1
В данной области известны различные типы доноров, и подходящими в качестве доноров являются, например, тиогликозиды, галогениды, н-пентенилгликозиды, селенгликозиды и т.д. Квалифицированному специалисту данной области техники ясно, что S- и С-гликозиды могут быть получены аналогичными или сходными способами, описанными в литературе, например, с использованием подходящего тиола (или тиол-производного) или известного углеродного нуклеофила (например, аллилтриметилсилана или подходящего фенола) с приемлемо активированным донором. Продукт затем может легко деацетилироваться или сульфатироваться. Продукт гликозилирования может представлять собой единственный аномер (α или β) или смесь, содержащую оба аномера. И чистые α и β аномеры и аномерная смесь подходят для последующих превращений. Это также применимо и для других производных, получаемых в результате взаимодействия по аномерному центру, описанного в последующих разделах. Следовательно, когда обозначен единственный аномер, подразумевается, что заявляется также его антипод или смесь двух аномеров. Квалифицированному специалисту также понятно, что полученный исходный гликозид может подвергаться последующему превращению в зависимости от природы агликона. Например, если в качестве спирта используется 2-бромгексанол, продукт может подвергаться превращению в азид (18). То есть он является весьма реакционно-способным соединением (схема 2) и может далее функционализироваться, например, циклоприсоединением с соединением, содержащим подходящий диполярофил. Альтернативно, азид может подвергаться восстановлению с получением амина и затем подвергаться последующей функционализации, например, алкилированием, ацилированием, 4-компонентной конденсацией по Уги и т.д.
Схема 2
N-присоединенные производные
Катализируемое кислотой Льюиса взаимодействие соединения 12, используемого в качестве исходного соединения, с TMSN3 приводит к получению азида 19 (главным образом, α). Альтернативно, β-азид 20 может быть получен исключительно с образованием сначала α-бромида с последующим замещением NaN3 (схема 3). Бромид также может использоваться в качестве промежуточного продукта для получения, например, тиогликозидов или изотиоцианатов. Азиды могут быть подвергнуты реакции удаления защитной группы и сульфироваться как таковые или могут подвергаться восстановлению и ацилированию хлорангидами различных кислот для получения ряда гликозиламидов (схема 3).
Схема 3
Производные, полученные взаимодействием по невосстанавливающемуся концу
Получение производных может осуществляться взаимодействием по невосстанавливающему концу, например, с применением фосфорилированных олигосахаридов (отдельных или в виде смеси) и с получением производных через фосфатную группу, например, с использованием сложных фосфат-эфиров или фосфорамидов. В самом деле, подходящие соединения могут быть получены осуществлением реакции по восстанавливающему концу либо с аналогичной, либо с другой функциональной группой.
Приведенное выше описание является общим, и далее будут приведены примеры конкретных соединений, их синтеза и их биологических активностей, но без ограничения области настоящего изобретения только данными примерами.
Примеры
Нейтральные манно-олигосахариды
(а) Манно-олигосахариды: (8) α-D-Ман-(1→2)-D-Ман, (9) α-D-Ман-(1→3)-α-D-Ман-(1→2)-D-Ман, (10) α-D-Ман-(1→3)-α-D-Ман-(1→3)-α-D-Ман-(1→2)-D-ман и (11) α-D-Ман-(1→3)-α-D-Ман-(1→3)α-D-Ман-(1→3)-α-D-Ман-(1→2)-D-ман - выделяют распределительной хроматографией из нейтральной фракции, полученной в результате гидролиза внеклеточного фосфоманнана из P. holstii NRRL Y-2448, проводимого в мягких условиях с использованием в качестве катализатора кислоты в соответствии с методикой, описанной в литературе [17]. Альтернативно, олигосахариды 8-11 синтезируют постадийным способом из составляющих моносахаридных блоков, как описано в примере 1 (см. ниже).
(b) Альтернативно, нейтральную фракцию подвергают прямому ацилированию (избыток смеси Ас2О/пиридин), индивидуальные перацетилированные олигосахариды выделяют флэш-хроматографией (силикагель) и сразу используют в следующей стадии без дополнительной очистки.
(с) В соответствии с другим подходом, перацетилированную смесь со стадии (b) сразу используют в следующей стадии, а затем индивидуальные продукты затем выделяют флэш-хроматографией.
Общая методика деацетилирования
Раствор перацетата в безводном метаноле (0,1 М) обрабатывают раствором метоксида натрия в метаноле (1,35 М, 0,2-0,6 экв.). Смесь перемешивают при комнатной температуре в течение 1-3 часов (контролируя ход реакции ТСХ). Для доведения рН до 6-7 добавляют кислотную смолу AG®-50W-X8 (H+ форма), смесь фильтруют и смолу подвергают разложению метанолом. Фильтрат и промывной раствор объединяют, смесь концентрируют в вакууме и тщательно сушат, получая полиол.
Общая методика сульфирования
Смесь полиола и SO3·триметиламинового или SO3·пиридинового комплекса (2 экв. на спирт) в ДМФА нагревают (60°С, в течение ночи). Охлажденную (до комнатной температуры) смесь обрабатывают МеОН и затем подщелачивают (до рН>10) добавлением Na2CO3 (10% мас./мас.). Смесь фильтруют, и фильтрат упаривают и затем подвергают совместному выпариванию (Н2О). Сырой полисульфатированный продукт подвергают вытеснительной хроматографии. Если необходимо, после лиофилизации продукт пропускают через колонку с ионно-обменной смолой (AG®-50W-X8, Na+ форма, 1х4 см, деионизированная Н2О, 15 мл) для полного превращения продукта в форму натриевой соли. Собранный раствор упаривают и лиофилизуют с получением конечного продукта в виде бесцветного стеклообразного вещества или белого порошка.
Распределительная хроматография
Распределительную хроматографию проводят на Bio-Gel P-2 в колонке 5х100 см с расходом элюента 2,8 мл/мин 0,1М NH4 +·HCO3 -, собирая фракции 2,8 мин (7,8 мл). Фракции анализируют на содержание углевода нанесением пятна на пластины силикагеля и визуализацией с помощью обработки углем и/или анализируют на полизаряженные виды пробой диметилметиленовым синим. И, наконец, фракции проверяют на чистоту с помощью СЕ15, и фракции, которые свободные от соли, объединяют и лиофилизуют. В случаях, когда присутствуют несульфатированные побочные продукты или другие органические соли (обычно лишь в небольших количествах, но, тем не менее, в действительности часто обнаруживаемые), для полного их удаления используют LH20 колоночную хроматографию (2х95 см,1,2 мл/мин, 3,5 мин на пробирку).
Пример 1: Общий синтез нейтральных манноолигосахаридов (8-11) из Pichia
Бензил-2-О-(3-О-Аллил-2,4,6-три-О-бензоил-α-D-маннопиранозил)-3,4,6-три-О-бензил-α-D-маннопиранозид (24)
Смесь 3-O-аллил-2,4,6-три-O-бензоил-α-D-маннопиранозилтрихлорацетимидата [26] (902 мл, 1,21 ммоль) и бензил-3,4,6-три-O-бензил-α-D-маннопиранозида [27] (723 мл, 1,34 ммоль) в 1,2-ДХЭ (10 мл) перемешивают в присутствии молекулярных сит (1,0 г 3Е порошка) в атмосфере аргона (30 мин). Смесь охлаждают (0°C) при непрерывном перемешивании (10 мин) перед добавлением TMSOTf (219 мкл, 1,21 ммоль). По истечении некоторого времени (10 мин) добавляют Et3N (100 мкл) и полученную смесь фильтруют. Растворитель выпаривают и остаток очищают ФХ (10-50% EtOAc/гексан), получая трибензоат (24) в виде бесцветного масла (1,14 г, 84%). 1H ЯМР (CDCl3) δ 3,67-3,81, 3,88-3,95, 4,06-4,15, 4,30-4,35 (4м, 12H; H-2I,-3I,-4I,-5I,-6aI,-6bI,-3II,-5II,-6aII,-6bII,OCH2), 4,94-4,70 (м, 7H; CH2Ph), 4,84 (д, 1H, JA,B 10,8 Hz; A AB квартета), 4,93-4,96, 5,04-5,09 (2м, 2H; =CH2), 5,02 (д, 1H, J1,2 1,9 Hz; H-1I), 5,24 (д, 1H; J1,2 1,9 Ha; H-1II), 5,59-5,69 (м, 1H; =CH), 5,72 (дд, 1H, J2,3 3,1 Hz; H-2II), 5,75 (дд, 1H, J3,4 9,8, J4,5 9,9 Hz; H-4II), 7,09-7,58, 7,97-8,06 (2м, 35 H; Ar). 13C ЯМР (CDCl3) δ 61,50, 63,49 (2C; C-6I,-6II), 68,63, 69,17, 69,3