Способ связывания интересующих последовательностей
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к множественной RT-PCR с удлинением цепи путем перекрывания. Предложенный способ эффективен для связывания двух или нескольких нуклеотидных последовательностей, кодирующих домены или субъединицы гетеромерного белка в результате выполнения одной реакции. Способ по настоящему изобретению, в частности, облегчает связывание последовательностей, кодирующих вариабельные области иммуноглобулинов, Т-клеточных рецепторов или В-клеточных рецепторов. Способ по настоящему изобретению также является более эффективным средством создания библиотек последовательностей, кодирующих вариабельные области. Возможность выполнения множественной RT-PCR с удлинением цепи путем перекрывания с использованием матрицы, полученной из выделенной отдельной клетки, обеспечивает высокоэффективное создание библиотек родственных пар. 4 н. и 47 з.п. ф-лы, 25 ил., 27 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу множественной молекулярной амплификации, способной к связыванию интересующих нуклеотидных последовательностей с помощью амплификации, в частности с помощью полимеразной цепной реакции (множественная PCR). Способ является особенно эффективным для создания библиотек родственных пар, а также комбинаторных библиотек последовательностей, кодирующих вариабельные области иммуноглобулинов, Т-клеточных рецепторов или В-клеточных рецепторов.
Уровень техники
Антигенсвязывающие белки, участвующие в иммунной реакции, присутствуют в организме млекопитающих в виде большого поликлонального набора, представляющего собой широкое разнообразие специфичностей связывания. Подобное разнообразие создается реаранжировкой генных последовательностей, кодирующих вариабельные области указанных связывающих белков. Такие связывающие белки, имеющие вариабельные области, включают растворимые и мембраносвязанные формы В-клеточного рецептора (известные также как иммуноглобулины или антитела) и мембраносвязанные Т-клеточные рецепторы (TcR). Что касается иммуноглобулинов, то их сродство усиливается после распознавания антигена рецептором антигена В-клеток вследствие процесса, именуемого “созреванием аффинности”, в который вовлечены циклы соматической сверхмутации этих генов вариабельных областей.
Кроме того, иммуноглобулины или их фрагменты, такие как Fab-фрагменты, Fv-фрагменты и одноцепочечные Fv-фрагменты (scFv), являются предметом клонирования и рекомбинантной экспрессии. Однако все другие связывающие белки, имеющие вариабельные области, в принципе могут быть клонированы и экспрессированы так же, как и антитела.
Известные методы выделения антител с требуемой специфичностью связывания чаще всего включают получение гибридом у иммунизированных хозяев с последующим скринингом специфических клонов или создание комбинаторных библиотек экспрессируемых последовательностей в E.coli, состоящих из вариабельных доменов иммуноглобулинов, которые затем обогащают при помощи таких методов, как, например, фаговый дисплей.
Главным ограничением, связанным с применением технологии гибридом для получения терапевтических антител, является отсутствие лимфомы человека, которая может использоваться в качестве сливающихся клеток для В-лимфоцитов человека. Гетерогибридомы (то есть В-клетки человека, слитые с лимфомами мыши) яляются, как известно, неустойчивыми и, таким образом, редко позволяют получить приемлемые линии клеток для целей продукции антител. В-клетки человека, иммортализованные в результате инфицирования вирусом Эпштейна - Барра, характеризуются такими же признаками неустойчивости. Отсутствие надежных клеточных методов получения антител человека для лечебных целей может быть компенсировано последними достижениями в области молекулярной биологии.
Применение комбинаторных библиотек и фагового дисплея позволяет создать большой спектр клонов антител с потенциальным разнообразием, превышающим 1010. Из вышеуказанного спектра можно выбрать тип связывания со специфической мишенью, создав таким образом подбиблиотеку. Такую подбиблиотеку можно использовать для создания поликлональных или моноклональных антител. Последовательности, кодирующие вариабельные области (например, последовательности, кодирующие вариабельную область тяжелой цепи и вариабельную область легкой цепи иммуноглобулина), которые образуют библиотеку, можно амплифицировать из лимфоцитов, плазматических клеток, гибридом или любой другой популяции клеток, экспрессирующей иммуноглобулин. Современные методы создания комбинаторных библиотек предусматривают раздельное выделение из популяции клеток последовательностей, кодирующих вариабельные области. Таким образом утрачивается первоначальное спаривание последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи иммуноглобулина. В комбинаторной библиотеке указанные последовательности спариваются произвольно, и первоначальные комбинации указанных вариабельных последовательностей образуются лишь случайно. Поэтому для выделения последовательностей, кодирующих вариабельные области, которые отвечают за требуемую специфичность связывания, необходимо произвести многостадийный скрининг. Такой скрининг обычно выполняют в сочетании с методами обогащения клонов, обладающих требуемой специфичностью, такими как фаговый или рибосомный дисплей. Даже после того как разнообразие достигнуто, оно может быть недостаточным для выделения пар последовательностей, кодирующих вариабельные области, с целью получения связывающих белков, обладающих таким же высоким сродством, которое может быть обнаружено в исходных клетках. Кроме того, методы обогащения, обычно применяемые для скрининга комбинаторных библиотек, вносят значительную стандартную ошибку, например, в случае полипептидов с особенно низкой токсичностью в E.coli, которая влияет на эффективность укладки цепи, замедляется скорость выделения или ухудшаются другие параметры, находящиеся в зависимости от системы, что еще больше уменьшает разнообразие библиотеки. Помимо этого клоны, полученные из таких комбинаторных библиотек, чаще продуцируют связывающие белки с перекрестной реактивностью против аутоантигенов, так как указанные пары белков, в отличие от первоначальных пар (далее именуемых родственными парами), не подвергаются происходящей in vivo отрицательной селекции на аутоантигены, как это имеет место в случае рецепторов В- и Т-лимфоцитов на определенных стадиях их развития. Поэтому желательно клонировать первоначальные пары последовательностей, кодирующих вариабельные области. Кроме того, ожидается, что частота встречаемости клонов, обладающих требуемой специфичностью связывания, будет значительно выше в библиотеке родственных пар, чем в обычной комбинаторной библиотеке, особенно если клетки исходного материала взяты от донора с высокой частотой встречаемости клеток, кодирующих пары со специфическим связыванием, то есть у иммунокомпетентных или иммунизированных доноров. Из вышеизложенного следует, что библиотека родственных пар необязательно должна быть такой же большой, как комбинаторная библиотека: библиотека родственных пар, содержащая 104-105 клонов или даже 102-103 клонов, полученных от донора с соответствующей иммунной реакцией, может быть вполне достаточной для получения связывающих белков, представляющих собой широкое разнообразие требуемых специфичностей связывания.
Для создания библиотек родственных пар необходимо связать последовательности, кодирующие вариабельные области, которые были выделены из одной клетки. В настоящее время описаны два разных подхода, обеспечивающих родственное спаривание последовательностей, кодирующих вариабельные области.
Внутриклеточная PCR представляет собой подход, при котором обеспечивают проницаемость фиксированной популяции клеток и осуществляют внутриклеточное связывание последовательностей иммуноглобулинов, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи. Указанное связывание можно осуществить методом RT-PCR с перекрыванием цепи (WO 93/03151) или путем рекомбинантного метода (Chapal, N. et al. 1997, Bio Techniques 23, 518-524). Процесс амплификации, описанный в указанных публикациях, является трех- или четырехстадийным процессом, предусматривающим i) обратную транскрипцию с использованием праймеров для константной области, образующих кДНК иммуноглобулина, ii) амплификацию методом PCR последовательностей, кодирующих вариабельные области тяжелой и легкой цепи, с использованием наборов праймеров, с сайтами перекрывания или рекомбинации, iii) связывание путем рекомбинации, если выбран данный метод, iv) осуществление гнездовой PCR продуктов, образующих сайты рестрикции для клонирования. Так как клетки являются проницаемыми, существует значительный риск выхода продуктов амплификации из клеток, в результате чего может произойти перестановка последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, что ведет к утрате родственного спаривания. Поэтому такой метод предусматривает стадии промывки после каждой реакции, что делает процесс трудоемким и уменьшает эффективность реакций.
Как правило, внутриклеточная PCR является неэффективной и приводит к низкой чувствительности. Поэтому метод связывания при помощи внутриклеточной PCR не нашел широкого распространения, причем первоначальное исследование невозможно было повторить с получением надежных результатов, подтверждающих, что внутри клетки действительно происходит связывание. Между тем при этом методе необходимо избегать перестановки последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, в результате которой происходит разрушение родственных пар.
Другой внутриклеточный метод описан в WO 01/92291. Указанный метод основан на транссплайсинге РНК и при нем достигается соединение VН- и VL-кодирующей мРНК внутри клетки. Указанный подход требует наличия конструкции ДНК, осуществляющей транссплайсинг внутри клеток.
Одноклеточная PCR представляет собой другой метод родственного спаривания последовательностей, кодирующих варибельную область тяжелой цепи и вариабельную область легкой цепи (см., например, публикации Coronella, J.A. et al. 2000, Nucleic Acids Res. 28, E85; Wang, X., et al. 2000, J. Immunol. Methods 20, 217-225). В указанных публикациях описан метод, в соответствии с которым популяцию иммуноглобулин-экспрессирующих клеток распределяют по пробиркам, разводя до плотности, соответствующей одной клетке в одной реакционной смеси, в результате чего в процессе клонирования устраняется перестановка последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи. Описанный метод состоит из трех-четырех стадий, включающих i) обратную транскрипцию с использованием олиго-dT-праймеров, произвольных гексамерных праймеров или праймеров для константной области, образующих кДНК, ii) фракционирование продукта кДНК в нескольких пробирках и амплификацию при помощи PCR отдельных последовательностей, кодирующих вариабельные области цепей (в отдельных пробирках), с использованием наборов праймеров, содержащих сайты рестрикции для клонирования, iii) осуществление гнездовой PCR продуктов, образующих сайты рестрикции для клонирования (необязательно), и iv) связывание последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, из отдельных пробирок путем клонирования их в соответствующем векторе, что само по себе является многостадийным процессом.
У человека присутствуют легкие цепи двух типов: лямбда (λ) и каппа (κ). Из этого следует, что для кДНК, полученной из каждой отдельной клетки, необходимо выполнить по крайней мере три отдельные реакции PCR с последующим анализом и клонированием соответствущих фрагментов в единичном векторе для достижения родственного спаривания. Таким образом, вышеописанный метод одноклеточной РCR требует большого числа манипуляций для создания библиотеки родственных пар. Хотя библиотека родственных пар не обязательно должна быть такой же большой, как комбинаторная библиотека, для получения связывающих белков, представляющих собой широкое разнообразие специфичностей связывания, создание библиотеки, содержащей, например, 104-105 клонов, вышеописанным методом одноклеточной PCR по-прежнему остается трудоемкой задачей. Кроме того, большое число манипуляций значительно увеличивает риск загрязнения и ошибки, вызванной человеческим фактором.
Для получения связывающих белков с высоким сродством, соответствующим сродству, обычно наблюдаемому при возникновении иммунной реакции, весьма перспективным является родственное спаривание последовательностей, кодирующих вариабельные области, в сочетании с их амплификацией. Для создания библиотеки с большим разнообразием клонов необходимо разработать высокоэффективный метод клонирования, отличающийся минимальным риском загрязнения и перестановки последовательностей.
Кроме того, желательно сократить число стадий клонирования для достижения высокоэффективного создания комбинаторных библиотек.
Сущность усовершенствования
Настоящее изобретение относится к эффективному способу связывания двух или нескольких интересующих нуклеотидных последовательностей, то есть последовательностей, кодирующих вариабельные области, применяя множественную молекулярную амплификацию, такую как множественная RT-PCR с удлинением цепи путем перекрывания или множественная RT-PCR с последующим связыванием путем лигирования или рекомбинации. Этот способ может быть выполнен в формате одной клетки, что делает возможным высокоэффективное клонирование родственных пар.
Краткое описание чертежей
На фиг.1 схематически изображены разные типы концевых сегментов удлинения цепи путем перекрывания. Жирные линии соответствуют геноспецифической части праймера, а обычные линии соответствуют перекрывающему концевому сегменту. Вертикальные линии иллюстрируют комплементарные области. Праймеры облегчают связывание двух интересующих нуклеотидных последовательностей. На фиг.1 (I) показаны два варианта концевых сегментов удлинения цепи путем перекрывания типа I, где полностью или частично перекрываются только удлиняющие сегменты; на фиг.1 (II) показаны концевые сегменты удлинения цепи путем перекрывания типа II, где некоторые 5'-концевые нуклеотиды удлиняющего сегмента первого праймера комплементарны геноспецифической части соседнего праймера; на фиг.1 (III) показаны концевые сегменты удлинения цепи путем перекрывания типа III, где все удлиняющие сегменты являются комплементарными геноспецифической области соседнего праймера.
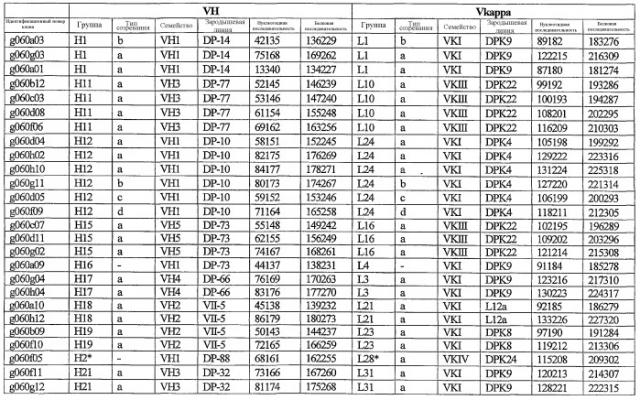
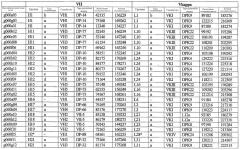
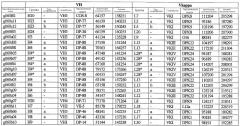
На фиг.2 схематически изображена смесь множественных праймеров для удлинения цепи путем перекрывания, используемая для связывания последовательностей, кодирующих вариабельные области иммуноглобулина. Подлежащие связыванию кДНК, кодирующие легкую цепь (LC) и вариабельную область тяжелой цепи (VH), изображены в виде трубок с обозначением 5'- и 3'-концов смысловых цепей, а также предполагаемого размера амплифицированного продукта. Множественные наборы праймеров для удлинения цепи путем перекрывания, используемые для амплификации кодирующей последовательностей, показаны стрелками. Изогнутые стрелки с пунктирными краями, направленные в сторону 5'-концов, показывают клонирующие концевые сегменты. Концевые сегменты удлинения цепи путем перекрывания изображены жирными линиями. Сайты рекстрикции, присутствующие в концевых сегментах, указаны рядом с концевым сегментом. Общее число праймеров в смеси множественных праймеров для удлинения цепи путем перекрывания равно шестнадцати и разделено на внешние праймеры, включающие один праймер для Ск и один праймер для СН1, и праймеры для удлинения цепи путем перекрывания, включающие шесть праймеров для VL и восемь праймеров для VН. Праймер для СН1 гибридизируется с 5'-концом константного домена 1 тяжелой цепи. Предполагается, что продукт, образующийся в результате множественной RT-PCR с удлинением цепи путем перекрывания, равен примерно 1070 п.о. и содержит всю легкую каппа-цепь, состоящую из константной области, J-гена и V-гена (Ск + JL + VL), и вариабельную область тяжелой цепи, состоящую из V-гена, D-сегмента и J-гена (VH + D + JH). 5'- и 3'-концы обозначают направление открытой рамки считывания. Только небольшая часть последовательности, кодирующей СН1-область, амплифицирована множественной смесью праймеров для удлинения цепи путем перекрывания, так как положение гибридизации праймера для СН1 находится рядом с J-областью тяжелой цепи.
На фиг.3 изображено несколько схем, показывающих разные направления связывания получаемых продуктов в зависимости от того, какие праймеры имеют концевой связывающий сегмент. Черным цветом показана область перекрывания. 5'- и 3'-концы обозначают направление открытой рамки считывания. На фиг.3А изображена схема, иллюстрирующая ориентацию продуктов “головной сегмент - головной сегмент”. На фиг.3В изображена схема, иллюстрирующая ориентацию продуктов “концевой сегмент - концевой сегмент”. На фиг.3С изображена схема, иллюстрирующая ориентацию “головной сегмент - концевой сегмент”, где первой является последовательность, кодирующая легкую цепь. На фиг.3D изображена схема, иллюстрирующая ориентацию “головной сегмент - концевой сегмент”, где первой является последовательность, кодирующая тяжелую цепь.
На фиг.4 схематически изображен вектор экспрессии иммуноглобулина pLL113, где кодирующие последовательности находятся в ориентации “головной сегмент - концевой сегмент”. Показанный вектор включает нижеследующие элементы: bla = промотор, экспрессии гена устойчивости к ампициллину. Amp = ген, кодирующий устойчивость к ампициллину. pUC ori = точка начала репликации pUC. AdMLP = главный поздний промотор аденовируса. Human IgG1 = последовательность, кодирующая тяжелую цепь иммуноглобулина изотипа G1 человека. hGH pA = поли-А-сигнальная последовательность гормона роста человека. bGH polyA = поли-А-последовательность гормона роста крупного рогатого скота. LC каппа человека = последовательность, кодирующая легкую каппа-цепь иммуноглобулина человека. FRT = сайт-мишень узнавания Flp. Гигромицин = ген, кодирующий устойчивость к гигромицину. SV40 polyA = поли-А-сигнальная последовательность вакуолизирующего обезьяньего вируса.
На фиг.5А изображен гель после электрофореза, показывающий результаты двухстадийной множественной RT-PCR с удлинением цепи путем перекрывания с последующей полугнездовой РCR. Продукты амплификации получены из кДНК, выделенной из отдельных клеток яичника китайского хомячка (СНО) Flp-In pLL113. Полосы 1-12 обозначают образцы, а стрелки показывают правильные продукты множественной гнездовой RT-PCR с удлинением цепи путем перекрывания длиной 1076 п.о.; М1 обозначает лэддер длиной 100 п.о. W обозначает воду, использованную в качестве отрицательного контрольного образца. С обозначает положительный контрольный образец кДНК, выделенный из линии клеток НВ-8501. Отдельно представлено менее контрастное изобретение тех же самых полос W, C и лэддера длиной 100 п.о. для выделения отдельных фрагментов ДНК. На фиг.5В дано схематическое изображение геля, показанного на фиг.5А, которое иллюстрирует соответствущие фрагменты геля.
На фиг.6 показано несколько фотографий и дано графическое изображение гелей после электрофореза, на которых представлены результаты одностадийной множественной RT-PCR с удлинением цепи путем перекрывания без дополнительной амплификации методом РCR. Во всех блоках М1 обозначает лэддер длиной 100 п.о., а М2 обозначает лэддер длиной 500 п.о. На фиг.6А изображен гель после электрофореза с продуктами амплификации, выделенными из лизата, соответствующего 100, 10, 1 или 0 клеток. Стрелка показывает продукт удлинения цепи путем перекрывания. На фиг.6В дано схематическое изображение геля, показанного на фиг.6А. На фиг.6С показан гель после электрофореза, подтверждающий наличие продукта, полученного удлинением цепи путем перекрывания, в полосах, соответствующих 100 и 1 клетке, на фиг.6А. На фиг.6D изображен гель после электрофореза, на котором видно расщепление рестрикционными ферментами NheI и NcoI продукта, полученного удлинением цепи путем перекрывания, из полосы, соответствующей 1 клетке, на фиг.6С.
На фиг.7 изображен гель после электрофореза, на котором видны результаты одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и последующей амплификации методом полугнездовой PCR. М1 обозначает лэддер длиной 100 п.о., и М2 обозначает лэддер длиной 500 п.о. Указанные результаты получены при использовании смесей множественных праймеров для удлинения цепи путем перекрывания, содержащих праймер для СН1, СН2, СН3, СН4 или СН5 в качестве внешнего праймера при выполнении множественной RT-PCR с удлинением цепи путем перекрывания. Указанные реакции выполняли в клеточных лизатах, соответствующих 100, 10, 1 или 0 клеток. Размер продукта, полученного удлинением цепи путем перекрывания, показан стрелкой.
На фиг.8 изображен гель после электрофореза, на котором видны результаты одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и последующей амплификации методом полугнездовой PCR с использованием обогащенных В-лимфоцитов человека в качестве матрицы. М1 обозначает лэддер длиной 100 п.о. Полосы 5 и 6 соответствуют размеру продукта, полученного удлинением цепи путем перекрывания.
На фиг.9А схематически изображены экспрессирущие векторы млекопитающих (Em465/01P582/Em465/01P581), использованные для получения линий клеток, экспрессирующих лямбда-цепь IgG1, где кодирующие последовательности находятся в ориентации “головной сегмент - головной сегмент”. Указанные векторы включают нижеследующие элементы: Amp = ген, кодирующий устойчивость к ампициллину. pUC ori = точка начала репликации pUC. AdMLP = главный поздний промотор аденовируса. EFP = промотор фактора элонгации. Лидерная AP = лидерная последовательность щелочной фосфатазы. VH = последовательность, кодирующая вариабельную область тяжелой цепи. IgG1 HC = последовательность, кодирующая константную область тяжелой цепи иммуноглобулина изотипа G1. rBG polyA = поли-А-сигнальная последовательность бета-глобулина кролика. bGH polyA = поли-А-последовательность гормона роста крупного рогатого скота. Лидерная IgK = последовательность, кодирующая лидерную последовательность каппа-цепи мыши. IgL (1b или 1с) = последовательность, кодирующая легкую лямбда-цепь иммуноглобулина семейства 1b или 1с. FRT = сайт-мишень узнавания Flp. Гигромицин = ген, кодирующий устойчивость к гигромицину. SV40 polyA = поли-А-сигнальная последовательность вакуолизирующего обезьяньего вируса. На фигурах 9В и 9С показаны агарозные гели, окрашенные этидием бромида, содержащие продукты PCR, выделенные из линий клеток СНО Flp-In/Em464/01P581 и CHOFlp-In/Em464/01P582 соответственно. Полосы 1-4 соответствуют концентрациям матрицы общей РНК, равным 50 пг, 5 пг, 0,5 пг или 0 пг, которые были использованы для выполнения множественной RT-PCR с удлинением цепи путем перекрывания. М обозначает лэддер длиной 100 п.о. (New England Biolabs, New England, USA). Стрелки показывают продукт PCR с удлинением цепи путем перекрывания.
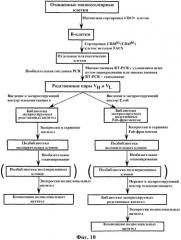
На фиг.10 изображена блок-схема, показывающая стадии создания библиотеки экспрессируемых родственных антител, из которой могут быть экспрессированы поликлональные или моноклональные антитела.
На фиг.11 схематически изображен вектор JSK301 E.coli, используемый для создания библиотеки векторов экспрессии Fab-фрагментов путем введения в вектор фрагментов удлинения цепи путем перекрывания, содержащих родственные последовательности, кодирующие вариабельные области, на указанных сайтах рестрикции NotI/XhoI. Указанный вектор содержит нижеследующие элементы: Amp и Amp pro = ген устойчивости к ампициллину и его промотор. pUC19 Ori = точка начала репликации. СН1 человека = последовательность, кодирующая домен 1 тяжелой цепи иммуноглобулина гамма 1 человека. Вставка = вставка неродственной последовательности, которую вырезают при введении фрагментов удлинения цепи путем перекрывания. tac P и lac Z = бактериальные промоторы, которые могут быть вырезаны на сайтах рестрикции NheI и AscI.
На фиг.12 изображена схема, иллюстрирующая создание библиотеки векторов экспрессии родственных Fab-фрагментов. Стадия 1 иллюстрирует вставку родственных пар последовательностей, кодирующих вариабельные области (VH1-VL1 - VHХ-VLХ), в вектор JSK301 E.coli путем гидролиза XhoI-NotI. Стадия II иллюстрирует вставку кластера бактериального промотора и лидерной последовательности (лидерная последовательность pelB и Р tac-промотор, стимулирующие экспрессию VHx, Р lac-промотор и лидерная последовательность pelB, стимулирующие экспрессию VLx) путем гидролиза AscI-NheI.
На фиг.13 показано связывание α-, β- и γ-субъединиц, образующих G-белок, при помощи одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и дополнительной амплификации при помощи PCR. На изображениях указаны размеры отдельных кодирующих областей, а также размер связанного продукта. Для конечного продукта указаны сайты рестрикции, введенные при помощи концевых сегментов праймера во время амплификации.
На фиг.14 показаны точечные диаграммы окрашивания при выполнении FACS-анализа (A) мононуклеарных клеток периферической крови (РВМС), выделенных из крови донора; (В) фракции немеченных CD19-отрицательных клеток, полученных методом магнитной сортировки клеток, и (С) фракции CD19+ клеток, полученных методом магнитной сортировки клеток. Для каждой фракции изображена диаграмма рассеяния, диаграмма CD19/CD38 и диаграмма CD38/CD45.
На фиг.15 показана фракция CD19+ клеток, изображенных на фиг.9С, которые предварительно хранили в жидком азоте, оттаивали и окрашивали антителом против CD19, CD38 и CD45. Изображены точечные диаграммы, соответствующие показанным на фиг.9С.
На фиг.16 показаны диаграммы совпадений, используемые для сортировки фракции СD19+ клеток. Диаграмма рассеяния и диаграмма флуоресценции на основе CD38 и CD45 были использованы для выделения высокопродуктивных CD38 клеток (CD38hi) и промежуточных CD45 клеток (CD45in).
На фиг.17 изображен гель после электрофореза, на котором видно успешное выполнение множественной RT-PCR с удлинением цепи путем перекрывания с использованием пробы крови, полученной от донора ТТ03 (ряд А, лунки 1-12 из восьми 96-луночных планшетов). Образцы наносили на агарозный гель в два ряда (А и В) по 48 образцов в каждом. Ожидаемый размер фрагмента удлинения цепи путем перекрывания составлял примерно 1070 п.о. Предполагаемые фрагменты удлинения цепи путем перекрывания отмечены стрелками.
На фиг.18 показан анализ ELISA периплазматических экстрактов с планшета G060. Планшет для ELISA сенсибилизировали антителом козы против каппа-цепи человека, при этом захваченные Fab-фрагменты были обнаружены при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.19 показан анализ ELISA периплазматических экстрактов с планшета G060. Планшет для ELISA сенсибилизировали 10 мкг/мл овальбумина (Sigma A-5503), при этом захваченные Fab-фрагменты были обнаружены при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.20 показан анализ ELISA периплазматических экстрактов с планшета G060. Планшет для ELISA сенсибилизировали столбнячным токсином, при этом захваченные Fab-фрагменты были обнаружены при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.21 показан одностадийный конкуретный анализ ELISA периплазматических экстрактов с планшета G060. Планшет на ELISA сенсибилизировали столбнячным токсином (ТТ) и в каждую лунку добавляли растворимый ТТ в количестве 10-7 М для конкурентного связывания Fab-фрагментов бактериальных супернатантов с иммобилизованным ТТ. Захваченные Fab-фрагменты обнаруживали при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.22 показан сравнительный анализ белковых последовательностей вариабельной области тяжелой цепи, полученных из клонов, связывающих ТТ-антиген, с планшета G060. Степень гомологии последовательностей выражена разными оттенками; 100%, 80% и 60% гомология изображена соответственно черным, серым и светло-серым цветом. CDR1 находится в сравниваемых положениях 34-41. CDR2 находится в сравниваемых положениях 55-73. CDR3 находится в сравниваемых положениях 107-127. Незрелые терминирующие кодоны обозначены звездочкой. Результаты сравнительного анализа показаны на восьми отдельных фигурах (a-h), расположенных в два ряда слева направо, при этом фиг.22а-d находятся в верхнем ряду и фиг.22е-h находятся в нижнем ряду.
На фиг.23 показан сравнительный анализ белковых последовательностей вариабельной области легкой цепи, полученных из клонов, связывающих ТТ-антиген, с планшета G060. Степень гомологии последовательностей выражена разными оттенками; 100%, 80% и 60% гомология изображена соответственно черным, серым и светло-серым цветом. CDR1 находится в сравниваемых положениях 26-42. CDR2 находится в сравниваемых положениях 58-64. CDR3 находится в сравниваемых положениях 97-106. Незрелые терминирующие кодоны обозначены звездочкой. Результаты сравнительного анализа показаны на восьми отдельных фигурах (a-h), расположенных в два ряда слева направо, при этом фиг.23а-d находятся в верхнем ряду и фиг.23е-h находятся в нижнем ряду.
На фиг.24 показан конкурентный анализ ELISA, выполненный для определения кажущегося сродства отобранных клонов с планшета G060. Растворимый ТТ, разведенный в концентрациях от 100 нМ до 25 пМ (четырехкратные разведения), добавляли к Fab-фрагментам, вызывая конкурентное связывание Fab-фрагментом с иммобилизованным ТТ. Степени взаимодействия выражены в виде соотношения наблюдаемого связывания при данной концентрации растворимого ТТ со связыванием, обнаруженным без добавления растворимого ТТ к реакционным смесям.
На фиг.25 представлена двойная филогенетическая гистограмма, показывающая внутригенетическую и межгенетическую взаимосвязь между последовательностями вариабельного домена тяжелой и легкой цепи антитела. Филогенетические группы из трех VН- и VL-последовательностей спарены на гистограмме для обозначения действительного спаривания конкретных V-генов. А) Клоны, связывающие ТТ-антиген, полученные из комбинаторной библиотеки методом отображения на фаге. В) Клоны, связывающие ТТ-антиген, полученные из библиотеки родственных пар способом по настоящему изобретению.
Описание изобретения
Настоящее изобретение относится к способу амплификации и связывания двух или нескольких интересующих несмежных нуклеотидных последовательностей, который обеспечивает высокоэффективное клонирование таких последовательностей. Указанный результат достигается главным образом за счет уменьшения числа стадий, необходимых для амплификации и связывания клонируемых последовательностей.
Одним из объектов настоящего изобретения является способ связывания нескольких несмежных нуклеотидных последовательностей, который предусматривает множественную молекулярную амплификацию интересующих нуклеотидных последовательностей с использованием матрицы, полученной из выделенной отдельной клетки, популяции изогенных клеток или популяции генетически разных клеток, и последующее связывание амплифицированных последовательностей. Если в качестве матрицы использована выделенная отдельная клетка или популяция изогенных клеток, то в результате связывания образуется сегмент нуклеиновой кислоты, содержащий родственные связанные интересующие нуклеотидные последовательности. Если в качестве матрицы использована популяция генетически разных клеток, то в результате связывания образуется библиотека сегментов, в которой каждый сегмент содержит произвольно связанные интересующие последовательности нуклеиновой кислоты; такая библиотека именуется также комбинаторной библиотекой.
В одном из вариантов осуществления настоящего изобретения вышеуказанная множественная молекулярная амплификация представляет собой амплификацию методом множественной PCR, которой предпочтительно предшествует стадия обратной транскрипции. В предпочтительном варианте осуществления изобретения обратную транскрипцию, амплификацию и связывание выполняют в виде одной стадии при помощи множественной RT-PCR с удлинением цепи путем перекрывания или, альтернативно, в виде двух стадий при помощи множественной RT-PCR и последующего связывания путем лигирования или рекомбинации.
Другой вариант осуществления настоящего изобретения относится к созданию библиотек родственных пар, включающих связанные последовательности, кодирующие вариабельные области, в частности последовательности, кодирующие вариабельные области тяжелой и легкой цепи, или последовательности, кодирующие альфа-цепь и бета-цепь Т-клеточного рецептора (TcR). Этот способ предусматривает получение лимфоцитсодержащей фракции клеток по крайней мере у одного приемлемого донора и, необязательно, обогащение определенной популяции лимфоцитов в указанной фракции, например В-лимфоцитов или Т-лимфоцитов, в зависимости от того, какие последовательности, кодирующие вариабельные области, желательно получить из иммуноглобулинов или TcR. Лимфоцитсодержащую фракцию клеток или обогащенную фракцию клеток распределяют в несколько сосудов, получая одну клетку в каждом сосуде. Несколько отдельных клеток подвергают обратной транскрипции (RT) или альтернативной процедуре получения кДНК, используя в качестве матрицы нуклеиновые кислоты, выделенные из популяции отдельных клеток. После стадии обратной транскрипции выполняют множественную молекулярную амплификацию и связывание пар полученных из каждой клетки последовательностей, кодирующих вариабельные области, одним из способов по настоящему изобретению.
Способы клонирования, описанные в настоящем изобретении, позволяют избежать трудоемкого и неэффективного клонирования и, кроме того, уменьшают риск загрязнения и потерю разнообразия на протяжении многочисленных стадий клонирования.
Другим объектом настоящего изобретения являются библиотеки родственных пар, получаемых в результате множественной молекулярной амплификации и связывания. Исходная библиотека родственных пар (первичная библиотека), полученная способом по настоящему изобретению, может быть подвергнута скринингу с созданием подбиблиотеки родственных пар, кодирующих вариабельные домены мишень-специфических связывающих белков или непроцессированные связывающие белки.
В другом варианте осуществления изобретения библиотеки и подбиблиотеки по настоящему изобретению могут быть использованы для экспрессии рекомбинантных моноклональных или поликлональных белков, в которых сохранено присущее донору первоначальное сродство и специфичность связывания.
Определения терминов
Термин “родственная пара” обозначает первоначальную пару интересующих несмежных нуклеиновых кислот, которые находятся внутри отдельной клетки или выделены из отдельной клетки. В предпочтительных вариантах осуществления изобретения родственная пара содержит две последовательности, кодирующие вариабельные области, которые вместе кодируют вариабельный домен связывающего белка и имеют генные последовательности, выделенные из одной и той же клетки. Таким образом, при экспрессии в виде полного связывающего белка или его устойчивого фрагмента они сохраняют сродство и специфичность связывания связывающего белка, первоначально экспрессированного из данной клетки. Родственная пара, например, может состоять из последовательности, кодирующей вариабельную область тяжелой цепи антитела, связанной с последовательностью, кодирующей вариабельную область легкой цепи, из той же клетки, или последовательности, кодирующей α-цепь Т-клеточного рецептора, связанной с последовательностью, кодирующей β-цепь, из той же клетки. Библиотека родственных пар представляет собой коллекцию таких родственных пар.
Под термином “полимераза, активируемая при нагревании” понимают полимеразы, которые являются неактивными или обладают очень низкой активностью при температурах, используемых для обратной транскрипции. Для активации таких полимераз нужны высокие температуры (90-95°С). Это является преимуществом выполнения одностадийных RT-PCR, так как при этом не происходит включение интерференции полимеразы в реакцию с участием обратной транскриптазы.
Термин “изогенная популяция клеток” обозначает популяцию генетически идентичных клеток. В частности, особый интерес при осуществлении настоящего изобретения представляет изогенная популяция клеток, полученная в результате клональной экспансии одной выделенной клетки.
Термин “выделенная отдельная клетка” обозначает клетку, которая физически отделена от популяции клеток и соответствует определению “одна клетка в одном сосуде”. Популяцию выделенных отдельных клеток получают при распределении популяции клеток в несколько сосудов. Как указано в разделе, озагла