Способ контроля за генетической изменчивостью в культуре животных клеток различной длительности пассирования
Иллюстрации
Показать всеИзобретение относится к области генной инженерии и может быть использовано для диагностики геномных изменений в клеточных линиях млекопитающих, происходящих при увеличении количества пассирований клеточных культур, необходимых для наращивания материала в медицине. Тест-система основана на использовании RAPD-PCR анализа ДНК. Способом исследовали стромальные клетки жировой ткани человека, а также клеточные культуры фибробластов человека различной длительности культивации. Изобретение позволяет с высокой чувствительностью контролировать стабильность генома в клеточных культурах различной длительности пассирования. 3 з.п. ф-лы, 6 ил., 1 табл.
Реферат
Настоящее изобретение относится к областям биологии и медицины, в частности к клеточной биологии и молекулярной генетике. Данное изобретение необходимо для диагностики геномных изменений в клеточных культурах млекопитающих (в том числе и человека), происходящих при пассировании (пассаж-пересев клеточной культуры), необходимом для наращивания материала.
Оценка генетической изменчивости проводится методом RAPD-PCR анализа ДНК клеточных культур, полученных при различной степени пассирования. Выделение ядерной ДНК проводится по методу Мэтью с использованием протеиназы K (Mathew, 1984). Нативность выделенной ДНК проверяют с помощью электрофореза в 0.8% агарозном геле («Sigma») в 1х трис-боратном (ТБЕ) буфере: 89 mM трис-борат, 89 mM борная кислота, 2 mM ЭДТА рН 8.0. PCR-амплификацию проводят на 100 нг геномной ДНК в объеме 20 мкл, используя набор «GenePak PCR Core» («Лаборатория Изоген»), на четырехканальном ДНК-амплификаторе «Терцик» (ТП4-ПЦР-01) («ДНК-технология»). Для амплификации используют олигонуклеотидные праймеры: Р29 с последовательностью 5' CATTCCGGCC 3' для подтверждения стабильности и повторяемости результатов, R45 с последовательностью 5' GCCGTCCGAG 3' и 447 с последовательностью 5' AACGGTCACG 3' для контроля генетического профиля ДНК клеточных линий млекопитающих. Подбор данных праймеров продиктован следующими характеристиками: праймер Р29 подобран для оценки высокой повторяемости экспериментов и для характеристики высокой идентичности внутривидовых клеточных культур, для праймеров R45 и 447 характерна внутривидовая чувствительность, которая предлагается нами для оценки генетической нестабильности в культивируемых клеточных линиях.
Оригинальность предложенного изобретения заключается в подборе случайных праймеров, при помощи которых можно контролировать внутривидовую генетическую изменчивость клеточных линий при длительном пассировании (от 5 пассажей и выше).
Использование клеточной терапии поднимает вопрос безопасности применения клеточных препаратов (M.Mikkola, BMC Developmental Biology, 2006). Увеличение количества пассажей при наращивании клеточного материала повышает вероятность геномных изменений, которые могут быть опасны для пациента. Таким образом, очевидна необходимость контроля за геномными изменениями в терапевтических культурах. В качестве тест-систем для такого контроля предлагается метод RAPD PCR анализа ДНК.
Мультилокусный анализ генома (RAPD PCR) был разработан на основе полимеразной цепной реакции со случайными праймерами. Он оказался весьма эффективным для идентификации и дифференциации клеточных линий и штаммов микроорганизмов (Welch et al., 1991; Булат и др., 1992, 1996).
Мы предлагаем использовать данный метод в качестве тест-системы геномных изменений в клеточном материале в ходе пассирования клеточных культур. Возможность применения данной тест-системы в промышленном масштабе повышает значимость такого исследования.
Актуальность разработки тест-систем по определению геномной изменчивости при длительном пассировании клеточных культур очевидна. Предложенный метод геномной паспортизации позволит контролировать геномные нарушения в клеточных препаратах, используемых не только при клинической терапии, но и при омолаживающей терапии и других коммерческих применениях клеточных культур. Такое тестирование обеспечит безопасность применения клеточных препаратов
Известно, что при длительном культивировании отмечается существенное изменение в скорости роста клеток, а также в их способности к дифференцировке (Mikkola, 2006). Кариотипический анализ показал нарушения в хромосомах и тенденцию к нестабильности кариотипа. Следовательно, при длительном культивировании клеточных линий и культур человека необходим строгий контроль их кариотипа. Эти исследования могут означать, что генетические нарушения начинаются значительно раньше, хотя их незначительность на хромосомном уровне не позволяет их обнаруживать при кариотипировании. Однако незначительные мутации могут привести к значительным нарушениям генетической регуляции. Как известно, надежность и безопасность использования клеточного материала зависит от генетической стабильности.
Таким образом, генетическая паспортизация первичных клеточных культур является существенно необходимым фактором, контролирующим генетическую стабильность. Однако не каждый метод позволяет адекватно и полно решать те или иные задачи исследования. Существует ряд методов, позволяющих контролировать генетические изменения.
Метод анализа белкового полиморфизма мог бы претендовать на возможность контроля за изменениями, происходящими в клетках. Использование нескольких сотен биохимических маркеров позволяет оценивать уровень генетического полиморфизма у более 2000 биологических видов (от микроорганизмов до человека) и дает возможность разработать основные теоретические положения популяционной генетики (Nei M. et al., 1987). Однако в ходе исследований выяснились определенные ограничения в применении этого типа маркеров. Прежде всего, это то, что анализ белков позволяет исследовать полиморфизм только белок-кодирующих последовательностей и только у экспрессирующихся генов. Если учесть, что у высших эукариот всего около 1% генома составляют белок-кодирующие последовательности, очевидно, что от внимания исследователей ускользает основная часть генома. При этом из анализа исключаются такие функционально значимые участки, как промоторные области, энхансеры, различные сайты регуляции, расположенные в интронах, нетранслируемых областях генов, а также вне генов, часто на значительном расстоянии от кодирующей последовательности.
Более перспективными оказались методы, оценивающие изменение на уровне ДНК. Среди них, например, метод ПДРФ (полиморфизм длины рестрикционных фрагментов), используемый для анализа полиморфизма конкретных локусов генома (Kohler, 1999). Данный метод основан на том, что расщепление геномной ДНК отдельными рестриктазами приводит к образованию определенного набора фрагментов ДНК, число и размеры которых соответствуют расположению сайтов рестрикции. Мутационная изменчивость в сайтах рестрикции может быть легко обнаружена по изменению длины рестрикционных фрагментов ДНК, гибридизующихся со специфическими ДНК-зондами. При наличии мутации в одном из сайтов рестрикции этот сайт остается нерасщепленным после завершения рестрикции/ что приводит к слиянию соседних рестрикционных фрагментов ДНК, разделяемых мутантным сайтом, и образованию фрагмента ДНК большего размера. В результате длина рестрикционных фрагментов ДНК, содержащих мутантные сайты, изменяется, что выявляется при электрофоретическом сравнении ДНК из разных источников методом ПДРФ.
Данным методом возможно определение крупных делеций, трансверсии, транслокации, транспозиции мобильных генетических элементов и мутации в сайтах рестрикции ДНК. Ограничения метода связаны с тем, что некоторые рестриктазы не способны расщеплять ДНК, если сайт узнавания рестриктазы содержит один или несколько метилированных нуклеотидов. В этом случае ПДРФ будет связан не со структрурными вариациями ДНК, а с характером ее метилирования. Другие ограничения метода ПДРФ - это: 1) необходимость использования больших количеств ДНК (10 мкг или более) для анализа, 2) использование радиоактивно меченых зондов, 3) использование мембранных фильтров для блоттинга ДНК, 4) многостадийность анализа. В совокупности метод занимает 1-2 недели, является весьма дорогостоящим и обладает ограниченной разрешимостью.
Один из вариантов ПДРФ, обладающий более совершенным разрешением, - это мультилокусный ДНК-фингерпринтинг (Jessireys et al, 1935, Ryskov et al, 1988). В его основе лежат ДНК-зонды, детектирующие рестрикционные фрагменты, содержащие минисателлиты и микросателлиты (Рысков, 1999). Высокая эффективность метода определяется гиперизменчивостью мини- и микросателлитов. Ранее различные варианты ДНК-фингерпринтинга были использованы для целей судебной медицины и криминалистики (Репа and Chakraborty, 1994), а также для решения фундаментальных проблем популяционной генетики, этологии, экологии, биоразнообразия (Wetton et al., 1987; Gilbert et al, 1990; Gilbert et al, 1991; Reeve et al., 1990; Ellegren et al., 1993; Baker et al., 1993; Aggarwal et al., 1994; Tegelstrom and Sjoberg, 1995; Tokarskaya et al.,2001, 2004). ДНК-фингерпринтинг также был использован для паспортизации клеточных линий. Однако данный метод крайне трудоемкий и обладает теми же ограничениями, что и метод ПДРФ.
Метод ДНК-биочипирования используется для изучения генетического полиморфизма клеточных линий и культур (Tanaka, 2002), однако данный метод обладает рядом недостатков, которые могут решаться с помощью RAPD-PCR анализа ДНК. Использование в качестве контроля генетического полиморфизма в клеточных культурах млекопитающих ДНК-биочипов крайне дорогостояще, а также несет ряд ограничений, таких как чувствительность метода к количеству образца, эффективности выделения РНК, эффективности обратной транскрипции, введения метки, эффективности детекции сигнала, а также присутствие кросс-гибридизации и неспецифической гибридизации.
Еще одним методом определения генетических изменений в клеточных культурах млекопитающих является in situ гибридизация: при использовании флуоресцентной метки - FISH (флуоресцентная in situ гибридизация) и при использовании хромогенной метки - CISH (хромогенная in situ гибридизация) (Jacobs et al, 1999). Оба метода выполняются на фиксированных препаратах. Недостатки этих методов связаны с тем, что они чувствительны к условиям фиксации материала. При использовании FISH метода требуется специализированное дорогостоящее оборудование и наборы реагентов, выпускающиеся фирмами Dako и Vysis.
В последние годы в изучении межвидовой генетической характеристики ДНК получил распространение метод, основанный на полимеразной цепной реакции ДНК с участием случайных праймеров (RAPD-анализ; RAPD - Randomly amplified polymorphic DNA). Метод используется тогда, когда нужно различить близкие по генетической последовательности организмы, например разные сорта культурных растений, породы собак или близкородственные микроорганизмы. В этом методе обычно используют один праймер небольшого размера (8-15 п.н.) с произвольной последовательностью и соотношением GC-nap около 60%.
Метод исследует анонимные локусы ДНК с помощью одиночных неспецифичных коротких праймеров, узнающих комплементарные участки на обеих цепях ДНК. RAPD-PCR анализ ДНК успешно используется в ряде лабораторий для целей таксономии и характеристики генетической структуры популяций (Raina et al, 2001).
По сравнению с другими методами RAPD-PCR имеет ряд преимуществ:
1) относительная простота, 2) короткое время анализа (несколько часов), 3) относительная дешевизна в реактивах и оборудовании. Один из преимуществ RAPD-PCR анализа заключается в том, что предлагаемый способ анализа генетической изменчивости ДНК основан на использовании одного короткого олигонуклеотидного праймера с произвольной последовательностью.
Случайные праймеры (праймеры с произвольной последовательностью) или праймеры, комплементарные повторяющимся последовательностям, - это короткие праймеры, связывающиеся с большим количеством участков бактериального генома [Платонов А.Е., Шипулин Г.А., Тютюнник Е.Н., Платонова О.В. Генодиагностика бактериальных менингитов и генотипирование их возбудителей. Пособие для врачей, ЦНИИ эпидемиологии МЗ РФ, Москва, 2000 г.]. Для синтеза таких праймеров нет необходимости в знании конкретных нуклеотидных последовательностей генома исследуемого организма. Праймеры с произвольной последовательностью должны лишь отвечать определенным требованиям по соотношению GC-пар (около 60%) и длине (8-15 оснований). Суть метода заключается в амплификации фрагментов ДНК с использованием единичного короткого праймера с низкой температурой отжига в реакции ПЦР. Праймер связывается с геномной ДНК в двух различных участках инвертированных повторов. При электрофоретическом разделении
амплифицированных продуктов образуются дискретные продукты, размер которых варьирует от 100 до 5000 п.н. (ДНК-спектры). Эти фрагменты представляют собой анонимную, как правило, уникальную последовательность ДНК, заключенную между двумя инвертированными повторами. Различия в ДНК-спектрах определяются различиями в одном или обоих праймер-связывающих сайтах (наличие или отсутствие полосы ПЦР-продукта в спектре) или присутствием инсерции/делеции в амплифицируемом фрагменте (различия ПЦР-продуктов по размеру) [Williams J.G.K., Kubelik A.R., Livak K.J. et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers//Nucl. Acids Res. 1990. V.18, N 22. P.6531-6535].
RAPD-анализ может служить своеобразным экспресс-методом выявления генетического полиморфизма. Диагностические возможности RAPD-технологии успешно проиллюстрированы на многочисленных примерах описания генетического разнообразия микроорганизмов, высших растений, беспозвоночных и позвоночных животных. RAPD применяется также для геномного маркирования в популяционных и эволюционных исследованиях. Например, для разных видов грибов с помощью УП-ПЦР (ПЦР с универсальными праймерами) показана видоспецифичность ДНК-паттернов. Наиболее подробно с помощью RAPD-PCR изучались культурные растения, сельскохозяйственные и лабораторные животные с целью идентификации и дифференциации пород и отдельных линий, картирования хромосом и маркирования хозяйственно-ценных признаков (Спиридонова Л.Н. et.al.,2004; E. Reinoso et. al., 2004; Devaiah K.M. et. al., 2004; Munoz M.A. et. al., 2007; Lee Y.C. et. al., 2007).
RAPD был использован для паспортизации бактериальных штаммов и клеточных линий. Нами этот метод был применен для исследования мозаицизма клеточных тканей млекопитающих. Для биологических систем описано явление соматического мозаицизма, что означает присутствие в одном организме генетически различных линий клеток. Различия между линиями определяются мутациями в ДНК, хромосомными перестройками/ различными эпигенетическими факторами. В 1929 г.
Бовери предположил, что раковая трансформация возникает по вине одной клетки, которая претерпевает генетические изменения (Youssoufian et al., 2002). Последующие исследования хромосом и нуклеотидных последовательностей ДНК доказали присутствие соматических мутаций в большинстве видов рака. Многие исследователи считают, что причиной рака является накопление соматических мутаций, что приводит к неконтролируемому клеточному делению. Раковый патогенез - наиболее известный пример соматического мозаицизма (Ionov et al., 1993). Его причинами могут служить как генетические, так и эпигенетические события (Vilkki et al., 2001), потеря гетерозиготности путем митотической рекомбинации (Cavenee et al., 1983), хромосомная нестабильность или изменения в микросателлитных локусах (Lengauer et al., 1998).
Бутовской П.Р. с соавторами (2008) с помощью метода PCR-амплификации со случайными праймерами была изучена ДНК органов и эмбриональной ткани млекопитающих. Из 27 протестированных олигонуклеотидных праймеров было отобрано 10 со стабильным, хорошо воспроизводимым спектром продуктов амплификации. Выявлены различия в RAPD-спектрах тканей одного из эмбрионов при использовании двух праймеров (447 и R45). Различия, связанные с изменением подвижности или появлением/утрачиванием фрагментов в RAPD-спектре, могут быть вызваны геномными перестройками или мутациями, затрагивающими участки комплементарного связывания ДНК с праймерами, а также различными эпигенетическими факторами.
На основании полученных данных мы предлагаем данный метод для контроля за изменениями ДНК в клеточных культурах. Мы утверждаем, что чувствительность данного метода позволяет его использовать не только для паспортизации клеточных линий, но и для контроля за генетическими изменениями, происходящими в клеточных культурах при пассировании.
Для использования данного метода следует соблюдать протокол Клеточные культуры:
Для исследования использовались клеточные культуры фибробластов человека, а также клеточные культуры прогениторных клеток, полученных их жировой ткани человека. Изучалось влияние длительного пассирования на семь различных клеточных культур фибробластов человека и семь клеточных культур мезенхимальных клеток, полученных из жировой ткани. Данные культуры отличались друг от друга различным возрастом пациентов. Сравнение производили между результатами RAPD-анализа ДНК с различных пассажей по сравнению с 0 или 1 пассажем (нулевым пассажем считать культуру не прошедшую смену питательной среды, первым пассажем считать первый пересев клеточной культуры). Образцы №10 и №10* отличаются различными средами культивации.
Выделение ядерной ДНК
Выделение ядерной ДНК проводили по методу Мэтью с использованием протеиназы K [Mathew C.G.P. Methods in Molecular Biology // Ed. Walker J.M., N.Y.; L.: Human Press, 1984. V.2. P.31-34]. Осадок ядер суспендировали в 300 мкл буфера следующего состава: 75 mM NaCl, 25 тМ ЭДТА рН 8.0. Ядра вскрывали добавлением SDS до концентрации 1% и протеиназы K («Promega») до концентрации 50-100 мкг/мл. Смесь инкубировали' в термостате при температуре 37°С в течение ночи. После инкубации в смесь добавляли 4М раствор ацетата натрия до концентрации 0.2 М, плавно перемешивали и добавляли фенол (насыщенный 1М трисом-HCl, рН 8.0) в объемном соотношении 1:1. Депротеинизацию фенолом (рН 8.0) проводили в течение 15 минут. Фазы разделяли центрифугированием в течение 20 минут при 4000 об/мин. В результате центрифугирования происходило разделение на три фазы: верхнюю - раствор ДНК, среднюю - оставшиеся белки, нижнюю - фенол. Раствор ДНК отбирали, к нему добавляли фенол-хлороформную смесь (соотношение компонентов в смеси 1:1). Далее проводили депротеинизацию смесью фенола и хлороформа и хлороформом. Осаждение ДНК проводили 2,5 объемами 96% этанола. Раствор плавно перемешивали до полного высаживания ДНК. Осажденную в виде медузы ДНК дважды промывали раствором 75% этанола и растворяли в ТЕ буфере (10 тМ трис-HCl, ImM ЭДТА рН 8.0). Концентрацию ДНК проверяли на спектрофотометре при длине волны 260 нм. Раствор ДНК хранили в холодильнике при +4°С.
Нативность выделенной ДНК проверяли с помощью электрофореза в 0.8% агарозном геле («Sigma») в 1 × трис-боратном (ТБЕ) буфере: 89 mM трис-борат, 89 mM борная кислота, 2 mM ЭДТА рН 8.0.
Полимеразная цепная реакция
PCR-амплификацию проводили на 100 нг геномной ДНК в объеме 20 мкл, используя набор «GenePak PCR Core» («Лаборатория Изоген»), на четырехканальном ДНК-амплификаторе «Терцик» (ТП4-ПЦР-01) («ДНК-технология»). Структура олигонуклеотидных праймеров и температурные режимы амплификации приведены в таблице 1.
| Таблица 1 | |||
| Температурные режимы PCR амплификации | |||
| Последовательность праймера (5'-3') | Температурные режимы | Количество праймера | Информация |
| Р29 CATTCCGGCC | 1. Денатурация 94°С - 4 минуты 2.35 циклов: денатурация: 94°С-1 минута отжиг праймера: 38°С - 1 минута элонгация: 72°С - 2 минуты | 1 мкМ | Токарская и др., 2000 |
| R45 GCCGTCCGAG | 1. Денатурация 94°С - 4 минута 2.35 циклов: денатурация: 94°С - 1 минута отжиг праймера: 38°С - 1 минута элонгация: 72°С - 2 минуты | 1 мкМ | Малышева и др., 2006 |
| 447 AACGGTCACG | 1. Денатурация 94°С - 5 минут 2.40 циклов: денатурация: 94°С - 30 секунд отжиг праймера: 40°С - 1 минута элонгация: 72°С - 1 минута | 1,5 мкМ | Alexandrova et al., 2005 |
Alexandrova S.A., Shvemberg I.N. Genetic variability of the mouse hepatoma cells MH-22a revealed by RAPDPCR-fingerprinting under different conditions of cultivation // Experimental Oncology. 2005. V.27. (2). P.114-119.
Малышева Д.Н., Токарская О.Н., Петросян В.Г. и др. Генетическая дифференциация партеногенетических ящериц Darevskia rostombekowi (сем. Lacertidae) по данным ядерных и митохондриальных маркеров ДНК // Докл. РАН. 2006. Т.410. №4. С.560-563.
Токарская. О.Н., Ефремова Д.А., Как Н.Г., Данилкин А.А., Семпере А., Петросян В.Г., Семенова С.К., Рысков А.П. Изменчивость мультилокусных маркеров ДНК в популяциях сибирской (Ccipreoluspygargw'PsSL)n европейской (С capreolusL) косуль // Генетика, 2000 Т.36. №11. С.1520-1530.
Электрофоретическое фракционирование фрагментов ДНК
Продукты амплификации фракционировали в 2% агарозном геле в течение 18 часов при температуре 4°С в 1х трис-боратном (ТБЕ) буфере: 89 mM трис-борат, 89 mM борная кислота, 2 mM ЭДТА рН 8.0 с последующей визуализацией раствором бромистого этидия 50 мкг/л. В качестве маркеров молекулярного веса использовали 100 bp Ladder + («Fermentas») и Ladder 1kb («Fermentas»).
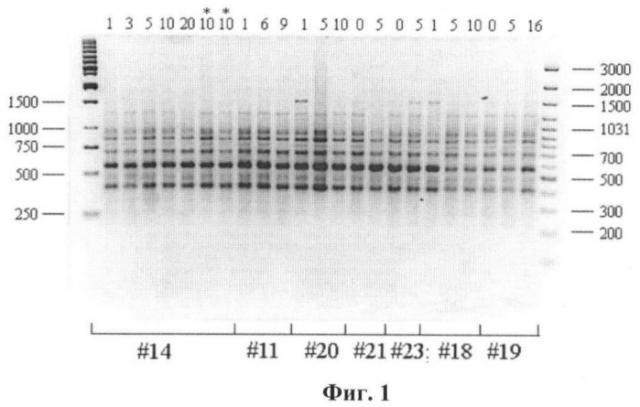
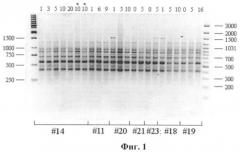
Пример 1. RAPD-PCR анализ ДНК был применен для изучения клеточных культур фибробластов человека. Изучалась возможность контроля за генетическими изменениями в культурах фибробластов при различных количествах их пассирования. Для изучения были отобраны семь культур фибробластов. Геномная ДНК была выделена из культур клеток разных линий фибробластов человека по стандартной фенольно-хлороформной методике с использованием протеиназы К (Mathew C.G.P., 1984). Амплификацию с 3 праймерами (Р29, 447 и R45) проводили в объеме 20 мкл, используя набор «GenePak PCR Core» («Лаборатория Изоген»), на четырехканальном ДНК-амплификаторе «Терцик» (ТП4-ПЦР-01) («ДНК-технология»). Структура олигонуклеотидных праймеров и температурные режимы амплификации приведены в таблице 1. Продукты амплификации фракционировали в 2% агарозном геле в течение 18 часов при температуре 4°С с последующей визуализацией бромистым этидием. В качестве маркеров молекулярного веса использовали 100 bp Ladder + («Fermentas») и Ladder 1kb («Fermentas»).Результаты PCR-амплификации образцов ДНК с праймером Р29, выделенных из разных линий фибробластов человека разных пассажей с использованием праймера 447, представлены на фиг.1: #14, #11, # 20, #21, #23, #18, #19 - разные линии клеток. Цифры 1-15 - разные пассажи. Результаты амплификации образцов ДНК, RAPD спектры пассажей одной линии являются мономорфными, представлены в среднем 12 фрагментами в пределах от 200 п.о. до 1500 п.о. Амплификационные спектры образцов ДНК клеточных линий, а также разных пассажей (от 0 до 20) в пределах одной клеточной линии были идентичны.
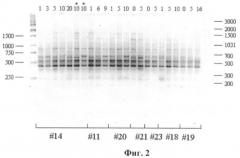
Результаты PCR-амплификации образцов ДНК, выделенных из разных линий фибробластов человека разных пассажей с использованием праймера R45, представлены на фиг.2: #14, #11, # 20, #21, #23, #18, #19 - разные линии клеток. Цифры 1-15 - разные пассажи. Профиль амплификации с олигонуклеотидом R45 (фиг.2) представлен в среднем 11 фрагментами в пределах 250-2000 п.о. Спектры амплификации образцов ДНК разных пассажей одной клеточной линии, полученные при использовании данного праймера, были идентичными, однако наблюдались различия между линиями. Так, линии #23 и #19 характеризовались отсутствием в RAPD-профиле фрагмента размером около 600 п.о. (фиг.2, показано стрелкой). Таким образом, использование праймера R45 в некоторых случаях позволяет выявить различия между клеточными линиями.
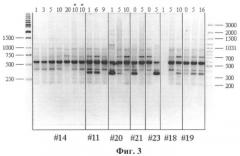
На фиг.3 представлены результаты PCR-амплификации образцов ДНК с олигонуклеотидом 447, выделенных из разных линий фибробластов человека разных пассажей с использованием праймера 447. #14, #11, #20, #21, #23, #18, #19 - разные линии клеток. Цифры 1-15 - разные пассажи. RAPD-спектры представлены в среднем 12 фрагментами в зоне электрофоретического фракционирования от 250 п.о. до 1500 п.о. Профили амплификации образцов ДНК различных клеточных линий были идентичными, одновременно наблюдалось изменение фрагмента размером около 350 п.о. в RAPD спектрах образцов ДНК разных пассажей в пределах одной клеточной линии. Изменение было связано с тем, что в амплификационных спектрах образцов ДНК некоторых линий данный фрагмент присутствовал (линии #18 и #19), в RAPD-профиле линии #14 фрагмент отсутствовал, а в случае линий #11, #20, #21 и #23 фрагмент наблюдался в спектрах амплификации образцов ДНК, выделенных из клеток на разных стадиях пассирования. Для RAPD-спектра линий #11, #20 и #21 характерно исчезновение фрагмента размером 350 п.о. на более поздних пассажах (линия #11 - отсутствие в образцах ДНК, выделенных их клеток на 9 пассаже; линия #20 - на 10 пассаже; линия #21 - на 5 пассаже). В амплификационном спектре линии #23 данный фрагмент отсутствовал в образцах ДНК, выделенных из клеток на 0 пассаже, и присутствовал в образцах из клеток на 5 пассаже. Несмотря на то, что изменения наблюдались на различных пассажах для отдельных клеточных линий, общий характер изменений сохранялся: пропадал/появлялся фрагмент размером около 350 п.о. Таким образом, использование праймера 447 позволяет выявить изменения образцов ДНК, выделенных из клеток на разных стадиях пассирования, на фоне общего профиля амплификации, характерного для всех линий фибробластов человека. Таким образом, результаты аплификации ДНК с праймерами Р29 и R45 представлены на фиг.1 и 2, различий между амплификационными спектрами ДНК, выделенной из клеток фибробластов разных пассажей, не выявляло.
RAPD-спектры являлись мономорфными. Тогда как результаты RAPD-анализа тех же образцов ДНК с использованием праймера 447 (фиг.3) обнаруживали заничительные отличия. Как видно, амплификация с данным олигонуклеотидом позволяет выявить различия между ДНК фибробластов одной линии на разных пассажах. Изменение подвижности или появление/утрачивание фрагментов ДНК в RAPD-спектре может быть связано с геномными перестройками или мутациями, затрагивающими участки комплементарного связывания ДНК с олигонуклеотидными праймерами.
Пример 2
RAPD-PCR анализ ДНК был применен для изучения клеточных культур стромальных клеток человека, полученных из подкожной жировой ткани. Изучалась возможность контроля за генетическими изменениями в культурах стромальных клеток жировой ткани при различных количествах их пассирования. Для изучения были отобраны семь культур. Геномная ДНК была выделена из культур клеток разных линий исследуемых клеточных культур человека по стандартной фенольно-хлороформной методике с использованием протеиназы K (Mathew C.G.P., 1984). Амплификацию с 3 праймерами (Р29, 447 и R45) проводили в объеме 20 мкл, используя набор «GenePak PCR Core» («Лаборатория Изоген»), на четырехканальном ДНК-амплификаторе «Терцик» (ТП4-ПЦР-01) («ДНК-технология»). Структура олигонуклеотидных праймеров и температурные режимы амплификации приведены в таблице 1. Продукты амплификации фракционировали в 2% агарозном геле в течение 18 часов при температуре 4°С с последующей визуализацией бромистым этидием. В качестве маркеров молекулярного веса использовали 100 bp Ladder + («Fermentas») и Ladder 1kb («Fermentas»).
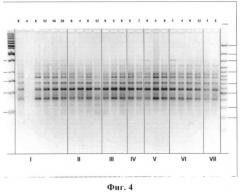
Результаты аплификации ДНК с праймерами Р29 и R45 представлены на фиг.4 и 5 соответственно. На фиг.4 - результаты PCR-амплификации образцов ДНК, выделенных из разных линий стромальных клеток жировой ткани человека разных пассажей с использованием праймера Р29. В качестве маркеров молекулярного веса использовались 100 bp Ladder + («Fermentas») и 1 kb Ladder («Fermentas»). I, II, III, IV, V, VI, VII - разные линии клеток; цифры 1-20 - разные пассажи. На фиг.5 - результаты PCR-амплификации образцов ДНК, выделенных из разных линий стромальных клеток жировой ткани человека разных пассажей с использованием праймера R45. В качестве маркеров молекулярного веса использовались 100 bp Ladder + («Fermentas») и 1 kb Ladder («Fermentas»). I, II, III, IV, V, VI, VII - разные линии клеток; цифры 1-20 - разные пассажи. Различий между амплификационными спектрами ДНК, выделенной из стромальных клеток жировой ткани разных пассажей, обнаружено не было - RAPD-спектры являлись мономорфными. На фиг.6 - результаты PCR-амплификации образцов ДНК, выделенных из разных линий стромальных клеток жировой ткани человека разных пассажей с использованием праймера 447. В качестве маркеров молекулярного веса использовались 100 bp Ladder + («Fermentas») и 1 kb Ladder («Fermentas»). I, II, III, IV, V, VI, VII - разные линии клеток; цифры 1-20 - разные пассажи. На фиг.6 представлены результаты RAPD-анализа тех же образцов ДНК с использованием праймера 447. Как видно, амплификация с данным олигонуклеотидом позволяет выявить различия между ДНК прогентиторных клеток жировой ткани одной линии на разных пассажах. Изменение подвижности или появление/утрачивание фрагментов ДНК в RAPD-спектре может быть связано с геномными перестройками или мутациями, затрагивающими участки комплементарного связывания ДНК с олигонуклеотидными праймерами.
На основе полученных данных можно отметить, что: 1) метод ПЦР-амплификации со случайными праймерами (RAPD-PCR) позволяет выявить различия в геномной ДНК, выделенной из клеточных линий различных пассажей; 2) при использовании одиночных праймеров спектры продуктов амплификации различаются по уровню наблюдаемого полиморфизма; 3) RAPD-изменчивость наблюдалась на разных стадиях пассирования в зависимости от исследованной линии.
Таким образом, чувствительность метода RAPD-PCR-анализа ДНК позволяет определить (по сравнению с нулевым пассажем) на каком пассировании будут проявляться генетические изменения, которые могут представлять угрозу для пациента.
Праймер Р29 подтверждает принадлежность пациентов к одному виду. Праймер Р29 подобран для оценки высокой повторяемости экспериментов, а также для характеристики высокой идентичности внутривидовых клеточных культур. Для праймеров R45 и 447 характерна внутривидовая чувствительность и они показали значительную изменчивость ДНК при длительном культивировании. Было обнаружено, что культуры фибробластов более стабильны при наращиваниии клеток, тогда как прогениторные клетки жировой ткани взрослых пациентов показали значительную генетическую нестабильность при пассировании. При этом №10 и №10* показали одинаковый паттерн, что говорит об отсутствии влияния среды культивирования на генетическую изменчивость клеточных культур. Таким образом, культуры фибробластов в ряде случаев можно использовать после восьмого пассажа (а иногда и при более длительном наращивании), тогда как клетки, полученные из подкожной жировой ткани человека, необходимо контролировать на генетические изменения уже после четвертого пассажа. Следует отметить, возраст и здоровье человека также влияет на стабильность ДНК, т.е. необходим контроль за генетической изменчивостью клеточных культур перед их использованием (сравнение с нулевым или первым пассажем). Предлагаемый метод RAPD-PCR анализ позволяет быстро и с наменьшими затратами контролировать данные нарушения.
Эффективность предлагаемого способа контроля за генетической изменчивостью подтверждается дополнительными экспериментами, в которых с помощью метода RAPD-PCR анализа ДНК исследовалась генетическая изменчивость линий почечных клеток НЕК293 с использованием олигонуклеотидного праймера ОРА12 с произвольной последовательностью TCGGCGATAG, длиной 10 оснований и соотношением GC-пар 45-60%
Предлагаемый способ контроля за генетической изменчивостью может быть полезен для выявления генетических изменений различного типа клеток с помощью метода RAPD-PCR анализа ДНК, в котором для этих целей используют олигонуклеотидные праймеры, удовлетворяющие определенным критериям: соотношение GC-пap 45-60%, праймер должно быть коротким (8-15 оснований) с произвольной последовательностью. Олигонуклеотидные праймеры подбирают в зависимости от их чувствительности к определенному виду клеток. При этом выявление генетической изменчивости в клеточной культуре, прошедшей длительное пассирование, осуществляют путем визуального сравнения геномного профиля клеток нулевого пассажа или прошедших первый пассаж с геномным профилем клеток, прошедших пассирование два раза или более.
1. Способ контроля за генетической изменчивостью в культуре животных клеток различной длительности пассирования, включающий выделение геномной ДНК клеточной культуры фенольно-хлороформным методом с использованием протеиназы К, затем амплификацию выделенной ДНК с помощью чувствительного к геномной изменчивости олигонуклеотидного праймера, который должен быть коротким, с произвольной последовательностью и соотношение в нем GC-nap должно составлять около 60%, с последующим электрофоретическим разделением и визуализацией продуктов амплификации в виде геномных профилей по методу RAPD-PCR, при этом выявление генетической изменчивости в клеточной культуре, прошедшей длительное пассирование, осуществляют путем визуального сравнения геномного профиля клеток нулевого пассажа или прошедших первый пассаж с геномным профилем клеток, прошедших пассирование два раза или более.
2. Способ по п.1, где олигонуклеотидный праймер выбран из группы, включающей: Р29 5' CATTCCGGCC 3'; 447 5' AACGGTCACG 3'; R45 5' GCCGTCCGAG 3'.
3. Способ по пп.1 и 2, где для подтверждения идентичности внутривидовых клеточных культур, стабильности и повторяемости результатов используют олигонуклеотидный праймер Р29 5' CATTCCGGCC 3'.
4. Способ по пп.1 и 2, где для контроля за генетической изменчивостью в культуре животных клеток различной длительности пассирования используют олигонуклеотидные праймеры 447 5' AACGGTCACG 3'; R45 5'GCCGTCCGAG 3'.