Способ оценки антиоксидантной активности
Иллюстрации
Показать всеИзобретение относится к экспериментальной и клинической медицине, в частности к медицинской биофизике, клинической фармакологии, биохимии, онкологии и иммунологии. Для оценки антиоксидантной активности вводят исследуемый антиоксидант в биологический объект, индуцируют свободнорадикальное окисление и оценивают антиоксидантную активность по оптической плотности образцов при их фотометрировании. В качестве биологического объекта используют цельную кровь, взятую на цитрате или гепарине. Исследуемый антиоксидант вводят в полученную из цельной крови 5% суспензию эритроцитов, инкубируют, вносят 10 µл взвеси клотримазола в концентрации 1 мМ и индуцируют окисление, добавляя 20 µл раствора третбутиловой гидроперекиси в концентрации 100 мМ. Повторно инкубируют образцы, после чего их центрифугируют и измеряют оптическую плотность надосадков. Использование способа позволяет повысить точность и эффективность определения антиоксидантной активности различных природных и химических соединений и биологических жидкостей. 5 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к экспериментальной и клинической медицине, в частности к медицинской биофизике, клинической фармакологии, биохимии, онкологии и иммунологии, и может быть использовано для медико-биологических исследований с целью определения антиоксидантной активности различных природных и химических соединений, а также биологических жидкостей.
Как известно, механизмы действия активных форм кислорода (АФК) достаточно сложны, разнообразны и до настоящего времени не вполне изучены. Учитывая эффективность применения антиоксидантных препаратов при коррекции состояний, связанных с действием окислительного стресса, актуальной становится задача оценки антиоксидантной активности (АОА) такого рода препаратов.
На сегодняшний день для оценки АОА отдельных соединений, их смесей или полной антиоксидантной активности биологических объектов разработано множество методов. Эти методы различаются по типу окислителя и окисляемого соединения (мишени), а также по способу измерения окисленного продукта. Они дают широкий спектр результатов, которые не имеют абсолютного значения, и должны интерпретироваться с учетом результатов, полученных другими методами. К такому выводу приходят авторы многочисленных публикаций, как отечественных, так и зарубежных. В частности, различные способы тестирования приведены в обзоре «Способы тестирования антиоксидантной активности» (Michael Antolovich et al., Журнал Королевского общества химиков ANALYST, август 2002, с.183-198).
В качестве прототипа нами рассмотрен способ оценки антиоксидантной активности образца (US 7132296, 2006), в котором описан способ определения показателя ORAC (oxygen radical absorbance capacity), который на сегодняшний день является стандартным показателем АОА в ряде стран, например США. Способ заключается в том, что антиоксидантную активность оценивают, вводя исследуемый антиоксидант в смесь натриевой соли флуоресцеина (F1) и 2,2'-Azobis(2-amidinopropane) dihydrochloride (ААРН). При температуре инкубации 37°С проводят измерение интенсивности флуоресценции смеси. Интенсивность снижается по мере окисления F1 пероксильными радикалами, образующимися при термической деградации ААРН. Присутствие антиоксидантов приводит к увеличению периода времени до момента начала снижения интенсивности флуоресценции. Способ требует наличия достаточно сложного оборудования и затратен в отношении используемых реактивов. Кроме того, условия проведения такого рода анализов далеки от физиологических.
Технический результат предлагаемого изобретения направлен на устранение перечисленных недостатков и заключается в физиологичности условий измерения, удобстве использования и минимальном расходовании реактивов.
Сущность предлагаемого способа заключается в том, что в методе оценки антиоксидантной активности путем введения исследуемого антиоксиданта в биологический объект, индукции свободнорадикального окисления и оценки антиоксидантной активности по оптической плотности образцов при их фотометрировании в качестве биологического объекта используют цельную кровь, взятую на цитрате или гепарине, преинкубируют полученную из цельной крови 5% суспензию эритроцитов с исследуемым антиоксидантом, добавляют взвесь клотримазола (конечная концентрация 10 µМ), после чего индуцируют окисление, внося раствор третбутиловой гидроперекиси (t-BHP) в конечной концентрации 2 мМ и инкубируют образцы, после чего образцы центрифугируют и измеряют оптическую плотность надосадков.
При этом инкубацию проводят в течение 3 часов при температуре 37°С.
Предпочтительно, чтобы оптическую плотность образцов измеряли на длине волны 490-540 нм.
Предпочтительно введение исследуемого антиоксиданта в суспензию эритроцитов в разных концентрациях, при этом инкубируют образцы 20 мин. После чего по оптической плотности образцов измеряют степень гемолиза, строят ее зависимость от концентрации исследуемого антиоксиданта и в качестве показателя антиоксидантной активности используют концентрацию антиоксиданта, приводящую к 50% снижению степени гемолиза.
Также в качестве показателя антиоксидантной активности может быть использовано отношение концентраций исследуемого антиоксиданта и стандартного антиоксиданта тролокса.
Ранее были предложены методы оценки АОА, в которых использовали эритроциты, подвергнутые действию азоинициаторов (ААРН или AMVN) как источников пероксильных радикалов (Kitagawa S, Sakamoto Н, Tano Н. Inhibitory effects of flavonoids on free radical-induced hemolysis and their oxidative effects on hemoglobin // Chem Pharm Bull (Tokyo). - 2004. - V.52, №8. - Pp.999-1001; Dai F, Miao Q, Zhou B, Yang L, Liu ZL. Protective effects of flavonols and their glycosides against free radical-induced oxidative hemolysis of red blood cells // Life Sci. - 2006. - V.78, №21. - Pp.2488-493; Abella A, Messaoudi C, Laurent D, Marot D, Chalas J, Breux J, Claise C, Lindenbaum A. A method for simultaneous determination of plasma and erythrocyte antioxidant status. Evaluation of the antioxidant activity of vitamin E in healthy volunteers // Br J Clin Pharmacol. - 1996. - V.42, №6. - Pp.737-741 и др.).
Показано, что присутствие азоинициаторов не вызывает внутриклеточного окисления гемоглобина и, соответственно, последующего высвобождения гемина (Lenfant F, Bureau A, Lahet JJ, Bouyer F, Chaillot B, Freysz M. Effects of an oxidative stress on human hemoglobin: a multiwavelength visible spectrometry study.// Biomed Pharmacother.- 2005.- V.59, №5, Pp.230-232).
Между тем окисление гемоглобина и последующая его деградация достаточно часто встречаются в условиях in vivo как в физиологических (старение эритроцитов), так и в патологических (малярия, ишемия - реперфузия, серповидно-клеточная анемия и др.) условиях. Таким образом, эритроциты, модифицированные окислителями, вызывающими образование метгемоглобина, в том числе третбутиловой гидроперекисью (t-BHP), представляются более адекватной и биологически значимой клеточной моделью для оценки антиоксидантной активности по сравнению с существующими моделями, основанными на использовании азо-соединений как экзогенных источников свободных радикалов.
Было показано, что клотримазол образует с экзогенным гемом (гемином) комплекс, обладающий значительно большим литическим эффектом, чем свободный гем (Huy NT, Kamei К, Yamamoto Т, Kondo Y, Kanaori К, Takano R, Tajima К, Hara S. Clotrimazole binds to heme and enhances heme-dependent hemolysis: proposed antimalarial mechanism of clotrimazole // J Biol Chem. - 2002. -V.277, №6, Pp.4152-4158).
В ходе нашей работы впервые было показано, что клотримазол в концентрации 10 µМ существенно усиливает как набухание, так и гемолиз эритроцитов под действием t-BHP, что свидетельствует о значительном усилении повреждения мембраны в присутствии этого соединения. Очевидно, что индуцированный перекисью гемолиз является, во всяком случае, частично, результатом литического эффекта гемина, высвобождаемого из гемихрома, образующегося в клетке при окислении гемоглобина. Степень гемолиза существенно возрастает, если в суспензию добавляется клотримазол, который образует с гемином комплекс, обладающий большей по сравнению со свободным гемином литической активностью.
Таким образом, можно рассматривать клотримазол как агент, усиливающий окислительный гемолиз эритроцитов под действием t-BHP.
Известно, что антиоксиданты снижают степень индуцированного гемином и t-BHP повреждения мембраны и последующего гемолиза.
Ингибирующее действие антиоксидантов, осуществляемое на начальных стадиях процесса, в дальнейшем подвергается усилению в присутствии клотримазола, что, вероятно, объясняет исключительно высокую чувствительность предлагаемой клеточной модели к действию различных антиоксидантов.
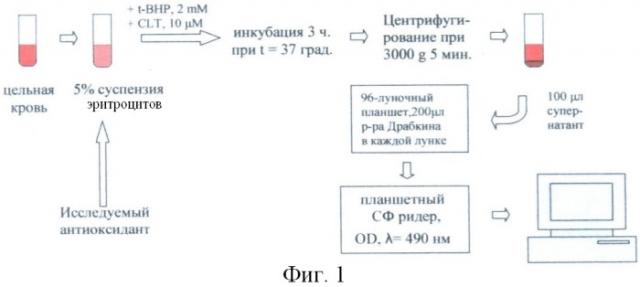
На фиг.1 приведена схема проведения способа оценки АОА.
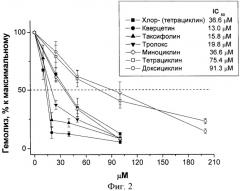
На фиг.2 приведена зависимость степени гемолиза, индуцированного t-ВНР в присутствии клотримазола, от концентрации антиоксидантов.
Предлагаемый способ осуществляется следующим образом.
Цельную кровь, взятую на цитрате или гепарине, отмывают физиологическим раствором (фиг.1) и ресуспендируют отмытые эритроциты в HEPES-буфере, содержащем в мМ 10 HEPES, 5 KCL, 0.8 MgSO4, 1.5 CaCl2, 5 глюкозы при рН 7,4, при гематокрите 5%.
70% водный раствор t-BHP разбавляют физиологическим раствором до концентрации 100 мМ.
Спиртовой раствор клотримазола 100 мМ хранят в холодильнике 1-2 месяца и непосредственно перед использованием разбавляют его физиологическим раствором до концентрации 1 мМ.
К 1 мл 5% суспензии эритроцитов добавляют исследуемый антиоксидант в разных концентрациях, преинкубируют 20 мин, после чего вносят 10 µл взвеси клотримазола, конечная концентрация клотримазола 10 µМ, после чего сразу вносят 20 µл 100 мМ раствора третбутиловой гидроперекиси (t-BHP), конечная концентрация 2 мМ.
Подготовленные образцы инкубируют 3 часа в термостате при температуре 37°С и непрерывном перемешивании. Затем образцы центрифугируют на центрифуге Eppendorf при 7000 об/мин в течение 5 мин.
По 100 мкл надосадка вносят в плоскодонные лунки планшета, содержащего по 200 мкл раствора Драбкина.
После чего измеряют степень гемолиза по оптической плотности образцов при λ=490 нм на планшетном спектрофотометрическом ридере (спектрофотометр) и строят кривые зависимости степени гемолиза от концентрации исследуемого антиоксиданта. АОА выражают как концентрацию антиоксиданта, соответствующую 50% ингибированию гемолиза (IC50). В качестве относительного показателя антиоксидантной активности используют отношение концентраций исследуемого антиоксиданта и стандартного антиоксиданта тролокса (IC50/IСтролокс 50).
На фиг.2 представлена зависимость степени гемолиза, выраженной в % к максимальному (т.е. к гемолизу, наблюдаемому без присутствия антиоксидантов). Суспензию эритроцитов преинкубировали в течение 10 мин с разными концентрациями антиоксидантов, затем добавляли клотримазол, 10 µМ и третбутиловую гидроперекись, 2 mМ и инкубировали в течение 3 ч, n=5-20.
В качестве показателя АОА используется концентрация антиоксиданта, приводящая к 50% снижению степени гемолиза. Антиоксидантную активность также можно выразить как отношение концентраций исследуемого антиоксиданта и стандартного антиоксиданта тролокса.
С помощью предлагаемого способа можно определять АОА различных соединений как гидрофильных, так и гидрофобных. Мы изучали действие известных флавоноидов, а также некоторых антибиотиков тетрациклинового ряда, антиоксидантное действие которых в последние годы является предметом изучения разных групп исследователей.
Предложенный способ является высокочувствительным, прост и удобен в использовании, требует минимального количества цельной крови (~ 100 µл) и используемых реактивов.
Кроме того, способ дает возможность одновременного скрининга целого ряда соединений с предлагаемыми антиоксидантными свойствами.
Также предложенный способ целесообразно использовать в клинике, так как степень гемолиза эритроцитов под действием третбутиловой гидроперекиси у здоровых доноров может отличаться от больных, страдающих некоторыми заболеваниями, связанными с активацией свободнорадикальных процессов в организме. Таким образом, степень гемолиза эритроцитов, обработанных третбутиловой гидроперекисью, оказывается диагностически или прогностически значимым критерием или способом оценки эффективности лекарственной терапии.
1. Способ оценки антиоксидантной активности путем введения исследуемого антиоксиданта в биологический объект, индукции свободнорадикального окисления и оценки антиоксидантной активности по оптической плотности образцов при их фотометрировании, отличающийся тем, что в качестве биологического объекта используют цельную кровь, взятую на цитрате или гепарине, вводят исследуемый антиоксидант в полученную из цельной крови 5% суспензию эритроцитов в HEPES-буфере, инкубируют, вносят 10 µл взвеси клотримазола в концентрации 10 мМ и индуцируют окисление, добавляя 20 µл раствора третбутиловой гидроперекиси в концентрации 100 мМ, повторно инкубируют образцы, после чего образцы центрифугируют и измеряют оптическую плотность надосадков.
2. Способ по п.1, отличающийся тем, что повторную инкубацию проводят в течение 3 ч при температуре 37°С.
3. Способ по п.1, отличающийся тем, что оптическую плотность надосадков измеряют на длине волны 490-540 нм.
4. Способ по любому из пп.1-3, отличающийся тем, что исследуемый антиоксидант вводят в суспензию эритроцитов в разных концентрациях и инкубируют образцы 20 мин при комнатной температуре.
5. Способ по п.4, отличающийся тем, что по оптической плотности надосадков определяют степень гемолиза, строят ее зависимость от концентрации исследуемого антиоксиданта и в качестве показателя антиоксидантной активности используют концентрацию антиоксиданта, приводящую к 50% снижению степени гемолиза (IC50).
6. Способ по любому из пп.1-4, отличающийся тем, что в качестве относительного показателя антиоксидантной активности используют отношение концентраций исследуемого антиоксиданта и стандартного антиоксиданта тролокса (IC50/ICтролокс 50).