Способ дифференциальной диагностики злокачественных и доброкачественных беспигментных опухолей кожи
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к онкологии. Для дифференциальной диагностики доброкачественных и злокачественных беспигментных новообразований кожи через 3 часа после перорального введения препарата «Аласенс» в дозе 15 мг/кг массы тела получают трехканальное RGB флуоресцентное изображение зоны интереса. Оценивают долю участия красного канала в изображении опухоли по формуле: Rtum=(R/(R+G+B))·100%, где Rtum - доля участия красного канала в изображении опухоли, R, G и В - яркости красного, зеленого и синего каналов изображения опухоли. Оценивают долю участия красного канала в изображении окружающей здоровой кожи по формуле: Rcut=(R/(R+G+B))·100%, где Rcut - доля участия красного канала в изображении здоровой кожи. Вычисляют коэффициент колориметрического отхода по красному каналу по формуле: Rdiff=((Rtum-Rcut)/Rcut)·100%, где Rdiff - коэффициент колориметрического отхода по красному каналу. При Rdiff менее 10% диагностируют доброкачественную опухоль, а при Rdiff, равном или более 10%, - злокачественную опухоль. Способ повышает точность дифференциальной диагностики различных беспигментных новообразований кожи на основе количественной оценки. 6 ил.
Реферат
Предлагаемое изобретение относится к медицине, в частности к онкологии, и предназначено для дифференциальной диагностики злокачественных и доброкачественных беспигментных опухолей кожи.
В настоящее время диагностика опухолей кожи в основном базируется на данных клинического исследования и дерматоскопии новообразования в белом свете. При этом не всегда удается определить истинный характер процесса и границы новообразования.
Для диагностики опухолей кожи используют следующие способы:
- Морфологические
- Лучевые (компьютерная томография, радиоизотопная диагностика, магниторезонансная томография)
- Комплексные ультразвуковые способы анализа
- Контактная и бесконтактная оптическая когерентная компьютерная томография (ОКТ)
- Термографические способы исследования (Лихванцева В.Г., Анурова О.А. «Опухоли век: клиника, диагностика и лечение. Иллюстрированное руководстводство» М.: Геотар-медиа, 2007)
Морфологический способ при всех своих достоинствах имеет и недостатки. Во многом результаты гистологического исследования зависят не только от квалификации морфолога, но и от качества забора материала. Метод исследования биопсийного материала не дает необходимую информацию о границах распространения опухолевого процесса на дооперационном этапе, что может приводить к продолженному росту новообразования уже после нерадикального вмешательства.
Комплексные ультразвуковые способы анализа информативны при определении границ новообразования кожи с подлежащими тканями, его объема и характера роста. Но для дифференциальной диагностики между доброкачественными, злокачественными и воспалительными новообразованиями кожи этот способ носит вспомогательный характер из-за схожести ультразвуковых характеристик новообразований кожи различного генеза.
Данные лучевых способов и ОКТ при диагностике опухолей кожи имеют наибольшую ценность в случае определения распространения патологического процесса в глубину тканей и малоинформативны при уточнении площади и границ новообразования на поверхности кожи. Применение таких лучевых способов диагностики, как радиоизотопное сканирование и компьютерная томография, приводит к лучевой нагрузке на пациента.
Таким образом, перечисленные выше способы диагностики новообразований кожи век из-за ряда недостатков (инвазивность, лучевая нагрузка на пациента, малоинформативность в случае определения границ новообразования) имеют ограниченное применение для дифференциальной диагностики новообразований кожи.
Ближайшим аналогом предлагаемого изобретения является способ того же назначения, включающий в себя термографию области новообразования с окружающей его здоровой кожей. При помощи термографии возможно определение уровня васкуляризации и метаболизма в анализируемой ткани, а следовательно, характера процесса и границ новообразования.
В тоже время термография кожи обладает недостатками, которые ограничивают ее применение для дифференциальной диагностики опухолей. К ним можно отнести существенные колебания температуры кожи в зависимости от пола, возраста, уровня метаболизма. У здорового человека распределение температур симметрично относительно средней линии тела. Нарушение этой симметрии и служит основным критерием тепловизионной диагностики заболеваний. Количественное выражение термоасимметрии - величина перепада температуры. Основными причинами развития термоасимметрии, кроме опухолей и воспалительного процесса (например, рожистого воспаления), являются:
- Врожденные сосудистые мальформации
- Вегетативные расстройства, приводящие к нарушению регуляции
- Нарушения кровообращения и лимфатического дренирования, вызванные травмой, операцией, рубцами, тромбозом, эмболией, склерозом сосудов
- Венозный застой, ретроградный ток крови при недостаточности клапанов вен.
- Лимфостатические отеки
Все эти особенности могут приводить к достаточно высокому проценту ложных результатов из-за высокой чувствительности способа к особенностям метаболизма организма, сопутствующим патологическим состояниям в анализируемой зоне, а также внешним условиям. Кроме того, при проведении термографии новообразований кожи для повешения интенсивности диагностики используется гипергликемическая проба, применение которой ограничено у пациентов с сахарным диабетом.
Задачей изобретения является разработка способа дифференциальной диагностики новообразований кожи на основе количественной оценки.
Техническим результатом предлагаемого способа является повышение точности дифференциальной диагностики различных беспигментных новообразований кожи с исключением влияния на полученные результаты таких патологических состояний, как вегетососудистые расстройства, нарушения кровообращения и лимфотока, и возможностью проведения диагностики у пациентов с сахарным диабетом.
Технический результат достигается за счет количественной оценки уровня накопления протопорфирина IX (ПП IX) в тканях беспигментного новообразования кожи и в окружающей его коже путем вычисления в флуоресцентном изображении опухоли коэффициента колориметрического отхода по красному каналу, величина которого определяет характер новообразования.
В последние годы предпринимаются активные попытки создания оптических методов диагностики злокачественных опухолей, позволяющих, не травмируя объект исследования, получить о нем необходимую достоверную информацию (Hewett J. Photochemistry and Photobiology 2000 Vol.73, No 3, 278-282, Wagnieres G., Photochemistry and Photobiology 1998 Vol.68, 603-632). Флуоресцентная диагностика (ФД) является наиболее перспективной и высоко чувствительной технологией обнаружения опухолей, локализующихся в поверхностных слоях кожи и слизистых оболочах (S. Andersson-Engels. J. Cell Pharmacology. 1992 Vol.3, 48-61). Методика базируется на обнаружении эндогенных люминофоров, таких как коллаген, никотинамид аденин динуклеатид (НАД), составляющих основную часть спектра аутофлуоресценции в сине-зеленом диапазоне, а также порфиринов и экзогенных фотосенсибилизаторов (ФС).
Альтернативным путем создания эффективных концентраций ФС в опухоли является стимуляция организма к продукции эндогенных фотосенсибилизаторов, посредством введения веществ, участвующих в их синтезе. К таким соединениям относится 5-аминолевулиновая кислота (АЛК) (Sharabasy M.M. Cancer 1992, Vol.65, №3, 409-412).
Опухолевые клетки благодаря большей активности в них ферментов начального этапа синтеза гема, а также благодаря дефициту в них фермента, превращающего ПП IX в гемм (феррохелатазы) способны селективно накапливать ПП IX в присутствии экзогенной 5-АЛК (Патока Е.Ю. Сб. трудов Международной конференции «Лазерные и информационные технологии в медицине XXI века». Научно-практическая конференция Северо-западного региона Российской федерации. II часть. Санкт-Петербург 2001, стр.431). Накопление ПП IX в опухоли происходит в течение нескольких часов, причем высокий уровень этого фотоактивного соединения удерживается до 1-2 суток. Заметим, что параллельно процессу накопления ПП IX в цитоплазме происходит быстрая утилизация ПП IX в нормальных клетках путем превращения его в фотонеактивный гем. Разница в накоплении ПП IX опухолевыми и здоровыми клетками обеспечивает высокую контрастность неопластичсского очага (Патока Е.Ю., Харнас С.С., Заводнов В.Я. и др. Исследование спектров флюоресценции ALA-индуцированного РР IX периферических опухолей in vivo. // Электронный журнал «Исследовано в России» http://zhurnal.ape.relarn.ru/articles/2003/129.pdf 1422).
Одним из способов регистрации флуоресценции является флуоресцентная фотография. Первые флуоресцентные изображения тканей человека при возбуждении лампой Вуда были опубликованы в середине прошлого века (Dake H. Chemical Publishing Brooklyn N.Y. 1942, Vol.45, 67-91). В настоящее время использование флуоресцентной фотографии осуществляется в основном с целью визуализации злокачественных новообразований и определения их истинных границ на дооперационном этапе без количественного вычисления контрастности флуоресценции в очаге.
Эти данные были использованы как предпосылка для наших исследований по разработке способа дифференциальной диагностики беспигментных опухолей.
Проанализированы флуоресцентные изображения беспигментных образований кожи 39 пациентов. При этом у 23 пациентов диагностированы злокачественные и предраковые опухоли (20 очагов базально-клеточного рака, 1 очаг эпителиомы Бовена, 2 очага кожного рога) и у 16 пациентов - доброкачественные опухоли (6 очагов кератопапилломы, 2 очага геангиомы, 3 эпидермальных невуса, 2 кисты потовых желез, 1 киста сальной железы, 4 очага фолликулярного кератоза). Все пациенты получали препарат «Аласенс» (5-аминолевулиновой кислоты гидрохлорид) перорально в дозе 15 мг/кг массы тела. «Аласенс» усиливает селективное накопление протопорфирина IX в опухолевых клетках, что обусловливает усиление флуоресценции в красном диапазоне длин волн. Регистрацию флуоресценции производили через 3 часа после введения препарата путем фотографирования зоны интереса цифровой фотокамерой с цветной (RGB) матрицей при возбуждении флуоресценции светом с длиной волн 390-433 нм. На полученном трехканальном RGB флуоресцентном изображении оценивали долю участия красного канала в изображении опухоли и окружающей здоровой кожи по формулам:
Rtum=(R/(R+G+B))·100%,
где Rtum - доля участия красного канала в изображении опухоли, R, G и В-яркости красного, зеленого и синего каналов изображения опухоли,
Rcut=(R/(R+G+B))·100%,
где Rcut - доля участия красного канала в изображении здоровой кожи, R, G и В - яркости красного, зеленого и синего каналов изображения здоровой кожи.
После этого вычисляли коэффициент колориметрического отхода по красному каналу по формуле:
Rdiff=((Rtum - Rcut)/Rcut)·100%,
где Rdiff - коэффициент колориметрического отхода по красному каналу, Rtum - доля участия красного канала в изображении опухоли, Rcut - доля участия красного канала в изображении здоровой кожи. Аналогичные расчеты можно производить при помощи программы для ЭВМ КанцерПлот (регистрационный №4859).
Установлено, что на флуоресцентных изображениях злокачественных и предраковых опухолей коэффициент колориметрического отхода по красному каналу превышал или был равен 10%, а на флуоресцентных изображениях доброкачественных новообразований был меньше 10%. Исходя из этого, величину коэффициента колориметрического отхода, равную 10%, можно обозначить как пограничную при дифференциальной диагностике злокачественных и доброкачественных беспигментных новообразований кожи.
Способ осуществляют следующим образом.
Пациенту перорально дают препарат «Аласенс» в дозе 15 мг/кг веса, растворяя его, как это принято, в обычной воде. Через 3 часа после введения препарата пациента усаживают перед экраном из высокопоглащающей ткани. С помощью 2 люминесцентных ламп с максимумами излучения 390, 415 и 433 нм, укрепленных на кронштейнах, добиваются максимально равномерного освещения возбуждающим излучением зоны новообразования. Производят регистрацию интересующего участка цифровой камерой с RGB CCD-матрицей. На полученном трехканальном RGB флуоресцентном изображении оценивают долю участия красного канала в изображении опухоли и окружающей здоровой коже по формулам:
Rtum - доля участия красного канала в изображении опухоли, R, G и В - яркости красного, зеленого и синего каналов изображения опухоли,
Rcut=(R/(R+G+B))·100%,
где Rcut - доля участия красного канала в изображении здоровой кожи, R, G и В - яркости красного, зеленого и синего каналов изображения здоровой кожи.
После этого вычисляли коэффициент колориметрического отхода по красному каналу по формуле:
Rdiff=((Rtum-Rcut)/Rcut)·100%, где Rdiff - коэффициент колориметрического отхода по красному каналу, Rtum - доля участия красного канала в изображении опухоли, Rcut - доля участия красного канала в изображении здоровой кожи. Аналогичные расчеты можно производить при помощи программы для ЭВМ КанцерПлот.
При Rdiff<10% диагностируют доброкачественное, а при Rdiff≥10% - злокачественное беспигментное новообразование кожи.
Примеры.
Пациентка П. 35 лет.
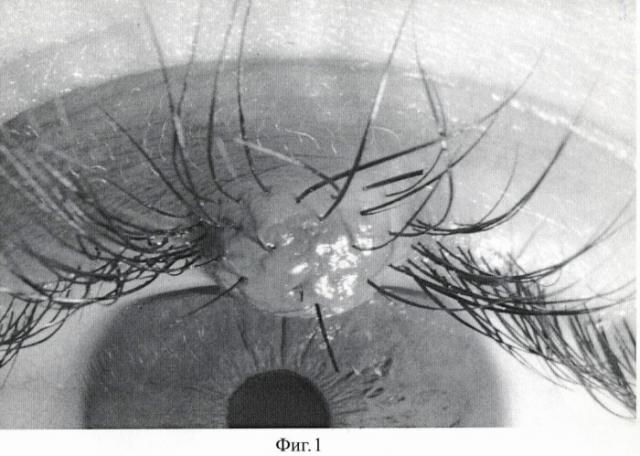
Диагноз: Новообразование кожи верхнего века левого глаза (Фиг.1).
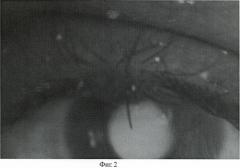
Пациенту перорально дают препарат «Аласенс» в дозе 15 мг/кг веса, растворяя его в обычной воде. Через 3 часа после введения препарата пациента усаживают перед экраном из высокопоглащающей ткани. С помощью 2 люминесцентных ламп с максимумами излучения 390, 415 и 433 нм, укрепленных на кронштейнах, добиваются максимально равномерного освещения возбуждающим излучением зоны новообразования. Производят регистрацию интересующего участка цифровой камерой с RGB CCD- матрицей. На полученном трехканальном изображении (Фиг.2) с помощью программы для ЭВМ CancerPlot оценивают долю участия красного канала, соответствующего флуоресценции протопорфирина-IX (Фиг.3). Доля участия красного канала в флуоресцентном изображении опухоли (Rtum) составила 40%. Доля участия красного канала в флуоресцентном изображении окружающей кожи (Rcut) составила 43.15%.
Rdiff=((40-43.15)/43.15)·100%=-7.3%
Колориметрический отход по красному каналу на флуоресцентном изображении опухоли составил - 7.3%, что меньше +10%. Полученный результат говорит в пользу доброкачественного характера опухоли. Гистологический диагноз: интрадермальный невус кожи, что подтверждает дифференциальный диагноз, полученный предложенным способом.
Пациентка Н. 75 лет.
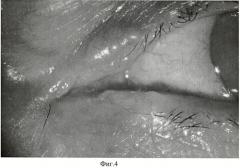
Диагноз: Новообразование кожи левого верхнего века. (Фиг.4).
Пациенту перорально дают препарат «Аласенс» в дозе 15 мг/кг веса, растворяя его в обычной воде. Через 3 часа после введения препарата пациента усаживают перед экраном из высокопоглащающей ткани. С помощью 2 люминесцентных ламп с максимумами излучения 390, 415 и 433 нм, укрепленных на кронштейнах, добиваются максимально равномерного освещения возбуждающим излучением зоны новообразования. Производят регистрацию интересующего участка цифровой камерой с RGB CCD-матрицей. На полученном трехканальном изображении (Фиг.5) с помощью программы для ЭВМ CancerPlot оценивают долю участия красного канала, соответствующего флуоресценции протопорфирина-IX (Фиг.6). Доля участия красного канала в флуоресцентном изображении интрадермального невуса (Rtum) составила 33.87%. Доля участия красного канала в флуоресцентном изображении окружающей кожи (Rcut) составила 27.89%.
Rdiff=((33.87-27.89)/27.89)·100%=21.4%
Колориметрический отход по R-каналу на флуоресцентном изображении новообразования составил +21.4%, что больше +10%. Полученный результат говорит в пользу злокачественного характера опухоли. Гистологический диагноз (базально-клеточный рак кожи) подтвердил злокачественный характер новообразования.
Таким образом, предлагаемый способ может быть рекомендован для проведения дифференциальной диагностики опухолей кожи благодаря высокой чувствительности количественной оценки и отсутствием противопоказаний.
Способ дифференциальной диагностики доброкачественных и злокачественных беспигментных новообразований кожи, отличающийся тем, что через 3 ч после перорального введения препарата «Аласенс» в дозе 15 мг/кг массы тела получают трехканальное RGB флуоресцентное изображение зоны интереса и оценивают долю участия красного канала в изображении опухоли и окружающей здоровой коже по формулам: Rtum=(R/(R+G+B))·100%, где Rtum - доля участия красного канала в изображении опухоли, R, G и В - яркости красного, зеленого и синего каналов изображения опухоли, Rcut=(R/(R+G+B))·100%, где Rcut - доля участия красного канала в изображении здоровой кожи, R, G и В - яркости красного, зеленого и синего каналов изображения здоровой кожи, после чего вычисляют коэффициент колориметрического отхода по красному каналу по формуле: Rdiff=((Rtum-Rcut)/Rcut)·100%, где Rdiff - коэффициент колориметрического отхода по красному каналу, Rtum - доля участия красного канала в изображении опухоли, Rcut - доля участия красного канала в изображении здоровой кожи, и при Rdiff менее 10% диагносцируют доброкачественную опухоль, а при Rdiff равным или более 10% - злокачественную опухоль.