Терапевтический агент для мезотелиомы
Иллюстрации
Показать всеИзобретение относится к области медицины и касается терапевтического агента для мезотелиомы. Сущность изобретения включает ингибитор роста против клеток мезотелиомы, содержащий в качестве активного ингредиента антитело к IL-6-рецептору (IL-6R). Преимущество изобретения заключается в обеспечении ингибирования клеток мезотелиомы посредством антител к IL-6-рецептору (IL-6R). 10 з.п. ф-лы, 17 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к новому терапевтическому агенту для мезотелиомы и ингибитору клеток мезотелиомы.
Уровень техники
Мезотелиома представляет собой опухоль, которая встречается в мезотелии, покрывающем поверхность плевры, брюшины и перикарда, которые, соответственно, обволакивают органы грудной полости, такие как легкие и сердце, и брюшные органы, такие как пищеварительный тракт и печень. В случае диффузной плевральной мезотелиомы боль в груди вызывается инвазией межреберных нервов на плевральной стороне грудной стенки и вследствие роста опухоли могут возникать респираторные и пиркуляторные нарушения и накопление плевральной жидкости в плевре на этой же стороне органа [Takagi, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», p.469-472, 1999]. В конечном счете происходит пролиферация опухоли в соседние медиастинальные органы, прогрессирующая до прямой инвазии сердца или развития опухоли в брюшную полость через диафрагму, или может быть ее развитие вне грудной полости в результате дополнительного лимфатического или циркуляторного (через кровь) метастазирования (Takagi, там же).
Сообщалось, что в США диффузная плевральная мезотелиома встречается у 3000 субъектов ежегодно, число случаев начало заметно увеличиваться в 1980-ых годах, часто ее наблюдают у людей в возрасте шестидесяти лет, причем встречаемость у мужчин является приблизительно в пять раз более высокой, чем встречаемость у женщин [Takagi, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», p.469-472, 1999]. Согласно недавним сообщениям в США и Европе встречаемость мезотелиомы демонстрирует тенденцию быстрого увеличения и на основании эпидемиологической статистики из Великобритании в 1995 году предсказывается, что количество смертей от мезотелиомы будет продолжать увеличиваться на протяжении следующих 25 лет, а также указывалось, что в самом плохом из возможных сценариев существует риск, что она будет ответственной за 1% всех смертей среди людей, родившихся в 1940-ых годах (Nakano, Respiration, Vol.18, №9, pp.916-925, 1999).
Многочисленные различные классификации клинических стадий заболевания использовали для мезотелиомы, и поскольку используемые способы классификации стадии заболевания были различными, предыдущие терапевтические сообщения о мезотелиоме встречались с трудностями для сравнения результатов лечения (Nakano, Respiration, Vol.18, №9, p.916-925, 1999). Международная классификация TNM (Система клинико-патологического анализа опухолей) для злокачественной плевральной мезотелиомы была разработана в 1995 году International Mesothelioma Interest Group (IMIG) (Nakano, Respiration, Vol.18, №9, pp.916-925, 1999).
Кроме того, злокачественная мезотелиома имеет причинную связь с подверганием воздействию асбеста и это было также продемонстрировано в экспериментах на животных [Tada, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.406-408, 1999]. Асбест, который ингалировали в дыхательные пути, достигает местоположения непосредственно под плеврой, где со временем развивается опухоль вследствие продолжительного раздражения в течение, по меньшей мере, приблизительно 20 лет, и эта опухоль распространяется тонким слоем по всей поверхности плевры [Takagi, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.469-472, 1999]. Таким образом, хотя злокачественная мезотелиома классифицируется как связанное с асбестом заболевание, не все злокачественные мезотелиомы обусловлены асбестом, и хорошо документированное подвергание воздействию асбеста наблюдается только у приблизительно половины из всех пациентов [Tada, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.406-408, 1999].
Злокачественная плевральная мезотелиома является устойчивой к лечению, ассоциирована с крайне плохим прогнозом и требует немедленного принятия контрмер (Nakano, Respiration, Vol.18, №9, pp.916-925, 1999). Например, хотя антагонист фолиевой кислоты - метотрексат (МТХ) имеет удовлетворительную степень эффективности, равную 37%, при лечении единственной большой дозой в комбинации с лейковином его применение не распространилось вследствие технической трудности, связанной с нанесением на мезотелиому, которое вызывает сохранение большого количества плевральной жидкости [Nakano, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.570-673, 2003]. Кроме того, хотя плевролегочное иссечение и плевроэктомию выполняли для диффузной плевральной мезотелиомы, существует повышенная вероятность возникновения рецидива после такого лечения, и частота послехирургического локального рецидива, в частности, является высокой (35-43%) [Takagi, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.469-472, 1999].
Известно, что многочисленные клеточные линии мезотелиомы человека и несколько клеточных линий мезотелиомы мыши экспрессируют IL-6 in vitro, и сообщалось, что у мышей с трансплантированной им линией клеток АВ22 мышиной мезотелиомы, которая экспрессирует высокий уровень IL-6, IL-6 детектировали в сыворотке перед началом роста раковых клеток, перед клиническими симптомами и изменениями в лимфоцитарной ткани периферической крови (Bielefeldt-Ohmann, Cancer Immunol. Immunother. 40, 241-250, 1995). Кроме того, уровни IL-6 в сыворотке у пациентов со злокачественной плевральной мезотелиомой являются более высокими в сравнении с пациентами с легочной аденомой, осложненной плевральным выпотом, это же относится к тромбоцитозу, который является одним из клинических симптомов злокачественной плевральной мезотелиомы, известно, что существует явная корреляция между уровнями IL-6 в сыворотке и количеством тромбоцитов (Nakano, British Journal of Cancer, 77, №6, 907-912, 1998). Кроме того, опухолевые клетки пациентов с плевральной мезотелиомой экспрессируют высокие уровни IL-6, и сообщалось, что уровни IL-6 в сыворотке увеличиваются перед смертью (Higashihara, Cancer, Vol.70, №8, pp.2105-2108, 1992).
Bielefeldt-Ohmann, et al. сообщали, что в результате введения дважды в неделю крысиных антител против мышиного IL-6 (6B4) мышам с трансплантированной АВ22 наблюдались эффекты, которые значительно уменьшали возникновение и прогрессирование клинических симптомов (Bielefeldt-Ohmann, Cancer Immunol. Immunother. 40, 241-250, 1995). Однако согласно сообщению Bielefeldt анти-IL-6 антитело не оказывает прямое ингибирующее рост воздействие на АВ22 in vitro, не наблюдались различия в посмертных аутопсиях (результатах вскрытия) мышей, подвергнутых лечению aнти-IL-6 антителом, и мышей, не обработанных указанным антителом, и наблюдались большое число опухолей значительного размера даже у леченых мышей (Bielefeldt-Ohmann, Cancer Immunol. Immunother. 40, 241-250, 1995). То есть ингибирование роста мезотелиомы анти-IL-6 антителом не было известно ни in vitro, ни in vivo.
Takagi, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.469-472, 1999.
Nakano, Respiration, Vol.18, №9, pp.916-925, 1999.
Tada, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.406-408, 1999.
Nakano, Journal of Clinical and Experimental Medicine (March Supplement), «Respiratory Diseases», pp.570-673, 2003.
Bielefeldt-Ohmann, Cancer Immunol. Immunother. 40, 241-250, 1995. Higashihara, Cancer, Vol.70, №8, pp.2105-2108, 1992.
Раскрытие изобретения
Известно, что антагонисты IL-6 действуют непосредственно на мезотелиому и демонстрируют ингибирующие рост воздействия. Целью данного изобретения является обеспечение нового терапевтического агента для мезотелиомы (ингибитора роста клеток мезотелиомы), который содержит антагонист IL-6 в качестве его активного ингредиента.
В результате проведения интенсивных исследований по разработке нового терапевтического агента для мезотелиомы, который ингибирует рост клеток мезотелиомы, автор данного изобретения сделал новое открытие, что рост клеток мезотелиомы может быть ингибирован с помощью ингибирования или прерывания передачи сигнала, связанного с IL-6, что и привело к реализации данного изобретения.
Таким образом, данное изобретение обеспечивает терапевтический агент для мезотелиомы, который содержит антагонист интерлейкина-6 (IL-6) в качестве его активного ингредиента.
Кроме того, данное изобретение обеспечивает также ингибитор роста против клеток мезотелиомы, который содержит антагонист интерлейкина-6 (IL-6) в качестве его активного ингредиента.
Вышеупомянутой мезотелиомой является, например, плевральная мезотелиома и, более конкретно, злокачественная плевральная мезотелиома. В злокачественную плевральную мезотелиому включена диффузная плевральная мезотелиома.
Вышеупомянутым антагонистом IL-6 является, например, антитело к IL-6 или антитело к IL-6-рецептору и, предпочтительно, моноклональное антитело к IL-6-рецептору. Вышеупомянутое антитело к IL-6-рецептору является особенно предпочтительно моноклональным антителом к IL-6-рецептору человека, таким как антитело РМ-1, или моноклональным антителом к мышиному IL-6-рецептору, таким как антитело MR16-1. Вышеупомянутым антителом к IL-6-рецептору является предпочтительно рекомбинантное антитело.
Вышеупомянутое антитело к IL-6-рецептору может быть химерным антителом, гуманизированным антителом или антителом человека. В данном изобретении особенно предпочтительным антителом является гуманизированное антитело РМ-1.
Данное изобретение может также быть в указанных ниже формах:
(1) Применение антагониста интерлейкина-6 (IL-6) для получения терапевтического агента для мезотелиомы.
(2) Применение по (1) выше, в котором мезотелиома является плевральной мезотелиомой.
(3) Применение по (2) выше, где плевральная мезотелиома является злокачественной плевральной мезотелиомой.
(4) Применение по любому из (1)-(3) выше, где антагонистом IL-6 является антитело к IL-6-рецептору.
(5) Применение по (4) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору.
(6) Применение по (4) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору человека.
(7) Применение по (4) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору мыши.
(8) Применение по любому из (4)-(7) выше, где антителом к IL-6-рецептору является рекомбинантное антитело.
(9) Применение по (6) выше, где моноклональным антителом к IL-6-рецептору человека является антитело РМ-1.
(10) Применение по (7) выше, где моноклональным антителом к IL-6-рецептору мыщи является антитело MR 16-1.
(11) Применение по любому из (4)-(10) выше, где антителом к IL-6-рецептору является химерное антитело, гуманизированное антитело или человеческое антитело к IL-6-рецептору.
(12) Применение по (11) выше, где гуманизированным антителом к IL-6-рецептору является гуманизированное антитело РМ-1.
(13) Применение антагониста интерлейкина-6 (IL-6) для получения ингибитора роста против клеток мезотелиомы.
(14) Применение по (14) выше, где мезотелиома является плевральной мезотелиомой.
(15) Применение по (14) выше, где плевральная мезотелиома является злокачественной плевральной мезотелиомой.
(16) Применение по любому из (13)-(15) выше, где антагонистом IL-6 является антитело к IL-6-рецептору.
(17) Применение по (16) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору.
(18) Применение по (16) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору человека.
(19) Применение по (16) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору мыши.
(20) Применение по любому из (16)-(19) выше, где антителом к IL-6-рецептору является рекомбинантное антитело.
(21) Применение по (18) выше, где моноклональным антителом к IL-6-рецептору человека является антитело РМ-1.
(22) Применение по (19) выше, где моноклональным антителом к IL-6-рецептору мыши является антитело MR16-1.
(23) Применение по любому из (16)-(22) выше, где антителом к IL-6-рецептору является химерное антитело, гуманизированное антитело или человеческое антитело к IL-6-рецептору.
(24) Применение по (23) выше, где гуманизированным антителом к IL-6-рецептору является гуманизированное антитело РМ-1.
Данное изобретение может также принимать указанные ниже формы.
(1) Способ лечения мезотелиомы, предусматривающий введение антагониста интерлейкина-6 (IL-6) субъекту, нуждающемуся в таком лечении.
(2) Способ по (1) выше, где мезотелиома является плевральной мезотелиомой.
(3) Способ по (2) выше, где плевральная мезотелиома является злокачественной плевральной мезотелиомой.
(4) Способ по любому из (1)-(3) выше, где антагонистом IL-6 является антитело к IL-6-рецептору.
(5) Способ по (4) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору.
(6) Способ по (4) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору человека.
(7) Способ по (4) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору мыши.
(8) Способ по любому из (4)-(7) выше, где антителом к IL-6-рецептору является рекомбинантное антитело.
(9) Способ по (6) выше, где моноклональным антителом к IL-6-рецептору человека является антитело РМ-1.
(10) Способ по (7) выше, где моноклональным антителом к IL-6-рецептору мыши является антитело MR16-1.
(11) Способ по любому из (4)-(10) выше, где антителом к IL-6-рецептору является химерное антитело, гуманизированное антитело или человеческое антитело к IL-6-рецептору.
(12) Способ по (11) выше, где гуманизированным антителом к IL-6-рецептору является гуманизированное антитело РМ-1.
(13) Способ ингибирования роста клеток мезотелиомы, предусматривающий введение антагониста интерлейкина-6 (IL-6) субъекту, нуждающемуся в таком ингибировании.
(14) Способ по (13) выше, где мезотелиома является плевральной мезотелиомой.
(15) Способ по (14) выше, где плевральная мезотелиома является злокачественной плевральной мезотелиомой.
(16) Способ по любому из (13)-(15) выше, где антагонистом IL-6 является антитело к IL-6-рецептору.
(17) Способ по (16) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору.
(18) Способ по (17) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору человека.
(19) Способ по (16) выше, где антителом к IL-6-рецептору является моноклональное антитело к IL-6-рецептору мыши.
(20) Способ по любому из (16)-(19) выше, где антителом к IL-6-рецептору является рекомбинантное антитело.
(21) Способ по (18) выше, где моноклональным антителом к IL-6-рецептору человека является антитело РМ-1.
(22) Способ по (19) выше, где моноклональным антителом к IL-6-рецептору мыши является антитело MR 16-1.
(23) Способ по любому из (16)-(22) выше, где антителом к IL-6-рецептору является химерное антитело, гуманизированное антитело или человеческое антитело к IL-6-рецептору.
(24) Способ по (23) выше, где гуманизированным антителом к IL-6-рецептору является гуманизированное антитело РМ-1.
Краткое описание фигур
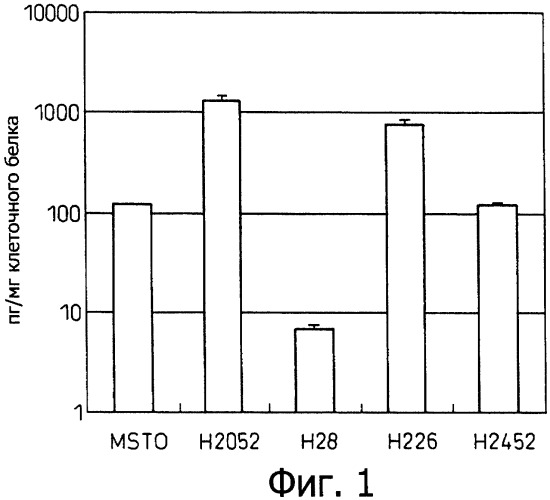
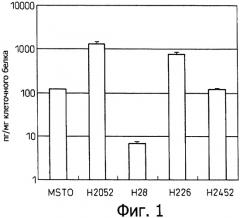
Фиг.1 является диаграммой, которая отображает результаты примера 1, показывающей продуцирование IL-6 различными клеточными линиями злокачественной мезотелиомы.
Фиг.2 является диаграммой, которая отображает результаты примера 2, показывающей продуцирование (или его отсутствие) IL-6-рецептора (IL-6R) различными клеточными линиями злокачественной мезотелиомы. Кроме того, GAPDH показывает количество мРНК GAPDH (глицеральдегид-3-фосфатдегидрогеназы), используемой в качестве внешнего контроля.
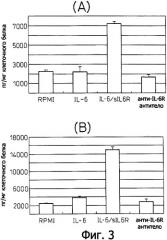
Фиг.3 является диаграммой, которая показывает результаты примера 3, где продуцирование фактора роста эндотелия сосудов (VEGF) клеточными линиями Н2050 (А) и Н2452 (В) злокачественной мезотелиомы индуцируется IL-6 и IL-6R.
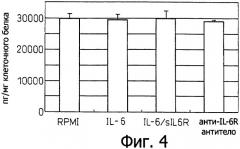
Фиг.4 является диаграммой, которая показывает результаты примера 4, в котором эксперимент, сходный с примером 3, проводили для клеточной линии Н28 злокачественной мезотелиомы, показывающей, что эта клеточная линия продуцирует фактор роста эндотелия сосудов (VEGF), не требуя индукции IL-6/IL-6R.
Фиг.5 является диаграммой, которая показывает результаты примера 5, где фосфорилирование STAT3, связанное со стимуляцией IL-6, усиливается в клеточной линии Н2025, в которой продуцирование VEGF индуцируется IL-6, и наоборот, фосфорилирование STAT3 вследствие стимуляции IL-6 не наблюдается в клеточной линии Н28, в которой продуцирование VEGF не индуцируется IL-6.
Фиг.6 является диаграммой, которая показывает результаты примера 6, где в противоположность экспрессии SOCS3 вследствие стимуляции IL-6 и IL-6R, индуцируемой в клеточной линии Н2052, в которой продуцирование VEGF индуцируется IL-6, SOCS3 неиндуктивно экспрессируется в клеточной линии Н28, в которой продуцирование VEGF не индуцируется IL-6.
Фиг.7 является схемой, показывающей структуру промотора плазмид pGL3-VEGF и pGL3-VEGFmut вместе с его окружением, используемого в примере 7.
Фиг.8 является диаграммой, которая показывает результаты примера 7, где в системе, в которой промотор VEGF связан с репортерным геном люциферазы, в случае изменения сайта связывания pSTAT3 в промоторе VEGF не происходит активация промотора VEGF IL-6.
Фиг.9 является схемой, показывающей механизм индукции промотора VEGF (продуцирования VEGF) вследствие стимуляции IL-6 в клеточной линии Н2052, как предсказано из результатов примеров 5-7.
Фиг.10 является диаграммой, которая показывает результаты примера 8, где рост клеточных линий Н2052 увеличивается в зависимости от концентрации IL-6 в присутствии IL-6R, где график (А) показывает результат в отсутствие растворимого рецептора IL-6, а график (В) показывает результат, полученный в присутствии растворимого рецептора IL-6.
Фиг.11 является диаграммой, которая показывает результаты примера 9, где стимуляция роста клеточной линии Н2052 IL-6 и IL-6R ингибируется MRA (гуманизированным антителом РМ-1).
Фиг.12 является диаграммой, которая показывает результаты примера 10, где рост клеточной линии Н226 увеличивается в зависимости от концентрации IL-6 в присутствии IL-6R и MRA демонстрирует ингибирующее воздействие на этот рост.
Фиг.13 является диаграммой, которая отражает результаты примера 8, показывающие, что рост клеточной линии Н226 увеличивается в зависимости от концентрации IL-6 в присутствии IL-6R.
Фиг.14 является диаграммой, которая показывает результаты примера 11, где стимуляция IL-6 и IL-6R роста клеточных линий злокачественной мезотелиомы Н2052 и Н226 ингибируется гуманизированным антителом РМ-1.
Фиг.15 является диаграммой, которая показывает результаты примера 12, где индукция продуцирования VEGF стимуляцией IL-6 в клеточных линиях злокачественной мезотелиомы MSTO, H226, Н2052 и Н2452 ингибируется гуманизированным антителом РМ-1.
Фиг.16 является диаграммой, которая показывает результаты примера 13, где фосфорилирование STAT3, индуцируемое стимуляцией IL-6/IL-6R в клеточных линиях Н2052 и Н2452, ингибируется гуманизированным антителом РМ-1.
Фиг.17 является диаграммой, которая показывает результаты примера 14, где активация роста клеточных линий Н2052 и H226 стимуляцией IL-6 и растворимым IL-6R не ингибируется анти-VEGF антителом.
Осуществление изобретения
IL-6 является цитокином, также называемым стимулирующим В-клетки фактором 2 (BSF2) или интерфероном β2. Первоначально было обнаружено, что IL-6 является фактором дифференцировки, участвующим в активации В-лимфоцитов (Hirano Т. et al., Nature, 324, 73-76, 1986), после чего было определено, что он является мультифункциональным цитокином, оказывающим воздействие на функции различных клеток (Akira S. et al., Adv. In Immunology, 54, 1-78, 1993). Сообщалось также, что IL-6 индуцирует созревание Т-клеток (Lotz M. et al., J. Exp.Med., 167,1253-1258, 1988).
IL-6 реализует свою биологическую активность с использованием различных белков на клетках. Одним из них является лигандсвязывающий белок IL-6-рецепторов, имеющий молекулярную массу приблизительно 80 кД (Taga Т. et al., J. Exp.Med., 166, 967-981, 1987; Yamasaki К. et al. Science, 241, 825-828, 1987). Кроме существования в мембранно-связанной форме, которая экспрессируется на клеточной мембране проникновением через эту мембрану, IL-6-рецепторы существуют также в виде растворимых IL-6-рецепторов, состоящих в основном из внеклеточного региона.
Другой из этих мембранно-связанных белков gpl30, имеющий молекулярную массу приблизительно 130 кД, участвует в передаче сигнала, не опосредованной связыванием лиганда. IL-6 и IL-6-рецепторы образуют комплекс IL-6/IL-6-рецептор и в результате последующего связывания с gpl30 биологическая активность IL-6 передается в клетки (TagaT. et al., Cell, 58, 573-581, 1989).
Антагонистами IL-6 являются вещества, которые ингибируют передачу биологической активности IL-6. Известные примеры этих антагонистов IL-6 включают в себя антитело к IL-6 (aHTH-IL-6 антитело), антитело к IL-6-рецепторам (анти-IL-6-рецептор антитело), антитело к gpl30 (анти-gр130 антитело), варианты IL-6 и неполные пептиды IL-6 или IL-6-рецептора.
Несколько сообщений появлялись в отношении анти-IL-6-рецептор антитела (Novick D. et al., Hybridoma, 10, 137-146, 1991; Huang Y.W. et al., Hybridoma, 12, 621-630, 1993; публикация не прошедшего экспертизу Международного патента №WO 95-09873; публикация не прошедшего экспертизу патента Франции №FR 2694767 и патент США US № 521628). Известно, что гуманизированное антитело РМ-1 было получено трансплантацией гипервариабельного участка (CDR, область, определяющая комплементарность) одной из форм мышиного анти-РМ-1 антитела (Hirata Y. et al., J. Immunol., 143, 2900-2906, 1989) в человеческое антитело (публикация не прошедшего экспертизу Международного патента №WO 92-19759).
Вышеупомянутым антагонистом IL-6 является предпочтительно антитело к IL-6-рецептору и более предпочтительно моноклональное антитело к IL-6-рецептору человека или моноклональное антитело к IL-6-рецептору мыши. Примером вышеуказанного моноклонального антитела к IL-6-рецептору человека является антитело РМ-1, тогда как примером моноклонального антитела к IL-6-рецептору мыши является антитело MR16-1. Вышеупомянутым антителом является предпочтительно химерное антитело, гуманизированное антитело или человеческое антитело, примером которых является гуманизированное антитело РМ-1.
Имеются определенные ограничения в отношении происхождения, типа или формы антагониста IL-6, используемого в данном изобретении, при условии, что он ингибирует рост клеток мезотелиомы и применим в качестве активного ингредиента терапевтического агента для лечения мезотелиомы.
Антагонистами IL-6 являются вещества, которые ингибируют биологическую активность IL-6 прерыванием передачи сигнала IL-6. Антагонистами IL-6 являются предпочтительно вещества, которые оказывают ингибирующее воздействие на связывание IL-6, IL-6-рецептора и gpl30. Примеры антагонистов IL-6 включают в себя анти-IL-6 антитело, анти-IL-6-рецептор антитело, анти-gp130 антитело, варианты IL-6, варианты растворимого IL-6-рецептора, неполные пептиды IL-6-рецептора и низкомолекулярные вещества, демонстрирующие сходную активность.
Анти-IL-6 антитело, используемое в данном изобретении, может быть получено в виде поликлонального или моноклонального антитела с использованием известных методов. Моноклональное антитело, происходящее из млекопитающего, является особенно предпочтительным для анти-IL-6 антитела, используемого в данном изобретении. Примеры моноклональных антител, происходящих из млекопитающего, включают в себя моноклональные антитела, продуцируемые гибридомами, и моноклональные антитела, продуцируемые хозяевами, трансформированными экспрессирующим вектором, содержащим ген антитела, с использованием методов генной инженерии. Это антитело прерывает передачу биологической активности IL-6 к клеткам в результате ингибирования связывания IL-6 с IL-6-рецепторами посредством связывания с IL-6.
Примерами таких антител являются антитело МН166 (Matsuda Т. et al., Eur. J. Immunol., 18, 951-956, 1998) и антитело SK2 (Sato К. et al., 21st General Meeting of the Japanese Society for Immunology, Academic Record, 1991, 21, 166).
Гибридома, продуцирующая aHTH-IL-6 антитело, может быть в основном получена способом, описанным ниже, с использованием известной технологии. А именно это антитело может быть получено с использованием IL-6 в качестве сенсибилизирующего антигена, иммунизацией этим антигеном в соответствии с обычными способами иммунизации, слиянием полученных иммуноцитов с известными клетками-хозяевами в соответствии с обычными способами слияния клеток и затем скринингом клеток, которые продуцируют моноклональное антитело, в соответствии с обычными способами скрининга.
Более конкретно, получение IL-6-антитела может проводиться способом, описанным ниже. IL-6 человека, используемый в качестве сенсибилизирующего антигена для получения антитела, получают с использованием генной или аминокислотной последовательностей IL-6, описанных в Eur. J. Biochem. (1987) 168, 543-550; J. Immunol. (1988) 140, 1534-1541 или Agr. Biol. Chem. (1990) 54, 2685-2688.
После вставки последовательности гена IL-6 в известную систему экспрессирующего вектора и трансформации подходящих клеток-хозяев полученный белок IL-6 очищают известными способами из клеток-хозяев или культурального супернатанта с последующим использованием этого очищенного белка IL-6 в качестве сенсибилизирующего антигена. Кроме того, слитый белок, состоящий из белка IL-6 и другого белка, может быть также использован в качестве сенсибилизирующего антигена.
Анти-IL-6-рецептор антитело, используемое в данном изобретении, может быть получено в форме поликлонального антитела или моноклонального антитела с использованием известных способов. Моноклональное антитело, происходящее из млекопитающего, является особенно предпочтительным в качестве анти-IL-6-рецептор антитела, используемого в данном изобретении. Примеры моноклонального антитела, происходящего из клеток млекопитающего, включают в себя антитела, продуцируемые гибридомами, и антитела, продуцируемые в хозяине, трансформированном экспрессирующим вектором, который содержит ген антитела, с использованием методов генной инженерии. В результате связывания этого антитела с IL-6-рецепторами связывание IL-6 с IL-6-рецепторами ингибируется с прерыванием посредством этого передачи биологической активности IL-6 клеткам.
Примерами таких антител являются антитело MR16-1 (Tamura Т. et al., Proc. Natl. Acad. Sci. USA, 90, 11924-11928, 1993), антитело РМ-1 (Hirata Y. et al., J. Immunol., 143, 2900-2906, 1989), антитело AUK12-20, антитело AUK64-7 и антитело AUK146-15 (публикация не прошедшего экспертизу Международного патента №WO 92-19759). Среди них в качестве такого антитела особенно предпочтительным является антитело РМ-1.
Кроме того, продуцирующая антитело РМ-1 гибридомная клеточная линия была депонирована согласно международному Будапештскому Договору под именем FERM ВР-2998 12 июля 1989 года в Международном Депозитарии запатентованных организмов Национального Института передовой промышленной науки и технологии (Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan) в виде РМ-1. Кроме того, продуцирующая антитело MR16-1 гибридомная клеточная линия была депонирована согласно международному Будапештскому Договору под именем FERM BP-5875 13 марта 1997 года в Международном Депозитарии запатентованных организмов Национального Института передовой промышленной науки и технологии (Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan) в виде гибридомы крыса-мышь MR16-1.
Продуцирующая моноклональное aнти-IL-6R антитело гибридома может быть в основном получена способом, описанным ниже с использованием известной технологии. А именно эта гибридома может быть получена с использованием IL-6-рецептора в качестве сенсибилизирующего антигена иммунизацией им в соответствии с обычными способами иммунизации, слиянием полученных иммуноцитов с известными клетками-хозяевами в соответствии с обычными способами слияния клеток и затем скринингом клеток, которые продуцируют моноклональное антитело, в соответствии с обычными способами скрининга.
Более конкретно, получение анти-IL-6-рецептор антитела может проводиться способом, описанным ниже. Например, IL-6-рецептор человека, используемый в качестве сенсибилизирующего антигена для получения антитела, получают с использованием генной или аминокислотной последовательностей IL-6-рецептора, описанных в публикации не прошедшего экспертизу Европейского патента №ЕР 325474, тогда как IL-6-рецептор мыши получают с использованием генной или аминокислотной последовательностей IL-6-рецептора, описанных в публикации не прошедшего экспертизу патента Японии №3-155795.
Имеются два типа белка IL-6-рецептора, состоящие из белка, который экспрессируется на клеточной мембране, и белка, который высвобождается из клеточной мембраны (растворимый IL-6-рецептор) (Yasukawa К. et al., J. Biochem., 108, 673-676, 1990). Растворимый IL-6-рецептор по существу состоит из внеклеточного региона IL-6-рецептора, который связывается с клеточной мембраной, и отличается от мембранно-связанного IL-6-рецептора тем, что он не имеет проникающего через клеточную мембрану региона или проникающего через клеточную мембрану региона и внутриклеточного региона. В качестве белка IL-6-рецептора может быть использован любой IL-6-рецептор при условии, что он может быть использован в качестве сенсибилизирующего антигена для получения анти-IL-6-рецептор антитела, используемого в данном изобретении.
После вставки последовательности гена IL-6-рецептора в известную систему экспрессирующего вектора для трансформации подходящих клеток-хозяев желаемый IL-6-рецептор очищают известными способами из клеток-хозяев или культурального супернатанта с последующим использованием этого очищенного IL-6-рецептора в качестве сенсибилизирующего антигена. Кроме того, слитый белок, состоящий из белка IL-6-рецептора и другого белка, может быть также использован в качестве сенсибилизирующего антигена.
Escherichia coli (Е. coli), содержащая плазмиду pIBIBSF2R, которая содержит кДНК, кодирующую IL-6-рецептор человека, была депонирована согласно международному Будапештскому Договору под депозитным номером FERM ВР-2232 9 января 1989 года в Международном Депозитарии запатентованных организмов Национального Института передовой промышленной науки и технологии (Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan) в виде НВ101-pIBIBSF2R.
Aнти-gpl30 антитело, используемое в данном изобретении, может быть получено в форме поликлонального антитела или моноклонального антитела с использованием известных способов. Моноклональное антитело, происходящее из млекопитающего, является особенно предпочтительным для aнти-gp130 антитела, используемого в данном изобретении. Моноклональные антитела, происходящие из клеток млекопитающего, включают в себя антитела, продуцируемые гибридомами, и антитела, продуцируемые в хозяине, трансформированном экспрессирующим вектором, который содержит ген антитела, с использованием методов генной инженерии. Это антитело ингибирует связывание комплекса IL-6/IL-6-рецептор с gp130 и прерывает передачу биологической активности IL-6 клеткам посредством связывания gp130.
Примеры этих антител включают в себя антитело АМ64 (публикация не прошедшего экспертизу патента Японии №3-219894), антитело 4В11, антитело 2Н4 (патент США №5571513) и антитело В-Р8 (публикация не прошедшего экспертизу патента Японии №8-291199).
Продуцирующая моноклональное aнти-gp130 антитело гибридома может быть получена способом, описанным ниже с использованием известной технологии. А именно эта гибридома может быть получена с использованием gp130 в качестве сенсибилизирующего антигена, иммунизацией им в соответствии с обычными способами иммунизации, слиянием полученных иммуноцитов с известными клетками-хозяевами в соответствии с обычными способами слияния клеток и затем скринингом клеток, которые продуцируют моноклональное антитело, в соответствии с обычными способами скрининга.
Более конкретно, моноклональное антитело может быть получено способом, описанным ниже. Например, gp130, используемый в качестве сенсибилизирующего антигена для получения антитела, получают с использованием генной или аминокислотной последовательностей gp130, описанных в публикации не прошедшего экспертизу Европейского патента №ЕР 411946.
После вставки последовательности гена gp130 в известную систему экспрессирующего вектора для трансформации подходящих клеток-хозяев желаемый белок gp130 очищают известными способами из клеток-хозяев или культурального супернатанта с последующим использованием этого очищенного белка gp130 в качестве сенсибилизирующего антигена. Кроме того, слитый белок, состоящий из белка gp130 или белка gp130 и другого белка, может быть также использован в качестве сенсибилизирующего антигена.
Хотя и нет особых ограничений в отношении млекопитающего, иммунизируемого сенсибилизирующим антигеном, его предпочтительно выбирают с учетом совместимости с клетками-хозяевами, использованными для слияния клеток, обычные примеры млекопитающих включают в себя грызунов, таких как мыши, крысы и хомячки.
Иммунизацию животного сенсибилизирующим антигеном проводят в соответствии с известными способами. В качестве типичного примера такого способа иммунизацию предпочтительно проводят инъекцией сенсибилизирующего антигена в брюшную полость или под кожу млекопитающего. Более конкретно, суспензию сенсибилизирующего антигена, разведенную подходящим количеством забуференного фосфатом солевого раствора (ЗФР) или физиологического солевого раствора, смешивают с подходящим количеством обычного адъюванта, такого как полный адъювант Фрейнда, необязательно с последующим эмульгированием и введением несколько раз млекопитающему каждые 4 дня - 21 день. Кроме того, может быть использован подходящий носитель при иммунизации сенсибилизирующим антигеном.
После подтверждения, что иммунизация была проведена таким образом и уровень антител в сыворотке увеличился до желаемого уровня, иммуноциты извлекают из этого млекопитающего и используют для слияния клеток. Предпочтительным примером иммуноцитов, используемых для слияния клеток, являются клетки селезенки.
Различные известные клеточные линии, такие как P3X6Ag8.653 (Keamey J.F. et al., J. Immunol., 123, 1548-1550, 1979), P3X63Ag8U.1 (Current Topics in Microbiology and Imminiology, 81, 1-7, 1978), NS-1 (Kohler G. and Milstein C., Eur. J. Immunol., 6, 511-519, 1976), MPC-11 (Nargulies D.H. et al.. Cell, 8, 405-415, 1976), SP2/0 (Shulman M. et al., Nature, 276, 269-270, 1978), F0 (de St. Groth S.F. et al., J. Immunol. Methods, 35,1-21,1980), S194 (Trowbridge I.S., J. Exp.Med., 148, 313-323, 1978) или R210 (Galfre G. et al.. Nature, Til, 131-133, 1979), уже использовали подходящим образом в качестве клеток миеломы млекопитающего, служащих в качестве других клеток-хозяев, слитых с вышеупомянутыми иммуноцитами.
Слияние вышеупомянутых иммуноцитов и миеломных клеток может в основном проводиться в соответствии с известными способами, такими как способ Milstein et al. (Kohler G. and Milstein C., Methods Enzymol., 73, 3-46, 1981).
Более конкретно, вышеупомянутое слияние клеток проводят, например, в обычной питательной культуральной жидкости в присутствии стимулятора слияния клеток. Примеры стимуляторов слияния, которые используют, включают в себя полиэтиленгликоль (ПЭГ) и вирус Сендай (HVJ) и, необязательно, может быть также добавлено вспомогательное вещество, такое как диметилсульфоксид, для увеличения эффективности слияния.
Соотношение используемых иммуноцитов и миеломных клеток равно предпочтительно 1:10 (миеломные клетки: иммуноциты). Примеры культуральных жидкостей, которые могут быть использованы для вышеупомянутого слияния клеток, включают в себя культуральную жидкость RPMI 1640 для выращивания вышеупомянутых миеломных клеток, культуральную жидкость MEM и другие обычные культуральные жидкости, используемые для этого типа культивирования клеток. Кроме того, сывороточная добавка, такая как фетальная телячья сыворотка (ФТС), может быть также использована в комбинации с вышеупомянутой культуральной жидкостью.
Слияние клеток проводят тщательным смешиванием заранее определенных количеств вышеупомянутых иммуноцитов и миеломных клеток в вышеупомянутой культуральной жидкости, добавлением раствора ПЭГ, такого как раствор ПЭГ, имеющего среднюю молекулярную массу приблизительно 1000-6000, предварительно нагретого до 37°С, обычно при концентрации 30-60% (масса/объем), и затем перемешиванием для образования слитых клеток (гибридом). Далее, агенты слияния клеток и т.д., которые могут быть вредными для развития гибридомы, могут быть удалены повторением процедуры, состоящей из последовательного добавления подходящей культуральной жидкости и затем центрифугирования для удаления супернатанта.
Гибридому отбирают культивированием в обычной селективной культуральной жидкости, такой как культуральная жидкость HAT (культуральная жидкость, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в указанной культуральной жидкости HAT продолжают в течение периода времени, который составляет обычно несколько дней - несколько недель, который является достаточным для разрушения клеток, не являющихся гибридомой-мишенью (неслитых клеток). Затем гибридому, которая продуцирует антитело-мишень, подвергают скринингу и клонируют проведением обычных способов конечного разведения.
Наряду с получением вышеупомянутой гибридомы с помощью иммунизации антигеном животных, отличающихся от человека, желаемое человеческое антитело, имеющее связывающую активность в отношении желаемого антигена или антиген-экспрессирующих клеток, может быт