Новые соединения для ингибирования ангиогенеза и их применение
Иллюстрации
Показать всеИзобретение относится к соединениям структуры (I) , где D представляет собой пирролидин, X представляет собой радикал, выбранный из группы, содержащей С=O, SO2, (C=O)-NH, СН2, O-(С=O), (С=O)-O, (С=S)-NH, Y представляет собой радикал, выбранный из группы, содержащей - (СН2)n-Е-(СН2)m-L-(СН2)k, где Е представляет собой О, k, m и n отдельно и независимо представляют собой 0, 1, 2 и 3, Z представляет собой алкил, где алкил представляет собой СН2 или СН2СН2, А представляет собой радикал, выбранный из группы, содержащей бензил, замещенный бензил, фенил, замещенный фенил, алкил и замещенный алкил, циклоалкил, гетероциклил, арил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксиарил, В представляет собой радикал формулы (II)
где R1 выбран из группы, содержащей Н, алкил и замещенный алкил, циклоалкил, R2 выбран из группы, содержащей Н, бензил, замещенный бензил, фенил, замещенный фенил, алкил и замещенный алкил, циклоалкил, замещенный циклоалкил, арил, гетероарил, циклоалкилалкил, замещенный циклоалкилалкил, G представляет собой аминогруппу, которая замещена гетероарилом или замещенным гетероарилом, и где Q и L, каждый и независимо друг от друга, представляют собой радикал, выбранный из группы, содержащей (C=O)-NH, NH, СН2, NH-(C=O)-NH, NH-(C=O), NH-SO2, NRc, (C=O)-NRC, и где любой Ra, Rb, Rc и Rd, каждый и независимо, представляет собой радикал, выбранный из группы, содержащей Н, алкил, циклоалкил, гетероциклил, арил, замещенный арил, а также к применению этих соединений в качестве ингибитора интегрина и для производства лекарственного и диагностического средства, к фармацевтической композиции на основе этих соединений и к способам лечения ассоциированного с интегрином состояния. Технический результат: получены и описаны новые соединения, которые представляют собой ингибиторы интегринов и могут быть пригодны для лечения заболеваний, при которых необходимо ингибирование ангиогенеза. 7 н. и 59 з.п. ф-лы, 3 табл., 7 ил.
Реферат
Изобретение относится к новым соединениям и к применению указанных соединений для производства лекарственных и диагностических средств.
Ангиогенез, также называемый неоваскуляризацией, является основным процессом, при котором образуются новые кровеносные сосуды. В нормальных физиологических условиях ангиогенез в значительной степени контролируется и необходим для репродукции, эмбрионального развития и заживления ран (Folkman and Shing, 1992, JBC, 267, 10931). Однако ангиогенез также происходит при различных патологических состояниях, включающих глазную неоваскуляризацию, такую как при диабетической ретинопатии, связанной с возрастом дегенерации желтого пятна и различных других глазных заболеваниях, воспалительные нарушения, подобные ревматоидному артриту, и опухолевый рост и метастазирование (Folkman and Shing, 1992, JBC, 267, 10931).
При неоваскулярных нарушениях при злокачественной опухоли вновь сформированные кровеносные сосуды обеспечивают опухолевые клетки кислородом и питательными веществами, которые необходимы для дальнейшего роста приблизительно на 1-2 мм3 и формируют для опухолевых клеток ворота для входа в систему кровообращения и для метастазирования в отдаленные участки организма (Folkman and Shing, 1992, JBC, 267, 10931).
При глазных неоваскулярных нарушениях патологический рост новых кровеносных сосудов вызывает потерю зрения. Ведущей причиной слепоты у индивидуумов старше 65 лет является связанная с возрастом дегенерация желтого пятна (AMD), характеризующаяся ростом новых кровеносных сосудов из сосудистой оболочки, которые остаются под пигментным эпителием сетчатки (RPE) или прорывают RPE и входят в субретинальное пространство, приводя к кровоизлиянию, отслоению RPE и формированию субретинальных рубцов с последующей слепотой (Ambati, 2003, Survey of Ophthalmology, 48, 257). Основной причиной слепоты у индивидуумов старше 55 лет является пролиферативная диабетическая ретинопатия (PDR), при которой увеличивается количество кровеносных сосудов сетчатки параллельно поверхности сетчатки и в задней части стекловидного тела вследствие ишемических стимулов (Klein, 1994, Arch Ophthalmol. 112, Friedlander, 1996, PNAS, 93, 9764).
Ангиогенез также ассоциирован с воспалительными заболеваниями, включающими ревматоидный артрит, псориаз, остеоартрит, воспалительные заболевания кишечника, болезнь Крона, язвенный колит и другие. Вхождение лимфоцитов в область воспаления стимулирует ангиогенез, а после этого разросшаяся сосудистая сеть делает возможным большее вхождение лейкоцитов, поддерживающих воспалительный процесс, такой как разрушения хрящей и костей в суставах при артрите.
Ангиогенез представляет собой высокорегулируемый процесс, запускающийся в ответ на различные проангиогенные стимулы, такие как факторы роста, цитокины и другие физиологические молекулы, а также другие факторы, такие как гипоксия и низкий pH (Folkman and Shing, 1992, JBC, 267, 10931). Для ангиогенного каскада для развития новых кровеносных сосудов необходимо взаимодействие множества молекул, регулирующих необходимые клеточные процессы, такие как перестройка внеклеточного матрикса (ECM), инвазия, миграция, пролиферация, дифференциация и формирование трубки (Brooks, 1996, Eur. J. Cancer, 32A, 2423). После фазы инициации проангиогенные молекулы, такие как VEGF, bFGF, PDGF и другие, активируют эндотелиальные клетки посредством стимуляции их поверхностных клеточных рецепторов (например, VEGFR1-Flt-1 и VEGFR2-Flk1/KDR). Эти активированные клетки подвергаются процессу клеточной пролиферации, усиленной экспрессии молекул клеточной адгезии, увеличенной секреции протеолитических ферментов и увеличенной клеточной миграции и инвазии. Для обеспечения пролиферации и инвазии вовлечен ряд особых молекул, включая сюда представителей интегринового, селектинового и иммуноглобулинового генных суперсемейств для обеспечения адгезии, а также протеолитические ферменты, такие как матриксные металлопротеиназы и сериновые протеиназы, для деградации ECM (Brooks, 1996, Eur. J. Cancer, 32A, 2423). В заключение сложный каскад биохимических сигналов, полученных от клеточных поверхностных рецепторов, взаимодействующих с компонентами ECM и растворимыми факторами, приводит к формированию просвета и дифференциации в зрелые кровеносные сосуды.
Показано, что ингибирование различных молекул, вовлеченных в ангиогенный каскад, эффективно для ингибирования ангиогенеза и лечения неоваскулярных заболеваний в моделях на животных и клинических исследованиях (Madhusudan, 2002, Curr. Op. Pharm., 2, 403; Folkman, 2001, Thromb Haemost, 86, 23; Eyetech Study Group, 2003, Ophthalmology, 110, 979; Ferrara, 2002, Semin Oncol. 6 Suppl 16, 10) злокачественной опухоли и связанной с возрастом дегенерации желтого пятна (AMD). Большинство из этих ингибиторов ангиогенеза направлены на блокирование опосредованной факторами роста начальной стадии активации, индуцированной VEGF или PDGF. Данные подходы направлены только на одну молекулу из множества вариантов проангиогенных стимулов. Однако ангиогенез происходит в ответ на различные факторы роста, такие как VEGF, bFGF, PDGF и другие (Folkman and Shing, 1992, JBC, 267, 10931). Таким образом, вследствие данного разнообразия стимулов, более полезным мог бы быть более широкий подход для ингибирования ангиогенеза.
Ингибирование клеточной адгезии к ECM, основной стадии для активации, срока существования, направления и миграции активированных эндотелиальных клеток (EC), представляет собой наиболее многообещающий целевой механизм для противодействия ангиогенезу. Большинство из этих взаимодействий опосредованы интегринами, семейством универсальных рецепторов клеточной адгезии.
Представители семейства интегринов являются нековалентно ассоциированными гетеродимерами альфа/бета, опосредующими взаимодействия клетка-клетка, клетка-внеклеточный матрикс и клетка-патоген. Эти трансмембранные белки типа I экспрессируются на разнообразных клетках и для их физиологического функционирования им необходимы бивалентные катионы. К настоящему времени известно 19 различных субъединиц интегрина альфа и 8 различных субъединиц интегрина бета, которые объединяются с формированием, по меньшей мере, 25 различных гетеродимеров альфа/бета с различной специфичностью к лигандам. Лигандами для внеклеточного домена многих интегринов являются белки внеклеточного матрикса, у которых главным образом распознается консенсусный мотив с аминокислотной последовательностью RGD (аргинин-глицин-аспартат). Внутриклеточные домены интегринов непосредственно или опосредованно связаны с внутриклеточными компонентами, такими как киназы и цитоскелет. Интегрины служат в качестве двунаправленных рецепторов передачи сигнала, посредством чего интегринами в ответ на связывание лиганда с их внеклеточным доменом изменяются активность белков и экспрессия генов, что также обозначают как передача сигнала снаружи внутрь. С другой стороны, в ответ на внутриклеточные изменения, такие как связывание белков с внутриклеточным доменов интегрина, модулируется аффинность интегринов, что обозначают как передача сигнала изнутри наружу (Humphries, 2000, Biochem. Soc. Trans., 28, 311; Hynes, 2002, Cell 110, 673).
Информацию об интегринах и белках ECM, вовлеченных в критические стадии ангиогенеза, позволили получить множество исследований структуры интегринов на активированных эндотелиальных клетках, исследования нокаута и ингибирования мышиных генов в моделях ангиогенеза на животных с применением антител, пептидов и низкомолекулярных соединений (Brooks, 1994, Science, 264, 569; Brooks, 1996, Eur. J. Cancer, 32A, 2423; Mousa, 2002, Curr. Opin. Chem Biol, 6, 534; Hynes, 2002, Cell, 110, 673; Hynes, 2002, Nature Medicine, 8, 918; Kim, 2000, Am. J. Path., 156, 1345). Таким образом, становится понятным, что все рецепторы витронектина, альфаvбета3, альфаvбета5 и рецептор фибронектина альфа5бета1 играют решающую роль в ангиогенезе. Исследования делеций генов интегринов приписывают важную роль почти всем интегринам. Наносимые делециями дефекты дают возможность предположить о большом вкладе различных интегринов в поддержание целостности тканей и в стимуляцию клеточной миграции. Но только делеция альфа5 и бета1 и их лиганда фибронектина приводит к гибели эмбриона вследствие больших сосудистых дефектов, тогда как удаление генов альфаv, бета3 и бета5 не блокировала ангиогенез, а в некоторых случаях даже усиливала ангиогенез (Hynes, 2002, Nature Medicine, 8, 918).
Дополнительно, экспериментальные исследования установили фундаментальную роль альфа5бета1 в регуляции опосредованного альфаvбета3 ангиогенеза (Kim, 2000, JBC, 275, 33920).
С фундаментальной ролью альфа5бета1 для ангиогенеза согласуются и подтверждают ее генетические и фармакологические данные только для альфа5бета1. Следовательно, альфа5бета1 должен быть предпочтительной мишенью для разработки лекарственных средств против ангиогенеза. Следовательно, антагонисты интегрина альфа5бета1 обладают большим терапевтическим потенциалом для лечения неоваскуляризации при опухолях, в глазу и при воспалительных процессах.
Опосредованные интегринами эффекты и процессы также вовлечены в некоторые другие заболевания, такие как прогрессирование атеросклероза и рестеноз. В частности, ангиогенез и миграция являются важными характерными особенностями формирования бляшки при атеросклерозе (Hoshiga, 1995, Circ. Res. 77, 1129), а нежелательные процессы восстановления сосудов у пациентов с атеросклерозом вызывают коронарный рестеноз (Panda, 1997, PNAS, 94, 9308). Опосредуемое интегринами заболевание глаз представляет собой пролиферативную витреоретинопатию с патологической пролиферацией клеток пигментного эпителия сетчатки (Proulx, 2003, Molecular Vision, 9, 473).
Существует множество доказательств, позволяющих предположить центральную роль альфа5бета1 в ангиогенезе, например, данные по нокауту мышей. Таким образом, генетическое удаление любого из мономеров альфа5бета1 приводит к гибели эмбрионов вследствие множества сосудистых дефектов (Hynes, 2002, Nature Medicine, 8, 918). Кроме того, альфа5бета1 слабо экспрессируется на покоящемся эндотелии, но сильно экспрессируется на пролиферирующем эндотелии. Его экспрессия значительно повышается на кровеносных сосудах в человеческих опухолях и после стимуляции факторами роста (Kim, 2000, Am. J. Path, 156, 1345; Collo, 1999, J. Cell Sc., 112, 569). После экспрессии альфа5бета1 регулирует срок существования и миграцию эндотелиальных клеток in vitro и in vivo (Kim, 2002, J. Clin. Invest., 110, 933; Kim, 2000, JBC, 275, 33920). Ангиогенез, индуцированный множеством факторов роста в нескольких моделях на животных, был блокирован антагонистами альфа5бета1 (Varner, 1998, 98 (suppI), I-795, 4166; Kim, 2000, Am. J. Path, 156, 1345). Кроме того, эти антагонисты также ингибируют опухолевый ангиогенез, тем самым вызывая регрессию человеческих опухолей в моделях на животных (Kim, 2000, Am. J. Path, 156, 1345).
Принимая во внимание важность интегринов в ангиогенезе, были приложены значительные усилия для разработки их ингибиторов.
Существует, по меньшей мере, три важных класса реагентов, разработанных в качестве антагонистов интегринов, особенно антагонистов интегрина альфа5бета1. Они включают в себя антитела, такие как моноклональные антитела, поликлональные антитела и фрагменты антител (Kim, 2000, Am. J. Path., 156, 1345), природные пептиды, такие как полученные из змеиного яда пептиды "дезинтегрина" (Marcinkiewicz, 1999, Biochemistry, 38, 13302), синтетические пептиды (Koivunen, 1994, JBC, 124, 373) и непептидные низкомолекулярные соединения такие как спиросоединения (WO 97/33887).
Хотя эти соединения в принципе пригодны в качестве антагонистов альфа5бета1, они имеют некоторые недостатки. Например, антитела представляют собой сложные биологические молекулы, обычно с высокой активностью и специфичностью к молекуле-мишени. Но в основном не являющиеся человеком источники антител могут вызывать иммунный ответ при последующем лечении людей или молекулы необходимо гуманизировать с применением специальных дополнительных процедур. Кроме того, человеческая иммунная система может вырабатывать антитела против антигенсвязывающей области терапевтического антитела (антиидиотипические антитела). Развитие иммунного ответа к терапевтическому антителу может вызывать иммунологические проблемы у людей и уменьшать эффективность антитела. Также получение антител требует специальной обработки так, чтобы избежать любых загрязнений, таких как прионы или другие белковые вещества, которые могут оказывать вредное воздействие при применении у пациента. Кроме того, высокая молекулярная масса этих молекул сокращает возможные маршруты введения лекарственного средства при лечении пациентов, обычно до внутривенного маршрута.
Существует несколько известных пептидных ингибиторов альфа5бета1, которые основаны на природной последовательности RGD, полученной из лиганда, но эти ингибиторы обычно не проявляют специфичности или проявляют только ограниченную специфичность к другим интегринам. Кроме того, пептидные молекулы обычно невыгодны относительно их применения в качестве лекарственного средства. Один из аспектов этого состоит в ограниченной стабильности по отношению к встречающимся в природе протеазам. Другой аспект состоит в ограничении возможных путей введения.
Существует несколько известных пептидных ингибиторов альфа5бета1, которые основаны на природной последовательности RGD, полученной из лиганда, но эти ингибиторы обычно не проявляют специфичности или проявляют только ограниченную специфичность к другим интегринам. Кроме того, пептидные молекулы обычно невыгодны относительно их применения в качестве лекарственного средства. Один из аспектов этого состоит в ограниченной стабильности по отношению к встречающимся в природе протеазам. Другой аспект состоит в ограничении возможных путей введения.
Один полученный из фибронектина пептид (US 6001965), предположительно действующий через альфа5бета1, продемонстрировал противометастатическую активность в опухолевой модели на мышах (Stoeltzing, 2003, Int. J. Cancer 104, 496) и ингибирование клеточной инвазии (Livant, 2000, Cancer Res., 60, 309), но прямого ингибирования взаимодействия альфа5бета1-фибронектина показать не смогли. Он только связывался с альфа5бета1 (без воздействия на связывание фибронектина) и с интегрином альфаvбета3 (доклад на конференции на 6 международном симпозиуме по средствам против ангиогенеза, San Diego, 30 января - 1 февраля 2004 года). Таким образом, молекулярный механизм действия и специфичность остаются неясными и оставляют некоторую дополнительную неопределенность о применении в качестве ингибиторов альфа5бета1 пептидов, полученных из не-RGD-последовательности фибронектина (так называемая синергическая последовательность).
Синтезированные в данной области низкомолекулярные соединения описаны, например, в международной патентной заявке WO 97/33887, в которой описаны соединения, содержащие в качестве основного элемента спирогруппу. Однако, вследствие того, что в данных соединениях содержится спирогруппа, они очень устойчивы по структуре и их трудно синтезировать. В противоположность этому в международной патентной заявке WO 95/32710 описано применение в качестве основного элемента бензилового остатка. Однако, по-видимому, у этих соединений отсутствует необходимая специфичность к особенно значимому в патологическом механизме указанных выше заболеваний интегрину.
Таким образом, лежащая в основе настоящего изобретения проблема состоит в предоставлении химических соединений, которые пригодны для взаимодействия с интегринами, более конкретно - специфически взаимодействовать с определенными видами интегринов, таких как интегрин альфа5бета1. Дополнительной лежащей в основе настоящего изобретения проблемой является предоставление антагонистов для альфа5бета1, которые предпочтительно демонстрируют увеличенную активность, стабильность, селективность и доступность для синтеза. Дополнительной лежащей в основе настоящего изобретения проблемой является предоставление новых способов лечения заболеваний, предпочтительно заболеваний, включающих в себя опосредованные интегринами эффекты и процессы.
Первым аспектом настоящего изобретения являются соединения формулы (I)
где
D представляет собой радикал, выбранный из группы, содержащей гетероциклическое и гомоциклическое кольца,
X представляет собой радикал, выбранный из группы, содержащей C=O, SO2, NH-(C=O), (C=O)-NH, C=S, CH2, O-(C=O), (C=O)-O, (C=S)-NH, NH-(C=S), NRa-(C=O), (C=O)-NRa, (C=S)-NRa и NRa-(C=S),
Y представляет собой радикал, выбранный из группы, содержащей -(CH2)n-E-(CH2)m-L-(CH2)k и -(CH2)m-L-(CH2)k,
где E представляет собой радикал, выбранный из группы, содержащей O, S и NRb,
k, m и n отдельно и независимо представляют собой 0, 1, 2 и 3,
Z представляет собой радикал, выбранный из группы, содержащей C=O, и алкил, где алкил предпочтительно представляет собой CH2 или CH2CH2,
A представляет собой радикал, выбранный из группы, содержащей бензил, замещенный бензил, фенил, замещенный фенил, алкил и замещенный алкил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, гетероарил, замещенный гетероарил, арилалкил, замещенный арилалкил, гетероарилалкил, замещенный гетероарилалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероциклилалкил, замещенный гетероциклилалкил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксициклоалкил, замещенный алкилоксициклоалкил, алкилоксигетероциклил, замещенный алкилоксигетероциклил, алкилоксиарил, замещенный алкилоксиарил, алкилоксигетероарил, замещенный алкилоксигетероарил, алкилтиоалкил, замещенный алкилтиоалкил, алкилтиоциклоалкил и замещенный алкилтиоциклоалкил,
B представляет собой радикал формулы (II)
где
R1 выбран из группы, содержащей H, бензил, замещенный бензил, фенил, замещенный фенил, алкил и замещенный алкил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, гетероарил, замещенный гетероарил, арилалкил, замещенный арилалкил, гетероарилалкил, замещенный гетероарилалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероциклилалкил, замещенный гетероциклилалкил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксициклоалкил, замещенный алкилоксициклоалкил, алкилоксигетероциклил, замещенный алкилоксигетероциклил, алкилоксиарил, замещенный алкилоксиарил, алкилоксигетероарил, замещенный алкилоксигетероарил, алкилтиоалкил, замещенный алкилтиоалкил, алкилтиоциклоалкил и замещенный алкилтиоциклоалкил,
R2 выбран из группы, содержащей H, бензил, замещенный бензил, фенил, замещенный фенил, алкил и замещенный алкил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, гетероарил, замещенный гетероарил, арилалкил, замещенный арилалкил, гетероарилалкил, замещенный гетероарилалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероциклилалкил, замещенный гетероциклилалкил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксициклоалкил, замещенный алкилоксициклоалкил, алкилоксигетероциклил, замещенный алкилоксигетероциклил, алкилоксиарил, замещенный алкилоксиарил, алкилоксигетероарил, замещенный алкилоксигетероарил, алкилтиоалкил, замещенный алкилтиоалкил, алкилтиоциклоалкил и замещенный алкилтиоциклоалкил,
G представляет собой радикал, содержащий, по меньшей мере, один атом азота, и
где Q и L, каждый и независимо друг от друга, представляют собой радикал, выбранный из группы, содержащей (C=O)-NH, C=O, C=S, NH, O, S, CH2, NH-NH, N=N, CH=N, N=CH, NH-(C=O)-NH, NH-(C=O), O-(C=O)-NH, NH-(C=O)-O, (C=O)-O, O-(C=O), NH-(C=S), (C=S)-NH, NH-(C=S)-NH, SO2, NH-SO2, SO2-NH, NRc, (C=O)-NRc, NRc, NRc-(C=O)-NH, NH-(C=O)-NRc, NRc-(C=O)-NRd, NRc-(C=O), O-(C=O)-NRc, NRc-(C=O)-O, NRc-(C=S), (C=S)-NRc, NRc-(C=S)-NH, NH-(C=S)-NRc, NRc-(C=S)-NRd, NRc-SO2 и SO2-NRc, и
где любой из Ra, Rb, Rc и Rd, каждый и независимо, представляет собой радикал, выбранный из группы, содержащей H, алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, гетероарил, замещенный гетероарил, арилалкил, замещенный арилалкил, гетероарилалкил, замещенный гетероарилалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероциклилалкил, замещенный гетероциклилалкил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксициклоалкил, замещенный алкилоксициклоалкил, алкилоксигетероциклил, замещенный алкилоксигетероциклил, алкилоксиарил, замещенный алкилоксиарил, алкилоксигетероарил, замещенный алкилоксигетероарил, алкилтиоалкил, замещенный алкилтиоалкил, алкилтиоциклоалкил и замещенный алкилтиоциклоалкил.
В одном из вариантов осуществления кольцо в D представляет собой ароматическое или неароматическое кольцо.
В одном из вариантов осуществления кольцо в D выбрано из группы, содержащей пятичленные кольца, шестичленные кольца, семичленные кольца, восьмичленные кольца, девятичленные кольца и десятичленные кольца или кольцо в D представляет собой конденсированную кольцевую систему, выбранную из группы, содержащей четыре четырехчленных кольца, четыре пятичленных кольца, пять пятичленных колец, пять шестичленных колец, шесть шестичленных колец, шесть семичленных колец, семь семичленных колец.
В одном из вариантов осуществления кольцо в D представляет собой гетероциклическое кольцо, содержащее, по меньшей мере, один атом азота.
В предпочтительном варианте осуществления любой из X, Y, Z присоединен к атому азота.
В одном из вариантов осуществления соединения представляет собой соединение формул (III a, III b)
где o и p независимо и отдельно представляют собой 0, 1, 2 или 3.
В одном из вариантов осуществления D выбран из группы, содержащей пиррол, пирролидин, индол, пиридин, пиперидин, хинолин, изохинолин, имидазол, пиримидин, пурин, пиридазин, пиперазин, 1,3,5-триазин, 1,2,3-триазол, имидазолидин и пиразол и любые производные каждого из них.
В одном из вариантов осуществления D представляет собой радикал, выбранный из группы, содержащей тиофен, тиазол, изотиазол, 1,4-дитиан, 1,3,5-тритиан и тиоморфолин.
В одном из вариантов осуществления D представляет собой радикал, выбранный из группы, содержащей фуран, диоксан, пиран и производные каждого из них.
В одном из вариантов осуществления D представляет собой радикал, выбранный из группы, содержащей оксазол, изоксазол и тиазол и производные каждого из них.
В одном из вариантов осуществления
n представляет собой 0, E представляет собой O, m представляет собой 1, L представляет собой (C=O)-NH и k представляет собой 0; или
n представляет собой 1, E представляет собой O, m представляет собой 1, L представляет собой (C=O)-NH и k представляет собой 0; или
n представляет собой 0, E представляет собой O, m представляет собой 2, L представляет собой (C=O)-NH и k представляет собой 0; или
n представляет собой 0, E представляет собой CH2, m представляет собой 1, L представляет собой (C=O)-NH и k представляет собой 0; или
n представляет собой 1, E представляет собой O, m представляет собой 2, L представляет собой (C=O)-NH и k представляет собой 0.
В одном из вариантов осуществления Z представляет собой CH2.
В одном из вариантов осуществления A выбран из группы, содержащей алкил и замещенный алкил, циклоалкил, замещенный циклоалкил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксициклоалкил, замещенный алкилоксициклоалкил, алкилтиоалкил, замещенный алкилтиоалкил, алкилтиоциклоалкил и замещенный алкилтиоциклоалкил.
В одном из вариантов осуществления A выбран из группы, содержащей бензил, замещенный бензил, фенил, замещенный фенил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, арилалкил, замещенный арилалкил, гетероарилалкил, замещенный гетероарилалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероциклилалкил, замещенный гетероциклилалкил, алкилоксигетероциклил, замещенный алкилоксигетероциклил, алкилоксиарил, замещенный алкилоксиарил, алкилоксигетероарил, замещенный алкилоксигетероарил, арилтиоалкил, замещенный арилтиоалкил, арилтиоциклоалкил и замещенный арилтиоциклоалкил.
В одном из вариантов осуществления A представляет собой производное фенила или производное бензила формулы (IV) или (V)
где R3, R4, и R5, каждый и независимо, представляет собой радикал, выбранный из группы, содержащей H, галоген, алкил, замещенный алкил, алкокси и замещенный алкокси.
В предпочтительном варианте осуществления алкил выбран из группы, содержащей метил, этил, пропил, бутил, пентил, гексил, где любой из остатков является неразветвленным, разветвленным, разветвленным-линейным или разветвленным нелинейным.
В дополнительном предпочтительном варианте осуществления алкокси выбран из группы, содержащей метокси, этокси, пропокси, бутокси, пентокси, гексокси.
В альтернативном варианте осуществления замещенный алкил представляет собой алкил, по меньшей мере, с одним остатком галогена, NO2, OH, CN.
В предпочтительном варианте осуществления замещенный алкил выбран из группы, содержащей CF3 и CCl3.
В одном из вариантов осуществления A представляет собой линейный алкил или нелинейный алкил, предпочтительно A представляет собой 2,2-диметилбутил.
В одном из вариантов осуществления галоген независимо выбран из группы, содержащей I, Br, Cl и F.
В одном из вариантов осуществления R2 выбран из группы, содержащей алкил и замещенный алкил, циклоалкил, замещенный циклоалкил, алкилоксиалкил, замещенный алкилоксиалкил, алкилоксициклоалкил, замещенный алкилоксициклоалкил, алкилтиоалкил, замещенный алкилтиоалкил, алкилтиоциклоалкил и замещенный алкилтиоциклоалкил, более предпочтительно выбранный из группы, содержащей циклоалкил и замещенный циклоалкил, а более предпочтительно R2 представляет собой
В альтернативном варианте осуществления R2 выбран из группы, содержащей бензил, замещенный бензил, фенил, замещенный фенил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, арилалкил, замещенный арилалкил, гетероарилалкил, замещенный гетероарилалкил, циклоалкилалкил, замещенный циклоалкилалкил, гетероциклилалкил, замещенный гетероциклилалкил, алкилоксигетероциклил, замещенный алкилоксигетероциклил, алкилоксиарил, замещенный алкилоксиарил, алкилоксигетероарил, замещенный алкилоксигетероарил, арилтиоалкил, замещенный арилтиоалкил, арилтиоциклоалкил и замещенный арилтиоциклоалкил.
В одном из вариантов осуществления R2 представляет собой радикал следующей формулы (VI)
где q представляет собой 0, 1, 2, 3 или 4,
R6, R7 и R8, каждый отдельно и независимо, выбраны из группы радикалов, содержащей галоген, алкил, замещенный алкил, алкокси и замещенный алкокси.
В предпочтительном варианте осуществления алкил и/или замещенный алкил выбран из группы, содержащей метил, этил, пропил, бутил, пентил, гексил, где любой из остатков является неразветвленным, разветвленным, разветвленным линейным или разветвленным нелинейным.
В дополнительном предпочтительном варианте осуществления алкокси выбран из группы, содержащей метокси, этокси, пропокси, бутокси, пентокси, гексокси.
В еще одном дополнительном предпочтительном варианте осуществления замещенный алкил представляет собой алкил, по меньшей мере, с одним остатком галогена, NO2, OH, CN.
В более предпочтительном варианте осуществления замещенный алкил выбран из группы, содержащей CF3 и CCl3.
В альтернативном предпочтительном варианте осуществления R2 представляет собой мезитилен.
В одном из вариантов осуществления Q из B представляет собой C=O.
В альтернативном варианте осуществления Q из B представляет собой SO2.
В одном из вариантов осуществления G представляет собой радикал формулы (VII).
где R9 представляет собой гетероциклическое кольцо, а r представляет собой 0, 1, 2, 3 или 4.
В предпочтительном варианте осуществления R7 представляет собой трехчленное, четырехчленное, пятичленное, шестичленное, семичленное, восьмичленное, девятичленное или десятичленное кольцо, предпочтительно, по меньшей мере, с одним атомом азота в кольце.
В альтернативном предпочтительном варианте осуществления R7 представляет собой конденсированное кольцо, предпочтительно, по меньшей мере, с одним атомом азота.
В объеме настоящего изобретения находится то, что любое из указанных выше колец, предпочтительно колец по трем последним указанным вариантам изобретения, может содержать один или несколько заместителей, таким образом, получая производные соответствующих колец. Такие производные содержат в качестве неограничивающих примеров алкильные производные, алкоксипроизводные, тиоалкильные производные и галогеновые производные. Другими словами, соответствующие кольца в дополнительных вариантах осуществления представляют собой замещенные алкилами кольца, замещенные алкокси кольца, замещенные тиоалкилами кольца и замещенные галогенами кольца.
В одном из вариантов осуществления G представляет собой гуанидиновый радикал.
В одном из вариантов осуществления G представляет собой (C=O)-NH2 или NH-(C=O)-NH2.
В одном из вариантов осуществления G выбран из группы, содержащей пиридин-2-иламин, пиримидин-2-иламин, 1(2)H-имидазол-2-иламин, 4,5-дигидро-1H-имидазол-2-иламин, 1,4,5,6-тетрагидро-пиримидин-2-иламин, 4,5,6,7-тетрагидро-1H-[1,3]диазепин-2-иламин, 1,4,5,6,7,8-гексагидро-[1,3]диазоцин, 1,4,5,6,7,8,9,10-октагидро-[1,3]диазецин-2-иламин, 4,5-дигидро-3H-пиррол-2-иламин, 3,4,5,6-тетрагидропиридин-2-иламин, 4,5,6,7-тетрагидро-3H-азепин-2-иламин, 3,4,5,6,7,8-гексагидроазоцин-2-иламин, 3,4,5,6,7,8,9,10-октагидроазецин-2-иламин, 1H-бензоимидазол-2-иламин, 2(3)H-пиразол-3-иламин, 1H-индол-2-иламин, 1,2,3,4-тетрагидро-[1,8]нафтиридин, пиразин-2-иламин и любое производное каждого из них, где предпочтительно такое производное выбрано из группы, содержащей алкильное производное, алкоксипроизводное, тиоалкильное производное и галогеновое производное.
В одном из вариантов осуществления G выбран из группы, содержащей пиридин-2-иламин, 4-метоксипиридин-2-иламин, 1(2)H-имидазол-2-иламин, 2(3)H-пиразол-3-иламин.
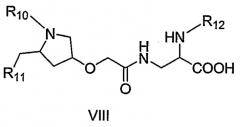
Во втором аспекте лежащую в основе настоящего изобретения проблему решают посредством соединения формулы (VIII)
где R10 представляет собой -CO-R13 или -CO-O-R13,
где R11 представляет собой замещенный пиридин-2-иламин,
где R12 представляет собой -CO-R13, -SO2-R13, и
где R13 представляет собой радикал, выбранный из группы, содержащей алкил, замещенный алкил, циклоалкил, арил, замещенный арил, гетероарил, замещенный гетероарил,
где соединение предпочтительно представляет собой соединение по первому аспекту настоящего изобретения.
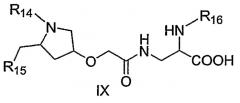
В одном из вариантов осуществления второго аспекта соединение обладает формулой (IX)
где R14 представляет собой 3,3-диметилбутирил или 3-карбоксифенил,
где R15 представляет собой пиридин-2-иламин, 4-метоксипиридин-2-иламин,
где R16 представляет собой -CO-R17, и
где R17 представляет собой мезитилен или 1-метилциклогексил.
В третьем аспекте лежащую в основе настоящего изобретения проблему решают посредством соединения, выбранного из группы, содержащей
соединение 5: бензиловый эфир [2-карбокси-2-(2,4,6-триметилбензолсульфониламино)этилкарбамоил]метокси-2-(пиридин-2-иламинометил)пирролидин-1-карбоновой кислоты
соединение 9: 2-[1-фенилацетил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 10: бензиловый эфир (2-бензолсульфониламино-2-карбоксиэтилкарбамоил)метокси-2-(пиридин-2-иламинометил)пирролидин-1-карбоновой кислоты
соединение 13: бутиловый эфир 4-{[2-карбокси-2-(2,4,6-триметилбензолсульфониламино)этилкарбамоил]метокси}-2-(пиридин-2-иламинометил)пирролидин-1-карбоновой кислоты
соединение 14: 3-{2-[1-(3-фенилпропионил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 15: 3-{2-[1-фенилметансульфонил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 16: 3-{2-[1-(бутан-1-сульфонил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 17: 3-{2-[1-метил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 18: 3-{2-[1-(3-фенилпропил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 19: 3-{2-[5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 20: 3-{2-[1-циклопентилкарбамоил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 21: 3-{2-[1-циклогексилкарбамоил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 22: 3-{2-[1-бутилкарбамоил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 23: 3-{2-[1-пентилкарбамоил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 24: 3-{2-[1-(2-фторбензилкарбамоил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 25: 3-{2-[1-(4-метилбензилкарбамоил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 26: 3-{2-[1-фенетилкарбамоил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 27: 3-{2-[1-(3-метилбензилкарбамоил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 28: 3-{2-[1-фенилкарбамоил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 29: 3-{2-[1-(2-метилпентаноил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 30: 3-{2-[1-(3-циклопентилпропионил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 31: 3-{2-[1-(3,3-диметилбутирил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 32: 3-{2-[1-циклогексанкарбонил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 33: 3-{2-[5-(пиридин-2-иламинометил)-1-(3,5,5-триметилгексаноил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 34: 3-{2-[5-(пиридин-2-иламинометил)-1-(2-тиофен-2-илацетил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 35: 3-{2-[1-(2-циклопентилацетил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 36: 3-{2-[1-[2-(3-метоксифенил)ацетил]-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 37: 3-{2-[1-изобутирил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 38: 3-{2-[1-пропионил-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионовая кислота
соединение 39: 3-{2-[1-(2-феноксиацетил)-5-(пиридин-2-иламинометил)пирролидин-3-илокси]ацетиламино}-2-(2,4,6-триметилбензолсульфониламино)пропионова