Пептидные соединения
Иллюстрации
Показать всеИзобретение относится к новым пептидным соединениям и их применению в способах диагностической оптической визуализации. Более конкретно, данное изобретение относится к применению таких пептидных соединений в качестве нацеленных векторов, которые связываются с рецепторами, ассоциирующимися с ангиогенезом. Соединения метят по меньшей мере одним цианиновым репортерным красителем, и они могут быть использованы в качестве контрастных агентов в оптической визуализации при диагностике заболеваний, связанных с ангиогенезом. 2 н. и 7 з.п. ф-лы.
Реферат
Данное изобретение относится к новым пептидным соединениям и их применению в способах диагностической оптической визуализации или лечения заболевания. Более конкретно, изобретение относится к применению таких пептидных соединений в качестве нацеленных векторов, связывающихся с рецепторами, ассоциирующимися с ангиогенезом. Соединения могут быть использованы в качестве контрастных агентов при диагностике или лечении заболеваний, связанных с ангиогенезом.
Как правило, новые кровеносные сосуды могут образовываться посредством двух разных механизмов: васкулогенеза или ангиогенеза. Ангиогенез представляет собой образование новых кровеносных сосудов посредством ветвления существующих сосудов. Первичным стимулом этого процесса может являться недостаточный приток питательных веществ и кислорода (гипоксия) к клеткам ткани. Клетки могут реагировать путем секреции ангиогенных факторов, которых существует множество; один из часто упоминаемых примеров - васкулярный эндотелиальный фактор роста (VEGF). Эти факторы инициируют секрецию протеолитических ферментов, которые разрушают белки базальной мембраны, а также ингибиторов, которые ограничивают действие этих потенциально вредных ферментов. Другое известное действие ангиогенных факторов заключается в том, чтобы вызвать миграцию и деление эндотелиальных клеток. Эндотелиальные клетки, которые прикреплены к базальной мембране и образуют непрерывный слой вокруг кровеносных сосудов на стороне, противоположной просвету сосудов, не претерпевают митоз. Объединенный эффект от утраты прикрепления и сигналов с рецепторов к ангиогенным факторам заставляет эндотелиальные клетки перемещаться, делиться, перегруппировываться и, наконец, синтезировать базальную мембрану вокруг новых сосудов.
Ангиогенез замечен в росте и ремоделировании тканей, включая заживление ран и воспалительные процессы. Кроме того, ингибирование ангиогенеза считается перспективной стратегией противоопухолевого лечения. Превращения, сопутствующие ангиогенезу, также являются очень многообещающими для диагностики, очевидным примером чего является злокачественное заболевание, но данная концепция также является многообещающей при воспалении и множестве заболеваний, связанных с воспалением, включая атеросклероз, причем макрофаги при ранних атеросклеротических поражениях представляют собой потенциальные источники ангиогенных факторов. Эти факторы также вовлечены в реваскуляризацию областей миокарда, подвергшихся инфаркту, которая происходит, если стеноз ликвидируют в течение короткого времени.
Дополнительные примеры нежелательных условий, ассоциированных с неоваскуляризацией или ангиогенезом, развитием или пролиферацией новых кровеносных сосудов, представлены ниже. В связи с этим также сделана ссылка на WO 98/47541.
Заболевания и показания, ассоциированные с ангиогенезом, представляют собой, например, разные формы рака и метастазирования, например рак молочной железы, кожи, колоректальный рак, рак поджелудочной железы, предстательной железы, легкого или яичников.
Другие заболевания и показания представляют собой воспаление (например, хроническое), атеросклероз, ревматоидный артрит и гингивит.
Дополнительными заболевания и показаниями, ассоциированными с ангиогенезом, являются артериовенозные дефекты, астроцитомы, хориокарциномы, глиобластомы, глиомы, гемангиомы (у детей, капиллярные), гематомы, гиперплазия эндометрия, ишемическое повреждение миокарда, эндометриоз, саркома Капоши, дегенерация желтого пятна, меланома, нейробластомы, окклюзивное заболевание периферических артерий, остеоартрит, псориаз, ретинопатия (диабетическая, пролиферативная), склеродерма, семиномы и неспецифический язвенный колит.
В ангиогенез вовлечены рецепторы, уникальные для эндотелиальных клеток и окружающих тканей. Эти маркеры включают рецепторы факторов роста, такие как VEGF и интегриновое семейство рецепторов. Иммуногистохимические исследования продемонстрировали, что множество интегринов, возможно наиболее значительно класс αv, экспрессируется на апикальной поверхности кровеносных сосудов [Conforti, G., et al. (1992) Blood 80:37-446] и доступны для нацеливания циркулирующих в кровеносной системе лигандов [Pasqualini, R., et al. (1997) Nature Biotechnology 15:542-546]. α5β1 также является важным интегрином, способствующим сборке фибронектиновой матрицы и инициации прикрепления клеток к фибронектину. Он также играет важную роль в миграции клеток.
Интегрин αvβ3 является одним из рецепторов, которые, как известно, ассоциированы с ангиогенезом. Стимулированные эндотелиальные клетки, по-видимому, полагаются на этот рецептор в отношении выживания в течение критического периода процесса ангиогенеза, поскольку антагонисты αvβ3 интегринового рецептора/взаимодействия с лигандом индуцируют апоптоз и ингибируют рост кровеносных сосудов.
Интегрины представляют собой гетеродимерные молекулы, в которых α- и β-субъединицы пронизывают липидный бислой клеточной мембраны. α-Субъединица имеет четыре домена, связывающих Са2+, на своей внеклеточной цепи, а β-субъединица имеет ряд внеклеточных цистеин-богатых доменов.
Множество лигандов (например, фибронектин), вовлеченных в клеточную адгезию, содержат трипептидную последовательность аргинин-глицин-аспарагиновая кислота (RGD). Последовательность RGD, по-видимому, действует в качестве первичного сайта распознавания для лигандов, презентирующих эту последовательность, и рецепторов на поверхности клеток. Обычно полагают, что вторичные взаимодействия между лигандом и рецептором усиливают специфичность взаимодействия. Эти вторичные взаимодействия могут происходить между группировками лиганда и рецептора, которые находятся непосредственно по соседству с последовательностью RGD, или в сайтах, которые находятся на расстоянии от последовательности RGD.
Известно, что RGD-пептиды связываются с рядом интегриновых рецепторов и могут регулировать ряд клеточных явлений, имеющих важное клиническое применение. Возможно, наиболее широко изученное действие RGD-пептидов и их имитаторов относится к их применению в качестве антитромботических средств, когда они нацелены на интегрин тромбоцитов Gpllbllla.
Ингибирование ангиогенеза в тканях путем введения антагониста αvβ3 или αvβ5 с использованием антител или пептидов, содержащих RGD, описано, например, в WO 97/06791 и WO 95/25543. В ЕР 578083 описан ряд моноциклических пептидов, содержащих RGD. Циклические RGD-пептиды, содержащие множество мостиков, также описаны в WO 98/54347 и WO 95/14714.
Дополнительные примеры RGD, включающие пептидные соединения, содержатся в WO 01/77145, WO 02/26776 и WO 03/006491. В WO 01/77145 раскрыты бициклические пептиды RGD-типа, конъюгированные с репортерной группировкой. В WO 05/003466 также раскрыты пептиды RGD-типа, конъюгированные с флуоресцеином, для применения в оптической визуализации.
Существует клиническая потребность в разработке более специфичных неинвазивных методов для визуализации заболеваний, связанных с ангиогенезом, и для лечения таких заболеваний. Такие способы визуализации играют главную роль в оценке новых антиангиогенных способов лечения. Возможность оценить действительный уровень ангиогенеза имеет клиническую значимость при диагностике заболеваний, связанных с ангиогенезом, на ранней стадии. Оптическая визуализация может быть использована для оценки уровня ангиогенеза, и в изобретении предложены новые соединения, полезные в качестве контрастных агентов для оптической визуализации для этой задачи.
Принимая во внимание потребности в данной области, в изобретении предложены пептидные соединения, меченные цианиновыми красителями, для применения в качестве контрастных агентов для оптической визуализации или для терапевтического лечения. Для эффективного in vivo нацеливания и визуализации интегриновых рецепторов, ассоциированных с ангиогенезом, требуется селективный, высокоаффинный вектор RGD-типа, который химически устойчив и стабилен. Кроме того, путь экскреции является важным фактором при разработке визуализирующих агентов с целью уменьшения проблем, возникающих с фоновым шумом. Этим жестким условиям удовлетворяют пептидные соединения, меченные цианиновым красителем, описанные в настоящем изобретении.
В соответствии с одним из аспектов изобретения предложены новые пептидные соединения, как они определены в формуле изобретения. Эти соединения обладают аффинностью в отношении интегриновых рецепторов, например аффинностью в отношении интегрина αvβ3, и помечены цианиновым репортерным красителем.
Соединения, или их физиологически приемлемые соли, включают пептидный вектор и по меньшей мере один цианиновый краситель, где пептидный вектор включает аминокислотную последовательность Х3-G-D и где пептидный вектор и по меньшей мере один цианиновый краситель соединены, предпочтительно ковалентной связью. Х3 представляет собой аргининовый, N-метиларгининовый или аргининовый миметик, G представляет собой глицин и D представляет собой аспарагиновую кислоту. Пептидный вектор обладает аффинностью к интегриновым рецепторам, таким как рецепторы αvβ3.
Цианиновый краситель (CyDye™) далее обозначен буквой Z. Цианиновые красители представляют собой соединения, характеризующиеся полиеновой цепью, содержащей нечетное количество атомов углерода, связанных чередующимися простыми и кратными, предпочтительно двойными углерод-углеродными связями, оканчивающимися на каждом конце аминогруппой, одна из которых кватернизирована. Цианин и аналогичные арил-линкер-арильные хромофоры возможно несут подвешенные или конденсированные кольцевые заместители. Общее описание цианиновых красителей и их синтез описаны в US 6048982 и US 5268486. которые включены в данное описание посредством ссылки. Цианиновые красители особенно полезны из-за широкого диапазона спектральных свойств и имеющихся структурных вариантов. Ассортимент цианиновых красителей хорошо известен и протестирован, они обладают низкой токсичностью и имеются в продаже (GE Healthcare, ранее Amersham Biosciences). Цианиновые красители представляют собой одно семейство высокоинтенсивных красителей, обладающих хорошей растворимостью в воде. Они не чувствительны к рН в интервале рН 3-10, демонстрируют низкое неспецифическое связывание и являются более фотостабильными по сравнению с флуоресцеином.
Предпочтительное воплощение изобретения предполагает конъюгацию цианиновых красителей с пептидными векторами, приводящую к уменьшению задерживания в пуле крови. В этом воплощении изобретения предложено соединение, включающее цианиновые красители с двумя или одной группировкой сульфоновой кислоты или без нее. Красители с уменьшенным количеством группировок сульфоновой кислоты, конъюгированные с пептидами, такими как RGD-пептид, обладают низким связыванием с плазмой крови и уменьшенным неспецифическим связыванием с фоновой тканью. Группы сульфоновой кислоты не придают какой-либо гидрофильности красителям, что является необходимым свойством для визуализации in vivo. Цианиновые красители традиционно использовались in vitro, где полисульфонирование красителей было важно для того, чтобы эти красители были очень хорошо растворимы в воде. Неожиданно было обнаружено, что путем удаления групп сульфоновой кислоты из красителя было получено более оптимальное биораспределение соединений.
В этом воплощении изобретения авторы изобретения предпочтительно используют цианиновые красители, каждый из которых содержат 2 или 1 группировку сульфоновой кислоты или не содержит группировок сульфоновой кислоты для уменьшения связывания с плазмой крови и неспецифического связывания пептидного соединения. Неожиданно было обнаружено, что соединения являются достаточно гидрофильными для растворения в воде.
Цианиновый краситель предпочтительно выбран из группы, состоящей из карбоцианинов, оксацианинов, тиацианинов и азацианинов, представленных ниже общими формулами
В этих структурах группы R1 являются одинаковыми или разными и представляют собой замещенные или незамещенные алкильные группы, предпочтительно С1-С6алкилы, и могут включать простой эфир или группу -N-CO-N-. Алкильные группы возможно замещены группами карбокси, сульфоновой кислоты, амина, аммония или сложного эфира. Группы R1 могут образовывать мостики с любым из атомов углерода полиеновых цепей, например группой -N-CO-N- или эфирной группой. Группы R2 также являются одинаковыми или разными и представляют собой замещенные или незамещенные алкильные группы. Алкильные группы возможно замещены группами карбокси или сульфоновой кислоты, но предпочтительно группы R2 представляют собой низшие алкильные группы, например С1-С6алкильные, и наиболее предпочтительно метильные группы. Возможные ароматические группы обозначены пунктирными линиями для того, чтобы охватить структуры, включающие конденсированные бензольные кольца и конденсированные нафтольные кольца. Кольца являются замещенными или незамещенными. Кольца могут быть замещены группами сульфоновой кислоты, карбоксильными группами, гидроксильными группами, алкил(сульфоалкил)аминогруппами, бис(сульфоалкил)аминогруппами, сульфоалкоксигруппами, сульфоалкилсульфонильными группами, алкильными или замещенными алкильными или сульфоалкиламиногруппами. Алкильные группы предпочтительно представляют собой низшие алкилы, например содержащие от 1 до 6 атомов углерода. Y выбран из водорода, галогенидной группы, аминогруппы или сульфонила, и предпочтительно представляет собой водород. Полиеновая цепь цианинового красителя также может содержать одну или более чем одну циклическую химическую группу, образующую мостики между двумя или более атомами углерода полиеновой цепи, например путем включения группы -СО- между двумя углеродными атомами цепи, как в сквареновых красителях, или путем включения алкильного мостика. Эти мостики могут служить для увеличения химической или фотостабильности красителя.
В формулах I-IV, I представляет собой положительное целое число 1, 2, 3 или 4, что приводит к триметинцианинам, имеющим углеродный мостик из трех атомов углерода, пентаметиновым, гептаметиновым или нонаметиновым цианиновым красителям. Предпочтительно цианиновый краситель представляет собой пентаметиновый или гептаметиновый краситель с углеродными мостиками, состоящими из 5 и 7 атомов углерода соответственно.
В отношении формулы I-IV предпочтительные красители содержат в общей сложности 2 или 1 группировку сульфоновой кислоты или не содержат группировок сульфоновой кислоты, присоединенных к индольным кольцам или бензиндольным кольцам.
Предпочтительные красители выбраны из группы карбацианинов. И еще предпочтительными являются карбацианиновые красители индольного типа. Предпочтительные красители этого типа проиллюстрированы формулой V:
где Х представляет собой группировку сульфоновой кислоты или отсутствует, группы R1 являются одинаковыми или разными и представляют собой замещенные или незамещенные низшие алкильные группы, например возможно замещенные С1-С6алкильные группы. Алкильные группы замещены, например, группами карбокси, сульфоновой кислоты, амино, аммониевыми или сложноэфирными группами, например гетероциклическими эфирными группами (например NHS-эфир). Группы R2 представляют собой низшие алкильные группы, такие как С1-С6алкилы, предпочтительно метильные группы, возможно замещенные, например, группами карбокси или сульфоновой кислоты. 1 представляет собой 1, 2 или 3.
R1, R2 и X представляют собой потенциальные сайты связывания для связывания красителя с пептидным вектором, причем предпочтительными являются группы R1 и X. В предпочтительном воплощении одна группа R1 связана с пептидным вектором, тогда как другая группа R1 представляет собой возможно замещенную низшую алкильную группу.
Наиболее предпочтительные красители представляют собой Cy5-моноNHS-эфир-бисSO3 и Cy7-моноNНS-эфир-бисSO3, представленные ниже:
Cy5-моноNHS-эфир-бисSO3
Cy7-моноNHS-эфир-бисSO3
Подходящие цианиновые красители для применения в соединениях по изобретению имеют спектр эмиссии в видимой или ближней инфракрасной области, предпочтительно в интервале 500-900 нм, более предпочтительно в интервале 650-850 нм.
Соединения по изобретению включают аминокислотную последовательность Х3-G-D, обладающую аффинностью в отношении интегриновых рецепторов. Соединение предпочтительно включает дополнительные аминокислоты и возможно другие группировки, где последовательность Х3-G-D представляет собой сайт связывания пептидного вектора, функционирующего в качестве вектора, связывающегося с рецептором интегринового типа.
Соединение по изобретению может быть связано, например, путем образования одного или более циклизирующих мостиков в участке пептидного вектора. Моноциклическое пептидное соединение может быть получено путем образования дисульфидной связи или тиоэфирной связи между аминокислотами. Пептидное соединение, включающее один циклизующий мостик, более специфично в отношении αvβ3 и более предпочтительно по сравнению с линейным пептидом. Соединения по изобретению предпочтительно включают два циклизующих мостика между разными аминокислотами соединений или между аминокислотами и другими группировками. Термин "циклизующие мостики" относится к любой комбинации аминокислот с функциональными группами, позволяющими вводить мостик, либо между аминокислотами и группами -(СН2)n-, либо -(СН2)n-С6Н4-. n представляет собой положительное целое число от 1 до 10. Некоторые предпочтительные примеры представляют собой дисульфиды, дисульфидные миметики, такие как -(СН2)4-карбамостик, тиоацеталь, тиоэфирные мостики (цистатион или лантионин) и мостики, содержащие сложные эфиры или простые эфиры. Предпочтительно один из мостиков образует дисульфидную связь, а второй мостик содержит тиоэфирную (сульфидную) связь.
Еще одно воплощение соединения по изобретению определено формулой (VIa)
где А определен формулой (VIб)
и Z представляет собой по меньшей мере один цианиновый краситель, связанный с одним или более чем одним X1, X6 или Х7 в А, возможно через спейсерную группу,
соединение, включающее два циклизующих мостика,
где,
Х3, G и D являются такими, как определено выше;
Ra представляет собой группу -(СН2)n- или -(СН2)Н-С6Н4-, которая образует участок мостика, связанный с любым из Х2, Х4 или Х6, где
n представляет собой положительное целое число от 1 до 10;
X1 представляет собой связь или 1, 2, 3, 4 или 5 аминокислотных остатков, где по меньшей мере один аминокислотный остаток возможно функционализирован спейсерной группировкой, и указанный аминокислотный остаток предпочтительно имеет функциональную боковую цепь, такую как кислотная или аминогруппа, и предпочтительно выбран из аспарагиновой или глутаминовой кислоты, гомолизина или диаминоалициклической кислоты, такой как лизин или диаминопропионовая кислота; и
Х2 и Х4 независимо представляют собой аминокислотные остатки, способные образовывать циклизующий мостик, такие как цистеиновые или гомоцистеиновые остатки, образующие дисульфидные или тиоэфирные связи, или другие аминокислотные остатки, способные образовывать циклизующий мостик, такие как аспарагиновая кислота и лизин, предпочтительно Х2 и Х4 представляют собой остатки цистеина или гомоцистеина, предпочтительно Х2 и Х4 образуют циклизующие мостики между друг другом или с Ra или Х6; и
Х5 представляет собой гидрофобную аминокислоту или ее производное, предпочтительно представляет собой тирозиновый, фенилаланиновый, 3-йодтирозиновый или нафтилаланиновый остаток, более предпочтительно фенилаланиновый или 3-йодтирозиновый остаток; и
Х6 представляет собой аминокислотный остаток, способный образовывать циклизующий мостик, предпочтительно тиолсодержащий аминокислотный остаток, предпочтительно цистеиновый или гомоцистеиновый остаток, предпочтительно Х6 образует циклизующий мостик с Ra, Х2 или Х4; и
Х7 представляет собой спейсерную или биомодифицирующую группировку или отсутствует, предпочтительно включает монодисперсный полиэтиленгликолевый (ПЭГ) структурный блок, содержащий от 1 до 10 единиц указанного структурного блока, причем указанный биомодификатор обладает функцией модифицировать фармакокинетику и почечный клиренс указанных агентов. Дополнительно Х7 также может представлять собой от 1 до 10 аминокислотных остатков, предпочтительно включающих глицин, лизин, аспарагиновую кислоту или серин. Х7 также может обозначать спейсер или биомодификатор, включающий как аминокислотные остатки, так и ПЭГ-подобную структуру, предпочтительно комбинацию бисаминоэтилэтиленгликоля и глицина. В предпочтительном воплощении Х7 представляет собой единицу, состоящую из монодисперсной ПЭГ-подобной структуры, 17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановой кислоты формулы (X)
где m равен целому числу от 1 до 10, и где С-конец представляет собой амидную или кислотную группировку. Обнаружено, что биомодификатор Х7 модифицирует фармакокинетику и скорость клиренса крови от этих соединений. Биомодификатор влияет на уменьшение поглощения соединений в ткани, т.е. мышце, печени и т.д., таким образом обеспечивая более хорошую диагностическую визуализацию ввиду меньшего влияния фона. Секреция в основном происходит через почки, и это является еще одним преимуществом данного биомодификатора.
Пептидное соединение содержит пептидный вектор, определенный аминокислотной последовательностью, образованной X1, Х2, Х3, G, D, Х4, X5 и Х6 формулы VIб, и этот пептид составляет нацеленный вектор, обладающий аффинностью к рецепторам интегрина, ассоциированным с ангиогенезом.
В зависимости от расположения циклизующих мостиков, соединения включают "дискретные", "гнездовые" или "взаимосвязанные" конфигурации. Предпочтительно два мостика в каждом из соединений находятся:
между Ra и Х6 и между Х2 и Х4 (образуя гнездовую конфигурацию);
между Ra и X2 и между Х4 и Х6 (дискретная конфигурация);
между Ra и Х4 и между Х2 и Х6 (образуя взаимосвязанную конфигурацию).
В предпочтительном воплощении один мостик образует тиоэфирную связь, а второй мостик образует дисульфидную связь.
В предпочтительном воплощении соединения по изобретению определены приведенными ниже формулами:
где Ra, Х3, G, D, Х5, и Х7 являются такими, как определено для формулы VIб;
X'1 содержит аминокислотный остаток с функциональной боковой цепью, такой как кислая или аминная группа, причем аминокислота предпочтительно выбрана из аспарагиновой или глутаминовой кислоты, гомолизина или диаминоалициклической кислоты, такой как лизин или диаминопропионовая кислота, более предпочтительно аспарагиновая кислота или лизин;
Х'2, Х'4 и Х'6 представляют собой аминокислотные остатки, образующие дисульфидную или тиоэфирную связь, например цистеины или гомоцистеины, (показаны дисульфидные и тиоэфирные связи);
W1 представляет собой спейсерную группировку или отсутствует, и предпочтительно представляет собой производное глутаровой и/или янтарной кислоты, и/или основанной на полиэтиленгликоле единицы, связывающей цианиновый репортерный краситель с пептидом. Другие типичные спейсерные (W1) элементы включают полисахариды структурного типа, полисахариды накапливаемого типа, полиаминокислоты, и их метиловые и этиловые эфиры, и полипептиды, олигосахариды и олигонуклеотиды, которые могут содержать или не содержать сайты расщепления ферментами. Роль спейсерной группировки W1 заключается в том, чтобы дистанционировать относительно объемный краситель от связывающегося с рецептором домена пептидного компонента;
h представляет собой положительное целое число 1 или 2;
и, когда присутствует по меньшей мере одна группа Z, Z представляет собой цианиновый краситель.
Соединения предпочтительно включают только одну группу Z.
Цианиновый краситель, обозначаемый Z, связан с X'1, W1, Х6 или Х7 пептидного вектора, например посредством образования амидной связи, сульфонамидной связи или тиоэфирной связи. Амидная связь, например, образуется в результате реакции между амином и карбоксильной группой, сульфонамидная связь, например, образуется в результате реакции между амином и активированной сульфоновой кислотой, а тиоэфирная связь, например, образуется в результате реакции между тиолом и галогенидом. X'1 пептидного вектора, содержащий по меньшей мере одну аминокислоту с функциональной боковой цепью, составляет предпочтительную точку присоединения цианинового красителя. Активные сложные эфиры цианиновых красителей, такие как NHS-эфиры, считаются особенно полезными при синтезе соединений, образующих амидную связь с пептидным вектором.
В предпочтительном аспекте соединения формулы VII-IX или их физиологически приемлемые соли имеют следующие характеристики:
Ra предпочтительно представляет собой -(CH2)-.
Кроме того, X'1 представляет собой аминокислотный остаток с функциональной боковой цепью, такой как кислота или аминогруппа, аминокислота предпочтительно выбрана из аспарагиновой или глутаминовой кислоты, гомолизина или диаминоалициклической кислоты, такой как лизин или диаминопропионовая кислота, более предпочтительно аспарагиновая кислота или лизин.
Х'2, Х'4 и Х'6 независимо предпочтительно представляют собой цистеиновый или гомоцистеиновый остаток.
Х3 предпочтительно представляет собой аргинин.
X5 предпочтительно представляет собой тирозин, фенилаланин, 3-иодтирозин или нафтилаланин, и более предпочтительно фенилаланин или 3-иодтирозин.
Х7 и W1 являются такими, как определено для формулы VIb. Предпочтительно Х7 содержит от 1 до 10 единиц монодисперсного ПЭГ структурного блока или отсутствует, а W1 предпочтительно отсутствует.
Z представляет собой цианиновый краситель или отсутствует, так что соединение содержит по меньшей мере одну группировку цианинового красителя.
В предпочтительном аспекте соединения представляет собой соединения формулы VII (гнездовая конфигурация) или их физиологически приемлемые соли, и более предпочтительно они имеют приведенные выше характеристики.
Любой из аминокислотных остатков, как определено в формуле VIб, предпочтительно может представлять собой встречающуюся в природе аминокислоту. В большинстве случаев предпочтительно, чтобы все аминокислоты в пептидном векторе находились в L-форме. Однако в некоторых воплощениях изобретения одна, две, три или более чем три аминокислоты в пептиде предпочтительно находятся в D-форме. Включение таких аминокислот в D-форме может оказывать значительный эффект на увеличение стабильности соединения в сыворотке крови.
Некоторые соединения по изобретению представляют собой высокоаффинные векторы RGD-типа. Используемый в данном описании термин "высокоаффинный вектор RGD-типа" относится к соединениям, которые имеют Ki менее 10 нМ и предпочтительно менее 5 нМ в конкурентном анализе связывания в отношении αvβ3 интегрина и где значение Ki определено путем конкуренции с известным высокоаффинным лигандом эхистатином. Способы осуществления таких конкурентных анализов хорошо известны в данной области техники.
Соединения, определенные в настоящем изобретении, неожиданно стабильны in vivo и в условиях, используемых при мечении с использованием цианинового красителя.
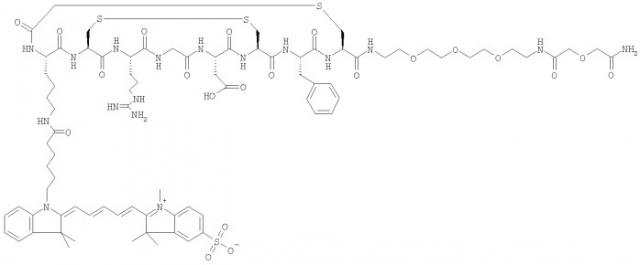
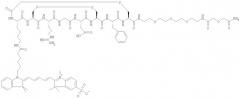
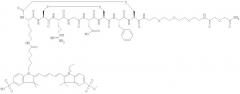
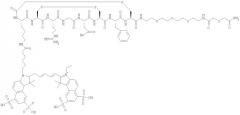
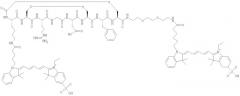
Некоторые примеры соединений по изобретению проиллюстрированы ниже. Соединения А, Б и В включают пентаметина карбацианин с соответственно одной, двумя или четырьмя группами сульфоновой кислоты, конъюгированными с RGD-содержащим пептидом (Lys-Cys-Arg-Gly-Asp-Cys-Phe-Cys). Соединения А и Б включают краситель Cy5, тогда как соединение В включает краситель Cy5.5:
Соединение А:
Соединение Б:
Соединение В:
Соединение Г:
Соединение содержит пептид RGD-типа (Lys-Cys-Arg-Gly-Asp-Cys-Phe-Cys), связанный с двумя группами цианинового красителя (Cy5).
Соединение Д: Соединение содержит пептид Lys-Cys-Arg-Gly-Asp-Cys-Phe-Cys, связанный с индоцианиновым зеленым (ICG).
Соединение Е: Соединение содержит пептид Lys-Cys-Arg-Gly-Asp-Cys-Phe-Cys, связанный с Сy3В.
Соединение Ж: Соединение содержит пептид Lys-Cys-Arg-Gly-Asp-Cys-Phe-Cys, связанный с Cy5, где R1 представляет собой алкил, замещенный аммониевой группой.
Соединение 3: Пептидное соединение, представленное ниже, содержащее пептид Asp-Cys-Arg-Gly-Asp-Cys-Phe-Cys, может быть связано с цианиновым красителем посредством образования связи между аспарагиновой кислотой (X1) с амино-функционализированным цианиновым красителем или путем реакции NHS-эфира цианинового красителя с амино-ПЭГ, расположенным в Х7.
Соединение И: Соединение содержит пептид Lys-Asp-Cys-Arg-Gly-Asp-Cys-Phe-Cys-Gly, связанный с Cy5.
Соединение K: c[-Asp-D-Phe-Lys(Cy5.5)-Arg-Gly-]
Новые соединения по изобретению могут быть использованы в качестве контрастных агентов в оптической визуализации или при лечении заболеваний. Предпочтительным воплощением изобретения являются соединения, описанные для применения в оптической визуализации и предпочтительно для диагностики заболеваний, связанных с ангиогенезом.
Соединения по изобретению полезны в качестве визуализирующих агентов в детекции ангиогенеза у людей и животных. Продукты также могут быть полезны в доклинических моделях животных и позволяют контролировать терапевтическую эффективность новых лекарственных средств в фармацевтическом исследовании, например, в онкологии.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая эффективное количество соединения по изобретению или его соли, например количество, эффективное для усиления контрастности изображения при in vivo визуализации, вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями.
Кроме того, в изобретении предложена фармацевтическая композиция для лечения заболевания, содержащая эффективное количество соединения или его соли вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями. Композиция может быть использована в лечении заболеваний, связанных с ангиогенезом, например путем фотодинамической терапии.
В соответствии с еще одним аспектом в изобретении предложено применение соединения по изобретению для изготовления контрастного агента для оптической визуализации для применении в способе диагностики, при котором указанный контрастный агент вводят в организм человека или животного и получают изображение по меньшей мере части указанного организма.
Таким образом предполагается, что применение соединений в изготовлении терапевтических композиций (лекарств) и в способах терапевтического или профилактического лечения организма человека или животного, предпочтительно лечения заболеваний, связанных с ангиогенезом, представляет собой дополнительные аспекты изобретения.
В соответствии с еще одним аспектом в изобретении предложен способ получения изображения организма человека или животного путем оптической визуализации, при которой в указанный организм, например в сосудистую систему, вводят контрастный агент и получают изображение по меньшей мере части указанного организма, в которой распределен указанный контрастный агент, где в качестве указанного контрастного агента используют описанное соединение.
В соответствии с еще одним аспектом изобретения предложен способ получения улучшенных изображений организма человека или животного путем оптической визуализации предварительно введенной композиции с контрастным агентом, содержащей соединение, как оно определено, при котором получают изображение по меньшей мере части указанного организма.
В соответствии с еще одним аспектом в изобретении предложен способ контроля за эффектом лечения организма человека или животного лекарством для борьбы с состоянием, ассоциированным с ангиогенезом, при котором в указанный организм вводят описанное соединение и детектируют захват указанного агента клеточными рецепторами, предпочтительно рецепторами эндотелиальных клеток, в частности рецепторами αvβ3, причем указанное введение и детекцию возможно, но предпочтительно, осуществляют неоднократно, например перед, во время и после лечения указанным лекарственным средством. Указанная детекция включает метод оптической визуализации.
Контрастные агенты по изобретению предназначены для применения при оптической визуализации. Любой способ, который позволяет получать изображение для диагностики заболевания, наблюдения за развитием заболевания или наблюдения за ходом лечения заболевания, основанный на взаимодействии со светом электромагнитного спектра в диапазоне от ультрафилетового до ближнего инфракрасного излучения, охвачен термином оптическая визуализация. Оптическая визуализация включает все способы, от непосредственной визуализации без применения какого-либо устройства и применения устройств, таких как различные индикаторы, катетеры и оборудование для оптической визуализации, например компьютерное оборудование для томографического представления. Контрастные агенты полезны в способах оптической визуализации и методиках изменения, включая, без ограничения ими: люминесцентную визуализацию; эндоскопию; флуоресцентную эндоскопию; оптическую когерентную томографию; визуализацию на основе светопропускания; визуализацию на основе светопропускания с разрешением по времени; конфокальную визуализацию; нелинейную микроскопию; фотоакустическую визуализацию; акустико-оптическую визуализацию; спектроскопию; отражательную спектроскопию; интерферометрию; когерентную интерферометрию; диффузную оптическую томографию и флуоресцентно-опосредованную диффузную оптическую томографию (непрерывно-волновые системы, системы с временными интервалами и частотными областями), и измерение светорассеяния, абсорбции, поляризации, люминесценции, длительности существования флуоресценции, квантового выхода и гашения. Предпочтительными являются способы оптической диагностической визуализации, основанные на флуоресцентной идентификации или измерениях.
Пептидные векторы соединений по настоящему изобретению можно синтезировать с использованием известных способов химического синтеза и особенно полезным является твердофазный способ Merrifield, используемый в автоматическом пептидном синтезаторе (J. Am. Chem. Soc, 85:2149 (1964)). Кроме того, связывание цианинового красител