Способ комбинированного иммунологического исследования клеток с помощью биочипа
Иллюстрации
Показать всеСпособ комбинированного иммунологического исследования клеток с помощью биочипа включает инкубирование биочипа, содержащего иммобилизованные антитела, с суспензией клеток, отмывку биочипа от несвязавшихся клеток, определение коэкспрессии антигенов на связанных клетках. Оценку полученного результата проводят путем определения наличия связывания клеток в области пятен биочипа и плотности связывания клеток и интерпретацию полученного результата. Определение коэкспрессии антигенов на связанных с биочипом клетках проводят путем осуществления одной или нескольких иммуноцитохимических реакций. При считывании результата дополнительно проводят морфологическое исследование связанных с биочипом клеток и определяют наличие и характер окрашивания клеток и их компонентов продуктом реакции. Использование способа по изобретению обеспечивает высокую надежность и информативность анализа. 8 з.п. ф-лы, 6 ил.
Реферат
Изобретение относится к области медицины и может быть использовано для диагностических целей в гематологии, онкологии и других отраслях медицины, а также в ветеринарии и биологии.
Известен способ определения поверхностных антигенов клеток с помощью биочипов (см. Liu A.Y. Differential Expression of Cell Surface Molecules in Prostate Cancer Cells // Cancer Research. 2000, Vol.60., p.3429-3434), взятый в качестве аналога, заключающийся в том, что биочип (представляющий собой подложку с иммобилизованными в строго определенных участках антителами, каждое из которых специфично к определенному клеточному поверхностному антигену) инкубируют с суспензией клеток. Клетки, имеющие на своей поверхности соответствующие антигены, связываются с антителами, иммобилизованными в строго определенных участках биочипа (пятнах), остальные клетки не специфически связываются с ее поверхностью. Затем биочип отмывают от не специфически связавшихся клеток путем ополаскивания буферным раствором. В результате на поверхности биочипа остаются только те клетки, которые связались с антителами. Осуществляют считывание результата, определяя, в каких пятнах биочипа произошло связывание клеток. Способ позволяет одновременно определять на разных клетках большое количество различных поверхностных антигенов. Максимально возможная панель антител, которая может быть размещена на одном биочипе, ограничивается только размерами подложки и размерами участков (пятен) биочипа, в которых иммобилизованы антитела.
Недостатком данного способа является то, что на каждой отдельно взятой клетке по факту связывания в том или ином пятне биочипа может быть определен только один антиген. Невозможность определения большего числа антигенов (коэкспрессии) на каждой отдельно взятой клетке снижает диагностическую ценность анализа и может быть причиной ошибок. Кроме того, способ не предусматривает проведения морфологического исследования клеток, что не позволяет их идентифицировать.
Известен способ исследования клеток с помощью иммунологических биочипов (см. Belov L, de la Vega О, dos Remedies C.G., Mulligan S.P., Christopherson R.I. Immunophenotyping of leukemias using a cluster of differentiation antibody microarray // Cancer research, - 2001. - Vol.61. - P.4483-4489), заключающийся в том, что биочип, содержащий иммобилизованные антитела, инкубируют с суспензией клеток. Клетки, имеющие на своей поверхности соответствующие антигены, связываются с антителами, иммобилизованными в строго определенных участках подложки. Затем биочип отмывают от клеток, не связавшихся с иммобилизованными антителами. После этого инкубируют биочип с раствором антител, конъюгированных с флуорохромом, осуществляют отмывку. Определяют плотность заполнения пятен биочипа связавшимися клетками. Для определения коэкспрессии антигенов исследуют биочип, например, с помощью люминесцентного микроскопа. При этом в пятнах биочипа определяют наличие (или отсутствие) флюоресцирующих клеток и оценивают их количество. Затем осуществляют интерпретацию полученного результата.
Недостатком способа, взятого в качестве прототипа, является необходимость использования дорогостоящего оборудования.
Недостатком также является сама необходимость использования ультрафиолетового излучения, обусловленная использованием флюоресцирующих меток. Под действием ультрафиолетового излучения происходит быстрое уменьшение флюоресценции меток («выцветание») за счет их разрушения. Биочип не может исследоваться повторно спустя сколько-нибудь продолжительное время.
Кроме того, при проведении считывания результата невозможно проведение морфологического исследования клеток (возможно только установление локализации метки и в некоторых случаях оценка размеров клеток). Это не позволяет идентифицировать клетки на основании морфологических признаков и резко снижает информативность способа.
Все вышеперечисленное ограничивает использование данного способа.
Задачей заявленного изобретения является: повышение надежности и информативности анализа при снижении его себестоимости и возможности выполнения без использования дорогостоящего оборудования.
Поставленная задача решается за счет того, что согласно способу комбинированного иммунологического исследования клеток с помощью биочипа, включающего инкубирование биочипа, содержащего иммобилизованные антитела, с суспензией клеток, отмывку биочипа от несвязавшихся клеток, определение коэкспрессии антигенов на связанных клетках, считывание полученного результата, включающее определение наличия связывания клеток в области пятен биочипа и определение плотности связывания клеток, и интерпретацию полученного результата, определение коэкспрессии антигенов на связанных с биочипом клетках выполняют путем осуществления одной или нескольких иммуноцитохимических реакций, при считывании результата дополнительно проводят морфологическое исследование связанных с биочипом клеток, и определяют наличие и характер окрашивания клеток и их компонентов продуктом реакции.
Осуществляют дополнительное окрашивание клеток, не препятствующее обнаружению продукта (продуктов) ферментативной реакции.
Для исследования одного образца клеточной суспензии используют несколько биочипов, на которых осуществляют иммуноцитохимическое исследование клеток с помощью антител, специфичных к различным антигенам.
Осуществляют морфометрическое исследование связанных с биочипом клеток.
При проведении анализа используют один или несколько дополнительных контрольных биочипов.
Обрабатывают биочип одним или несколькими растворами, содержащими одно или несколько веществ, вызывающих повышение прочности связывания клеток с поверхностью биочипа.
Из биочипа приготовляют долговременный препарат для микроскопических исследований.
На биочип или изготовленный из него долговременный препарат наносят разметку, облегчающую нахождение нужных пятен.
При проведении анализа используют, один или несколько дополнительных биочипов, на которых выполняют окрашивание связанных клеток для их последующего морфологического исследования, при этом иммуноцитохимическую реакцию не осуществляют.
Использование заявленного способа позволяет определять наличие или отсутствие коэкспрессии антигенов на каждой отдельно взятой связавшейся с биочипом клетке. При этом определяется на один антиген больше, чем при проведении иммуноцитохимического исследования без использования биочипа. Иммуноцитохимическое (иммуноферментное) исследование связанных с биочипом клеток может быть выполнено при использовании прямого метода (см. например, Петров С.В., Райхлин И.Т. Руководство по иммуноцитохимической диагностике опухолей человека, издание 3-е, переработанное, Казань: Титул, 2004. - с.21). Такое исследование является наименее трудоемким и требует меньших затрат времени и реактивов, но дает менее интенсивное окрашивание клеток продуктами реакции. Иммуноцитохимическое исследование связанных с биочипом клеток также может быть выполнено с использованием любого непрямого иммунохимического метода или с помощью методов EPOS, En Vision, CSA (см. например, Петров С.В., Райхлин И.Т. Руководство по иммуноцитохимической диагностике опухолей человека, издание 3-е, переработанное, Казань: Титул, 2004. - с.22-25). В этом случае выполнение данного этапа анализа является более длительным и трудоемким, но за счет большей интенсивности окрашивания клеток продуктом реакции возрастает чувствительность, что позволяет определять слабо экспрессированные антигены. В ряде случаев требуется определение наличия или отсутствия коэкспрессии не двух, а, например, трех антигенов на каждой клетке. В этом случае используется двойное цитохимическое окрашивание, в основе которого лежит различная цветовая визуализация двух различных антигенов (третий антиген определяется по факту связывания клетки в области того или иного пятна биочипа). Для этого осуществляется проведение двух иммуноцитохимических реакций (возможные сочетания иммуноцитохимических методов: прямой/прямой, прямой/непрямой, непрямой/непрямой метод, двойной EPOS-метод, двойной En-Vision метод). (См. например, Петров С.В., Райхлин И.Т. Руководство по иммуноцитохимической диагностике опухолей человека, издание 3-е, переработанное, Казань: Титул, 2004. - с.25-27). По такому же принципу возможно определение и большего числа антигенов.
Использование иммуноферментных реакций позволяет исключить недостатки, характерные для иммунофлюоресцентного анализа: выцветание метки, невозможность повторного проведения исследования и другие. При этом для осуществления исследования предлагаемым способом не требуется дорогостоящее оборудование. Исследование клеток на биочипе может осуществляться с помощью обычного светового микроскопа. Микроскопическое исследование может проводиться многократно и через продолжительное время после выполнения иммоноцитохимической реакции без искажения результатов.
При морфологическом исследовании могут быть определены форма и размеры клеток и их ядер и других структур, а также другие признаки. Определяется не только наличие окрашивания клеток продуктом реакции, но и его характер (интенсивность окрашивания, локализация окрашенного продукта), позволяющий оценивать на каких именно структурах клетки располагается определяемый антиген и оценивать его количество.
Для более полноценного морфологического исследования может быть осуществлено дополнительное окрашивание связанных с биочипом клеток, не препятствующее обнаружению продукта (продуктов) иммуноцитохимической реакции. Например, при использовании в качестве хромогена 3-диаминобензидин тетрахлорида (ДАБ), возможно выполнение окраски по Романовскому-Гимзе или окрашивание гематоксилином (фиг.2). В результате значительно повышается информативность исследования. Становится возможным выявление различных субпопуляций среди клеток, связавшихся в любом из пятен биочипа (и, следовательно, имеющих тот или иной поверхностный антиген). При этом субпопуляции клеток могут быть определены как на основании результатов определения коэкспрессии антигенов с помощью иммуноцитохимической реакции, так и на основании результатов морфологического исследования. При обработке результатов может быть количественно определено содержание клеток, относящихся к той или иной субпопуляции. Может быть определена их доля от количества клеток, связавшихся в данном пятне биочипа, или от общего количества клеток.
В ряде случаев требуется определение нескольких вариантов коэкспрессии антигенов, которое не может быть выполнено на одном биочипе. В этом случае может быть использовано несколько биочипов, на которых осуществляются иммуноцитохимические реакции (одна или несколько) с использованием нескольких конъюгированных с ферментом антител, специфичных к разным антигенам.
Может осуществляться морфометрическое исследование связавшихся клеток, что существенно повышает информативность анализа. Данный подход может быть использован в научно-исследовательских целях.
Для исключения ошибок при проведении анализа одного и того же образца могут быть использованы дополнительные контрольные биочипы (один или несколько). Например, могут быть использованы биочипы, содержащие антитела, специфичные к другим эпитопам антигенов, выявляемых с помощью первого биочипа. В этом случае сопоставление результатов, получаемых с помощью основного и контрольных биочипов (одного или нескольких), позволяют исключить ошибки, связанные с перекрестной реактивностью антител, а также ошибки, связанные с потерей активности используемых антител. Для исключения ошибок, связанных с иммуноцитохимическим окрашиванием препарата, могут быть использованы контрольные биочипы, на которых связанные клетки фиксируют иным способом (например, используют фиксацию абсолютным этанолом вместо ацетона или наоборот) или применяют иную цитохимическую реакцию или используют иной хромоген. Возможно также проведение различных положительных и отрицательных контролей для определения специфичности связывания с клеточными антигенами антител, используемых в цитохимической реакции (реакциях).
После отмывки от не связавшихся с антителами клеток в некоторых случаях может выполняться обработка биочипа веществами, повышающими прочность связывания с поверхностью биочипа оставшихся клеток. Это повышает точность анализа, поскольку позволяет предотвратить отрыв клеток при выполнении последующих манипуляций и исключить ложно отрицательные результаты. Использование данного подхода также повышает чувствительность анализа, поскольку позволяет исследовать клетки, слабо связанные с иммобилизованными антителами (например, из-за низкой экспрессии соответствующих антигенов).
Приготовление из биочипа долговременного препарата позволяет многократно осуществлять морфологическое исследование связанных клеток с использованием иммерсионных объективов без загрязнения последних и без повреждения поверхности биочипа и связанных на ней клеток. Такой подход является весьма полезным, например, в тех случаях, когда для верной интерпретации результата может потребоваться просмотр препарата несколькими специалистами. Кроме того, это позволяет проводить сравнительное исследование клеток одного и того же больного, подвергнутых анализу с помощью разных биочипов в разное время. Это может оказаться весьма полезным, например, для оценки динамики развития заболевания или для оценки результатов лечения. Приготовление долговременного препарата позволяет хранить биочип неограниченное время и делает его намного более устойчивым к различным повреждениям. Возможно приготовление долговременного препарата различными способами. При этом необходимо учитывать, что использование данного подхода возможно, если применяемые для этого вещества не приводят к растворению продукта (продуктов) ферментативной реакции.
На биочип или изготовленный из него долговременный препарат может быть нанесена разметка (фиг.6), облегчающая нахождение и идентификацию пятен и позволяющая избежать возможных ошибок, например, при неавтоматизированном считывании результата.
В ряде случаев проведение дополнительной окраски биочипа наиболее предпочтительным для осуществления морфологического исследования клеток способом препятствует обнаружению продукта реакции. Например, при использовании не ДАБ, а некоторых других хромогенов выполнение окраски по Романовскому-Гимзе препятствует обнаружению продукта реакции. В этих случаях при проведении анализа могут быть использованы один или несколько дополнительных биочипов, на которых выполняют одно только окрашивание связанных клеток, необходимое для проведения морфологического исследования. Иммуноцитохимические реакции при этом не осуществляют. Результаты исследования клеток, полученные с помощью дополнительного биочипа (биочипов), сравнивают с результатами исследования клеток, полученных с помощью биочипа (биочипов), на котором осуществлялось проведение цитохимической реакции. Это повышает надежность анализа и позволяет избежать возможных противоречий между результатами иммунофенотипирования и результатами морфологического исследования.
Предлагаемый способ может использоваться в различных модификациях, пригодных как для клинических исследований, так и для решения различных научно-исследовательских и иных задач.
Заявленный способ поясняется чертежами (фиг.1-6).
Фиг.1 - микрофотография фрагмента биочипа, включающего пятна с иммобилизованными антителами. В области пятен связались клетки, выделенные из крови больной хроническим В-лимфолейкозом (В-ХЛЛ). Плотность связывания клеток в области пятен с различными антителами неодинакова. Увеличение в 17,5 раз.
Фиг.- 2 микрофотографии клеток больной хроническим В-лимфолейкозом (В-ХЛЛ), связавшихся на биочипе в области пятна с антителами анти-CD23. Иммуноцитохимически определена экспрессия антигена CD19. Характер окраски клеток продуктом реакции свидетельствует о поверхностной локализации антигена CD19. Таким образом, обнаруживается коэкспрессия CD19/CD23, характерная для клеток хронического В-лимфолейкоза. Ядра клеток докрашены гематоксилином. Увеличение в 400 раз.
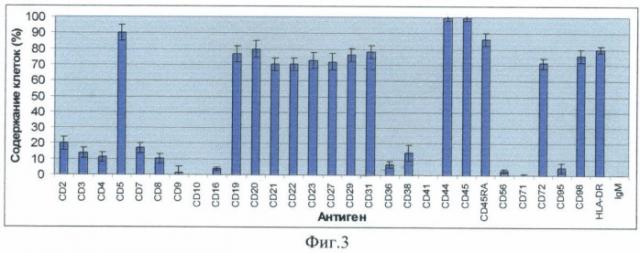
Фиг.3 - диаграмма, отражающая результат определения содержания в исследуемой суспензии клеток, экспрессирующих различные поверхностные антигены. С помощью биочипа исследовались клетки, выделенные из периферической крови больной хроническим В-лимфолейкозом (В-ХЛЛ).
Фиг.4 - диаграмма, отражающая результат определения содержания в исследуемой суспензии клеток, экспрессирующих различные поверхностные антигены. С помощью биочипа исследовались клетки, выделенные из периферической крови здорового человека.
Фиг.5 - микрофотография клеток больной хроническим В-лимфолейкозом (В-ХЛЛ), связанных на дополнительном биочипе в области пятна с антителами анти-CD19. Окраска по Романовскому-Гимзе. Увеличение в 900 раз.
Фиг.6 - фотография участка изготовленного из биочипа долговременного препарата, на который перед проведением неавтоматизированного считывания результата нанесена разметка, облегчающая нахождение нужных пятен. Разметка в виде сетки разделяет пятна биочипа на группы в виде «рядов» и «столбцов». Это позволяет избежать ошибок при последовательном фотографировании пятен биочипа через микроскоп. В данном случае разметка нанесена вручную. Увеличение в 3 раза.
Заявленный способ осуществляется следующим образом. Перед проведением анализа биочип (представляющий собой прозрачную пластину, на которой в строго определенных участках (пятнах) иммобилизованы антитела, специфичные к поверхностным антигенам клеток) закрепляют в какой-либо емкости, например в чашке Петри, контейнере или кювете. Вместо этого биочип может быть закреплен в проточной камере (см. Шишкин А.В., Шмырев И.И., Кузнецова С.А., Овчинина Н.Г., Бутылин А.А., Атауллаханов Ф.И., Воробьев А.И. Иммунологические биочипы для исследования эритроцитов человека, Биологические мембраны, 2008, том 25, № 4, с. 267-276). Осуществляют инкубацию биочипа с исследуемой клеточной суспензией. Клетки оседают на поверхность биочипа и приходят в контакт с иммобилизованными антителами. Если клетки имеют соответствующие поверхностные антигены, происходит их связывание в данных участках (пятнах) поверхности биочипа. Затем осуществляют отмывку биочипа для устранения клеток, не связавшихся с антителами. Если биочип находится в проточной камере, отмывка осуществляется путем пропускания над поверхностью биочипа потока промывочного раствора с заданной скоростью. Если биочип находится в чашке Петри, кювете (контейнере) или иной емкости, его отмывка может осуществляться путем ополаскивания промывочным раствором или путем многократного помещения (погружения) в данный раствор. После завершения отмывки в области пятен биочипа остаются связанными только те клетки, которые имеют соответствующие поверхностные антигены. Контроль качества отмывки осуществляется с помощью микроскопического исследования. Отмывка считается завершенной, если за пределами пятен биочипа (в фоновых участках) связанные клетки отсутствуют.
После завершения отмывки от не вязавшихся с антителами клеток в некоторых случаях (например, при использовании проточных камер с узким капилляром для предотвращения отрыва клеток в момент заполнения капилляра воздухом перед извлечением биочипа) может быть проведена обработка биочипа растворами веществ, повышающими прочность связывания оставшихся клеток с его поверхностью. При работе с лейкоцитами при использовании биочипа, изготовленного на пластиковой подложке, может быть использована, например, инкубация (10-20 минут) с раствором, содержащим соли кальция и магния, ионы которых участвуют в процессах адгезии клеток к твердым поверхностям. При выборе используемых веществ необходимо учитывать, что проведение такой обработки не должно препятствовать выполнению последующих этапов исследования, в первую очередь проведению иммуноцитохимической реакции (реакций). После проведения такой обработки биочип промывают изотоническим буферным раствором.
Затем биочип извлекают из емкости (или проточной камеры), где выполнялись предыдущие этапы анализа. Если не предусмотрено повторное использование емкости, биочип можно из нее не извлекать и проводить в ней все последующие манипуляции, связанные с обработкой биочипа используемыми растворами.
Затем связавшиеся с биочипом клетки фиксируют. Для этого, например, биочип высушивают (оптимальное время высушивания на воздухе - 1 час) и в течение 1-3 минут обрабатывают в абсолютном ацетоне при +4°С. Возможно также проведение фиксации биочипа со связанными клетками абсолютным этанолом (10-15 минут) с последующим высушиванием. При использовании выбранного способа фиксации не должно происходить растворения подложки биочипа или потери ее прозрачности под действием фиксирующего вещества.
Далее осуществляют проведение иммуноцитохимической реакции (реакций) любым известным способом. При этом возможно как проведение одной иммуноцитохимической реакции, так и выполнение двойного иммуноцитохимического окрашивания (см., например, Петров С.В., Райхлин И.Т. Руководство по иммуноцитохимической диагностике опухолей человека, издание 3-е, переработанное, Казань: Титул, 2004. - с.21-27). Возможно выполнение и большего числа иммуноцитохимических реакций на клетках, связанных с одним биочипом, но такой подход является излишне трудоемким.
В случае использования иммуноцитохимического метода EnVision для проведения одной иммуноцитохимической реакции последовательность действий будет следующей.
Проводят обработку 3% раствором перекиси водорода в течение 10 минут, после чего дважды отмывают биочип буферным раствором (TBS) по 5 минут. Затем в течение 20 минут инкубируют биочип с раствором неиммунной сыворотки для блокирования неспецифического связывания антител. Затем удаляют избыток сыворотки и в течение 40 минут инкубируют с раствором первичных антител, после завершения инкубации биочип ополаскивают буфером и еще дважды отмывают его TBS (по 5 минут). Затем удаляют остаток жидкости и добавляют реагент EnVision, представляющий собой макромолекулы полимера, конъюгированные с молекулами вторичных антител и молекулами фермента, в данном случае пероксидазы хрена. В течение 40 минут проводят инкубацию. Затем биочип ополаскивают буфером и еще дважды отмывают его TBS (по 5 минут). После чего проводят инкубирование биочипа с раствором ДАБ, которое осуществляется в темноте в течение 5-10 минут (при определении некоторых антигенов оптимальное время инкубации может отличаться в большую или меньшую сторону). Отмывают биочип дистиллированной водой и при необходимости высушивают. Можно провести дополнительное окрашивание клеток, например, гематоксилином или по Романовскому-Гимзе (в последнем случае предпочтительна фиксация ацетоном). Такое окрашивание клеток в данном случае не препятствует обнаружению продукта иммуноцитохимической реакции (при использовании хромогена ДАБ), если не произошло «перекрашивания препарата». Следует заметить, что при проведении дополнительного окрашивания по Романовскому-Гимзе необходимо тщательно выдерживать установленное время обработки биочипа красителем, поскольку «перекрашивание» начинает мешать обнаружению продукта реакции. Оптимальное время инкубации биочипа с красителем (красителями) подбирается экспериментально, поскольку может быть разным для разных партий красителя, а также зависит от концентрации раствора красителя. После проведения дополнительного окрашивания биочип ополаскивают дистиллированной водой.
В ряде случаев может потребоваться определение коэкспрессии нескольких пар (или групп) антигенов, которое не может быть выполнено на одном биочипе. В этом случае может быть использовано несколько биочипов, на которых иммуноцитохимически определяют разные антигены. При этом также может быть использован любой иммуноцитохимический метод. При необходимости также может быть выполнено дополнительное окрашивание.
Затем из биочипа может быть приготовлен долговременный препарат. Для этого на поверхность предметного стекла (или прозрачной пластины из иного материала) наносят каплю канадского бальзама (или иного вещества с подобными свойствами, например, жидкости для приготовления гистологических препаратов «Shandon-Mount»; производитель - «Thermo-electron corporation», США, Pitsburg). Сверху накладывают биочип (стороной со связавшимися клетками вверх) и прижимают таким образом, чтобы между ним и стеклом не оставалось пузырей воздуха. Затем на поверхность биочипа наносят еще одну порцию канадского бальзама. Сверху накладывают и таким же образом прижимают покровное стекло. Препарат помещают под груз или пресс до затвердевания канадского бальзама. Приготовление долговременного препарата возможно, если используемые для этого вещества не приводят к растворению продукта (продуктов) ферментативной реакции. Например, описанный выше вариант методики приготовления долговременного препарата может быть применен при использовании ДАБ в качестве хромогена. Возможно приготовление долговременного препарата и другими способами.
Далее при необходимости на биочип или изготовленный из него долговременный препарат может быть нанесена разметка (фиг.6), облегчающая нахождение нужных пятен при неавтоматизированном считывании результата. Например, в простейшем случае могут быть проведены линии, разделяющие пятна биочипа на группы (например, ряды и столбцы), что позволяет в последующем избежать ошибок при последовательном фотографировании пятен биочипа через микроскоп.
Затем осуществляют считывание результата, для этого получают изображение пятен и фоновых участков биочипа (фиг.1), (например, в простейшем случае путем фотографирования через микроскоп) и определяют плотность связывания клеток (количество клеток, связавшихся на участке поверхности биочипа заданной площади) в области пятен биочипа и фоновых участков. В зависимости от целей анализа может проводиться качественное, полуколичественное или количественное определение содержания в исследуемой суспензии клеток, имеющих данные поверхностные антигены. Для количественного определения плотности связывания клеток в простейшем случае может быть использован прямой подсчет клеток в области заданных участков поверхности биочипа. Например, на фотографиях пятен биочипа могут быть выбраны участки заданной площади, на которых осуществляют подсчет клеток. Данный процесс может быть автоматизирован.
Далее определяют содержание в исследуемой суспензии клеток, имеющих определяемые (с помощью биочипа) поверхностные антигены (фиг.3, 4). Для этого плотность связывания клеток в области того или иного пятна выражают в процентах относительно принимаемой за 100% максимально возможной при данных условиях плотности связывания (определяемой, например, расчетным путем) или относительно плотности связывания клеток в области пятна с антителами, способными связываться со всеми исследуемыми клетками (например, с антителами анти-CD45 при исследовании суспензий лейкоцитов). Получаемые при этом значения хорошо соответствуют фактическому содержанию в суспензии клеток, имеющих определяемые поверхностные антигены. Использование данного подхода возможно, если инкубация биочипа с клеточной суспензией осуществлялась без перемешивания или подачи потока жидкости, а размеры клеток, относящихся к различным субпопуляциям, достаточно близки.
Далее осуществляют морфологическое исследование клеток, связавшихся в области каждого пятна биочипа. При этом определяют морфологические признаки, необходимые для идентификации клеток, определяют их окрашивание продуктом иммуноцитохимической реакции (реакций) и оценивают его особенности (интенсивность, локализацию). Морфологическое исследование может быть выполнено как без автоматизации (например, путем просмотра препарата под микроскопом или путем изучения микрофотографий клеток, связавшихся в области пятен биочипа), так и с использованием автоматизации (например, при использовании компьютерных программ, распознающих изображение и осуществляющих его анализ). При необходимости может также осуществляться морфометрическое исследование связавшихся клеток. В случае, если из биочипа был приготовлен долговременный препарат, проведение его микроскопического исследования возможно как с применением объективов, не приходящих в контакт с поверхностью препарата, так и с применением иммерсионных объективов.
При проведении микроскопического исследования в каждом пятне биочипа на участках заданной площади может быть определено количество клеток, окрашенных продуктом реакции и, следовательно, экспрессирующих соответствующий антиген совместно с антигеном, определенным по связыванию клетки в данном пятне биочипа. Аналогично может быть определено число клеток, имеющих какой-либо другой отличительный (морфологический, иммуноцитохимический или морфометрический) признак. Может быть определена доля таких клеток от числа клеток, связавшихся в данном пятне на участке заданной площади, или расчетным путем определено их процентное содержание в исследуемом образце клеточной суспензии.
В некоторых случаях при проведении исследования требуется использование дополнительных биочипов.
1) В ряде случаев необходимо использование дополнительных контрольных биочипов (одного или нескольких), на которых осуществляется только окраска клеток, необходимая для выполнения их морфологического исследования. Иммуноцитохимическую реакцию при этом не проводят. Этот подход может быть использован, например, в том случае, если проведение окрашивания наиболее приемлемым для морфологического исследования способом препятствует обнаружению продукта реакции, образующегося при использовании выбранного хромогена, или в случае, когда требуется использование нескольких видов дополнительной окраски. При обработке результатов сопоставляют данные, полученные с помощью основного и дополнительных биочипов. Проведение морфологического исследования на дополнительном биочипе (биочипах) повышает надежность анализа и позволяет избежать возможных противоречий.
2) Дополнительные биочипы могут быть использованы для контроля. При этом количество используемых контрольных биочипов и условия проведения контрольных исследований зависят от поставленных задач (оценка специфичности связывания клеток с иммобилизованными на биочипе антителами, воспроизводимость исследования, контроль осуществления иммуноцитохимических реакций, положительный и отрицательный контроль при проведении иммуноцитохимических реакций и другие) и могут быть индивидуальными в каждом конкретном случае.
Заявленное изобретение направлено на повышение надежности способа, снижение себестоимости выполнения анализа, достижение возможности выполнения исследования в лабораториях, не располагающих дорогостоящим оборудованием, повышение информативности и диагностической ценности результатов анализа, а также на достижение возможности длительного сохранения биочипов, на которых был выполнен анализ, для проведения повторных микроскопических исследований.
Примеры использования способа.
Пример 1
Были исследованы клетки больной А., 61 год, со зрелоклеточным лимфопролиферативным заболеванием, сопровождающимся поражением костного мозга. При исследовании мазка крови было отмечено повышенное содержание зрелых лимфоцитов. Необходимо было определить Т- или В-клеточную природу опухоли и определить ее нозологическую форму. Для этого нужно было определить иммунофенотип опухолевых клеток.
Использовался набор из 3 биочипов, содержащих иммобилизованные антитела (IgG), специфичные к антигенам: CD2, CD3, CD4, CD5, CD7, CD8, CD9, CD10, CD16, CD19, CD20, CD21, CD22, CD23, CD27, CD29, CD31, CD36, CD38, CD41, CD44, CD45, CD45RA, CD56, CD71, CD72, CD95, CD98, HLA-DR, IgM.
Лейкоцитарная фракция клеток была выделена путем центрифугирования на градиенте плотности. Выделенные клетки были ресуспензированы в рабочем растворе. Биочипы закрепляли в кюветах. Заполняли кюветы клеточной суспензией и инкубировали в течение 40 минут без какого-либо перемешивания.
Затем биочипы (которые при этом оставались в кюветах) ополаскивали отмывочным раствором для устранения не связавшихся с антителами клеток. Контроль качества отмывки осуществлялся с помощью микроскопии. Биочипы обрабатывали абсолютным этанолом в течение 10 минут и высушивали.
Далее проводили иммуноцитохимическую реакцию методом EnVision (ход реакции описан выше) по следующей методике: 1) обработка 3% раствором перекиси водорода в течение 10 минут; 2) ополаскивание буфером (TBS) с последующей двукратной отмывкой TBS по 5 минут; 3) инкубация с раствором первичных антител, специфичных к определяемому антигену, в течение 40 минут; 4) ополаскивание буфером (TBS) с последующей двукратной отмывкой TBS по 5 минут; 5) удаление остатка жидкости; 6) инкубация биочипа с реагентом EnVision («Daco», USA) в течение 40 минут; 7) инкубирование биочипа с раствором хромогена ДАБ в темноте в течение 10 минут; 8) отмывка биочипа дистиллированной водой и высушивание.
На клетках, связанных с биочипом № 1, проводили иммуноцитохимическое определение антигенов CD19.
На клетках, связанных с биочипом №2, проводили иммуноцитохимическое определение антигенов CD2.
Для окрашивания ядер у связанных клеток биочипы № 1 и № 2 дополнительно обрабатывали гематоксилином.
Биочип № 3 никакими реагентами, необходимыми для осуществления иммуноцитохимического исследования, не обрабатывали. Вместо этого после осуществления отмывки от не связавшихся с антителами клеток его фиксировали метанолом (15 минут) и окрашивали по Романовскому-Гимзе, для чего в течение 40 минут обрабатывали раствором, содержащим азур и эозин.
После этого из биочипов приготовляли долговременные препараты и проводили микроскопическое исследование.
Была определена плотность связывания клеток в области различных пятен биочипа, исходя из чего определено процентное содержание клеток. Плотность связывания клеток определяли путем прямого подсчета. Для этого в каждом пятне биочипа подсчитывали число клеток, связавшихся на участках заданной площади. Подсчет проводили не менее чем на 3 участках 100×100 мкм, полученные значения усредняли. Плотность связывания клеток в каждом пятне выражали в процентах. За 100% принимали плотность связывания клеток в области пятна с антителами анти- CD45 (11500 кл/мм2). Полученные результаты приводятся на фиг.3.
Помимо контрольных пятен с антителами анти-CD44 и анти-CD45 (где могут связаться все лейкоциты) наибольшая плотность связывания клеток отмечалась в области пятен биочипа с антителами, специфичными к антигенам: CD5, CD19, CD20, CD21, CD22, CD23, CD27, CD29, CD29, CD31, CD72, CD98, HLA-DR. При морфологическом исследовании клеток, связавшихся в области этих пятен, было установлено, что практически все они являются зрелыми лимфоцитами.
На биочипе №1 накопление клетками (всеми или большей их частью) окрашенного продукта ферментативной реакции отмечалось в области пятен с антителами, специфичными к антигенам: CD5, CD19, CD20, CD21, CD22, CD23, CD27, CD29, CD31, CD44, CD45, CD45RA, CD72, CD98, HLA-DR. Это свидетельствует о совместной экспрессии на одних и тех же клетках (коэкспрессии) антигена CD19 с антигенами CD5, CD20, CD21, CD22, CD23, CD27, CD29, CD31, CD44, CD45, CD45RA, CD72, CD98, HLA-DR. На фиг.2 приводится микрофотография, иллюстрирующая пример определения совместной экспрессии антигенов CD19 и CD23 (коэкспрессии CD19/CD23).
На биочипе №2 накопление клетками окрашенного продукта ферментативной реакции отмечалось в области пятен с антителами, специфичными к антигенам CD2, CD3, CD4, CD8 (на всех связанных в этих пятнах клетках) и CD7 (на части клеток), кроме того, окрашивалась небольшая часть клеток, связавшихся в области пятен с антителами анти-CD5, анти-CD44, анти-CD45, анти-CD45RA. Таким образом, отмечалась типичная для зрелых Т-клеток коэкспрессия CD2/CD3, CD2/CD4, CD2/CD5, CD2/CD7, CD2/CD8 и др. Таким образом, продуктом реакции окрашивались только клетки, расположенные в области пятен с антителами, специфичными к Т-клеточным антигенам и тем антигенам, которые встречаются на разных типах клеток. Плотность связывания клеток в области с антителами, специфичными к Т-клеточным антиге