Гены grg23 и grg51, придающие устойчивость к гербицидам
Иллюстрации
Показать всеНуклеотидные последовательности, кодирующие полипептиды устойчивости к глифосату, используют в конструкциях ДНК или экспрессионных кассетах для трансформации или экспрессии в организмах, включая микроорганизмы и растения. Трансформированные организмы приобретают устойчивость к гербициду. 9 н. и 8 з.п. ф-лы, 5 ил., 11 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение раскрывает новые гены, кодирующие устойчивость к гербицидам, которые применимы в биологии растений, при селекции сельскохозяйственных культур и для культур растительных клеток.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
N-фосфонометилглицин, обычно называемый глифосатом, является важным агрономическим химикатом. Глифосат ингибирует фермент, который превращает фосфоенолпировиноградную кислоту (РЕР) и 3-фосфошикимовую кислоту (S3P) в 5-енолпирувил-3-фосфошикимовую кислоту. Ингибирование этого фермента (5-енолпирувилшикимат-3-фосфатсинтаза; обозначаемая в настоящем описании как "EPSPS"), уничтожает растительные клетки посредством отключения пути метаболизма шикимата, подавляя таким образом биосинтез ароматических кислот.
Поскольку гербициды класса глифосата подавляют биосинтез ароматических аминокислот, они не только уничтожают растительные клетки, но и являются токсичными для бактериальных клеток. Глифосат подавляет много бактериальных синтаз EPSP, и таким образом является токсичным для этих бактерий. Однако определенные бактериальные синтазы EPSP имеют высокую устойчивость к глифосату.
Растительные клетки, устойчивые к токсичности глифосата, могут быть получены посредством трансформирования растительных клеток для экспрессии глифосат-устойчивых бактериальных EPSP-синтаз. В частности, бактериальный ген из штамма CP4 Agrobacterium tumefaciens был использован для придания растительным клеткам устойчивости к гербицидам после экспрессии в растениях. Мутированная EPSP-синтаза из штамма CT7 Salmonella typhimurium придает устойчивость к глифосату бактериальным клеткам и придает устойчивость к глифосату растительным клеткам (Патенты США №№ 4535060; 4769061 и 5094945). Однако существует потребность в других генах устойчивости к гербицидам.
Кинетическая активность EPSPS может быть оценена посредством измерения высвобождения фосфата. Высвобождение фосфата определяется с использованием сопряженного анализа для флуоресцентного обнаружения фосфата на основе образования N-ацетил-3,7-дигидроксифеноксацина (Amplex® Red), как известно в области техники (Vazquez et al. (2003) Analytical Biochemistry 320: 292-298). Опубликованные условия анализа могут привести к насыщению анализа в экспериментах, где фосфат высвобождается очень быстро. Для измерения кинетической активности EPSPS необходимы дополнительные способы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Представлены композиции и способы придания устойчивости или толерантности к гербициду бактериям, растениям, растительным клеткам, тканям и семенам. Композиции включают молекулы нуклеиновых кислот, кодирующие полипептиды устойчивости или толерантности к гербициду, векторы, содержащие такие молекулы нуклеиновых кислот, и клетки-хозяева, содержащие векторы. Композиции также включают антитела к полипептидам устойчивости или толерантности к гербициду. Как отмечено, нуклеотидные последовательности по изобретению могут быть использованы в конструкциях ДНК или экспрессионных кассетах для трансформации и экспрессии в организмах, включающих микроорганизмы и растения. Композиции также содержат трансформированные бактерии, растения, растительные клетки, ткани и семена. Кроме того, представлены способы получения полипептидов, кодирумых синтетическими нуклеотидами по изобретению.
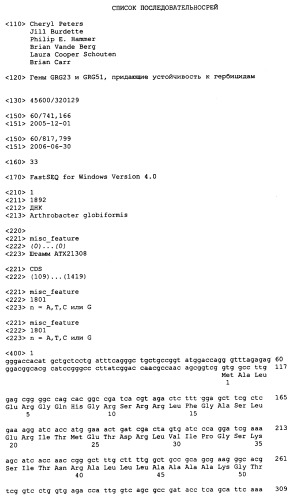
Представлены изолированные молекулы нуклеиновых кислот и варианты таковых, кодирующие полипептиды устойчивости или толерантности к гербициду. Дополнительно, охвачены последовательности аминокислоты и варианты таковых, кодируемые полинуклеотидами, которые придают устойчивость или толерантность к гербициду. Настоящее изобретение представляет молекулы изолированных нуклеиновых кислот, содержащие нуклеотидную последовательность, представленную в SEQ ID NO: 1, 3 или 5, нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную в SEQ ID NO: 2, 4 или 6, нуклеотидную последовательность устойчивости к гербициду, депонированную в бактерии-хозяине в виде номеров доступа NRRL B-30888 или NRRL B-30949, так же, как и варианты и фрагменты таковых. Нуклеотидные последовательности, которые комплементарны нуклеотидным последовательностям по изобретению, или те, которые гибридизуются с последовательностями по изобретению, также охвачены.
Также представлены способы измерения ферментативной кинетической активности с применением флуорогенных субстратов.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 показано выравнивание GRG23 ORF1 аминокислотной последовательности (SEQ ID NO:2) и GRG51 (SEQ ID NO:6) с Bacillus clausii (SEQ ID NO:7), Rubrobacer xylanophilus (SEQ ID NO:8), Escherichia coli (SEQ ID SEQ NO: 11), штаммом CP4 Agrobacterium sp. (SEQ ID NO:10) и Zea mays (SEQ ID NO:9).
На Фиг.2 показан график рассеяния ферментативной активности GRG23 (ось Y) как функции концентрации РЕР (ось X) при концентрациях глифосата 0, 3, 5 и 10 мМ.
На Фиг.3 показан график рассеяния Кm(app.) (ось Y) как функции концентрации глифосата (ось X). Точка пересечения оси X представляет Ki для глифосата.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящие изобретения теперь будут описаны более подробно со ссылкой на приложенные чертежи, в которых представлены несколько, но не все, варианты осуществления изобретений. Действительно, эти изобретения могут быть воплощены во многих различных формах и не должны быть рассмотрены как ограниченные вариантами осуществления, представленными здесь; скорее эти способы осуществления представлены так, чтобы это раскрытие удовлетворило применимые законные требования. Подобные номера на всем протяжении относятся к подобным элементам.
Множество модификаций и других вариантов осуществления изобретений, представленных здесь, будут понятны специалисту в области техники, к которой эти изобретения принадлежат, имеющих преимущество идеи изобретения, представленного в предшествующих описаниях и сопутствующих чертежах. Поэтому следует понимать, что изобретения не должны быть ограничены конкретными раскрытыми вариантами осуществления, и что модификации и другие варианты осуществления предназначены для включения в объем притязаний. Хотя здесь используются определенные термины, они применены только в типичном и описательном смысле, а не в целях ограничения.
Настоящее изобретение относится к композициям и способам регуляции в организмах устойчивости к гербициду, особенно у растений или растительных клеток. Способы включают трансформацию организмов нуклеотидными последовательностями, кодирующими ген устойчивости к глифосату по изобретению. Нуклеотидные последовательности по изобретению пригодны для получения растений, которые проявляют повышенную толерантность к гербицидному глифосату. Таким образом, представлены трансформированные бактерии, растения, растительные клетки, растительные ткани и семена. Композиции включают нуклеиновые кислоты и белки, имеющие отношение к толерантности к гербициду в микроорганизмах и растениях так же, как и трансформированные бактерии, растения, растительные ткани и семена. Раскрыты нуклеотидные последовательности гена устойчивости к глифосату (grg23 и grg51) и аминокислотные последовательности белков, кодируемых ими. Последовательности находят применение в конструировании экспрессионных векторов для последующей трансформации интересующих растений, в качестве зондов для выделения других генов устойчивости к глифосату, в качестве маркеров селекции, и т.п. Таким образом, под "геном устойчивости к глифосату по изобретению" подразумевается нуклеотидная последовательность, приведенная в SEQ ID NO:1 или 3, и варианты и фрагменты таковых (SEQ ID NO:5, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30 и 32), которые кодируют полипептид устойчивости или толерантности к глифосату. Аналогично, "полипептид устойчивости к глифосату по изобретению" представляет собой полипептид, обладающий аминокислотной последовательностью, приведенной в SEQ ID NO:2 или 4, и вариантами и фрагментами таковых (SEQ ID NO:6, 15, 17, 19, 21, 23, 25, 27, 29, 31 и 33), которые придают клетке-хозяину устойчивость или толерантность к глифосату.
Плазмиды, содержащие нуклеотидные последовательности устойчивости к гербициду по изобретению, депонированы в постоянной коллекции Коллекции Культур Службы сельскохозяйственных исследований, Северной Региональной Научно-исследовательской лаборатории (NRRL) 18 ноября 2005 под номером доступа NRRL B-30888 (grg23), и 26 июня 2006 под номером доступа NRRL B-30949 (grg51). Это депонирование будет поддерживаться в соответствии с Будапештским Договором о Международном Признании Депонирования Микроорганизмов для целей Патентной Процедуры. Это депонирование было сделано для удобства специалистов в области техники, и не допускается, что депонирование является необходимым по 35 своду законов США §112.
Под "глифосатом" подразумевается любая гербицидная форма N-фосфонометилглицина (включая любую соль такового) и другие формы, из которых получается анион глифосата in planta. "Белок устойчивости к гербициду" или белок, являющийся продуктом экспрессии "молекулы нуклеиновых кислот, кодирующей устойчивость к гербициду", включает белки, которые придают клетке способность быть толерантной к более высокой концентрации гербицида, чем клетки, которые не экспрессируют белок, или переносить определенную концентрацию гербицида в течение более длительного времени, чем клетки, которые не экспрессируют белок. "Белок устойчивости к глифосату" включает белок, который придает клетке способность оставаться толерантной к более высокой концентрации глифосата, чем клетки, которые не экспрессируют белок, или быть толерантной к определенной концентрации глифосата в течение более длинного промежутка времени, чем клетки, которые не экспрессируют белок. Под выражением "быть толерантным" или "толерантностью" подразумевается либо выживание, либо выполнение важнейших клеточных функций, таких как синтез белка и дыхание, таким способом, который с трудом отличим от необработанных клеток.
Изолированные молекулы нуклеиновых кислот и варианты и фрагменты таковых
Один аспект изобретения относится к изолированным молекулам нуклеиновых кислот, содержащим нуклеотидные последовательности, кодирующие белки и полипептиды устойчивости к гербициду или биологически активные части таковых так же, как и молекулы нуклеиновых кислот, подходящие для применения в качестве гибридизационных зондов для идентификации нуклеиновых кислот, кодирующих устойчивость к гербициду. Как используется в настоящем описании, термин "молекула нуклеиновой кислоты" предназначен включать молекулы ДНК (например, кДНК или геномной ДНК) и молекулы РНК (например, мРНК) и аналоги ДНК или РНК, полученные с использованием нуклеотидных аналогов. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной.
Нуклеотидные последовательности, кодирующие белки по настоящему изобретению, включают последовательности, приведенные в SEQ ID NO: 1, 3 и 5, нуклеотидную последовательность устойчивости к гербициду, введенную в бактериального хозяина под номерами доступа NRRL B-30888 и NRRL B-30949, и варианты, фрагменты, и комплементарные таковым. Под термином "комплементарный" подразумевается нуклеотидная последовательность, которая достаточно комплементарна данной нуклеотидной последовательности таким образом, что она может гибридизироваться с данной нуклеотидной последовательностью, образуя, таким образом, устойчивый дуплекс. Соответствующая аминокислотная последовательность для белка устойчивости к гербициду, кодируемая этими нуклеотидными последовательностями, приведена в SEQ ID NO:2, 4 или 6. Изобретение также охватывает молекулы нуклеиновых кислот, содержащие нуклеотидные последовательности, кодирующие неполноразмерные белки устойчивости к гербициду, и комплементарные таковым.
"Изолированная" или "очищенная" молекула нуклеиновой кислоты, или белка, или биологически активная часть таковой, является по существу свободной от другого клеточного материала или культуральной среды, если производится посредством рекомбинантных методик, или является по существу свободной от химических предшественников или других химических реагентов, если синтезируется химически. Предпочтительно, "изолированная" нуклеиновая кислота свободна от последовательностей (предпочтительно последовательностей, кодирующих белок), которые в природе примыкают к нуклеиновой кислоте (то есть, последовательности, расположенные на 5' и 3' концах нуклеиновой кислоты) в геномной ДНК организма, из которого получена нуклеиновая кислота. В целях изобретения термин "изолированная" применительно к молекулам нуклеиновых кислот исключает изолированные хромосомы. Например, в различных вариантах осуществления изолированная молекула нуклеиновой кислоты, кодирующая устойчивость к глифосату, может содержать меньше, чем приблизительно 5 т.п.н., 4 т.п.н., 3 т.п.н., 2 т.п.н., 1 т.п.н., 0,5 т.п.н или 0,1 т.п.н. нуклеотидной последовательности, которая в природе примыкает к молекуле нуклеиновой кислоты в геномной ДНК клетки, из которой получена нуклеиновая кислота. Белок устойчивости к гербициду, который по существу не содержит клеточный материал, включает получение белка, имеющего меньше, чем приблизительно 30%, 20%, 10% или 5% (сухой вес) белка устойчивости к не гербициду (также обозначаемый в настоящем описании как "загрязняющий белок").
Молекулы нуклеиновых кислот, которые являются фрагментами этих нуклеотидных последовательностей, кодирующих устойчивость к гербициду, также входят в объем настоящего изобретения. Под "фрагментом" понимается часть нуклеотидной последовательности, кодирующей белок устойчивости к гербициду. Фрагмент нуклеотидной последовательности может кодировать биологически активную часть белка устойчивости к гербициду, или это может быть фрагмент, который может быть использован в качестве гибридизационного зонда или ПЦР-праймера с использованием способов, раскрытых ниже. Молекулы нуклеиновых кислот, которые являются фрагментами нуклеотидной последовательности устойчивости к гербициду, содержат по меньшей мере приблизительно 15, 20, 50, 75, 100, 200, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1550, 1600, 1650, 1700, 1750, 1800, 1850, 1900, 1950 последовательных нуклеотидов, или до числа нуклеотидов, присутствующих в полноразмерной нуклеотидной последовательности, кодирующей устойчивость к гербициду, раскрытой в настоящем описании (например, 1892 нуклеотидов для SEQ ID NO: 1, 1259 нуклеотидов для SEQ ID NO:3, и 1242 нуклеотидов для SEQ ID NO:5). Под "последовательными" нуклеотидами подразумеваются нуклеотидные остатки, которые являются непосредственно прилегающими друг к другу.
Фрагменты нуклеотидных последовательностей по настоящему изобретению главным образом будут кодировать фрагменты белка, которые сохраняют биологическую активность полноразмерного белка устойчивости к глифосату; то есть активность устойчивости к гербициду. Под выражением "сохраняет активность устойчивости к гербициду" подразумевается, что фрагмент будет иметь по меньшей мере приблизительно 30%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 70% или по меньшей мере приблизительно 80% активности устойчивости к гербициду полноразмерных белков устойчивости к глифосату, которые раскрыты в настоящем описании как SEQ ID NO:2, 4 или 6. Способы измерения активности устойчивости к гербициду известны в области техники. См., например, Патенты США №№ 4535060 и 5188642, каждый из которых включен в настоящее описание полностью посредством ссылки.
Фрагмент нуклеотидной последовательности, кодирующей устойчивость к гербициду, которая кодирует биологически активную часть белка по изобретению, будет кодировать по меньшей мере приблизительно 15, 25, 30, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400 последовательных аминокислот, или вплоть до общего числа аминокислот в полноразмерном белке устойчивости к гербициду по настоящему изобретению (например, 436 аминокислот для SEQ ID NO:2, 413 аминокислот для SEQ ID NO: 4 и 413 аминокислот для SEQ ID NO:6).
Белки устойчивости к гербициду по настоящему изобретению кодируются нуклеотидной последовательностью, достаточно идентичной нуклеотидной последовательности SEQ ID NO:1, 3 или 5. Под термином "достаточно идентичная" подразумевают аминокислотную или нуклеотидную последовательность, которая имеет по меньшей мере приблизительно 60% или 65% идентичность последовательности, приблизительно 70% или 75% идентичность последовательности, приблизительно 80% или 85% идентичность последовательности, приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности при сопоставлении с последовательностью сравнения с использованием одной из программ выравнивания, описанных в настоящем описании, с использованием стандартных параметров. Квалифицированный специалист в этой области техники признает, что эти значения могут быть подходящим образом приспособлены для определения соответствующих идентичностей белков, кодируемых двумя нуклеотидными последовательностями посредством принятия во внимание вырожденности кодонов, сходства аминокислот, расположения рамки считывания, и т.п.
Чтобы определить процент идентичности двух последовательностей аминокислот или двух нуклеиновых кислот, последовательности выравнивают с целью оптимального сравнения. Процент идентичности между двумя последовательностями является функцией числа идентичных положений, которые являются общими для последовательностей (т.е. процент идентичности = число идентичных положений/общее количество положений (например, перекрывающиеся положения) × 100). В одном варианте осуществления две последовательности имеют одинаковую длину. Процент идентичности между двумя последовательностями может быть определен с использованием методик, подобных описанным ниже, с или без допущения пропусков. При вычислении процента идентичности, как правило, подсчитывают точные совпадения.
Определение идентичности процента между двумя последовательностями может быть достигнуто с использованием математического алгоритма. Неограничивающим примером математического алгоритма, используемого для сравнения двух последовательностей, является алгоритм Karlin and Altschul (1990) Proc. Natl Acad. Sci. USA 87:2264-2268, измененный как в Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Такой алгоритм включен в BLASTN и программы BLASTX от Altschul et al. (1990) J. Mol. Biol. 215:403-410. BLAST нуклеотидные поиски могут быть выполнены программой BLASTN, число очков = 100, длина слова = 12, для получения нуклеотидных последовательностей, гомологичных GDC-подобным молекулам нуклеиновых кислот по изобретению. BLAST поиски белка могут быть выполнены программой BLASTX, число очков = 50, длина слова = 3, для получения аминокислотных последовательностей, гомологичных молекулам белка устойчивости к гербициду по изобретению. Чтобы получить, с целью сравнения, выравнивания с разрывами, может быть использован Gapped BLAST, как описано в Altschul et al. (1997) Nucleic Acid Res. 25:3389-3402. В качестве альтернативы для выполнения повторного поиска, который обнаруживает отдаленные сходства между молекулами, может быть применен PSI-Blast. См. Altschul et al. (1997) выше. При использовании BLAST, Gapped BLAST и PSI-BLAST программ можно использовать параметры по умолчанию соответствующих программ (например, BLASTX и BLASTN). См. www.ncbi.nlm.nih.gov. Другим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм ClustalW (Higgins et al. (1994) Nucleic Acid Res. 22:4673-4680). ClustalW сравнивает последовательности и выравнивает аминокислотные или ДНК-последовательности полностью, и таким образом может предоставить данные о консервативности последовательности всей аминокислотной последовательности. Алгоритм ClustalW используется в нескольких коммерчески доступных пакетах программ для анализа ДНК/аминокислот, таких как модуль ALIGNX Набор Программы Vector NTI (Корпорация Invitrogen, Carlsbad, CA). После выравнивания аминокислотных последовательностей ClustalW может быть определен процент аминокислотной идентичности. Неограничивающим примером программы, пригодной для анализа выравниваний ClustalW, является GeneDocТМ. GenedocТМ (Karl Nicholas) позволяет оценивать аминокислотное сходство (или ДНК) и идентичность между несколькими белками. Другим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers и Miller (1988) CABIOS 4:11-17. Такой алгоритм включен в программу ALIGN (версия 2.0), которая является частью пакета программ для выравнивания последовательности GCG (доступный от Accelrys, Inc., Сан-Диего, Калифорния). Используя программу ALIGN для сравнения аминокислотных последовательностей, могут быть применены таблица веса остатков PAM120, штраф длины разрыва 12 и штраф разрыва 4.
Если не указано иначе, Версия 10 GAP, которая использует алгоритм Needleman и Wunsch (1970) J. Mol. Biol. 48 (3):443-453, будет использована для определения идентичности последовательности или сходства с использованием следующих параметров: % идентичности и % сходства для нуклеотидной последовательности с использованием GAP Weight 50 и Length Weight 3 и nwsgapdna.cmp матрицы очков; % идентичности или % сходства для аминокислотной последовательности с использованием GAP Weight и Length Weight 2, и программа начисления очков BLOSUM62. Также могут быть использованы эквивалентные программы. Под "эквивалентной программой" подразумевают любую программу сравнения последовательности, которая для любых двух рассматриваемых последовательностей, производит выравнивание, имеющее идентичные совпадения нуклеотидных остатков и идентичный процент идентичности последовательностей по сравнению с соответствующим выравниванием, произведенным посредством GAP Версии 10.
Изобретение также охватывает молекулы вариантов нуклеиновой кислоты. "Варианты" нуклеотидных последовательностей, кодирующих устойчивость к гербициду, включают те последовательности, которые кодируют белок устойчивости к гербициду, раскрытый в настоящем описании, но который консервативно отличается из-за вырожденности генетического кода, так же, как и те, которые достаточно идентичны, как обсуждено выше (например, SEQ ID NO:5, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30 и 32 являются вариантами SEQ ID NO:1). Природные аллельные варианты могут быть идентифицированы с использованием известных методов молекулярной биологии, таких как полимеразная цепная реакция (PCR) и методы гибридизации, как изложено в общих чертах ниже. Вариантные нуклеотидные последовательности также включают синтетически полученные нуклеотидные последовательности, которые были получены, например, с использованием сайт-направленного мутагенеза, но которые все еще кодируют белки устойчивости к гербициду, раскрытые в настоящем изобретении, как обсуждено ниже.
Вариантные белки, охваченные настоящим изобретением, являются биологически активными, если они сохраняют желательную биологическую активность природного белка, то есть активность устойчивости к гербициду. Под "сохраняет активность устойчивости к гербициду" понимают, что вариант будет иметь по меньшей мере приблизительно 30%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 70% или по меньшей мере приблизительно 80% активности устойчивости к гербициду природного белка. Способы измерения активности устойчивости к гербициду хорошо известны в области техники. См., например, Патенты США №№ 4535060 и 5188642, каждый из которых включен в настоящее изобретение полностью посредством ссылки.
Квалифицированный специалист в дальнейшем оценит, что в нуклеотидные последовательности по изобретению могут быть введены изменения посредством мутации, таким образом приводящей к изменениям в аминокислотной последовательности кодируемых белков устойчивости к гербициду, без изменения биологической активности белков. Таким образом, изолированные вариантные молекулы нуклеиновых кислот могут быть созданы посредством введения одной или нескольких нуклеотидных замен, добавлений или делеций в соответствующую нуклеотидную последовательность, раскрытую в настоящем описании, таким образом, что в кодируемый белок будут введены одна или несколько аминокислотных замен, добавлений или делеций. Мутации могут быть введены посредством стандартных методик, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Такие вариантные нуклеотидные последовательности также входят в объем настоящего изобретения.
Например, консервативные аминокислотные замены могут быть сделаны в одном или нескольких предсказанных несущественных аминокислотных остатках. "Несущественным" аминокислотным остатком является остаток, который может быть изменен в последовательности белка дикого типа устойчивости к гербициду без изменений биологической активности, тогда как "существенный" аминокислотный остаток необходим для биологической активности. "Консервативная аминокислотная замена" является такой, в которой аминокислотный остаток замещен на аминокислотный остаток, имеющий сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолецин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Аминокислотные замены могут быть сделаны в неконсервативных областях, которые сохраняют функцию. Главным образом, такие замены не были бы сделаны для консервативных аминокислотных остатков или для аминокислотных остатков, находящихся в пределах консервативного мотива, где такие остатки являются существенными для активности белка. Однако квалифицированный специалист в этой области техники понял бы, что функциональные варианты могут иметь малые консервативные или неконсервативные изменения в консервативных остатках.
Lys-22, Arg-124, Asp-313, Arg-344, Arg-386 и Lys-411 являются консервативными остатками EPSP-синтазы из E. coli (Schönbrunn et al. (2001) Proc. Natl. Acad. Sci. USA 98:1376-1380). Консервативные остатки, важные для EPSP-синтазной активности, также включают Arg-100, Asp-242 и Asp-384 (Selvapandiyan et al. (1995) FEBS Letters 374:253-256). Arg-27 связывается с S3P (Shuttleworth et al. (1999) Biochemistry 38:296-302).
В качестве альтернативы вариантные нуклеотидные последовательности могут быть получены посредством введения мутаций случайным образом вдоль всей или части кодирующей последовательности, например, посредством мутагенеза насыщения, и полученные мутанты могут быть проверены на способность обеспечивать активность устойчивости к гербициду для идентификации мутантов, которые сохраняют активность. После мутагенеза кодируемый белок может быть экспрессирован рекомбинантным способом, и активность белка может быть определена с использованием стандартных методов тестирования.
Используя способы, такие как ПЦР, гибридизация и т.п., могут быть идентифицированы соответствующие последовательности устойчивости к гербициду, такие последовательности, которые имеют существенную идентичность с последовательностями по изобретению. См., например, Sambrook и Russell (2001) Molecular Cloning: Laboratory Manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY) и Innis, et al. (1990) PCR PRotocols: A Guide to Methods and Applications (Academic Press, St.-Louis, MO).
В способе гибридизации вся или часть нуклеотидной последовательности устойчивости к гербициду может быть использована для скринирования кДНК или геномных библиотек. Способы создания таких кДНК и геномных библиотек являются общеизвестными в области техники и раскрыты в Sambrook and Russell (2001) выше. Так называемые гибридизационные зонды могут быть фрагментами геномной ДНК, фрагментами кДНК, фрагментами РНК или другими олигонуклеотидами, и могут быть помечены обнаруживаемой группой, такой как 32P или любым другим обнаруживаемым маркером, таким как другие радиоизотопы, флуоресцентное соединение, фермент или кофактор фермента. Зонды для гибридизации могут быть получены посредством мечения синтетических олигонуклеотидов, основываясь на известной(ых) нуклеотидной(ых) последовательности(ях), кодирующей(их) устойчивость к гербициду, раскрытой(ых) в настоящем описании. Дополнительно могут быть использованы вырожденные праймеры, сконструированные на основе консервативных нуклеотидов или аминокислотных остатков в нуклеотидной последовательности или кодируемой аминокислотной последовательности. Зонд, как правило, содержит область нуклеотидной последовательности, которая гибридизуется в жестких условиях с по меньшей мере приблизительно 12, по меньшей мере приблизительно 25, по меньшей мере приблизительно 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 500, 600, 700, 800, 900, 1000, 1200, 1400, 1600 или 1800 последовательными нуклеотидами нуклеотидной последовательности(ей), кодирующей устойчивость к гербициду по изобретению, или фрагмента или варианта таковых. Способы для получения зондов для гибридизации являются общеизвестными в области техники и раскрыты в Sambrook and Russell (2001) выше, и Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY), каждый из которых включен в настоящее описание посредством ссылки.
Например, полная последовательность устойчивости к гербициду, раскрытая в настоящем описании, или одна или более частей таковой, могут быть использованы в качестве зонда, способного специфически гибридизоваться с соответствующим последовательностями устойчивости к гербициду и с матричными РНК. Для достижения специфической гибридизации при различных условиях, такие зонды включают последовательности, которые являются уникальными и представляют собой по меньшей мере приблизительно 10 нуклеотидов в длину и по меньшей мере приблизительно 20 нуклеотидов в длину. Такие зонды могут быть использованы для амплификации соответствующих последовательностей устойчивости к гербициду из выбранного организма посредством ПЦР. Эта методика может быть использована для выделения дополнительных кодирующих последовательностей из желательного организма или в качестве диагностического теста для определения присутствия кодирующих последовательностей в организме. Методы гибридизации включают гибридизационное скринирование высеянных на чашки библиотек ДНК (или бляшек, или колоний; см., например, Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY).
Гибридизация таких последовательностей может быть выполнена в жестких условиях. Под "жесткими условиями" или "жесткими условиями гибридизации" подразумевают условия, в которых зонд гибридизуется со своей последовательностью-мишенью в детектируемо большей степени, чем с другими последовательностями (например, по меньшей мере с 2-кратным превышением фона). Жесткие условия являются зависимыми от последовательности и будут различны при различных обстоятельствах. Посредством управления жесткостью гибридизации и/или условиями промывки последовательности-мишени, которые на 100% комплементарны зонду, могут быть идентифицированы (homologous probing). В качестве альтернативы, жесткие условия могут быть отрегулированы для позволения некоторого несоответствия в последовательностях так, чтобы были обнаружены более низкие степени сходства (heterologous probing). Обычно зонд составляет по длине меньше, чем приблизительно 1000 нуклеотидов, или меньше, чем приблизительно 500 нуклеотидов в длину.
Как правило, жесткими условиями будут такие, при которых концентрация соли меньше, чем приблизительно 1,5 М ион Na, как правило, от приблизительно 0,01 до 1,0 М концентрации иона Na (или других солей) при pH от 7,0 до 8,3 и температуре по меньшей мере приблизительно 30°C для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере приблизительно 60°C для длинных зондов (например, больше, чем 50 нуклеотидов). Жесткие условия могут также быть достигнуты добавлением агентов для дестабилизации, таких как формамид. Иллюстративные условия низкой жесткости включают гибридизацию в буферном растворе 30%-35%-ного формамида, 1 М NaCl, 1%-ной SDS (натрия додецилсульфат) при 37°C, и промывку в 1X-2X SSC (20X SSC = 3,0 М NaCl/0,3 М тринатрия цитрат) при 50-55°C. Иллюстративные условия умеренной жесткости включают гибридизацию в 40%-45%-ном формамиде, 1,0 М NaCl, 1%-ном SDS при 37°C, и промывку в 0,5X-1X SSC при 55-60°C. Иллюстративные условия высокой жесткости включают гибридизацию в 50%-ном формамиде, 1 М NaCl, 1%-ном SDS при 37°C, и промывку в 0,1X SSC при 60-65°C. Необязательно, буферы для промывки могут содержать от приблизительно 0.1% до приблизительно 1% SDS. Продолжительность гибридизации составляет обычно менее чем приблизительно 24 часа, обычно от приблизительно 4 до приблизительно 12 часов.
Специфичность, как правило, является функцией постгибридизационных промывок, критическими факторами являются ионная сила и температура раствора для заключительной промывки. Для ДНК-ДНК гибридов, Тm может быть приближена к уравнению Meinkoth and Wahl (1984) Anal. Biochem. 138:267-284: Tm = 81,5°C + 16,6 (log M), + 0,41 (%GC) - 0,61 (% форм.) - 500/L; где М является молярностью одновалентных катионов, %GC - процент нуклеотидов гуанозина и цитозина в ДНК, % форм. - процент формамида в растворе гибридизации, и L - длина гибрида в парах азотистых оснований. Тm является температурой (при определенной ионной силе и pH), при которой 50% комплементарной последовательности-мишени гибридизуется с идеально соответствующей пробой. Тm уменьшается приблизительно на 1°C с каждым 1% несоответствия; таким образом, Тm, гибридизация и/или условия промывки могут быть отрегулированы для гибридизации с последовательностями желательной идентичности. Например, если требуется найти последовательности с ≥ 90%-ной идентичностью, Tm может быть уменьшена на 10°C. Обычно жесткие условия выбираются, чтобы быть примерно на 5°C ниже, чем температура точки плавления (Тm) для специфической последовательности и комплементарной ей при определенной ионной силе и pH. Однако при очень жестких условиях гибридизация и/или промывка могут проводиться при 1, 2, 3 или 4°C ниже, чем температура точки плавления (Тm); при умеренно жестких условиях гибридизация и/или промывка могут проводиться при 6, 7, 8, 9, или 10°C ниже, чем температура точки плавления (Тm); в условиях низкой жесткости гибридизация и/или промывка могут проводиться при 11, 12, 13, 14, 15 или 20°C ниже, чем температура точки плавления (Тm). Применяя уравнение, гибридизацию и составы промывки и желательную Тm, среднему специалисту понятно, что разнообразие в жесткости гибридизации и/или растворов промывки по существу описано. Если желательная степень несоответствия приводит к Тm меньше, чем 45°C (водный раствор) или 32°C (раствор формамида), предпочтительно увеличить концентрацию SSC так, чтобы можно было использовать более высокую температуру. Обширное руководство по гибридизации нуклеиновых кислот найдено в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Acid Probes, Part I, Chapter 2 (Elsevier, New York); и Ausubel et al., eds. (1995) Current Protocols in Molecular Biology, Chapter 2 (Greene Publishing and Wiley-Interscience, New York). См. Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY).
Изолированные белки и варианты и фрагменты таковых
Белки устойчивости к гербициду также охвачены объемом настоящего изобретения. Под "белком устойчивости к гербициду" или "белком толерантности к гербициду" подразумевают белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:2, 4 или 6. Фрагменты, биологически активные части и варианты таковых также представлены и могут быть использованы для осуществления на практике способов по настоящему изобретению.
"Фрагменты" или "биологически активные части" включают полипептидные фрагменты, содержащие часть аминокислотной последовательности, кодирующей белок устойчивости к гербициду, как приведено в SEQ ID N0:2, 4, или 6, и которые сохраняют активность устойчивости к гербициду. Биологически активная часть белка устойчивости к гербициду может быть полипептидом, который, например, имеет 10, 25, 50, 100 или больше аминокислот в длину. Такие биологически активные части могут быть получены посредством рекомбинантных методик и оценены на активность устойчивости к гербициду. Способы измерения активности устойчивости к гербициду хорошо известны в области техники. См., например, Патенты США №№ 4535060 и 5188642, каждый из которых включен в настоящее описание полно