Способ извлечения ионов меди (ii) из кислых растворов
Иллюстрации
Показать всеИзобретение относится к сорбционному извлечению ионов меди (II) из кислых растворов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков. Способ извлечения ионов меди (II) из кислых растворов включает сорбцию ионов меди (II) контактированием раствора с анионитом. При этом сорбцию ионов меди (II) ведут при температуре 70-80°С из растворов, содержащих 40 г/дм3 соляной кислоты и хлориды аммония, щелочных или щелочноземельных металлов. Сорбцию проводят на анионитах марок АМП или АМ-2б, предварительно обработанных раствором соляной кислоты или водой. В качестве анионитов можно использовать аниониты марок АМН, содержащие обменные группы
и АМ-26, содержащие обменные группы
Техническим результатом изобретения является нахождение оптимальных условий для сорбции ионов меди на анионитах. 1 з.п. ф-лы, 1 ил., 3 табл.
Реферат
Сорбционное извлечение ионов меди из кислых растворов относится к области извлечения веществ с использованием сорбентов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков.
Известно применение катионитов и анионитов в гидрометаллургии для очистки растворов соответственно от катионов и анионов металлов [Г.М.Вольдман, А.Н.Зеликман. Теория гидрометаллургических процессов. М.: Металлургия. 1993. С.263-267].
Однако применение анионитов для извлечения катионов металлов недостаточно исследовано и представляет интерес для нахождения дополнительных возможностей селективного извлечения ионов металлов из растворов сложного состава.
Наиболее близким техническим решением является способ извлечения ионов меди (II) из кислых растворов [Иониты в цветной металлургии, под ред. К.Б.Лебедева, Металлургия, М., 1975, с.222-224], включающий сорбцию ионов меди (II) контактированием раствора с анионитом.
Недостатком способа является то, что не указаны оптимальные условия сорбции ионов меди (II) на анионитах марки АМН и АМ-2б.
Задачей, на решение которой направлено заявленное изобретение, является нахождение оптимальных условий для сорбции ионов меди (II) на анионитах марки АМП и АМ-2б.
Техническим результатом, который может быть достигнут при осуществлении изобретения, является эффективная сорбция ионов меди на анионитах марки АМП или АМ-2б.
Этот технический результат достигается тем, что извлечение ионов меди (II) из кислых растворов включает сорбцию ионов меди (II) контактированием раствора с анионитом, сорбцию ионов Cu(II) ведут при температуре 70-80°С из растворов, содержащих 40 г/дм3 соляной кислоты и хлориды аммония, щелочных или щелочноземельных металлов, на анионитах марок АМП или АМ-2б, предварительно обработанных раствором соляной кислоты или водой. В качестве анионитов используют анионит марки АМП, содержащий обменные группы
или марки АМ-26, содержащий обменные группы
Сущность способа заключается в том, что ионы Cu2+ в солянокислых растворах образуют устойчивые анионные комплексы типа [CuCl2]-, [CuCl3]-, [CuCl4]2-, [CuCl5]3- и др., которые могут быть извлечены из раствора на анионитах.
Известно, что хлоридная гидрометаллургия находит применение в процессах выщелачивания полиметаллических концентратов. Использование соляной кислоты вследствие повышенной ее способности к комплексообразованию интересно в схемах, включающих сорбционно-экстракционную технологию разделения металлов.
Примеры конкретного выполнения способа
Рассмотрены возможности использования анионитов для извлечения хлоридных анионных комплексов меди из солянокислых растворов.
В качестве сорбентов использовали аниониты марок АМП и АМ-2б.
Пористый анионит АМ-2б смешанной основности со сферическими гранулами получен аминированием ХМС стирола и ДВБ смесью диметил- и триметиламинов. Крупность гранул 0,63-1,60 мм; удельный объем набухшей смолы 2,7-3,2 см3/г; удельная поверхность 50-100 м2/г; общий объем пор 0,80-0,87 см3/г, механическая прочность 98-99%; ПОЕ 3,3-3,7 мг-экв/г. Обменные группы:
Гелевый высокоосновный анионит АМП со сферическими гранулами получен аминированием ХМС стирола и 3,5-4,0% ДВБ пиридином. Крупность гранул 0,63-1,60 мм; удельный объем набухшей смолы 2,7-2,9 см3/г, механическая прочность 98-99%; ПОЕ 3,3-3,7 мг-экв/г. Обменные группы:
Сорбцию ионов меди осуществляли при 70-80°С из насыщенных хлоридами аммония NH4C1, щелочными (NaCl, KCl) и щелочноземельными (CaCl2, MgCl2) металлами растворов, подкисленных до 40 г/дм3 НС1. Объем раствора 50-100 см3, масса сухого сорбента 1 г.
В табл.1-3 и на чертеже даны результаты сорбции, где указаны используемая соль металла, марка анионита, способ предварительной обработки сорбента, концентрация иона металла исходная и после наступления сорбционного равновесия, г/дм3, время сорбции, ОЕ, мг/г - обменная емкость сорбента, в мг сорбируемого иона металла на 1 г сорбента, СОЕ, мг/г - обменная емкость в равновесном состоянии.
Пример 1 (табл.1)
В табл.1 даны результаты сорбции ионов меди в зависимости от концентрации макрокомпонентов NaCl и HCl, предварительно сорбент обрабатывали в 0,1 н растворах НС1.
Из данных табл.1 следует, что результаты сорбции зависят от концентрации макрокомпонентов NaCl и HCl в растворе.
| Таблица 1 | |||||||
| Результаты сорбции ионов меди в зависимости от концентрации макрокомпонентов NaCl и НС1, объем раствора 100 см3 | |||||||
| № п/п | Соль | Концентрация, г/дм3 | Концентрация Cu, г/дм3 | Время достижения равновесия, мин | СОЕ, мг/г | ||
| NaCl | HCl | исходная | равновесная | ||||
| 1 | CuCl2 | 150 | 40 | 10,09 | 8,58 | 30 | 151 |
| 2 | CuCl2 | 300 | 40 | 10,20 | 9,39 | 30 | 81 |
| 3 | CuCl2 | 150 | 80 | 11,60 | 9,59 | 15 | 201 |
| 4 | CuCl2 | 150 | 120 | 11,64 | 9,59 | 15 | 205 |
| 5 | CuCl2 | 150 | 240 | NaCl полностью не растворилась за время 30 мин | |||
| 6 | CuSO4 | 150 | 40 | 12,08 | 9,39 | 15 | 269 |
| 7 | CuSO4 | 300 | 40 | 8,83 | 8,32 | 30 | 51 |
| 8 | CuSO4 | 300 | 40 | 11,28 | 10,74 | 30 | 54 |
| 8 | CuSO4 | 150 | 80 | 9,58 | 8,58 | 30 | 100 |
| 9 | CuSO4 | 150 | 120 | 9,58 | 8,57 | 30 | 101 |
Пример 2 (табл.2, чертеж)
В табл.2 даны результаты сорбции ионов меди при использовании сорбентов марок АМП и АМ-2б. Сорбцию осуществляли из солянокислых растворов, содержащих хлориды щелочных металлов и аммония и HCl. Предварительно сорбенты в течение суток выдерживали в дистиллированной воде или в 0,1 н растворах HCl.
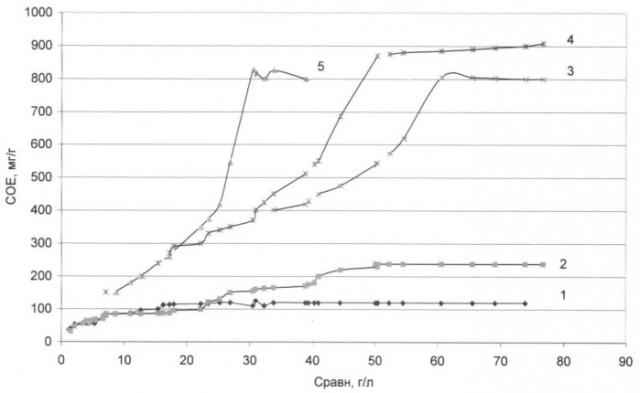
На чертеже даны изотермы сорбции в виде зависимостей сорбционной обменной емкости СОЕ, мг/г, от равновесной концентрации сорбируемых ионов Сравн, полученных в условиях опытов табл.2: кривая 1 соответствует опытам 1-12, кривая 2 - опытам 13-23, кривая 3 - опытам 28-32, кривая 4 -опытам 33-38, кривая 5 - опытам 39-42.
Из данных табл.2 и чертежа следует, что получены высокие показатели сорбции ионов меди на анионитах марок АМП и АМ-26 из солянокислых растворов щелочных металлов и аммония. Максимальные показатели сорбции получены в следующих условиях: сорбция из кислых растворов сульфатов меди с исходной концентрацией 80-90 г/дм3 Cu2+, с концентрацией макрокомпонентов, г/дм3: 150 NaCl и 40 HCl, времени сорбции 15-30 мин, СОЕ=800-900 мг/г.
| Таблица 2 | |||||||
| Результаты сорбции в зависимости от аниона соли, предварительной обработки сорбента, марки сорбента, исходной концентрации соли, времени сорбции, макрокомпоненты - хлориды щелочных металлов и аммония | |||||||
| № п/п | Соль | Марка сорбента | Предварительная обработка сорбента | Время достижения равновесия, мин | Концентрация Cu2+, г/дм3 | СОЕ, мг/г | |
| исходная | Равновес-ная | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Сорбция из 50 мл раствора, содержащего, г/дм3: 370 NaCl и 40 HCl | |||||||
| 1 | CuSO4 | АМП | H2O | 60 | 1,97 | 1,26 | 36 |
| 2 | CuSO4 | АМП | H2O | 60 | 3,15 | 2,10 | 53 |
| 3 | CuSO4 | АМП | H2O | 15 | 4,63 | 3,47 | 57 |
| 4 | CuSO4 | АМП | Н2О | 30 | 6,37 | 5,26 | 55 |
| 5 | CuSO4 | АМП | H2O | 30 | 8,21 | 6,63 | 79 |
| 6 | CuSO4 | АМП | Н2О | 30 | 12,72 | 5,26 | 87 |
| 7 | CuSO4 | АМП | H2O | 60 | 18,46 | 16,21 | 112 |
| 8 | CuSO4 | АМП | H2O | 60 | 25,44 | 23,42 | 101 |
| 9 | CuSO4 | АМП | H2O | 15 | 32,92 | 30,93 | 125 |
| 10 | CuSO4 | АМП | H2O | 30 | 41,71 | 39,32 | 119 |
| 11 | CuSO4 | АМП | H2O | 15 | 53,62 | 52,23 | 119 |
| 12 | CuSO4 | АМП | H2O | 15 | 76,26 | 73,88 | 119 |
| 13 | CuCl2 | АМП | H2O | 60 | 2,10 | 1,47 | 32 |
| 14 | CuCl2 | АМП | H2O | 60 | 3,05 | 2,10 | 47 |
| 15 | CuCl2 | АМП | H2O | 60 | 5,26 | 4,00 | 63 |
| 16 | CuCl2 | АМП | H2O | 60 | 6,73 | 5,37 | 68 |
| 17 | CuCl2 | АМП | H2O | 60 | 8,84 | 7,15 | 84 |
| 18 | CuCl2 | АМП | H2O | 30 | 18,96 | 17,21 | 87 |
| 19 | CuCl2 | АМП | H2O | 30 | 28,93 | 25,94 | 150 |
| 20 | CuCl2 | АМП | H2O | 60 | 43,90 | 40,91 | 200 |
| 21 | CuCl2 | АМП | H2O | 30 | 54,81 | 50,05 | 238 |
| 22 | CuCl2 | АМП | H2O | 30 | 73,88 | 69,11 | 238 |
| 23 | CuCl2 | АМП | H2O | 15 | 102,48 | 97,71 | 238 |
| 24 | CuCl2 | АМ-26 | H2O | 30 | 27,65 | 24,79 | 143 |
| 25 | CuCl2 | АМ-26 | H2O | 30 | 61,01 | 56,24 | 238 |
| 26 | CuSO4 | АМ-26 | Н2О | 15 | 25,73 | 22,20 | 177 |
| 27 | CuSO4 | АМ-26 | Н2О | 30 | 54,24 | 51,72 | 126 |
| Сорбция из 100 мл раствора, содержащего, г/дм3: 150 NaCl и 40 HCl | |||||||
| 28 | CuCl2 | АМП | HCl | 15 | 5,05 | 4,41 | 64 |
| 29 | CuCl2 | АМП | HCl | 15 | 14,80 | 12,61 | 219 |
| 30 | CuCl2 | АМП | HCl | 15 | 59,55 | 54,45 | 510 |
| 31 | CuCl2 | АМП | HCl | 15 | 68,60 | 60,54 | 806 |
| 32 | CuCl2 | АМП | HCl | 15 | 98,00 | 90,80 | 720 |
| Таблица 2, продолжение | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 33 | CuSO4 | АМП | H2O | 15 | 8,57 | 7,06 | 151 |
| 34 | CuSO4 | АМП | H2O | 15 | 17,15 | 15,38 | 177 |
| 35 | CuSO4 | АМП | H2O | 15 | 34,81 | 32,29 | 252 |
| 36 | CuSO4 | АМП | H2O | 15 | 49,10 | 44,40 | 470 |
| 37 | CuSO4 | АМП | H2O | 15 | 58,15 | 49,45 | 870 |
| 38 | CuSO4 | АМП | H2O | 15 | 85,77 | 76,69 | 908 |
| 39 | CuCl2 | АМП | H2O | 30 | 10,09 | 8,58 | 151 |
| 40 | CuCl2 | АМП | H2O | 30 | 20,68 | 17,91 | 277 |
| 41 | CuCl2 | АМП | H2O | 30 | 28,76 | 25,23 | 353 |
| 42 | CuCl2 | АМП | H2O | 30 | 46,90 | 38,85 | 805 |
| Сорбция из 50 мл раствора, содержащего, г/дм3: 380 KCl и 40 г/дм3 HCl | |||||||
| 43 | CuCl2 | АМП | H2O | 15 | 44,09 | 38,13 | 298 |
| 44 | CuSO4 | АМП | H2O | 15 | 3,01 | 2,41 | 30 |
| Сорбция из 50 мл раствора, содержащего, г/дм3: 600 NH4Cl и 40 г/дм3 HCl | |||||||
| 45 | CuCl2 | АМП | H2O | 15 | 29,79 | 26,22 | 179 |
| 46 | CuSO4 | АМП | H2O | 15 | 2,61 | 1,71 | 45 |
Пример 3 (табл.3)
В табл.3 даны результаты сорбции при использовании сорбентов марки АМП. Сорбцию ионов металлов осуществляли из солянокислых растворов, содержащих хлориды щелочноземельных металлов и 40 г/дм3 HCl. Предварительно сорбенты в течение суток выдерживали в дистиллированной воде.
| Таблица 3 | |||||||
| Результаты сорбции в зависимости от предварительной обработки сорбента, исходной концентрации соли, времени сорбции, макрокомпоненты - хлориды щелочноземельных металлов | |||||||
| № п/п | Соль | Сорбент | Время достижения равновесия, ч | Концентрация Cu2+, г/дм3 | СОЕ, мг/г | ||
| марка | способ предварительной обработки | исходная | равновесная | ||||
| Сорбция из 50 мл раствора, содержащего, г/дм3: 1100 CaCl2 и 40 HCl | |||||||
| 1 | CuCl2 | АМП | H2O | 0,5 | 3,72 | 3,05 | 33 |
| 2 | CuCl2 | АМП | Н2О | 2 | 10,79 | 9,46 | 66 |
| 3 | CuCl2 | АМП | H2O | 1 | 1,56 | 0,75 | 40 |
| Сорбция из 100 мл раствора, содержащего, г/дм3: 400 CaCl2 и 40 HCl | |||||||
| 4 | CuCl2 | АМП | HCl | 0,25 | 9,08 | 6,56 | 252 |
| 5 | CuCl2 | АМП | HCl | 0,5 | 46,64 | 40,28 | 636 |
| Сорбция из 50 мл раствора, содержащего, г/дм3: 620 MgCl2 и 40 HCl | |||||||
| 6 | CuCl2 | АМП | H2O | 1 | 19,54 | 14,40 | 257 |
| 7 | CuCl2 | АМП | H2O | 1 | 42,90 | 21,9 | 105 |
Из данных табл.3 следует, что получены высокие показатели сорбции ионов меди на анионитах марки АМП из солянокислых растворов щелочноземельных металлов. Максимальные показатели сорбции получены при следующих условиях: сорбция из кислых растворов хлоридов меди с исходной концентрацией 40-50 г/дм3 Cu2+, с концентрацией макрокомпонентов, г/дм3: 400 CaCl2 и 40 HCl, при кислой обработке сорбента, времени сорбции 15-30 мин, СОЕ=600 мг/г.
По сравнению с прототипом показаны возможности эффективной сорбции ионов Cu2+ из кислых хлоридных растворов на анионитах марок АМП и АМ-2б.
1. Способ извлечения ионов меди (II) из кислых растворов, включающий сорбцию ионов меди (II) контактированием раствора с анионитом, отличающийся тем, что сорбцию ионов меди (II) ведут при температуре 70-80°С из растворов, содержащих 40 г/дм3 соляной кислоты и хлориды аммония, щелочных или щелочноземельных металлов, на анионитах марок АМП или АМ-2б, предварительно обработанных раствором соляной кислоты или водой.
2. Способ по п.1, отличающийся тем, что в качестве анионитов используют анионит марки АМП, содержащий обменные группы или марки АМ-2б, содержащий обменные группы