Способ пластики обширных пострезекционных окончатых дефектов стенок грудной клетки и/или свода черепа
Иллюстрации
Показать всеИзобретение относится к хирургии и может быть применимо для пластики обширных пострезекционных окончатых дефектов стенок грудной клетки и/или свода черепа. Накладывают на образованный пострезекционный дефект лоскут никелид-титановой ткани и фиксируют к краям дефекта. Укладывают поверх и поперек лоскута никелид-титановой ткани, по крайней мере, один ленточный, анатомически сформованный никелид-титановый элемент жесткости, опирают его концами на костные структуры краев пострезекционного окончатого дефекта и фиксируют к лоскуту никелид-титановой ткани. Способ позволяет обеспечить механическую прочность. 2 з.п. ф-лы, 7 ил.
Реферат
Изобретение относится к медицинской технике.
Грудная клетка и черепная коробка - полости организма, вмещающие жизненно важные и нежные органы. Физико-механические характеристики грудной клетки отвечают требованиям прочности, надежности, строгой заданности формы, сопряженной с формой вмещаемых органов, эластичной изменяемости объема.
Череп человека, вмещающий самый сложный и тонко организованный орган - головной мозг - идеально соответствует выполняемой функции, сочетая легкость, способность трансформироваться (при родах), противостоять экстремальным механическим нагрузкам (бокс, цирковые номера), выполнять функции резонатора (голосовой аппарат человека) и многое другое.
Проблемы хирургического вмешательства при полостных операциях на этих органах, определяемые жесткими требованиями физиологических норм, усложняются в отдельных видах патологии. Например, при торакальных операциях удаления злокачественных опухолей предполагается отдаление границ резекции до 5-7 см от видимых изменений в пораженных тканях. Производимые при этом раневые дефекты стенок грудной клетки могут достигать 1200 см2 и даже более. Для герметичного, надежного и прочного закрытия таких обширных дефектов, кроме высокого мастерства хирурга, требуется наличие замещающих материалов, максимально соответствующих вышеупомянутым условиям. Дефицит их выбора ранее приводил к сокращению показаний к операциям, обрекая больного на гибель. Статистический анализ 1910 г. свидетельствует, что из 188 обследованных больных с опухолями грудной стенки и грудины была прооперирована только незначительная их часть. Вследствие несовершенства технических средств сопровождающие операции пневмотораксы заставляли хирургов воздерживаться от иссечения опухолей грудной клетки.
Многовековой (начиная от Галена) исторический опыт развития хирургии в этой области исходит из использования аллотрансплантатов и достигает современного апогея благодаря успехам материаловедения.
Из аутотканей для замещения дефектов грудной стенки, в зависимости от их величины и анатомических особенностей, используют мышечно-фасциальные, кожно-мышечные и кожно-фасциальные лоскуты, большой сальник, твердую мозговую оболочку и другие ткани [Давыдов М.И., Алиев М.Д., Соболевский В.А., Илюшин А.Л. Хирургическое лечение злокачественных опухолей грудной стенки // Вестник онкологии, 2008, №1, с.35-40].
Известен способ реконструкции передней стенки грудной клетки с использованием большого сальника (оментопластика) [Вишневский А.А., Алиев Т.Р. и др. Использование большого сальника при операциях на грудной стенке, органах средостения и легких. Обзор литературы // Хирургия, 1990, №2, с.144-149]. Обширный окончатый дефект передней стенки грудной клетки, образованный удалением пораженных тканей, укрывают лоскутом большого сальника с кровоснабжением его из правой или левой сосудистой ножки. Сформованный лоскут проводят через подкожный тоннель к дефекту, фиксируют несколькими швами к краям дефекта и укрывают лоскутом кожи, трансплантированным с интимных участков тела больного.
Недостатки способа: повышенная сопутствующая травматизация и связанная с этим неизбежная коррекция анестезиологического пособия. Размеры сальника могу оказаться недостаточными для укрытия большого дефекта. Созданный тоннель является морфологической основой для контактного распространения инфекции в полость брюшины. Недостатки способа ограничивают его применение и несмотря на заслуги давней известности и длительного использования составляют неудовлетворенность клиницистов.
С появлением синтетических биоинертных материалов возможности реконструктивной пластики обширных дефектов грудной клетки увеличились, расширились границы операбельности.
Известны исследовательские работы по реконструкции грудной стенки после обширных резекций с применением полимерных материалов различной номенклатуры и сочетаний [Давыдов М.И., Алиев М.Д., Соболевский В.А., Илюшин А.Л. Хирургическое лечение злокачественных опухолей грудной стенки // Вестник онкологии, 2008, №1, с.35-40]. Для замещения послеоперационных дефектов мягких тканей используют синтетические сетки Gor-Tex (политетрафторэтилен), сетки из полипропилена, викрила, пролена. Наилучший эффект получают при сочетании синтетических материалов для восстановления жесткого каркаса с перемещенными аутолоскутами, закрывающими дефекты мягких тканей. Для создания жесткого каркаса применяют композицию «сэндвич» из метилакрилатовой или стальной пластины, помещенной между двумя слоями сетки марлекс (полипропилен) [Mansour К.А., Thourani V. Н. et al. Chest wall resections and reconstruction: a 25-year experience. Ann Thorac Surg 2002, Jun; 73(6): 1720-6; discussion 1725-6 Related Articles, Links Atlanta, Georgia, USA]. Известно использование в аналогичных способах пористой керамики, углерода [Patent Abstracts of Japan 04-156840, Takagi Shigeharu, Shinjo Kiyoshi. Composite material as artificial bone for reconstruction of chest wall]. Для протезирования ребер, т.е. костных фрагментов жесткого каркаса, применяют сверхэластичный никелид титана - самый прогрессивный материал современной хирургической техники [Патент РФ №2157151].
Известен способ пластики обширных окончатых дефектов стенок грудной клетки, образованных в результате хирургической коррекции стерномедиастинита, хронического остеомиэлита ребер и грудины. В нем в комбинации с мягкими укрывными трансплантатами для реконструкции жесткого каркаса грудной клетки использован никелид титана. По сходству используемого материала как доминирующего существенного признака данный аналог выбран в качестве прототипа предлагаемого изобретения [Муков М.Б. Реконструктивно-пластический этап в хирургическом лечении распространенных форм опухолей груди (клинико-анатомическое и экспериментальное исследование): автореферат дисс. канд. мед. наук/ Санкт-Петербургская медицинская академия последипломного образования (СПбМАПО). - 2001 г.]. В указанной комбинации имплантаты для лучшей интеграции с тканями организма укрывались мышечными стеблями с кожным островком на сосудистой ножке. Такая методика влечет дополнительный травматизм грудной клетки. Само вмешательство фармакоемко. Главный недостаток - низкая состоятельность операции.
Технический результат предлагаемого изобретения - повышение состоятельности операции.
Указанный технический результат достигается тем, что в способе пластики обширных пострезекционных окончатых дефектов стенок грудной клетки и/или свода черепа, включающем замещение резецированной стенки биосовместимыми имплантатами, резецированную стенку замещают лоскутом никелид-титановой ткани, который накладывают на образованный пострезекционный дефект и фиксируют к его краям. Поверх и поперек лоскута никелид-титановой ткани укладывают по крайней мере один ленточный, сформованный по анатомии никелид-титановый элемент жесткости, который опирают концами на края пострезекционного окончатого дефекта и фиксируют к лоскуту никелид-титановой ткани.
Предпочтительно, в качестве элемента жесткости используют ленту из монолитного никелида титана, покрытую с обеих сторон слоем пористого никелида титана. Предпочтительно, в качестве элемента жесткости используют ряд параллельно расположенных никелид-титановых проволочных отрезков.
Никелид-титановая ткань обладает рядом свойств, отвечающих требованиям решения указанной задачи. Из обширного перечня таковых основными являются:
1. Биосовместимость. Она проявляется в быстрой и успешной интеграции имплантата как инородного тела с тканями грудной клетки, с которыми сетка приводится в контакт. В результате интраоперационного пропитывания кровью, интерстициальной жидкостью сетка становится герметичной, а впоследствии, после трансформации жидкой фазы в коллагеновые волокна, превращается в арматуру тканей. Бескапсулярный, бесконфликтный контакт инородного тела с живой тканью - главный признак биосовместимости никелида титана и залог согласованного функционирования получившейся композиции в акциях деформации стенки грудной клетки.
2. Механическая и циклическая прочность. Сплав никелида титана достаточно прочен даже для замещения экстремально нагруженных тканей организма, таких как сухожилие. Циклостойкость (противостояние разрушению при многократной деформации) превосходит все известные материалы медицинского назначения. Изготовленная из никелида титана проволока выдерживает без разрушения при умеренной (в пределах эластичности) деформации несколько миллионов циклов. Это свойство существенно важно с учетом непрерывной дыхательной подвижности грудной клетки.
3. Коррозионная стойкость. Никелид титана в агрессивных средах, коими являются жидкости организма, не коррелирует и не резорбирует, в отличие от полимерных материалов. Срок его безущербного нахождения в тканях не ограничен. По этой причине нет необходимости удалять имплантат после реконвалесценции и, тем самым, дополнительно травмировать больного.
4. Сетчатый имплантат легок, податлив в формообразовании, незатруднительно выкраивается ножницами в ходе операции «по месту», т.е. адекватно образованному окончатому дефекту.
Эти и другие, менее существенные для данного случая, свойства никелида титана позволяют решить задачу более успешно по сравнению с прототипом в отношении состоятельности операции, прочности и надежности восстановленных стенок полостей грудной клетки и черепной коробки, сроков выздоровления.
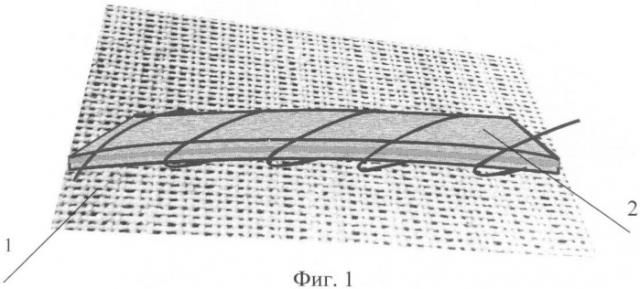
При обширных дефектах стенок, когда удален прочностной и формообразующий костный каркас (ребра и грудина грудной клетки или участок свода черепа), лоскут мягкой никелид-титановой ткани нуждается в позиционной поддержке. В качестве отдельного каркасообразующего элемента жесткости использована никелид-титановая лента, изогнутая в продольном направлении по кривизне замещаемой стенки. Элементы жесткости в количестве, зависящем от укрываемой площади окончатого дефекта, устанавливают поперек дефекта, поверх никелид-титановой ткани, фиксируют к последней, например, узловыми швами. Длину элементов выбирают, превышающую поперечный размер окончатого дефекта для опоры их на края сохранившейся ткани. Исходным признаком вариантов конструкций элементов жесткости является материал - никелид титана. Его высокая биосовместимость, эластичная жесткость, сопоставимая с таковой у костной ткани, обуславливают повышение состоятельности операции. Для ускорения интеграции элементов с тканями организма и органического соединения в отдаленные сроки с никелид-титановой тканью монолитное тело элемента жесткости предпочтительно покрывать слоем проницаемо-пористого никелида титана. В постоперационный период пористая структура пропитывается жидкостями организма, трансформируемыми впоследствии в соединительную ткань, аналогично процессу, происходящему в ячеистой структуре никелид-титановой ткани. Таким образом, медиальная поверхность ребра жесткости срастается с поддерживаемой им никелид-титановой тканью, латеральная - с покровными тканями дефекта.
Облегченный вариант конструкции ребра жесткости выполняют в виде ряда параллельно расположенных никелид-титановых отрезков проволоки, сформованных, также в продольном направлении, по кривизне замещаемой стенки. Для ускорения тканевой интеграции поверхность проволоки также целесообразно покрывать пористым слоем никелида титана. Фиксацию отрезков проволоки к никелид-титаной ткани можно осуществлять внедрением их в структуру ткани на манер арматуры. В этом случае исключается интраоперационное действие шовной фиксации, ребра жесткости, сокращаются время операции и заботы хирурга.
Укрывание дефектов грудной клетки и черепа никелид-титановой тканью имеет следствием длительное (постоянное) взаимодействие тканей органов грудной клетки и головного мозга с инородным телом. В уровне техники нет уверенных сведений об ожидаемых результатах такого контакта. Таким образом, предлагаемое техническое решение не основано на известных специалисту рекомендациях, что свидетельствует о соответствии его критерию патентоспособности «изобретательский уровень».
На иллюстрациях представлено:
Фиг.1. Имплантат для пластики пострезекционных окончатых дефектов стенок грудной клетки и/или свела черепа. 1 - лоскут никелид-титановой ткани, 2 - ребро жесткости.
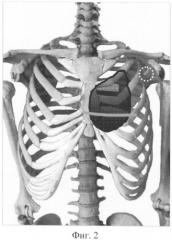
Фиг.2. Больной Б., схема резекции передней стенки грудной клетки.
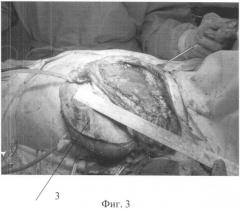
Фиг.3. Рабочий момент операции. 3 - торако-дорзальный лоскут.
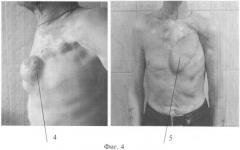
Фиг.4. Фото больного Б. 4 - после комбинированного лечения, 5- после операции.
Фиг.5 Больной Л., схема резекции передней стенки грудной клетки.
Фиг.6. Больной Г., пластика обширного дефекта затылочной области черепа. Рабочий момент операции.
Фиг.7. Фото больного Г. 6 - после комбинированного лечения, 7 - после операции.
Примерами конкретной реализации предлагаемого способа являются операции по удалению злокачественных опухолей стенки грудной клетки и свода черепа, проведенные в НИИ онкологии ТНЦ СО РАМН.
Пример 1.
Больной Б., 68 лет, с 1993 г. находился под наблюдением и комбинированным лечением по поводу злокачественной фиброзной гистицистомы стенки грудной клетки. За этот период больному выполнено 7 операций, 3 курса смешанной лучевой терапии (интраоперационная лучевая терапия и дистанционная гамма-терапия с курсовой дозой 40-50 Изо Гр), 8 курсов полихимиотерапии. После очередного рецидива болезни (фиг.4, поз.4) 8.11.2007 г. больному выполнена операция: широкая окончатая резекция грудной стенки и пластика образованного дефекта по предлагаемому способу. Границы резекции (фиг.2): левая - II, III, IV ребра, хрящевые отрезки V, VI ребер, правая - тело грудины на 2/3 ширины. Размеры окончатого дефекта -14×10(8) см.
Для пластики дефекта использован выкроенный по размерам и форме дефекта лоскут ткани (фиг.1, поз.1), сотканный из никелид-титановой проволоки - нити диаметра 60 мкм, размер ячеек 0,1 мм, а также ленточное ребро жесткости (фиг.1, поз.2) из никелида титана, с наложенными с медиальной и латеральной стороны слоями проницаемо-пористого никелида титана. Толщина слоев соответственно 1 и 0,5 мм. Вся трехкомпонентная композиция скреплена спирально-циркулярным обвивом ее никелид-титановой проволокой.
Пластика дефекта проведена следующим образом: лоскут никелид-титановой ткани 1 (фиг.1) наложен на образованный окончатый дефект встык с мягкими маргинальными тканями и фиксирован к ним узловыми комбинированными швами, умеренным натяжением, викриловыми и никелид-титановыми нитями. Поверх лоскута установлено ребро жесткости 2 (фиг.1) с наложением его концов на края дефекта над костными структурами (фиг.2). Позиция ребра жесткости выбрана несимметрично относительно дефекта и снижена книзу, в область большей дыхательной подвижности стенки грудной клетки. Ребро жесткости фиксировано к никелид-титановой ткани узловыми швами (фиг.3).
Рана поверх имплантата герметизирована путем подшивания широчайшей мышцы к мягким тканям стенки грудной клетки и укрыта торако-дорзальным лоскутом с наложением микроанастомозов его сосудов с подлопаточными сосудами. Установлены два дренажа - в синус и к месту резекции в плевральной полости. Гистологические исследования подтвердили диагноз заболевания - злокачественная фиброзная гистиоцистома G3, 1-я степень патоморфоза.
В послеоперационный период (швы сняты на 9-е сутки) признаков осложнения не отмечено. Дыхательной недостаточности и флотации грудной стенки нет. Состояние больного и его внешний вид нормальные (фиг.4, поз.5).
Пример 2.
Больной Л., 38 лет. Признаки заболевания с 2000 г., появление опухоли кожи в проекции большой грудной мышцы, язвенный дефект под корочкой. В 2004 г. установлен диагноз: плоскоклеточный рак кожи T4N1MO. До 2007 г. проведены 2 курса полихимиотерапии, иссечение опухоли с резекцией большой грудной мышцы, подключичной и подмышечной диссекцией, 4 сеанса фотодинамической терапии на область язвенного дефекта.
Прогрессирование болезни предписало радикальное хирургическое вмешательство. В 2007 г.произведена операция по методике предлагаемого способа.
Резецирована передняя грудная стенка по границам: нижняя граница - II межреберье и проксимальнее на 1-1,5 см тела грудины, верхне-латеральная - II ребро по передне-асиллярной линии, средняя часть ключицы, верхняя - передняя группа мышц шеи, I ребро, медиальная - суставной конец ключицы, хрящевые отрезки I и II ребер (фиг.5).
Произведен тупой и острый пневмолиз легкого, подпаянного к грудной стенке, герметизация паренхимы легкого Z-образным швом, резекция подключичной вены на протяжении 3 см - место опухолевой инфильтрации.
Размеры образованного окончатого овалообразного дефекта реберного каркаса 12×8 см; мягких тканей - 25×15 см. Реконструктивное замещение стенки грудной клетки осуществлено поэтапно, в соответствии с предлагаемым способом. Образованный дефект укрыт лоскутом никелид-титановой ткани, поверх которого установлено ребро жесткости с опорой его на опил 1-го ребра и грудину. Лоскут фиксирован к краям дефекта и скреплен викриловой нитью с ребром жесткости. Установлены 2 дренажа: в левую плевральную полость и к опилу грудины. Мягкотканевый дефект герметически укрыт торако-дорзальным лоскутом на сосудистой ножке размером 25×13 см, который подшит узловыми швами викриловой нитью 1.0 к краям дефекта и к никелид-титановой ткани.
В постоперационный период заживление в месте пластики - первичным натяжением, в месте забора торако-дорзального лоскута - под корочкой. Швы сняты на 13 сутки. Признаков дыхательной недостаточности не было.
Пример 3.
Больной Г., 41 год. Диагноз заболевания: рак кожи затылочной области слева T2NOMO, дефект костей свода черепа (размеры 4×6 см) с обнажением твердой мозговой оболочки (фиг.7, поз.6). С 2001 г., когда была обнаружена и развивалась болезнь, проведены 2 курса дистанционной лучевой терапии, иссечение опухоли, 2 курса полихимиотерапии. По поводу продолженного роста опухоли в 2008 г. проведена хирургическая операция по методике предлагаемого способа. Способ осуществлен следующим образом: выполнена резекция затылочной и теменной костей с образованием овального дефекта 8х7 см. Дефект укрыт лоскутом никелид-титановой ткани и укреплен поверх ткани никелид-титановым ребром жесткости (фиг.6). Лоскут фиксирован узловыми швами к надкостнице и мягким тканям, ребро жесткости - к ткани лоскута. Рана с имплантатом укрыта свободным торако-дорзальным лоскутом, запитанным через микроанастомозы с височными сосудами. Рана дренирована вакуумной системой.
Послеоперационное заживление раны - первичным натяжением. Через 20 суток после операции больному проведена дистанционная гамма-терапия суммарной очаговой дозы 40 Гр. Семимесячное наблюдение больного признаков рецидива болезни не выявило.
Приведенные примеры свидетельствуют о высокой состоятельности предлагаемого способа, а его техническая клиническая готовность - о соответствии предложения критерию изобретения «промышленная применимость».
1. Способ пластики обширных пострезекционных окончатых дефектов стенок грудной клетки и/или свода черепа путем замещения резецированной стенки биосовместимыми имплантатами, отличающийся тем, что замещение резецированной стенки осуществляют лоскутом никелид-титановой ткани, который накладывают на образованный пострезекционный дефект и фиксируют к его краям, укладывают поверх и поперек лоскута никелид-титановой ткани, по крайней мере, один ленточный, анатомически сформованный никелид-титановый элемент жесткости, опирают его концами на костные структуры краев пострезекционного окончатого дефекта и фиксируют к лоскуту никелид-титановой ткани.
2. Способ по п.1, отличающийся тем, что в качестве элемента жесткости используют ленту из монолитного никелида титана, покрытую с обеих сторон слоем пористого никелида титана.
3. Способ по п.1, отличающийся тем, что в качестве элемента жесткости используют ряд параллельно расположенных никелид-титановых проволочных отрезков.