Эмульсия перфторорганических соединений медицинского назначения, способ ее приготовления и способ ее применения
Иллюстрации
Показать всеЗаявленное изобретение относится к химико-фармацевтической промышленности и касается эмульсии перфторорганических соединений (ПФОС) для биологических и медицинских целей, содержащей смесь перфторуглеродов (ПФУ), основным компонентом которой является перфтордекалин (ПФД) и смесь перфторированных третичных аминов (ПФТА), основным компонентом которой является перфтор-N-(4-метилциклогексил)-пиперидин (ПФМЦП), имеющий меньшие, чем ПФД, скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, отличающейся тем, что все компоненты ПФОС имеют значения критической температуры растворения в гексане (ТкрГ), различающиеся не более чем на 2-4°С, а стабилизирующий агент представляет собой смесь блок-сополимеров из группы блок-сополимеров полиоксиэтилена-полиоксипропилена со средним массовьм содержанием полиоксипропилена 20%. Изобретение также касается способа получения эмульсии и способа лечения с применением заявленной эмульсии. Эмульсии обладают высокой стабильностью и нетоксичны. 3 н. и 18 з.п. ф-лы, 5 табл., 2 ил.
Реферат
Заявляемая группа изобретений относится к области биомедицины, трансфузиологии, фармакологии, биофизики, в частности к лекарственным средствам на основе эмульсии перфторорганических соединений (ПФОС), предназначенным для лечения системных и локальных нарушений кровотока, гипоксических и ишемических состояний, улучшения массообмена газов и метаболитов между кровью и тканями, поддержания функции изолированных органов и тканей, уменьшения явлений воспаления, проведения инфузионно-трансфузионной терапии при шоке и кровопотере.
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ, СИМВОЛОВ, ЕДИНИЦ И ТЕРМИНОВ, ИСПОЛЬЗОВАННЫХ В НАСТОЯЩЕЙ ЗАЯВКЕ
| НАС | Насыщающая аффинная сепарация |
| СА | Поверхностно-активное вещество |
| П-168, П-268, | Блок-сополимер полиоксиэтилена и полиоксипропилена |
| P1F-268 | Проксанол 168, проксанол 268, плюроник F68 |
| ПОП | Полиоксипропиленовый блок проксанола |
| ПОЭ | Полиоксиэтиленовый блок проксанола |
| ПФД | Перфтордекалин |
| ПФДЭ | Перфтордигексиловый эфир |
| ПФМЦП | Перфторметилциклогексилпиперидин |
| ПФОБ | Перфтороктилбромид |
| ПФОС | Перфторорганические соединения |
| ПФТА | Перфторированные третичные амины |
| ПФТБА | Перфтортрибутиламин |
| ПФТПА | Перфтортрипропиламин |
| ПФУ | Перфторуглероды |
| ПФЭ | Перфторированные эфиры |
| РЭС | Ретикуло-эндотелиальная система |
| СА | Стабилизирующий агент |
| ТкрГ | Температура критического растворения в гексане |
| ФЛ | Фосфолипиды |
| ⌀ | Средний диаметр частиц |
| IR | Индекс реактогенности |
Используемые в биологии и медицине ПФОС представляют собой полностью фторированные органические соединения разных классов, включающие перфторуглероды (ПФУ) - соединения, содержащие атомы только фтора и углерода, перфторированные третичные амины (ПФТА), в которых наряду с атомами фтора и углерода имеется атом азота, а также перфторированные эфиры, в структуре которых имеются атомы кислорода. В последние годы используются также бромсодержащие ПФОС. Жидкие ПФОС прозрачные, бесцветные, без запаха, примерно в 2 раза тяжелее воды. Высокая прочность связи C-F (485,6 кДж/моль) обеспечивает химическую стабильность ПФОС и слабые силы межмолекулярного взаимодействия (1, 2). Последнее свойство обеспечивает повышенную способность ПФОС растворять различные газы.
ПФОС практически не растворяются в H2O, однако некоторые ПФОС слаборастворимы в липидах - липофильные ПФОС. Все виды ПФОС не подвергаются метаболическим превращениям в организме человека и животных. Вопрос о стабильности и отщепление атома брома и, следовательно, возможности распада оставшейся без брома молекулы в литературе не обсуждался. Липофильные ПФОС, а среди них наиболее липофильным является перфтороктилбромид (ПФОБ), вследствие физического взаимодействия с биологическими мембранами и гидрофобными участками белковых молекул могут оказывать выраженное влияние на метаболизм и многие функции клеток, тканей организма в целом (3, 4, 5, 6). Согласно данным L.Clark (7), подтвержденным позже А.Н.Склифас и др (8), включение в состав эмульсии наряду с липофильным ПФД других липофильных ПФОС может приводить к гибели животных через несколько месяцев после внутривенного введения таких эмульсий.
Известно, что для ликвидации этого смертельного эффекта к липофильным перфторорганическим соединениям предлагается добавлять липофобное перфторорганическое соединение, например, перфтор-N-(4-метициклогексил)-пиперидин (8, 9). Однако при этом возникает проблема подбора эмульгатора, так как липофильные перфторорганические соединения стабилизируются фосфолипидами, а липофобные перфторорганические соединения - блоксополимерами окисиэтилена и окисипропилена (плюроником F-68 - по западной классификации; проксанолом 268 - по российской номенклатуре). Кроме того, использование смеси резко различающихся по физико-химическим свойствам веществ (липофилильных и липофобных) существенно уменьшает стабильность эмульсии при хранении (замораживании-оттаивании, или длительном хранении в незамороженном виде) и при попадании эмульсии в кровоток. Расчеты и модельные эксперименты (10) дают основание полагать, что это связано с кластеризацией недостаточно однородной смеси веществ внутри частиц эмульсии и постоянным турбулентным движением фторуглеродной фазы вблизи адсорбционного слоя поверхностно-активного компонента - стабилизирующего агента.
Введенные внутривенно в виде эмульсий ПФОС довольно быстро выводятся из кровотока. Основная масса ПФОС выводится через легкие. Поэтому те ПФОС, которые имеют относительно высокую упругость пара (они же, как правило, отличаются большей липофильностью), могут вызывать эмфизему легких вплоть до разрыва отдельных альвеол и нарушения газообмена и кровотока в ткани легких. До 30% введенных в организм в составе эмульсий ПФОС захватываются клетками ретикуло-эндотелиальной системы (РЭС) - преимущественно в печени, селезенке, костном мозге, лимфатических узлах, а также частично растворяются в жировой ткани и фосфолипидах мембран практически всех клеток. Аккумулированные таким образом ПФОС задерживаются в органах и тканях на срок от нескольких дней (ПФОБ, ПФД) до нескольких лет (ПФТБА) в зависимости от физико-химических свойств ПФОС и дозы введенной эмульсии. Скорость выведения ПФОС из органов зависит от ряда связанных между собой физико-химических параметров: структуры, молекулярной массы (ММ), температуры кипения, упругости пара, а главным образом от параметра, определяемого как критическая температура растворения ПФОС в гексане (ТкрГ). ТкрГ - это температура, при которой смешиваются друг с другом равные объемы исследуемого соединения и гексана. ТкрГ рассматривают как меру относительной растворимости ПФОС в липидах, которая характеризует как степень их растворения в липидах мембран, скорость их прохождения через мембраны, так и степень сродства с гидрофобными участками белковых молекул.
Чем ниже ТкрГ, меньше ММ и выше упругость пара, тем лучше данное ПФОС растворимо в липидах, быстрее диффундирует и тем оно легче и быстрее выводится из организма. Прослежена хорошая корреляция между указанными параметрами и периодом полувыведения (t1/2) ПФОС из клеток РЭС. В настоящее время внимание исследователей, занятых разработкой и изучением эмульсий ПФОС, сосредоточено на относительно небольшом числе соединений (таблица 1).
| Таблица 1 | ||||
| Значения критической температуры растворения в гексане (ТкрГ), упругости пара (Р) и периода полувыведения из органов (t1/2) для различных ПФОС [1] | ||||
| Вид ПФОС | мм | ТкрГ, °С | Р, мм рт.ст. (37°) | t1/2, сутки |
| F-октилбромид | 493 | -20 | 10,5 | 4 |
| F-Бицикло[4.3.0]нонан | 412 | 13 | 33 | 4 |
| F-Декалин | 462 | 22 | 12 | 7 |
| F-Декагидроаценафтен | 524 | 24 | 2 | 7 |
| F-1-пропил-2 метилпиперидин | 483 | 35 | 19 | 24 |
| F-Трипропиламин | 521 | 43 | 17 | 65 |
| F-N-(4-метилциклогексилпиперидин) | 595 | 40 | 1 | 90 |
| F-Трибутиламин | 671 | 61 | 1 | 900 |
| F-Дигексиловый эфир | 652 | 59 | 2 | 500 |
При изготовлении эмульсий для внутрисосудистого введения большинство специалистов отдает предпочтение быстро выводящимся липофильным ПФОС (2, 10, 11, 12, 13, 14), имеющим относительно малую величину ТкрГ, включая высоколипофильный ПФОБ. Однако в состав «Fluosol DA», выпускаемого в 70-80 гг. фирмой Green Cross Corporation (Japan), наряду с быстро выводящимся ПФД входил и относительно медленно выводящийся ПФТПА (12). В состав «Oxygent», разработанного фирмой Alliance Therapeutic (USA), входят высоколипофильный ПФОБ и ПФДБ (13, 14). Коммерческий фармакопейный препарат «Перфторан», разработанный в СССР и выпускаемый в аптечную сеть компанией ОАО НПФ «Перфторан», наряду с быстро выводящимся ПФД содержит ПФМЦП относительно долго задерживающийся в клетках РЭС (6).
Следует отметить, что собственно эмульсии ПФОС, несмотря на химическую и метаболическую инертность входящих в них компонентов, имеют также выраженную биологическую активность, которая определяется не только свойствами собственно компонентов, но в значительной степени зависит от формируемой поверхностно-активным веществом (СА) границы раздела фаз, наличия СА или его дисперсии в водном фазе, от стабильности адсорбционного слоя, а также от степени дисперсности эмульсии, которая может выполнять роль огромной сорбционной и обменной каталитически активной поверхности. Введенная в организм эмульсия фактически привносит в кровоток и в мембраны огромную гидрофобную фазу, которая может выполнять роль среды для осуществления различных реакций между соединениями, имеющими повышенную растворимость в гидрофобной фазе. Иными словами, эмульсия ПФОС может стимулировать явления микрокатализа, протекающие в гидрофобной фазе или на границе раздела фаз.
Поскольку жидкие ПФОС не растворяются в воде и в них не растворяются полярные соединения, играющие важнейшую роль в гомеостазе биологических объектов, постольку ПФОС могут вводиться в кровоток лишь в виде тонко диспергированной эмульсии. Способность ПФОС и эмульсий ПФОС участвовать в газообмене определяется физическим растворением газов, и согласно закону Генри количество растворенного газа прямо пропорционально его парциальному давлению. Количество газа, растворенного в эмульсии ПФОС, зависит от объемного содержания фторуглеродной фазы и не зависит от размера частиц. Так, количество растворенного в эмульсиях ПФОС газа, определяемого экспериментально, практически равно расчетным значениям, получаемым при сложении значений содержания этого газа в каждой фазе в отдельности (количество растворенного кислорода в водной фазе плюс количество растворенного газа в ПФОС) при данной величине парциального давления газа. Таким образом, количество любого газа, содержащегося в эмульсии ПФОС, может быть рассчитано в соответствии с физическими законами их растворимости, исходя из парциального давления газа и объемного соотношения фракций ПФОС/Н2О. Благодаря субмикронному размеру эмульсий ПФОС, при их введении в кровоток более чем на порядок возрастает площадь поверхностей, участвующих в газообмене. Вместе с почти десятикратным по сравнению с гемоглобином в эритроцитах ускорением процессов насыщения и отдачи кислорода это способствует значимому ускорению массобмена по кислороду и углекислому газу, даже в том случае, если доза введенной в кровоток эмульсии, содержащей всего 10 об.% ПФОС, не превышает 1-5% от объема циркулирующей крови.
Лечебная эффективность эмульсий ПФОС, описанная в экспериментальных и клинических исследованиях, выполненных с Fluosol-DA (12) и Перфтораном (6, 15), ограничена их возможным побочным действием. Следующие факторы ограничивают лечебное использование эмульсий ПФОС как лекарственных препаратов. Во-первых, еще в 1971 Fujita (12) установил, что при размере частиц эмульсии более 0,1 мкм резко возрастает их токсичность, что, вероятно, обусловлено тромбоэмболическими осложнениями. При увеличении доли крупных частиц (со средним диаметром, превышающим 0,4 мкм) с 3% до 10% ЛД50 для эмульсий ПФОС снижается более чем в 2 раза. Значимость размера частиц для переносимости эмульсий показал С.И.Воробьев (16), установивший, что увеличение размера частиц, даже если их доля составляет всего 1-2%, приводит к появлению реактогенности, проявляющейся в развитии анафилактоидных реакций уже после введения первых капель эмульсии в кровоток. Проявления анафилактоидной реакций могут быть разными по степени выраженности - легкими, средники и тяжелыми: от покраснения кожи и легких аллергических проявлений вплоть до остановки дыхания.
По результатам исследования жировых эмульсий и Fluosol DA большинство исследователей считают, что реактогенность определяется природой стабилизирующего агента - СА, используемого для диспергирования ПФОС и формирующего адсорбционный слой вокруг частиц. Полагают, что ответственным за реактогенность является неионогенный СА блок-сополимер полиоксиэтилена (ПОЭ) и полиоксипропилена (ПОП) Pluronic F 68, формально являющийся аналогом проксанола 268, и что его замена на природные фосфолипиды может полностью снять проблемы реактогенности. Однако известно, что жировые эмульсии, стабилизированные природными фосфолипидами, обладают в большинстве своем реактогенностью. Следовательно, реактогенность эмульсий ПФОС не может быть ликвидирована только за счет использования фосфолипидов в качестве эмульгатора и стабилизатора частиц ПФОС. Согласно патенту (17) реактогенность эмульсий ПФОС помимо степени дисперсности определяется, прежде всего, свойствами поверхности эмульгированных частиц, то есть состоянием слоя эмульгатора, стабилизирующего частицы. Ведущими параметрами при этом являются прочность связи СА с масляным фторуглеродным «ядром» частиц эмульсии, характер расположения молекул СА на поверхности, плотность их упаковки, устойчивость адсорбционных свойств по отношению к белкам и другим биологически активным молекулам, находящимся в кровотоке. Для получения нужного соответствия в указанном патенте предлагается опытным путем подбирать состав масляного «ядра», композицию ПФОС и взаимодействующего с ним СА. Однако эмпирический подбор и установленные в результате сочетания ПФОС и СА в любом случае оставляют неопределенным широкий диапазон вариаций стабильности эмульсий ПФОС вследствие вариабельности химических технологий получения ПФОС и СА, а также, казалось бы, незначительных отклонений в технологии диспергирования.
Основные причины вариаций состава СА заключаются в самой природе полимерных и фосфолипидных СА. Важным дестабилизирующим фактором является также наличие внутри масляной фазы ПФОС постоянных турбулентных потоков, возникающих при смешивании разнородных ФСПО, включенных в состав масляного «ядра»: из смеси липофильных и липофобных ПФОС, существенно отличающихся по величине ТкрГ.
С целью повышения стабильности и уменьшения реактогенности эмульсий ПФОС согласно патенту РФ №2206319 (18), который выбран в качестве прототипа, было предложено увеличить однородность «маслянного» ядра путем использования добавок ПФОС, близких к основным компонентам ПФД и ПФМЦП по структуре и несколько уменьшающих различия между ПФД и ПФМЦП по величине ТкрГ. Однако диапазон различий в величинах ТкрГ между ПФОС, использованными в составе по патенту РФ № 2206319, остается более 10°С - достаточно большим. Экспериментальный анализ, выполненный с помощью тепловизионого высокочувствительного матричного детектора показал, что при таком разрыве по величине ТкрГ в смеси ПФОС, использованных в эмульсии по патенту РФ № 2206319, наблюдаются весьма интенсивные турбулентные движения во фторуглеродной фазе.
Задачей заявляемой группы изобретений, связанных единым изобретательским замыслом, является создание стабильной эмульсии ПФОС в первую очередь за счет уменьшения различий в величинах ТкрГ внутри фторуглеродной самосборки за счет адсорбционной сепарации, в соответствии с видом используемых ПФОС ядра частиц эмульсии и изменения состава стабилизирующего агента. Решение поставленной задачи достигается с помощью оригинального метода получения эмульсии.
Сущность изобретения в части эмульсии перфторорганических соединений (ПФОС) для биологических и медицинских целей состоит в том, что она содержит смесь перфторуглеродов (ПФУ), основным компонентом которой является перфтордекалин (ПФД) и смесь перфторированных третичных аминов (ПФТА), основным компонентом которой является перфтор-N-(4-метилциклогексил)-пиперидин (ПФМЦП), имеющий меньшие, чем ПФД, скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, причем все компоненты ПФОС имеют значения критической температуры растворения в гексане (ТкрГ), различающиеся не более чем на 2-4°С, а стабилизирующий агент представляет собой смесь блок-сополимеров из группы блок-сополимеров полиоксиэтилена-полиоксипропилена со средним массовым содержанием полиоксипропилена 20%, при этом в смеси ПФД содержатся только полностью фторированные примеси ПФУ, получаемые при синтезе ПФД, а в смеси ПФМЦП - только полностью фторированные примеси ПФТА, а также, по меньшей мере, один компонент из группы: смеси перфтортрипропиламина (ПФТПА) только с полностью фторированными примесями ПФТА, смеси перфтортрибутиламина (ПФТБА) только с полностью фторированными примесями ПФТА, смеси перфтордецилового эфира (ПФДЭ) только с полностью фторированными примесями перфторированных эфиров (ПФЭ).
В частных случаях реализации эмульсия в качестве перфторуглеродов содержит смесь перфторированных копродуктов перфтордекалина, имеющих средний период полувыведения из организма не менее 12 дней и диапазон ТкрГ в пределах 22-29°С, очищенную от водородсодержащих и непредельных примесей, в качестве перфторированных третичных аминов она содержит смесь всех копродуктов перфтортрипропиламина, имеющих средний период полувыведения из организма не менее 60 дней и диапазон ТкрГ в пределах 41-46°С, очищенную от водородсодержащих и непредельных примесей, или в качестве перфорированных третичных аминов она содержит смесь копродуктов перфтор-N-(4-метилциклогексил)-пиперидина, имеющих средний период полувыведения из организма не менее 80 дней и диапазон ТкрГ в пределах 32-40°С, очищенную от водородсодержащих и непредельных примесей, в качестве медленно выводящихся ПФОС она содержит смесь копродуктов перфтордецилового эфира (ПФДЭ), имеющих средний период полувыведения из организма не менее 500 дней и диапазон ТкрГ в пределах 49-53°С, очищенную от водородсодержащих и непредельных примесей, в качестве перфторированных третичных аминов она может содержать смесь копродуктов перфтортрибутиламина, имеющих средний период полувыведения из организма не менее 900 дней, и диапазон ТкрГ в пределах 56-60°С, очищенную от водородсодержащих и непредельных примесей, соотношение содержащихся в ней быстро выводящихся и медленно выводящихся ПФОС составляет от 5:1 до 1:5, в качестве стабилизирующего агента она содержит смесь отобранных методом насыщающей аффинной сепарации (НАС) сополимеров полиоксиэтилена (ПОЭ)-полиоксипропилена (ПОП) с молекулярной массой 5-13 тыс. Да, в качестве стабилизирующего агента она содержит смесь отобранных методом НАС сополимеров ПОЭ и ПОП при соотношении ПОЭ:ПОП в диапазоне от 78:22 до 82:18, содержание стабилизирующего агента в ней составляет 1-5%, для обеспечения вязкости 2-5 сП, а физиологически приемлемый водно-солевой раствор включает NaCl, KCl, MgCl2, NaHCO3, NaH2PO4, Na2HPO4D-глюкозу для обеспечения изоосмотичности в конечной лекарственной форме, при этом поддерживается соотношение ионов Na и К на уровне 10:1-30:1 и величина рН в диапазоне 6,9-8,0, водно-солевая часть готовой конечной лекарственной формы содержит 110-150 мМ NaCl, 4-5 мМ KCl, 1-3 мМ MgCl2 6-20 мМ NaHCO3, 1-2 мМ NaH2PO4, 1-2 мМ Na2HPO4 и 10-15 мМ D-глюкозы, а для использования в качестве противоишемического протектора водно-солевая часть препарата содержит 4-15 мМ KCl, соли три-, ди- и монокарбоновых кислот, в том числе 1-7 мМ цитрата натрия, 1-7 мМ изоцитрата натрия, 1-7 мМ сукцината натрия, 1-7 мМ α-кетоглутарата натрия, 1-7 мМ пирувата натрия, 1-7 мМ β-оксибутирата натрия, 1-7 мМ глутамата натрия, 1-7 мМ аспартата натрия.
Сущность изобретения в части способа приготовления эмульсии ПФОС (в соответствии с вышеизложенной совокупностью признаков эмульсии) для биологических и медицинских целей включает смешивание и диспергирование смеси жидких ПФОС с водным раствором стабилизирующего агента с последующим измельчением в гомогенизаторе высокого давления до субмикронного размера частиц эмульсии, причем:
- смесь ПФОС, имеющую различия по ТкрГ не более 2-3°С, заливают в емкость, содержащую раствор смеси СА в соотношении 10-30 объемных частей ПФОС к 90-70 объемам раствора смеси СА,
- полученную неоднородную смесь подвергают процедуре НАС, проводимой при температуре 50-60°С, включающей получение грубой дисперсии ПФОС в растворе СА путем перемешивания на высокоскоростной мешалке при скорости вращения ротора при 1000-3000 об/мин, полученную грубую дисперсию подвергают экструзии в гомогенизаторе под давлением 100-300 кг/см2, в атмосфере, не содержащей кислород, и отделяют грубую дисперсию ПФОС от водного раствора СА, полученный осадок грубой дисперсии смешивают со свежей порцией раствора СА из такого расчета, чтобы объемная доля ПФОС составляла 10-30%,
- при этом описанная операция НАС повторяется не менее 2 раз,
- после чего эмульсию пропускают многократно через гомогенизатор при давлении 300-700 кг/см2,
- полученную субмикронную эмульсию разбавляют водно-солевым раствором таким образом, чтобы конечная концентрация ПФОС составляла 4-12 об.% и эмульсия имела осмотическое давление в диапазоне 270-330 мОсм.
В частных случаях реализации способа смеси из жидких ПФУ и ПФТА или ПФЭ получают в соотношении от 5:1 до 1:5, подвергают после смешивания промыванию апирогенными водно-спиртовыми растворами и водой, отделяют смеси более плотных жидких ПФОС от водно-спиртового раствора и воды, фильтруют под давлением газа, не содержащего кислород, разливают и укупоривают во флаконы под закатку и осуществляют автоклавирование, СА приготавливают в виде 10-30% водного раствора сополимеров полиоксиэтилена-полиоксипропилена - проксанола 168 и проксанола 268, взятых в соотношении от 10:1 до 1:10 в зависимости от состава композиции смеси ПФОС, очищают раствор СА путем пропускания через угольный сорбент и стерилизующий фильтр под давлением газа, не содержащего кислород, прогревают раствор СА в течение 8-24 часов и охлаждают до 16-20°С для полного восстановления прозрачности раствора, водный раствор смеси сополимеров полиоксиэтилена-полиоксипропилена прогревают при температуре, которая выбирается в диапазоне ±2°С от температуры помутнения, установленной экспериментальным путем для полученной смеси СА.
Сущность изобретения в части способа лечения заболеваний кровеносной системы состоит в том, что осуществляют введение в кровоток или в лимфатический проток быстровыводящихся перфторорганических соединений, отличающийся тем, что в качестве быстровыводящихся перфторорганических соединений в кровоток вводят эмульсию ПФОС (в соответствии с вышеизложенной совокупностью признаков эмульсии).
В частных случаях реализации способа для лечения явлений гипоксии, ишемии, отека, воспаления при шоке, кровопотере, тромбо-эмболических поражениях, функциональных и органических нарушениях проходимости сосудов, повреждении тканей осуществляют внутривенное введение эмульсии ПФОС в дозе 0,5-30 мл на 1 кг массы тела, для подавления вторичной альтерации при воспалении и раневом процессе, а также для ускорения заживления травматических, трофических и операционных ран осуществляют внутривенное введение эмульсии ПФОС в дозах 0.3 - 6 мл на кг массы тела и/или местно порциями по 0,5-50 мл подкожно, внутримышечно, в глубину вокруг поврежденного участка или в окружающие воспаленные и травмированные ткани полости или биологические жидкости, в частности интраплеврально, интраперитонеально, интралюмбально, в общий лимфатический проток в дозе 1-100 мл, а также в качестве очищающей или аппликационной жидкости при обработке открытых раневых поверхностей, а для улучшения системного и локального кровотока, регуляции системного артериального давления и перфузионного регионарного давления, облегчения и ускорения массообмена по газам, субстратам и метаболитам осуществляют внутрисосудистое или местное введение эмульсии ПФОС в ткани, в том числе при перфузионной и бесперфузионной защите изолированных или отключенных от кровотока органов и тканей.
Таким образом, снижение основного процесса разрушения эмульсий ПФОС, вызываемого молекулярной диффузией, достигают в заявляемом составе так же, как и в других патентах (12, 17, 18), введением во фторуглеродную основу компонента с низкой упругостью пара (например, ПФМЦП или ПФТБА) и менее растворимого в воде, имеющего более высокую температуру кипения и замедляющего этот процесс. Но при этом, в отличие от прототипа, в предлагаемом изобретении максимально возможным образом ликвидируются «окна» разрыва между физико-химическими характеристиками различных ПФОС, входящих в ядро капель эмульсии, и адсорбционный слой частиц эмульсии формируется из смеси СА путем самосборки - методом насыщающей адсорбционной сепарации (НАС).
Эмульсия ПФОС для биологических и медицинских целей содержит смесь быстро выводящихся перфторуглеродов (ПФУ) с основным компонентом ПФД и смесь перфторированных третичных аминов (ПФТА) с основным компонентом перфтор-N-(4-метилциклогексил)-пиперидином (ПФМЦП), имеющим меньшие скорости выведения из организма, стабилизирующий агент и физиологически приемлемый водно-солевой раствор с субстратами энергетического обмена, ПФОС содержат дополнительно в смеси ПФД все полностью фторированные примеси ПФУ, получаемые при синтезе ПФД, в смеси ПФМЦП - все полностью фторированные примеси ПФТА, и/или дополнительно содержит перфтортрипропиламин (ПФТПА) со всеми присущими ему при получении полностью фторированными примесями ПФТА, и/или дополнительно содержит перфтортрибутиламин (ПФТБА) со всеми присущими ему при получении полностью фторированными примесями ПФТА, и/или дополнительно содержит перфтордигексиловый эфир (ПФДЭ) со всеми присущими ему при получении полностью фторированными примесями перфторированных эфиров (ПФЭ) и стабилизирующий агент в виде смеси блоксопоримеров, с возможностью образования выбранными смесями ПФОС гомогенной структуры внутри капель эмульсии, за счет того, что компоненты смеси ПФОС имеют малые различия по критической температуры растворения в гексане (ТкрГ) с интервалом не более 2-4°С.
Эмульсия ПФОС характеризуется тем, что в качестве быстро выводящихся ПФУ используется смесь всех перфторированных копродуктов перфтордекалина, имеющих средний период полувыведения из организма не менее 12 дней и диапазон ТкрГ 22-29°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве ПФТА содержит смесь всех копродуктов ПФТПА, имеющих средний период полувыведения из организма не менее 60 дней и диапазон ТкрГ 41-46°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве ПФТА содержит смесь копродуктов ПФМЦП, имеющих средний период полувыведения из организма не менее 80 дней и диапазон ТкрГ 32-40°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве медленно выводящихся ПФОС содержит смесь копродуктов ПФДЭ, имеющих средний период полувыведения из организма не менее 500 дней и диапазон ТкрГ 49-53°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что в качестве ПФТА содержит смесь копродуктов перфтортрибутиламина (ПФТБА), имеющих средний период полувыведения из организма не менее 900 дней, и диапазон ТкрГ 56-60°С, очищенная от водородсодержащих и непредельных примесей.
Эмульсия ПФОС характеризуется тем, что соотношение быстро выводящихся и медленно выводящихся ПФОС составляет 5:1 или 1:5.
Эмульсия ПФОС характеризуется тем, что в качестве стабилизирующего агента содержит смесь сополимеров полиоксиэтилена (ПОЭ)-полиоксипропилена (ПОП) с молекулярной массой 5-13 тыс. Да, формируемую (отобранных) методом насыщающей аффинной сепарации (НАС).
Эмульсия ПФОС характеризуется тем, что в качестве стабилизирующего агента содержит смесь отобранных методом НАС сополимеров ПОЭ и ПОП при массовом соотношении ПОЭ:ПОП в диапазоне от 78:22 до 82:18.
Эмульсия ПФОС характеризуется тем, что содержание стабилизирующего агента в водной фазе составляет 1-5% для обеспечения вязкости 2-5 сПуаз.
Эмульсия ПФОС характеризуется тем, что физиологически приемлемый водно-солевой раствор включает NaCl, KCl, MgCl2, NaHCO3, NaH2PO4, Na2HPO4 и D-глюкозу для обеспечения изоосмотичности в конечной лекарственной форме, при этом поддерживается соотношение ионов Na и К на уровне 8:1-30:1 и величина рН в диапазоне 6,9 - 8,0.
Эмульсия ПФОС характеризуется тем, что водно-солевая часть готовой конечной лекарственной формы содержит 110-150 мМ NaCl, 4-5 мМ KCl, 1-3 мМ MgCl2, 6-20 мМ NaHCO3, 1-2 мМ NaH2PO4, 1-2 мМ Na2HPO4 и 10-15 мМ D-глюкозы.
Эмульсия ПФОС характеризуется тем, что в случае использования в качестве противоишемического протектора водно-солевая часть содержит 4-15 мМ KCl, 10-20 мМ D-глюкозы и соли три-, ди- и монокарбоновых кислот, в том числе 1-7 мМ цитрата натрия, 1-7 мМ изоцитрата натрия, 1-7 мМ сукцината натрия, 1-7 мМ α-кетоглутарата натрия, 1-7 мМ пирувата натрия, 1-7 мМ β-оксибутирата натрия, 1-7 мМ глутамата натрия, 1-7 мМ аспартата натрия.
Способ приготовления эмульсии ПФОС для биологических и медицинских целей реализуется путем смешивания и диспергирования смеси жидких ПФОС с водным раствором стабилизирующего агента с последующим измельчением в гомогенизаторе высокого давления до субмикронного размера частиц эмульсии, причем:
- смесь ПФОС, содержащую компоненты, различающиеся по ТкрГ не более чем на 4°С, заливают в емкость, содержащую раствор смеси СА в соотношении 10-30 объемных частей ПФОС к 90-70 объемам раствора смеси СА,
- полученную неоднородную смесь подвергают процедуре НАС, проводимой при температуре 50-60°С, включающей получение грубой дисперсии ПФОС в растворе смеси СА путем перемешивания на высокоскоростной мешалке при скорости вращения ротора 1000-3000 об/мин; полученную грубую дисперсию подвергают экструзии в гомогенизаторе под давлением 100-300 кг см2, в атмосфере, не содержащей кислород, и отделяют грубую дисперсию ПФОС от водного раствора СА; полученный осадок грубой дисперсии смешивают со свежей порцией раствора СА из такого расчета, чтобы объемная доля ПФОС составляла 10-30%,
- при этом описанная операция НАС повторяется не менее 2 раз,
- после чего эмульсию пропускают многократно через гомогенизатор при давлении 300-700 кг/см2,
- полученную субмикронную эмульсию разбавляют водно-солевым раствором таким образом, чтобы конечная концентрация ПФОС составляла 4-12 об.% и эмульсия имела осмотическое давление в диапазоне 270-330 мОсм на л.
Способ приготовления эмульсии ПФОС реализуется таким образом, что смеси из жидких ПФУ и ПФТА или ПФЭ получают в соотношении от 5:1 до 1:5, подвергают после смешивания промыванию апирогенными водно-спиртовыми растворами и водой, отделяют смеси более плотных жидких ПФОС от водно-спиртового раствора и воды, фильтруют под давлением газа, не содержащего кислород, разливают и укупоривают во флаконы под закатку и осуществляют автоклавирование.
Способ приготовления эмульсии ПФОС реализуется таким образом, что смесь СА приготавливают в виде 10-30% водного раствора блоксополимеров полиоксиэтилена-полиоксипропилена - смеси проксанола 168 и проксанола 268, взятых в соотношении от 10:1 до 1:10 в зависимости от состава композиции смеси ПФОС, очищают раствор СА путем пропускания через угольный сорбент и стерилизующий фильтр под давлением газа, не содержащего кислород, прогревают раствор СА в течение 8-24 часов и охлаждают до 16-20°С для полного восстановления прозрачности раствора.
Способ приготовления эмульсии ПФОС реализуется таким образом, что водный раствор смеси блоксополимеров полиоксиэтилена-полиоксипропилена прогревают при температуре, которая выбирается в диапазоне ±2°С от температуры помутнения, установленной экспериментальным путем для полученной смеси СА.
Способ применения эмульсии ПФОС для уменьшения явлений гипоксии, ишемии, отека, воспаления при шоке, кровопотере, тромбо-эмболических поражениях, функциональных и органических нарушениях проходимости сосудов, повреждении тканей реализуется путем внутривенного введения в дозе 0,5-30 мл на 1 кг массы тела.
Способ применения эмульсии ПФОС для подавления вторичной альтерации при воспалении и раневом процессе, а также для ускорения заживления травматических, трофических и операционных ран реализуется путем внутривенного введения в дозах 0.3-6 мл на кг массы тела и/или местно порциями по 0,5-50 мл подкожно, внутримышечно, в глубину вокруг поврежденного участка или в окружающие воспаленные и травмированные ткани полости или биологические жидкости, в частности интраплеврально, интраперитонеально, интралюмбально, в общий лимфатический проток в дозе 1-100 мл, а также в качестве очищающей или аппликационной жидкости при обработке открытых раневых поверхностей.
Способ применения эмульсии ПФОС для улучшения системного и локального кровотока, регуляции системного артериального давления и перфузионного регионарного давления, облегчения и ускорения массообмена по газам, субстратам и метаболитам реализуется путем внутрисосудистого или местного введения в ткани, а также при перфузионной и бесперфузионной защите изолированных или отключенных от кровотока органов и тканей.
Снижение основного процесса разрушения эмульсий ПФОС, вызываемого молекулярной диффузией, достигают обычно путем введения во фторуглеродную основу компонента ПФОС с низкой упругостью пара (например, ПФМЦП или ПФТБА) и менее растворимого в воде, имеющего более высокую температуру кипения и замедляющего этот процесс. Однако это приводит к появлению неоднородностей во фторуглеродной фазе, уменьшающих стабильность эмульсий. С целью повышения стабильности эмульсий ПФОС в предлагаемом изобретении используются такие смеси ПФОС, которые существенным образом повышают однородность «масляной фазы» и способствуют формированию адсорбционного слоя из смеси СА методом насыщающей аффинной сепарации, когда происходит физическая самосборка и обогащение адсорбционного слоя частиц эмульсии наиболее подходящими для данной композиции ПФОС молекулами СА, содержащимися в неоднократно обновляемой в процессе приготовления эмульсии общей смеси СА.
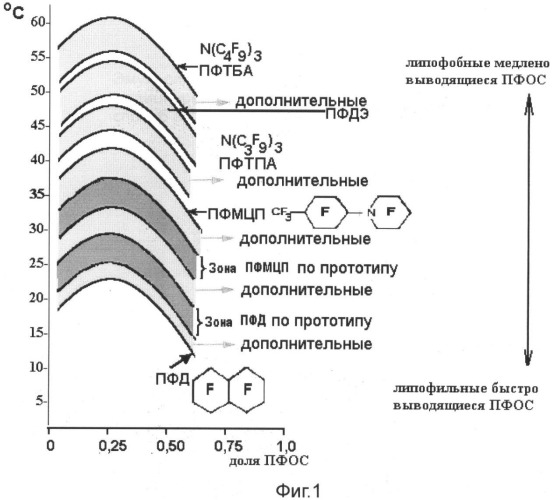
Судя по диаграммам ТкрГ для ПФОС по патенту РФ № 2206319, между ними имеется зазор более чем в 10°С, что свидетельствует о наличии довольно значимых различий в физико-химических свойствах компонентов «масляного» ядра, а следовательно, оно не является физически однородным, что проявляется в кластеризации фторуглеродной фазы и в постоянном турбулентном перемещении кластеров внутри этой фазы. С целью повышения однородности фторуглеродной фазы в предлагаемом нами изобретении используются составы ПФОС, которые практически образуют почти непрерывный ряд значений ТкрГ и тем самым существенно повышают однородность «масляной» фазы, повышают стабильность эмульсий ПФОС. При этом несколько изменяются скорости выведения ПФОС из клеток РЭС и липидов: период полувыведения ПФД при введении его в составе предлагаемых смесей возрастает в среднем на 10-15%, то есть составляет не 12-13 дней (характерных для ПФД вне указанных смесей), а 14-15 дней, тогда как, напротив, первоначальная скорость выведения ПФТА и ПФДЭ возрастает на 10-15%, а следовательно и период полувыведения уменьшается на 5-7%.
Повышение однородности масляной фазы достигается на этапе отбора ПФОС. Как известно, получение индивидуальных ПФОС в индустриальных масштабах является наиболее дорогостоящим этапом процесса превращения органических соединений в ПФОС. Проведенные В.А.Архиповым и К.Н.Макаровым исследования показали, что токсичность ПФОС для клеток человека зависит лишь от примесей водородсодержащих и непредельных соединений, то есть от наличия неполностью фторированных веществ, даже если при этом остается всего лишь один атом водорода или одна непредельная связь. Примеры формул таких соединений, встречающихся в недостаточно очищенных от примесей ПФОС, прив