Применение 5'-метилтиоаденозина (мта) для предотвращения и/или лечения аутоиммунных заболеваний и/или отторжения трансплантата
Иллюстрации
Показать всеПредложено применение 5'-метилтиоаденозин (МТА), или его фармацевтически приемлемой соли, пролекарства для изготовления лекарственного средства для лечения аутоиммунного заболевания, где указанное лекарственное средство задерживает начало вспышек заболевания у индивидуума, страдающего рассеянным склерозом (PC), или замедляет прогрессирование PC (прогрессирующая фаза) у индивидуума, страдающего PC, а также соответствующий способ. Показано, что МТА отсрочивает начало развития второй вспышки PC и повышает процент выживания. 2 и 6 з.п. ф-лы, 6 ил., 2 табл.
Реферат
Область применения данного изобретения
Данное изобретение, в целом, относится к применению 5'-метилтиоаденозина (МТА), его фармацевтически приемлемых солей и/или пролекарств для предотвращения и/или лечения аутоиммунных заболеваний, а также для предотвращения и/или лечения отторжения трансплантата и, в частности, для предотвращения и/или лечения рассеянного склероза (РС).
Предпосылки создания изобретения
Аутоиммунные заболевания представляют собой тяжелые заболевания, являющиеся причиной значительных проблем со здоровьем и проблем личностного характера, и в настоящее время представляют собой четвертую по значимости проблему со здоровьем в промышленно развитых странах. В качестве примера, рассеянный склероз (РС) является аутоиммунным заболеванием, требующим значительной медицинской помощи, что является причиной значительных осложнений. Подобным образом, отторжение трансплантата является конкретным примером аутоиммунной реакции, при которой активирование антиген-специфических Т-лимфоцитов трансплантата приводит к удалению их из организма, что представляет собой значительное осложнение для пациентов, получающих трансплантат, с высокой персональной и социальной ценой.
Благодаря своим специфическим характеристикам (механизмы и реакции на лечение), аутоиммунные заболевания формируют специфическую подгруппу в группе воспалительных заболеваний. Как хорошо известно, воспалительными заболеваниями являются такие заболевания, при которых преобладает врожденное воспаление или при которых лечение направлено на борьбу с врожденным воспалением. Однако аутоиммунные заболевания представляют собой другую форму воспалительных заболеваний, при которых преобладает воспаление в результате искусственного иммунитета (лимфоциты); следовательно, классические противовоспалительные методы лечения, нацеленные на модуляцию врожденного воспаления, являются неэффективными при лечении аутоиммунных заболеваний, по-видимому, вследствие того, что для контролирования затяжного процесса аутоиммунного заболевания необходимо, в дополнение к подавлению местного воспаления, модулировать активность лимфоцитов посредством иммуномодуляторов.
Лечение аутоиммунных заболеваний представляет собой серьезную проблему, поскольку многие схемы лечения являются симптоматическими, и способы лечения, которые смягчают течение данного заболевания, имеют частичную эффективность и побочные эффекты, а также значительную стоимость. Контролирование состояния при аутоиммунном заболевании базируется, главным образом, на модулировании активации Т-лимфоцитов посредством иммуносупрессантов или иммуномодуляторов; по этой причине классические противовоспалительные методы лечения являются неэффективными.
В настоящее время при лечении аутоиммунных заболеваний и отторжения трансплантата обычно применяют три вида терапий, все они сконцентрированы на ограничении активации и действия аутореактивных Т-лимфоцитов:
а) с одной стороны, введение кортикоидов (например, преднизона, 5'-метилпреднизона и АКТГ, среди прочего), либо перорально, подкожно или внутривенно и в виде болюсов, в течение короткого периода времени или в течение неопределенного периода времени, может облегчить некоторые из этих патологических состояний, хотя всегда частично и со значительными длительными побочными эффектами, что ограничивает их применение;
b) с другой стороны, применение иммуносупрессантов (например, циклофосфамида, митоксантрона, метотрексата, азатиоприна и циклоспорина А, среди прочего), перорально или внутривенно, улучшает контроль над многими из этих заболеваний, хотя они имеют потенциально опасные или даже смертельные побочные эффекты, что значительно ограничивает их применение; и
c) с другой стороны, введение иммуномодуляторов (например, интерферона-бета, интерферона-альфа, глатирамера ацетата, анти-CD20 или анти-TNFα моноклональных антител, среди прочего) улучшает контроль над этими заболеваниями, хотя частично имеются присущие побочные эффекты и высокая стоимость, поскольку они являются биотехнологическими продуктами.
Таким образом, чрезвычайный интерес представляет новый доступный способ лечения, который эффективно предотвращает активацию лимфоцитов и предотвращает или уменьшает интенсивность аутоиммунных заболеваний или отторжения трансплантата, с ограниченными побочными эффектами.
Было обнаружено, что 5'-метилтиоаденозин (МТА) можно применять для предотвращения и/или лечения аутоиммунных заболеваний, а также для предотвращения и/или лечения отторжения трансплантата, в частности для предотвращения и/или лечения рассеянного склероза (РС).
MTA представляет собой гидрофобный аденин серосодержащий нуклеозид, в котором гидроксильная группа в рибозе в положении 5' заменена метилтио-группой. MTA обнаружен в небольших количествах во всех типах клеток, в том числе у прокариот, дрожжей, растений и высших эукариот, и, согласно наблюдениям, присутствует во всех тканях млекопитающих. MTA представляет собой хорошо изученную молекулу, имеющую очень разнообразные свойства для контроля злокачественного новообразования, а также для регенерации и врожденного воспаления.
В патенте США № 4454122 описано применение MTA в качестве противовоспалительного, аналгетического и жаропонижающего агента; в частности применение МТА при лечении врожденного воспаления. Данное противовоспалительное действие анализировали посредством супрессии врожденной иммунной реакции в моделях отека, плеврита и гранулемы, обусловленной инородным телом. Роль МТА в подавлении активации лимфоцитов не исследована, так же как и его роль в качестве иммуномодулятора при аутоиммунных заболеваниях или отторжении трансплантата.
Также изучены эффекты МТА на злокачественное новообразование. Известно, что во многих злокачественных клетках отсутствует активность МТАР (5'-метилтиоаденозин фосфорилаза) и что в культуре эти клетки с дефицитом МТАР секретируют МТА, вместо того, чтобы метаболизировать его. В качестве примера, в международной патентной заявке WO2004/074325 раскрыто применение соединения, которое ингибирует фермент МТАР, при лечении злокачественного новообразования. В экспериментальных моделях индуцированного химическим веществом гепатоканцерогенеза, при котором наблюдается снижение уровней МТА, применение МТА индуцирует дозозависимое ингибирование предракового повреждения печени и синтеза ДНК.
С другой стороны, считают, что функция и пролиферация Т-лимфоцитов чрезвычайно чувствительны к ингибированию посредством МТА. Это соединение ингибирует в обратимой, нетоксичной и дозозависимой манере пролиферацию митоген-стимулированных лимфоидных клеточных линий крыс и периферических лимфоцитов человека. Среди эффектов МТА, которые могут препятствовать клеточной пролиферации, можно отметить ингибирование метилирования белка или ингибирование активности фосфодиэстеразы. Авторы данного изобретения в статье «A Methylation-Inhibitor Suppresses T Cell Activation and Prevents Experimental Autoimmune Encephalomyelitis», опубликованной в материалах 7th Meeting of the International Society of Neuroimmunology, Venice, September 2004 [абстракт опубликован в Journal of Neuroimmunology 2004, Vol. 154, numbers 1-2, page 85] объявили об эффективности МТА в качестве мощного ингибитора реакций метилирования, что предотвращает развитие аутоиммунной реакции в модели на животных экспериментального аутоиммунного энцефаломиелита (ЭАЭ), состоящей из крыс Льюиса, иммунизированных основным миелиновым белком (MBP).
Краткое изложение сущности изобретения
Неожиданно было обнаружено, что МТА способен оказывать модулирующее действие на активацию Т-лимфоцитов, что обеспечивает возможность модулировать воспаление при аутоиммунных заболеваниях и отторжении трансплантата, и, таким образом, его можно использовать для предотвращения и/или лечения аутоиммунных заболеваний, а также для предотвращения и/или лечения отторжения трансплантата, в частности предотвращения и/или лечения РС. В этом отношении, в данном изобретении МТА действует как иммуномодулирующий агент, поскольку он, в частности, оказывает влияние на лимфоциты.
Это новое применение МТА основано на исследовании, проведенном авторами данного изобретения на экспериментальных моделях на животных острого ЭАЭ и хронически текущего ЭАЭ, в которых использовали МТА; обнаружили, что у тех животные, которые получали МТА, либо не обнаруживали никаких клинических признаков данного заболевания, либо, если заболевание уже было выявлено, наблюдали значительное ослабление течения заболевания.
Поэтому в одном аспекте данное изобретение относится к использованию МТА при изготовлении лекарственного средства, предназначенного для (i) предотвращения и/или лечения аутоиммунного заболевания или (ii) для предотвращения и/или лечения отторжения трансплантата. В определенном варианте осуществления этим аутоиммунным заболеванием является РС.
В другом аспекте данное изобретение относится к способу предотвращения и/или лечения аутоиммунного заболевания у индивидуума, страдающего аутоиммунным заболеванием, который включает введение терапевтически эффективного количества МТА указанным индивидуумам. В определенном варианте осуществления этим аутоиммунным заболеванием является РС.
В другом аспекте данное изобретение относится к способу предотвращения и/или лечения отторжения трансплантата у индивидуума, получившего трансплантат, или того, который собирается получить трансплантат, который включает введение терапевтически эффективного количества МТА указанным индивидуумам.
Применение МТА для предотвращения и/или лечения аутоиммунных заболеваний, в частности РС, и отторжения трансплантата является эффективным способом избежать проблемы, определенные современными терапевтическими стратегиями, такие как отдаленные побочные эффекты кортикоидов, иммуносупрессантов и иммуномодуляторов, используемых при лечении аутоиммунных заболеваний и отторжения трансплантата.
Краткое описание фигур
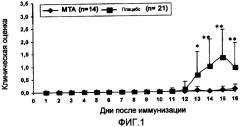
На Фигуре 1 представлен иллюстративный график индукции ЭАЭ у крыс Льюиса, иммунизированных MBP68-82 морской свинки. Среднее значение ежедневной оценки клинических показателей +S.E.M. представлено для каждой группы крыс, где (*) означает статистически значимое различие c р<0,05 по сравнению с лечением посредством МТА, и (**) означает статистически значимое различие с р<0,005 по сравнению с лечением посредством МТА. Эти данные получены в 3 отдельных экспериментах.
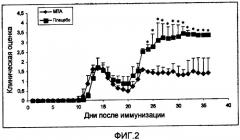
На Фигуре 2 представлен иллюстративный график индукции хронически-протекающего ЭАЭ у крыс линии DA, иммунизированных посредством rMOG. Среднее значение ежедневной оценки клинических показателей +S.E.M. представлено для каждой группы крыс, где (*) означает статистически значимое различие c р<0,005, по сравнению с лечением посредством МТА.
На Фигуре 3 представлен иллюстративный график кривой выживаемости крыс DA, иммунизированных посредством MOG, до тех пор, пока они не достигнут умеренного нарушения функций (клинический показатель=3,5) (p<0,001 по критерию Бреслоу) [Фигура 3A], и кривой выживаемости крыс DA, иммунизированных посредством MOG, до тех пор, пока не наступит смерть (клинический показатель=5) (p=0,02 по критерию Бреслоу) [Фигура 3B].
На Фигуре 4 представлена гистограмма, на которой показан MBP-специфический ответ T-лимфоцитов на 16 день после иммунизации у крыс Льюиса, иммунизированных посредством MBP. Данные результаты выражены как среднее значение индекса стимуляции, где (*) означает статистически значимое различие с р<0,05, по сравнению с использованием плацебо.
На Фигуре 5 представлена гистограмма, на которой показан характер экспрессии мРНК IL-2, IFN-γ, TNF, IL-10 и iNOS в спленоцитах крыс с ЭАЭ. Эти данные выражены относительно уровня 18S рРНК конститутивного гена, где (*) означает статистически значимое различие с р<0,05, по сравнению с использованием MTA.
На Фигуре 6 представлена гистограмма, на которой показаны гистологические показатели воспаления и демиелинизирующих повреждений, где (*) означает статистически значимое различие с р<0,05, по сравнению с использованием MTA.
Подробное описание данного изобретения
В одном аспекте данное изобретение относится к применению МТА,
его фармацевтически приемлемых солей и/или пролекарств, при изготовлении лекарственного средства, предназначенного для (i) предотвращения и/или лечения аутоиммунного заболевания или (ii) для предотвращения и/или лечения отторжения трансплантата.
Используемый термин «фармацевтически приемлемые соли» относится к любой соли МТА, которую можно использовать при изготовлении лекарственного средства. Природа соли не важна, при условии, если она фармацевтически приемлема. К фармацевтически приемлемым солям МТА относятся кислотно-аддитивные соли, которые могут быть получены из органических и неорганических кислот посредством стандартных методов, хорошо известных специалисту из уровня техники, посредством проведения реакции соответствующей кислоты с МТА в соответствующем стехиометрическом количестве. Иллюстративные примеры кислот, которые можно использовать для получения этих кислотно-аддитивных солей, включают, но не ограничиваются ими, органические кислоты, такие как, например, аскорбиновая кислота, лимонная кислота, 1,4-бутандисульфоновая кислота, р-толуолсульфоновая кислота, и тому подобное, или неорганические кислоты, такие как, например, соляная кислота, серная кислота, и тому подобное. В качестве иллюстрации, например, гидрохлорид МТА можно использовать в композициях для инъекций; гидрохлорид МТА, сульфат МТА, цитрат МТА, аскорбат МТА, 1,4-бутандисульфонат МТА (таблетка с энтеросолюбильным покрытием), п-толуолсульфонат МТА можно использовать в пероральных композициях.
Кроме того, в диапазон данного изобретения включены пролекарства МТА. Термин «пролекарство» включает в себя любое соединение, полученное из МТА, например эфир, амид и тому подобное, которое при введении индивидууму, способно доставить МТА, напрямую или опосредованно, в организм указанного индивидуума. Предпочтительно указанным производным является соединение, которое повышает биологическую доступность МТА при введении индивидууму или которое стимулирует высвобождение МТА из биологического компартмента. Происхождение указанного производного непринципиально, при условии, что его можно вводить в организм индивидуума и что оно обеспечивает МТА в биологическом компартменте. Изготовление указанного пролекарства можно осуществить посредством стандартных способов, известных специалисту в уровне техники.
MTA является коммерческим продуктом, который может быть поставлен фирмой Sigma. Альтернативно, указанное соединение может быть получено известными способами, например из S-аденозилметионина (SAM), с последующей обработкой, описанной у Schlenk F. et al., Arch. Biochem. Biophys., 1964, 106:95-100, как указано в примере, который включен в данное описание.
Для введения в качестве предотвращения и/или лечения аутоиммунного заболевания, например РС, или предотвращения и/или лечения отторжения трансплантата, из МТА, его фармацевтически приемлемых солей и/или пролекарств, должны быть получены соответствующие фармацевтические композиции, в терапевтически эффективном количестве, совместно с одним или несколькими фармацевтически приемлемыми носителями, адъювантами или инертными наполнителями.
Примеры фармацевтических композиций включают любую твердую (например, таблетки, капсулы, гранулы и тому подобное) или жидкую композицию (например, растворы, суспензии, эмульсии и тому подобное) для применения посредством соответствующего пути введения, например перорально, подкожно, внутрибрюшинно, внутривенно, и тому подобное; обычно, посредством перорального пути введения, по причине хронического течения заболевания, подвергающегося лечению.
В конкретном варианте осуществления указанные фармацевтические композиции могут быть в форме для перорального применения, либо в твердой, либо в жидкой форме. Примеры фармацевтических форм для перорального применения включают в себя таблетки, капсулы, гранулы, растворы, суспензии и тому подобное и могут содержать в себе традиционные инертные наполнители, например связывающие, разбавляющие, дизентегрирующие вещества, смазывающее вещество, увлажняющие вещества, и тому подобное, наполнители, и могут быть получены посредством стандартных способов. Данные фармацевтические композиции также могут быть адаптированы для парентерального введения, в форме, например, растворов, суспензий или стерильных, лиофилизированных продуктов, в соответствующей лекарственной форме; в этом случае указанные фармацевтические композиции должны включать в себя соответствующие наполнители, такие как буферы, поверхностно-активные соединения и тому подобное. В любом случае, данные наполнители должны быть выбраны исходя из выбранного пути введения данной фармацевтической формы. Ознакомиться с различными фармацевтическими формами для применения лекарственного средства и их изготовлением можно в книге «Tratado de Farmacia Galenica», de C. Fauli i Trillo, 10th Edition, 1993, Luzan 5, S.A. de Ediciones.
Для его применения при лечении МТА предпочтительно должен находиться в фармацевтически приемлемой или по существу чистой форме, а именно МТА должен иметь фармацевтически приемлемый уровень чистоты, исключая фармацевтически приемлемые наполнители и не включая вещество, являющееся токсическим при нормальных уровнях дозировки. Уровни чистоты МТА предпочтительно составляют выше 50%, более предпочтительно выше 70%, более предпочтительно выше 90%. В предпочтительном варианте осуществления они составляют более 95% МТА.
В целом, вводимое терапевтически эффективное количество МТА должно зависеть, среди прочих факторов, от принимающего лечение индивидуума, тяжести заболевания, которым страдает данный индивидуум, выбранного способа применения, и тому подобного. Ввиду этого, дозы, упомянутые в данном изобретении, должны рассматриваться исключительно в качестве ориентира для специалиста в уровне техники, и последний должен скорректировать данные дозы на основании указанных параметров. Тем не менее, МТА можно применять один или несколько раз в день, например 1, 2, 3 или 4 раза в день, обычное суммарное суточное количество составляет от 25 до 75 мг/кг/день.
МТА, его фармацевтически приемлемые соли и/или пролекарства и фармацевтические композиции, в которых они содержатся, можно применять в сочетании с другими дополнительными лекарственными средствами, которые применяются для предотвращения и/или лечения аутоиммунных заболеваний или отторжения трансплантата, например кортикоидами, иммуносупрессантами, иммуномодуляторами, и тому подобным, для обеспечения комбинированного лечения. Указанные дополнительные лекарственные средства могут являться частью той же фармацевтической композиции или, альтернативно, могут быть в составе отдельной композиции для одновременного или неодновременного введения с фармацевтической композицией, в состав которой входит МТА, или его пролекарство, или его фармацевтически приемлемая соль.
Используемое в описании выражение «аутоиммунное заболевание» означает заболевание, которое развивается в ответ на триггерные или агрессивные действия в защите пациента (иммунная система) по отношению к ее/его собственным тканям организма. Конкретнее, аутоиммунные заболевания характеризуются тем, что преобладает воспаление в результате приобретенного иммунитета (также называемое специфический или искусственный иммунитет), где иммунитет стимулируется после воздействия инфекционных агентов, и его главными компонентами являются лимфоциты. Перечень аутоиммунных заболеваний можно найти на Web-сайте Американского Общества по Аутоиммунным Заболеваниям [http://www.aarda.org]. Примеры аутоиммунных заболеваний включают в себя, но не ограничиваются: РС, болезнь Крона, ревматоидный артрит, сахарный диабет I типа, псориаз, волчанку, язвенный колит, витилиго, целиакия, васкулит, дерматомиозит, полимиозит, тироидит (Хашимото, болезнь Грейвса), миастению гравис, синдром Джулиана-Барре, увеит, плоский лишай, височный артериит, саркоидоз, сухой синдром (синдром Шегрена), бронхиальную астму, пемфигус, анкилозирующий спондилит, склеродермию, фибромиалгию, ревматический полиартрит и тому подобное.
В определенном варианте осуществления данное изобретение относится к применению МТА, его фармацевтически приемлемых солей и/или пролекарств, при изготовлении лекарственного средства, предназначенного для предотвращения и/или лечения РС, в частности для лечения РС, более конкретно для предотвращения и/или лечения РС для предотвращения появления последующих вспышек или прогрессирования данного заболевания (прогрессирующая фаза) у индивидуума, страдающего РС, то есть после того, как РС уже развился. Испытания, проведенные авторами данного изобретения, в дополнение к предотвращающему действию МТА на развитие аутоиммунности, наблюдаемой при предотвращении ЭАЭ у крыс Льюиса, иммунизированных с помощью МВР (модель острого ЭАЭ), показали, что МТА также имеет лечебный эффект при хронической аутоиммунности, поскольку лечение с помощью МТА привело к улучшению клинических проявлений и выживаемости, когда заболевание (РС) уже развилось, что было выявлено в модели ХР-ЭАЭ на крысах линии DA, иммунизированных с помощью rMOG. Этот аспект является высоко значимым, поскольку в настоящее время, если болезнь уже развилась, можно использовать только иммуномодулирующие схемы лечения, невозможно проводить профилактическое лечение, поскольку не существует пресимптоматических маркеров.
В другом специфическом варианте осуществления данное изобретение относится к применению МТА, его фармацевтически приемлемых солей и/или пролекарств, при изготовлении лекарственного средства, предназначенного для предотвращения и/или лечения отторжения трансплантата. MTA, его фармацевтически приемлемые соли и/или пролекарства можно применять для предотвращения и/или лечения отторжения практически любого трансплантата. Примеры таких трансплантатов включают в себя, но не ограничиваются: почки, печень, сердце, легкие, кишечник, гематопоэтический и костный мозг, кожу, конечности, роговицу, поджелудочную железу, стволовые клетки и клеточную терапию, импланты или биоматериалы и тому подобное.
В другом аспекте данное изобретение относится к способу предотвращения и/или лечения аутоиммунного заболевания у индивидуума, страдающего аутоиммунным заболеванием, который включает в себя введение терапевтически эффективного количества МТА, или одной из его фармацевтически приемлемых солей или пролекарства, в организм указанного индивидуума. Аутоиммунные заболевания, которые можно лечить, определены выше, поскольку имеют особенности введения фармацевтической композиции и терапевтически эффективного количества МТА. В определенном варианте осуществления указанным аутоиммунным заболеванием является РС. MTA, его фармацевтически приемлемые соли и/или пролекарства, в определенном варианте осуществления, можно применять для предотвращения появления последующих вспышек у индивидуума, страдающего РС, или замедления прогрессирования РС (прогрессирующая фаза) у индивидуума, страдающего РС.
В другом аспекте данное изобретение относится к способу предотвращения и/или лечения отторжения трансплантата у индивидуума, который собирается получить трансплантацию или кто уже получил трансплантацию, который включает в себя введение в организм указанного индивидуума терапевтически эффективного количества МТА, или одной из его фармацевтически приемлемых солей и/или пролекарств. Примеры трансплантатов, не ограниченные, отторжение которых можно предотвратить или лечить с помощью МТА, его фармацевтически приемлемых солей и/или пролекарств, уже упомянуты, поскольку имеют особенности введения фармацевтической композиции и терапевтически эффективного количества МТА. Указанную фармацевтическую композицию можно применять либо до, либо после трансплантации (то есть для профилактических или терапевтических целей), или иначе, до или после трансплантации, даже если изначально нет признаков отторжения (то есть для профилактических целей).
Используемый здесь термин «индивидуум» означает любое млекопитающее, в том числе, но, не ограничиваясь этим, домашних животных, грызунов, приматов и человека. Предпочтительно указанным индивидуумом является человек, мужчина или женщина, любого возраста или расы.
В специфическом варианте осуществления данного изобретения МТА вводят отдельно или в комбинации с другими схемами лечения, или другими лекарственными средствами, в форме комбинированной терапии.
Следующий пример иллюстрирует данное изобретение и не должен рассматриваться как ограничивающий его диапазон.
Пример
Начиная с 1970-х годов считают, что модель острого Экспериментального Аутоиммунного Энцефаломиелита (ЭАЭ) была моделью для Рассеянного Склероза (РС) и что, таким образом, эффективные способы лечения острого ЭАЭ также должны быть эффективными для РС. Тем не менее, проверили сотни соединений, которые были эффективны при остром ЭАЭ, но не при РС (Hohlfeld R. & Wekerle H. Proceeding National Academy of Sciences USA, October 2004, Vol. 101, Suppl. 2, page 14, 599, heading: MS and EAE, paragraph 3). В свете этого, кроме демонстрации эффективности для предотвращения острого ЭАЭ, необходимо доказать эффективность при лечении хронически рецидивирующего ЭАЭ (модель РС в целом). В этом отношении, в данном примере использовали две экспериментальные модели на животных, не являющихся человеком, для доказательства эффективности МТА при лечении аутоиммунного заболевания и, в особенности, РС; в частности, (i) острый ЭАЭ у крыс Льюиса, иммунизированных с помощью MBP [модель вспышки РС и Острого Рассеянного Энцефаломиелита (ОРЭ)], и (ii) хронически рецидивирующий ЭАЭ (ХР-ЭАЭ) у крыс линии Dark Agouti (DA), иммунизированных с помощью MOG [модель РС].
I. Материалы и Методы
Животные
Для модели острого ЭАЭ, вызванного посредством иммунизации с помощью основного миелинового белка (MBP), использовали Charles River самок крыс Льюиса в возрасте 6-8 недель, с массой тела 175-200 грамм.
Для модели хронически рецидивирующего ЭАЭ, вызванного посредством иммунизации с помощью гликопротеина олигодендроцитов (MOG), использовали крыс линии Dark Agouti (DA) с массой тела приблизительно 200 грамм.
Животных содержали в пластиковых клетках в комнате с натуральным освещением и их обеспечивали кормом и водой исходя из дневной нормы.
Индукция и оценка ЭАЭ
Крыс Льюиса иммунизировали с помощью 100 мкл эмульсии, содержащей в себе физиологический раствор и неполный адъювант Фрейнда (IFA) с 75 мкг MBP (фрагмент 68-82 основного миелинового белка морской свинки (Sigma), в одинаковых объемах, и дополненной 4 мг/мл Mycobacterium tuberculosis H37RA (Difco). Вакцинацию проводили в основания обеих задних конечностей.
Крыс DA иммунизировали с помощью 100 мкл эмульсии, содержащей в себе физиологический раствор и неполный адъювант Фрейнда (IFA) с 75 мкг rMOG [Villoslada, P., et al., J. Exp Med, 2000. 191 (10): 1799-806] (очищенный в лаборатории авторов изобретения) в одинаковых объемах и также дополненной 4 мг/мл Mycobacterium tuberculosis. Вакцинацию проводили в основания обеих задних конечностей, как и в случае крыс Льюиса.
Данных животных взвешивали и ежедневно проверяли клинические симптомы ЭАЭ посредством слепой оценки результатов лечения. Тяжесть ЭАЭ оценивали, используя следующую шкалу: 0 = норма; 1 = вялый хвост; 2 = легкий парапарез задних конечностей, нестабильная локомоция; 3 = параплегия; 4 = тетрапарез; 5 = смерть.
Лечение
Крыс Льюиса, иммунизированных с помощью MBP, случайным образом делили на 2 группы. Одну группу лечили с помощью МТА (концентрация 100 мкМ) в дозе 4,3 мг/животное (эквивалент 28,6 мкг/кг массы тела). Данный МТА синтезировали из SAM (Europharma, Madrid (Spain)), в соответствии процедурам, описанным у Schlenk F. et al., Arch. Biochem. Biophys., 1964, 106: 95-100, в отделе Гепатологии и Генной терапии Факультета Внутренних Болезней, CIMA, Университета г.Наварра, восстанавливали в 10% диметилсульфоксиде (DMSO), а другую группу, получавшую плацебо, обрабатывали физиологическим раствором в 10% DMSO посредством внутрибрюшинной инъекции (в/б) ежедневно после иммунизации.
Крыс DA, иммунизированных с помощью rMOG, также случайным образом делили на две группы, одну из которых обрабатывали, используя 100 мкМ MTA, восстановленного в 300 мМ Трис pH 7,8, а другую группу, получавшую плацебо, обрабатывали, используя только 300 мМ Трис. Данные обработки начинали на 15 день после иммунизации, и проводили ежедневно посредством инъекций в/б. Оценку проводили вслепую на всем протяжении болезни.
Образцы тканей
На 16 день болезни крысам Льюиса из двух групп давали анестезию и посредством внутрисердечной инъекции вводили 4% параформальдегид в 0,1 М фосфатном буфере (рН 7,6). Извлекали головной мозг и шейный, грудной и поясничный сегменты спинного мозга и фиксировали в течение всей ночи при 4°C. После фиксации данные ткани пропитывали парафином для гистопатологического и иммуногистохимического исследования.
На 35 день после иммунизации крысам DA из двух групп также давали анестезию и проводили инъекцию согласно тому же протоколу. Ткани также обрабатывали тем же способом для гистопатологического и иммуногистохимического исследования.
Также от каждого животного получали селезенку, печень и образцы крови. Селезенки и печени быстро замораживали в жидком азоте и хранили по частям при -80°C для обеспечения возможности изучения посредством ОТ-ПЦР (полимеразная цепная реакция с обратной транскрипцией). Кровь центрифугировали при 800 об/мин в течение 10 минут для получения сыворотки, которую хранили при -80°C.
Выделение РНК и синтез кДНК
Фрагменты тканей селезенки и печени гомогенизировали в лизирующем буфере для выделения РНК с 2% β-меркаптэтанола, используя ручной гомогенизатор. Общую РНК выделяли, используя мини-набор Rneasy Mini Kit (Quiagen), следуя инструкциям фирмы-производителя. Во время очистки РНК ДНК удаляли посредством обработки ДНазой. Концентрацию РНК и ее чистоту определяли посредством измерения поглощения при 260 нм и 280 нм на спектрофотометре (Eppendorf). Обратную транскрипцию общей РНК проводили, используя набор High Capacity cDNA Archive Kit (Applied Biosystems). Реакцию обратной транскрипции проводили при 25°C в течение 10 минут, 37°C в течение 2 часов и в заключение хранили при 4°C.
Конструкция праймеров и зондов
Использовали флуоресцентно меченные Taqman последовательности праймеров и специфические зонды (Taqman Gene Expression Assays) (Applied Biosystems) для 18S рРНК эукариот, интерферона-гамма (IFN-γ), интерлейкина 2 (IL-2), фактора некроза опухоли альфа (TNF-α), интерлейкина 10 (IL-10) и индуцируемой синтазы оксида азота (iNOS).
Количественная ПЦР в режиме реального времени
Для количественной ПЦР использовали универсальную смесь TaqMan Universal Master Mix (Applied Biosystems). Амплификацию кДНК проводили в 96-луночных планшетах (MJ Research, Inc.) на системе, работающей в режиме реального времени Opticon 2 (MJ Research). Реакцию проводили в конечном объеме реакционной смеси 25 мкл, состоящей из 1-кратной универсальной смеси Taqman Universal Master Mix, 1-кратной реакционной смеси TaqMan Gene Expression Assay Mix (по 0,9 мкМ каждого праймера и 0,25 мкМ зонда) и 20 нг кДНК, растворенной в воде, свободной от РНаз и ДНаз.
Условия реакции были следующие: 2 мин при 50°C, 10 мин при 95°C и 40 15-с циклов при 95°C и 1 мин при 60°C. Каждый образец нагружали в трех повторах на каждый планшет и бланк, и эндогенный контроль амплифицировали в отдельных лунках.
Уровни экспрессии мРНК IL-2, IFN-γ, TNF-α, IL-10 и iNOS количественно определяли по отношению к 18S рРНК конститутивного гена.
Гистопатология, воспаление и демиелинизация
Проводили гистопатологическую оценку срезов головного мозга и спинного мозга, заключенных в парафин. Эти срезы окрашивали с помощью гематоксилин-эозина (ГЭ) и Люксола быстрого голубого, для оценки тканевого воспаления и демиелинизации. Для каждой крысы исследовали 24-30 сагиттальных срезов. Слепую полуколичественную гистологическую оценку воспаления и демиелинизации проводили, как описано ранее [Villoslada, P., et al., J. Exp Med, 2000. 191 (10): 1799-806].
Иммуногистохимия
Иммуногистохимические процедуры проводили на 10 мкм срезах головного мозга и спинного мозга, заключенных в парафин. Эндогенную пероксидазную активность инактивировали посредством 0,3% H2O2 в метаноле в течение 20 мин.
Данные срезы инкубировали в течение 30 мин в PBS с 0,5% Tween® 20 и 10% козьей или лошадиной сыворотки (Vector Laboratorios) и в течение 2 часов в PBS с 0,5% Tween® 20 и первичными антителами в следующих разведениях: поликлональное кроличье антитело к глиальному фибриллярному кислому белку (GFAP), 1:1000 (Dakocytomation); мышиное антитело к белку-предшественнику бета-амилоида (APP), 1:100 (Zymed Laboratorios); анти-IgA антитело мыши (OX-6), 1:200 (Serotec); анти-CD8 антитело крысы, 1:250 (Serotec); антитело анти-iNOS II типа, 1:250 (Serotec); анти-CD68 антитело крысы (ED1), 1:200 (Serotec) и анти-CD43 антитело крысы (W3/13), 1:50 (Serotec). Далее, срезы отмывали с помощью PBS и инкубировали в течение 45 мин при комнатной температуре с соответствующим биотинилированным вторичным IgG антителом (1:100 в PBS; Vector Laboratorios), с последующими несколькими отмывками с помощью PBS/Tween® и 45-минутным инкубированием при комнатной температуре с авидин-биотиновым пероксидазным комплексом (ABC, Vector Laboratorios).
После отмывок с помощью PBS/Tween® выявляли иммунологическую реактивность, используя 0,5 мг/мл 3,3'-диаминобензидин тетрагидрохлорида (DAB; Sigma). Специфичность иммунной реакции определяли в результате инкубирования данных срезов без первичного антитела. Используя оптический микроскоп получали изображения.
Анализ пролиферации лимфоцитов
Спленоциты, полученные от крыс с ЭАЭ и неиммунизированных крыс, очищали посредством центрифугирования в градиенте плотности фикол-гипака. Анализ пролиферации лимфоцитов проводили таким же способом, как описано ранее [Villoslada, P., et al., J. Exp Med, 2000. 191 (10): 1799-806].
Вкратце, спленоциты помещали в концентрации 2 × 106/мл в среду для культивирования RPMI 1640, дополненную 10% эмбриональной сывороткой теленка и пенициллином/стрептомицином, в присутствии или отсутствие фитогемагглютинина (ФГА, 5 мкг/мл), MBP (10 мкг/мл), MTA (100 мкМ) и DMSO. Данные культуры инкубировали в течение 5 дней в 96-луночных круглодонных планшетах (0,2 мл/лунку) при 37°C. Данные лунки бомбардировали 0,5 мкКи [3Н]TdR в течение 18 часов. Считывание показателей осуществляли с помощью жидкостного сцинтилляционного счетчика. Результаты выражены как среднее значение индекса стимуляции, полученное из трех определений.
Статистический анализ
Статистическое сравнение осуществляли с использованием двустороннего критерия Манна-Уитни и кривых выживаемости. Значения p<0,05 считаются достоверными различиями. Статистическую оценку осуществляли с помощью статистической программы SPSS 11.0.
II. Результаты
Действие МТА на развитие модели вспышки РС (острый ЭАЭ) у крыс Льюиса, иммунизированных с помощью МВР
Начиная со дня иммунизации, крыс Льюиса случайным образом разделили на группу, получающую МТА, и группу, получающую плацебо, и в обеих группах крыс ежедневно проводили внутрибрюшинные (в/б) инъекции. У всех животных, получавших плацебо, за исключением одного, развились неврологические симптомы ЭАЭ, включающие в себя нарастающую потерю массы тела, отсутствие силы в хвосте и паралич задних конечностей или умеренную или выраженную параплегию. Первые неврологические симптомы были выявлены на 12 день, среднее начало заболевания составляет 13,6±1,2 дней (n=21). Максимальное число баллов, набранных отдельными животными на протяжении данного эксперимента, составляло 1,48±1 (Таблица 1).
| Таблица 1. Оценка ЭАЭ | |||||
| Лечение | Количество крыс | Частота возникновения ЭАЭ | Начало ЭАЭ (дни) | Максимальный балльный показатель ЭАЭ | Совокупный балльный показатель ЭАЭ |
| МТА | 14 | 4/14 (28,57%) | 15±1,2 | 0,14±0,23 | 2±0,07 |
| Плацебо | 21 | 20/21 (95,23%)а | 13,6±1,2 | 1,48±1а | 83,5±0,65а |
| а статистически значимое различие при р<0,005 по сравнению с лечением с помощью МТА |
Напротив, у тех животных, которые получали МТА, либо не развивались никакие клиническ