Высокочистые сложные 3,3-дифенилпропиламиномоноэфиры
Иллюстрации
Показать всеИзобретение относится к сложным 3,3-дифенилпропиламиномоноэфирам в виде высокочистых оснований, в частности к (R)-2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутирату (фезотеродин), к их получению и применению в качестве лекарственных средств для трансдермального и трансмукозного введения. Технический результат - продукт, содержащий соединение (R)-2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутират (фезотеродин) в виде свободного основания с содержанием соли менее 3 мас.% и со степенью чистоты выше 97 мас.%. 3 н. и 13 з.п. ф-лы, 4 ил., 4 табл.
Реферат
Настоящее изобретение относится к сложным 3,3-дифенилпропиламино-моноэфирам в виде высокочистых оснований, к их получению и применению в качестве лекарственных средств, прежде всего для трансдермального и трансмукозного введения.
За последние 50 лет значительно возросла доля пожилых людей в общей массе населения. У этой группы людей к наиболее распространенным заболеваниям, связанным с возрастными изменениями организма, относятся расстройства функции мочевого пузыря. Поэтому особое, все более важное значение приобретает разработка максимально эффективной и щадящей терапии заболеваний мочевого пузыря.
При императивном недержании расстройство функции мочевого пузыря обусловлено нарушением функции его мышц. Причиной такого расстройства во многих случаях является стимуляция, соответственно гиперактивность мускариновых рецепторов. Поэтому для терапии гиперактивности мочевого пузыря и связанных с этим симптомов, таких как повышенный позыв на мочеиспускание, недержание, поллакизурия или никтурия, предпочтительно применять антимускариновые действующие вещества толтеродин и оксибутинин.
Оксибутинин представляет собой эффективное антимускариновое действующее вещество, применение которого, однако, сопровождается значительными побочными действиями. При этом речь прежде всего идет о ярко выраженной сухости во рту, которая у многих пациентов вызывает крайне неприятные ощущения.
Преимущество толтеродина состоит предположительно в том, что в отличие от оксибутинина он обладает более низкой частотой мускариновых побочных явлений. В организме толтеродин деалкилируется преимущественно под действием изофермента 2D6 цитохрома Р-450, превращаясь в главный активный метаболит 2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенол, а под действием изофермента 3А4 цитохрома Р-450 медленно деалкилируется, превращаясь в неактивный метаболит.
Поскольку толтеродин метаболизируется исключительно под действием изоферментов цитохрома Р-450, существует потенциальная опасность взаимодействия толтеродина с другими действующими веществами, сопровождающегося их разложением, например с варфарином (Colucci, Annals of Pharmacotherapy 33, 1999, с.1173), с противогрибковыми средствами, такими как кетоконазол (Brynne, Br. J. Clin. Pharmacol. 48, 1999, с.564), с макролидными антибиотиками или с ингибиторами протеазы. Подобная опасность существует прежде всего у так называемых "медленных метаболизаторов" (людей со сниженной активностью системы цитохрома Р450) с дефицитом изофермента 2D6, в организме которых толтеродин метаболизируется исключительно под действием изофермента 3А4 и в плазме которых толтеродин присутствует соответственно в значительно более высокой концентрации.
В заявке WO 99/58478 описаны новые производные 3,3-дифенилпропиламина в качестве мускариновых действующих веществ. Предлагаемые в этой публикации производные 3,3-дифенилпропиламина представляют собой пролекарства 2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенола, которые при прохождении через биологические мембраны и в плазме гидролизуются эстеразами. Тем самым удается избежать зависящего от изофермента 2D6 механизма разложения.
Поэтому такие производные 3,3-дифенилпропиламина, например 2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутират (МНН: фезотеродин), в отличие от толтеродина не склонны к накоплению в организме, в том числе и в организме "медленных метаболизаторов", не взаимодействуют с индукторами, соответственно ингибиторами цитохрома Р-450 и обладают предпочтительным набором свойств, которыми определяется безопасность их применения с точки зрения их потенциального взаимодействия с другими действующими веществами и их накопления в организме.
С учетом сказанного выше преимуществами описанных в WO 99/58478 производных 3,3-дифенилпропиламина, прежде всего преимуществами фезотеродина, и определялась необходимость в их разработке. Именно особенностями пути метаболизма толтеродина и недостатками оксибутинина (сухость во рту) объясняется потребность медицины в лекарственном средстве, не имеющем недостатков обоих вышеуказанных веществ.
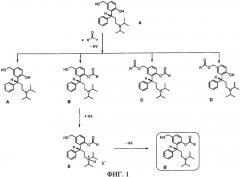
Описанные в WO 99/58478 3,3-дифенилпропиламины получают взаимодействием 2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола в щелочных условиях с соответствующим хлорангидридом кислоты, например с хлорангидридом изомасляной кислоты (см. пример 3аа в WO 99/58478). Следует, однако, отметить, что указанная реакция позволяет получать требуемый основной продукт (В) с выходом, составляющим лишь от примерно 90 до максимум примерно 94%. Продукт обычно содержит от 6 до 10% примесей, которыми являются исходное вещество (А), используемый ацилирующий агент, а также нежелательные продукты реакции в виде соответствующего сложного диэфира (С), сложного моноэфира (D) 4-гидроксигруппы (см. фиг.1), и продукты, образующиеся в результате димеризации/полимеризации.
Попытки авторов настоящего изобретения повысить избирательность реакции, например, за счет варьирования количества ацилирующего агента и/или за счет варьирования условий ацилирования (температуры, растворителей, концентраций, последовательности введения добавок и т.д.) не дали положительных результатов.
Безуспешными оказались также многочисленные попытки, направленные на выделение традиционными методами очистки из образовавшейся смеси содержащегося в ней продукта в виде высокочистого основания в количествах, удовлетворяющих требованиям фармацевтики.
Возможность очистки путем кристаллизации исключается, поскольку основания общей формулы I, например фезотеродин, получаемые описанным в ЕР 1077912 способом, представляют собой вязкие масла и до настоящего времени не удавалось кристаллизовать из содержащей их в качестве продукта смеси.
Попытки очистки путем перегонки также не дали положительных результатов.
Известно, однако, что чистота лекарственного вещества порядка 90-96 мас.% является недостаточной для фармацевтических препаратов. Более того, предпочтительная для применения в фармацевтических препаратах чистота лекарственного вещества обычно должна превышать 97 мас.%. Поэтому проблема получения 3,3-дифенилпропиламинов в виде высокочистых оснований осталась нерешенной.
В заявке WO 01/35957 описаны стабильные кристаллические соли производных 3,3-дифенилпропиламина, преимущество которых перед аморфными солями состоит в их более высокой стабильности и чистоте. Подобные соли в принципе пригодны для применения в терапевтических целях и могут назначаться, например, для перорального или парентерального введения в организм.
Однако такие соли действующих веществ во многих случаях оказываются малопригодными для их введения в организм некоторыми путями, например, для трансдермального или трансмукозного применения, поскольку их ионная форма препятствует их проникновению через кожу, соответственно через слизистую в терапевтически эффективном количестве. Поэтому при трансдермальном или трансмукозном введении аминосодержащее действующее вещество часто приходится применять в виде основания.
Согласно изобретению неожиданно было установлено, что получение свободного основания общей формулы I (приведенной ниже) с чистотой, превышающей, как правило, 97 мас.%, предпочтительно превышающей 98 мас.%, особенно предпочтительно превышающей 98,5 мас.%, наиболее предпочтительно превышающей 99 мас.%, и с хорошим выходом, составляющим более 80 мол.%, обычно более 90 мол.%, возможно путем его высвобождения из высокочистой кристаллической соли с помощью соответствующего реагента.
Объектом изобретения в соответствии с этим является свободное основание соединения формулы I
в которой А обозначает водород или дейтерий, a R представляет собой группу, выбранную из C1-С6алкила, С3-С10циклоалкила и фенила, каждый из которых может быть замещен C1-С3алкоксигруппой, фтором, хлором, бромом, иодом, нитрогруппой, аминогруппой, гидроксигруппой, оксогруппой, меркаптогруппой или дейтерием, и в которой помеченный символом * (звездочкой) С-атом может находиться в (R)-конфигурации, (S)-конфигурации или в смешанной конфигурации, отличающееся тем, что степень его чистоты составляет более 97 мас.%, предпочтительно более 98 мас.%, особенно предпочтительно более 98,5 мас.%, наиболее предпочтительно более 99 мас.%.
В одном из предпочтительных вариантов R выбран из группы, включающей метил, этил, изопропил, 1-пропил, 1-бутил, 2-бутил, трет-бутил, изобутил, пентил, гексил, С4-С8циклоалкил и фенил.
В одном из особенно предпочтительных вариантов R обозначает изопропил, и в этом случае соединение представляет собой 2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутират (фезотеродин в виде основания).
В другом варианте осуществления изобретения соединения общей формулы I представлены в виде рацематов, т.е. в виде смесей молекул с (R)- и (S)-конфигурациями.
Еще в одном из предпочтительных вариантов помеченный символом * (звездочкой) С-атом находится в (R)-конфигурации, которую имеют предпочтительно более 98 мас.% соединения, особенно предпочтительно более 99 мас.% соединения, наиболее предпочтительно более 99,5 мас.% соединения.
В одном из наиболее предпочтительных вариантов соединение представляет собой (R)-2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутират в виде высокочистого свободного основания (фезотеродин в виде основания) со степенью чистоты выше 97 мас.%, предпочтительно выше 98 мас.%, особенно предпочтительно выше 98,5 мас.%, наиболее предпочтительно выше 99 мас.%.
Под понятием "C1-С6алкил" согласно настоящему изобретению подразумевается содержащая от 1 до 6 С-атомов углеводородная группа с прямой или разветвленной цепью. К предпочтительным C1-С6алкильным группам относятся незамещенные группы с прямой или разветвленной цепью, выбранные прежде всего из группы, включающей метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил и гексил.
Под понятием "С3-С10циклоалкил" подразумевается циклическая углеводородная группа, содержащая от 3 до 10 атомов углерода.
Под понятием "высокочистый" согласно изобретению имеется в виду степень чистоты моноэфира общей формулы I, превышающая по меньшей мере 97 мас.%, предпочтительно превышающая 98 мас.%, особенно предпочтительно превышающая 98,5 мас.%, наиболее предпочтительно превышающая 99 мас.%, т.е. на долю диэфира, дигидроксисоединений, 4-моноэфиров или полимеров приходится соответственно незначительная часть. Степень чистоты при этом определяют с помощью методов, рассмотренных ниже в соответствующем разделе настоящего описания.
Понятие "свободное основание" согласно изобретению означает, что соединение общей формулы I представлено в виде соли менее чем на 10 мас.%, предпочтительно менее чем на 5 или 3 мас.%, особенно предпочтительно менее чем на 1 мас.%. Содержание соли при этом определяют с помощью методов, рассмотренных ниже в соответствующем разделе настоящего описания.
Предлагаемые в изобретении высокочистые основания общей формулы I можно получать путем их высвобождения из высокочистых кристаллических солей общей формулы II
в которой А и R имеют указанные выше значения, а Х- обозначает остаток соответствующей физиологически совместимой кислоты и в которой помеченный символом * (звездочкой) С-атом может находиться в (R)-конфигурации, (S)-конфигурации или в смешанной конфигурации.
Кислотным остатком Х- может при этом служить прежде всего анион одной из кислот из группы, включающей соляную кислоту, бромистоводородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую кислоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, янтарную кислоту, DL-яблочную кислоту, L-(-)-яблочную кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)-винную кислоту, лимонную кислоту, L-аспарагиновую кислоту, L-(+)-аскорбиновую кислоту, D-(+)-глюкороновую кислоту, 2-оксопропионовую кислоту (пировиноградную кислоту), фуран-2-карбоновую кислоту (пирослизевую кислоту), бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту, ванилиновую кислоту, 4-гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (N-бензоилглицин), ацетуровую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4-гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту и оротовую кислоту, при этом особенно предпочтительны такие анионы кислот, как гидрофумарат и гидрохлорид.
Из указанного высокочистого соединения общей формулы II соответствующие высокочистые свободные основания высвобождают путем добавления пригодных для этих целей основных реагентов ("реагентов высвобождения"). В качестве примера подобных реагентов высвобождения можно назвать щелочные соединения из группы, включающей
- гидроксиды, карбонаты и гидрокарбонаты щелочных, щелочноземельных металлов и аммония,
- амины, полиамины и оснòвные полиаминокислоты, которые могут быть представлены как в растворенном виде, так и в фиксированном на соответствующих носителях виде, и
- оснòвные иониты,
предпочтительны при этом слабощелочные соединения с показателем кислотности (pKB) 8-11.
Из числа реагентов высвобождения предпочтительно использовать те из них, которые препятствуют осаждению 3,3-дифенилпропиламиномоноэфира в виде свободного основания в используемом растворителе. Кроме того, следует избегать гидролиза эфирной связи.
При взаимодействии в водной среде, например, соединения формулы II с соответствующим гидрокарбонатом сначала в качестве промежуточного продукта образуется гидрокарбонат 3,3-дифенилпропиламиномоноэфира. При экстрагировании органическим растворителем, например дихлорметаном, путем встряхивания происходит улетучивание СО2, что позволяет без дополнительной очистки получать из органической фазы малорастворимый в воде свободный сложный 3,3-дифенилпропиламиномоноэфир в виде высокочистого масла.
Такая технология позволяет предотвратить осаждение сложного 3,3-дифенилпропиламиномоноэфира непосредственно после его высвобождения, что в противном случае может привести к снижению чистоты и/или выхода продукта. При этом удается также избежать гидролиза эфирной связи.
Гидрокарбонаты соединений общей формулы I, прежде всего гидрокарбонат фезотеродина, в качестве предпочтительных промежуточных продуктов также являются объектом настоящего изобретения.
С учетом этого в качестве реагента высвобождения особенно предпочтительно использовать гидрокарбонат щелочного металла, щелочноземельного металла или аммония, наиболее предпочтителен из которых гидрокарбонат натрия.
Поэтому в одном из предпочтительных вариантов осуществления способа получения соединений с предлагаемыми в изобретении характеристиками сначала соль формулы II растворяют в воде и смешивают с оснòвным реагентом высвобождения, например с предусмотренным для этой цели гидрокарбонатом. Затем смесь экстрагируют соответствующим растворителем путем встряхивания и органическую фазу концентрируют до получения в качестве остатка высокочистого основания формулы I в виде вязкого масла. Этот вариант осуществления способа более подробно рассмотрен в примере 1В.
К пригодным для очистки свободного основания растворителям относятся прежде всего дихлорметан, трет-бутилметиловый эфир, диэтиловый эфир, этилацетат, этилметилкетон и толуол, особенно предпочтителен среди которых дихлорметан.
В другом варианте осуществления способа получения соединений с предлагаемыми в изобретении характеристиками сначала высокочистую соль формулы II растворяют в соответствующем растворителе, после чего пропускают через носитель, содержащий, например, фиксированный на его поверхности ионит. В этом случае высокочистое основание общей формулы I содержится в элюате.
Для получения (R)-2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутирата в виде высокочистого свободного основания особенно предпочтительно использовать в качестве исходного соединения гидрофумарат (R)-2-[3-(1,1-диизопропиламмоний)-1-фенилпропил]-4-(гидроксиметил)фенилизобутирата.
Объектом изобретения в соответствии с этим является способ получения высокочистого основания общей формулы I
в которой А обозначает водород или дейтерий, a R представляет собой группу, выбранную из C1-С6алкила, С3-С10циклоалкила и фенила, каждый из которых может быть замещен C1-С3алкоксигруппой, фтором, хлором, бромом, иодом, нитрогруппой, аминогруппой, гидроксигруппой, оксогруппой, меркаптогруппой или дейтерием, и в которой помеченный символом * (звездочкой) С-атом может находиться в (R)-конфигурации, (S)-конфигурации или в смешанной конфигурации, со степенью чистоты выше 97 мас.%, предпочтительно выше 98 мас.%, особенно предпочтительно выше 98,5 мас.%, наиболее предпочтительно выше 99 мас.%, отличающийся тем, что высокочистое свободное основание общей формулы I выделяют с чистотой выше 97 мас.%, предпочтительно выше 98 мас.%, особенно предпочтительно выше 98,5 мас.%, наиболее предпочтительно выше 99 мас.%, из кристаллической соли общей формулы II
в которой А и R имеют указанные выше значения, а Х- обозначает остаток соответствующей физиологически совместимой кислоты и в которой помеченный символом * (звездочкой) С-атом может находиться в (R)-конфигурации, (S)-конфигурации или в смешанной конфигурации.
Предпочтительным является предлагаемый в изобретении способ получения высокочистых оснований общей формулы I, в которых помеченный символом * (звездочкой) С-атом находится в (R)-конфигурации и/или в которых заместитель R выбран из группы, включающей метил, этил, изопропил, 1-пропил, 1-бутил, 2-бутил, трет-бутил, изобутил, пентил и гексил.
Особенно предпочтительно предлагаемый в изобретении способ предназначен для получения (R)-2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутирата в виде высокочистого свободного основания, при этом в качестве исходного соединения формулы II наиболее целесообразно использовать гидрофумарат (R)-2-[3-(1,1-диизопропиламмоний)-1-фенилпропил]-4-(гидроксиметил)фенилизобутирата.
Способ получения высокочистых солей формулы II известен из WO 01/35957. С этой целью сначала раствор 2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенола подвергают в щелочном растворе взаимодействию с хлорангидридом соответствующей кислоты, например с хлорангидридом изомасляной кислоты. Затем полученное таким путем основание с низкой степенью чистоты смешивают при нагревании с кислотой, например с фумаровой кислотой. Образовавшуюся соль общей формулы II можно выкристаллизовывать из соответствующих растворителей. Полученные кристаллы вновь растворяют и перекристаллизовывают. Этот процесс при необходимости можно повторять несколько раз до получения в результате соединения формулы II с требуемой степенью чистоты. Из таких солей описанным выше путем получают высокочистое основание формулы I. Выход высокочистого свободного основания формулы I составляет при этом, как правило, более 90% от теории в пересчете на количество используемого сложного 3,3-дифениламиномоноэфира формулы II.
В таблице 1 представлены результаты очистки фезотеродина в виде основания с помощью предлагаемого в изобретении способа.
| Таблица 1 | |
| Стадии способа а) | Чистота соединения В или Е (%) |
| 1. Химический синтез основания В из соединения А | 94,37 |
| 2. Получение соли Е из основания В, полученного на стадии 1 | 92,58 |
| 3. Перекристаллизация полученной на стадии 2 соли Е | 99,32 |
| 4. Высокочистое основание В, выделенное из полученной на стадии 3 соли Е | 99,14 |
| а)Соединения А, В, С, Е: R обозначает изопропил, см. фиг.1. |
Предлагаемые в изобретении высокочистые основания общей формулы I получают в виде масла, и они остаются стабильными при -20°С. При более высоких температурах, например при 2-8°С, предлагаемые в изобретении свободные основания предпочтительно хранить в присутствии осушителей.
Предлагаемый в изобретении способ впервые позволяет эффективно получать свободные основания общей формулы I в высокочистом виде. Предлагаемый в изобретении способ допускает возможность его расширения до масштабов промышленного получения высокочистых соединений, впервые предоставляя возможность получения фармацевтических композиций, содержащих высокочистые основания общей формулы I.
Еще одним объектом настоящего изобретения в соответствии с этим является фармацевтическая композиция, содержащая соединение общей формулы I
в которой А обозначает водород или дейтерий, a R представляет собой группу, выбранную из C1-С6алкила, С3-С6циклоалкила и фенила, каждый из которых может быть замещен C1-С3алкоксигруппой, фтором, хлором, бромом, иодом, нитрогруппой, аминогруппой, гидроксигруппой, оксогруппой, меркаптогруппой или дейтерием, и в которой помеченный символом * (звездочкой) С-атом может находиться в (R)-конфигурации, (S)-конфигурации или в смешанной конфигурации, а также по меньшей мере один фармацевтически приемлемый носитель, при этом свободное основание соединения формулы I имеет чистоту выше 97 мас.%, предпочтительно выше 98 мас.%, особенно предпочтительно выше 98,5 мас.%, наиболее предпочтительно выше 99 мас.%.
В одном из предпочтительных вариантов осуществления изобретения предлагаемая в нем фармацевтическая композиция содержит соединение общей формулы I, в которой R выбран из группы, включающей метил, этил, изопропил, 1-пропил, 1-бутил, 2-бутил, трет-бутил, изобутил, пентил и гексил, особенно предпочтительно представляет собой изопропил, а помеченный символом * (звездочкой) С-атом особенно предпочтительно находится в (R)-конфигурации.
В одном из наиболее предпочтительных вариантов осуществления изобретения фармацевтическая композиция содержит (R)-2-[3-(1,1-диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенилизобутират в виде свободного основания (фезотеродин в виде свободного основания) со степенью чистоты по меньшей мере 97 мас.%, предпочтительно выше 98 мас.%, особенно предпочтительно выше 98,5 мас.%, наиболее предпочтительно выше 99 мас.%.
Поскольку предлагаемые в изобретении свободные основания восприимчивы к гидролизу, соответственно к переэтерификации, содержащие их фармацевтические композиции рекомендуется хранить при температуре предпочтительно ниже 25°С, особенно предпочтительно ниже 8°С, в присутствии осушителей.
В предпочтительном варианте предлагаемые в изобретении свободные основания находятся в составе содержащей их фармацевтической композиции в слабокислой среде, т.е. при рН 3-7, предпочтительно при рН 3-6 или 3-5, поскольку стабильность свободных оснований в этих условиях является наиболее высокой.
По соображениям стабильности предпочтительно далее избегать наличия в фармацевтических композициях C1-C8-спиртов с короткой цепью, прежде всего С1-С4-спиртов.
Тип лекарственной формы, в виде которой может быть представлена фармацевтическая композиция, зависит прежде всего от предусматриваемого пути ее введения в организм, а также от требуемых свойств конкретной лекарственной формы. В соответствии с этим предлагаемая в изобретении фармацевтическая композиция может быть представлена, например, в виде лекарственных форм для перорального применения, таких как порошки, гранулы, таблетки, драже, капсулы, растворы или суспензии, в виде лекарственных форм для парентерального применения, таких как растворы или суспензии, в виде лекарственных форм для трансдермального применения, таких как трансдермальные терапевтические системы (ТТС), мази, кремы, пленки, примочки, спреи, гели или пены, или в виде лекарственных форм для трансмукозного применения, к которым относятся лекарственные формы для буккального или сублингвального применения, такие как таблетки с быстрым высвобождением действующего вещества, спреи, капли, лекарственные формы в виде облаток, мукоадгезивные пилюли или пластыри, лекарственные формы для назального применения, такие как примочки, капли, спреи или мази, и лекарственные формы для пульмонального применения, такие как аэрозоли.
В качестве фармацевтически приемлемых носителей в принципе могут использоваться вспомогательные вещества, известные специалистам в области фармацевтических технологий и описанные, например, у Sucker, Fuchs и Speiser, Pharmazeutische Technologie, изд-во Georg Thieme Verlag, Stuttgart, а также в других обзорных публикациях, посвященных соответствующим лекарственным формам.
Подобная фармацевтическая композиция может быть представлена в виде традиционной лекарственной формы, однако в зависимости от особых потребностей пациента может быть также представлена в виде лекарственной формы с быстрым высвобождением действующего вещества или в виде ретард-формы (форма с замедленным высвобождением действующего вещества).
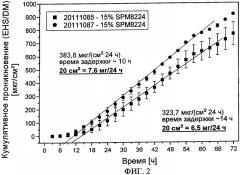
Основания общей формулы I, например фезотеродин, способны, как неожиданно было установлено, проникать через мембраны. По этой причине они особенно пригодны для трансдермального или трансмукозного применения в составе соответствующих фармацевтических композиций.
Предлагаемые в изобретении высокочистые основания общей формулы I предпочтительно использовать в предназначенных для трансдермального или трансмукозного применения композициях с контролируемым высвобождением из них действующего вещества. Особенно предпочтительны при этом фармацевтические композиции, которые после определенной начальной фазы задержки обеспечивают проникновение высвобождающегося из них действующего вещества через кожу или слизистую оболочку пациента с постоянной скоростью на протяжении по меньшей мере 24 ч, предпочтительно по меньшей мере 48 ч. Для обеспечения такого контролируемого высвобождения действующего вещества фармацевтическая композиция предпочтительно содержит по меньшей мере один полимерный слой, в котором высокочистое основание общей формулы I присутствует в диспергированном либо растворенном виде. Подбором состава подобного полимерного слоя можно влиять на характеристику высвобождения из него действующего вещества. Так, например, растворимостью действующих веществ в полимерной матрице в решающей степени определяется режим высвобождения того или иного действующего вещества из трансдермальных или трансмукозных терапевтических систем, а тем самым и скорость его проникновения через кожу, соответственно через слизистую оболочку.
Помимо этого в состав полимерного слоя могут входить обладающие свойствами контактных (активируемых при кратковременном прижатии) клеев вещества, позволяющие прикреплять и фиксировать фармацевтическую композицию на коже или слизистой оболочке пациента. Так, например, буккальную композицию можно приготавливать в виде мукоадгезивной системы, из которой действующее вещество высвобождается постепенно, с замедлением. Для приклеивания к слизистой оболочке используют обладающие адгезионной способностью полимеры, соответственно сополимеры, такие, например, как ПВП (поливинилпирролидон), пектины, карбопол, полиакрилаты, производные целлюлозы, хитозан или полиоксиэтилен. Соответствующие примеры таких веществ и более подробную информацию о них можно найти, в частности, в US 6210699, US 4855142, US 4680323, US 5700478, US 4948580, US 4715369, US 4876092, US 5750136, а также у Woodley, Clin. Pharmacokinet. 40, 2001, с.77, или у Singla, Drug Dev. Ind. Pharm. 26, 2000, с.913. Подобные полимеры, соответственно сополимеры могут выполнять роль клейкой оболочки, например, у таблеток, но вместе с тем могут также, например, в предназначенном для буккального применения пластыре являться компонентом клейкой полимерной матрицы, в которой действующее вещество присутствует в растворенном или диспергированном виде (Wong, Int. Journ. Pharm. 178, 1999, с.11).
В соответствии с этим согласно одному из вариантов осуществления изобретения фармацевтическая композиция для трансдермального введения в организм высокочистого основания формулы I представляет собой предназначенную для буккального применения композицию, прежде всего в виде буккального пластыря по меньше мере с одним полимерным слоем, в котором высокочистое основание общей формулы I присутствует в растворенном или диспергированном виде. Такой содержащий высокочистое основание полимерный слой предпочтительно обладает мукоадгезивными свойствами.
В одном из особенно предпочтительных вариантов осуществления изобретения фармацевтическая композиция для трансдермального введения в организм высокочистого основания формулы I представляет собой пластырь для трансдермального введения в организм этого действующего вещества, называемый просто трансдермальным пластырем. Подобные трансдермальные пластыри (часто называемые также трансдермальными терапевтическими системами, сокращенно ТТС) можно классифицировать по-разному, однако в большинстве случаев их подразделяют на три следующие основные группы.
К первой группе относятся ТТС резервуарного типа, в которых действующее вещество присутствует в растворе или геле и поступает к коже пациента через регулирующую скорость такого его поступления к коже мембрану.
Ко второй группе относятся ТТС матричного типа, которые в свою очередь можно подразделять на ТТС ламинатного типа, в которых действующее вещество содержится в слое (матрице) из неадгезивного полимера и которые для их прикрепления к коже могут содержать другие слои, например клеевой слой, однако могут фиксироваться на коже и отдельными клейкими пленками (лейкопластырями), и на ТТС монолитного типа, в которых действующее вещество содержится в слое контактного клея (клеевой матрице). Пример типичной структуры монолитной ТТС представлен на фиг.4. Схематично показанная на этом чертеже монолитная ТТС состоит из содержащей действующее вещество клеевой матрицы (1), из инертного по отношению к компонентам клеевой матрицы и непроницаемого для них тыльного слоя (2), который после нанесения ТТС на кожу располагается с обращенной от кожи стороны ТТС, а также удаляемого перед нанесением ТТС на кожу слоя (3).
К третьей группе ТТС относятся ионтофоретические системы, в которых проникновение действующего вещества через кожу дополнительно интенсифицируют за счет приложения электрического напряжения.
К особенно предпочтительным лекарственным формам согласно настоящему изобретению относятся ТТС матричного типа, из которых наиболее предпочтительными являются монолитные ТТС, в которых действующее вещество содержится во внедренном в клеевую матрицу виде.
В последующей части описания под понятием "полимерная матрица" или просто "матрица" подразумевается полимерсодержащий слой или полимерсодержащая масса, при этом в указанное понятие включено и понятие "клеевая матрица".
Под понятием "общая масса полимерной матрицы" согласно изобретению подразумевается масса полимерной матрицы, включая массу внедренного в нее действующего вещества и возможных вспомогательных веществ.
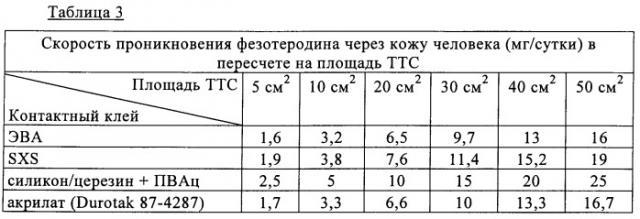
В качестве не ограничивающих примеров адгезионных полимеров, соответственно сополимеров, которые могут использоваться для изготовления трансдермальных устройств (систем) и которые могут содержать действующее вещество общей формулы I в растворенном, частично растворенном или диспергированном виде, можно назвать кремнийорганические (силиконовые) клеи, клеи на основе сополимеров этилена с винилацетатом (ЭВА-клеи), клеи на основе блоксополимеров стирола (SXS-клеи), акрилатные клеи, полиуретановые клеи, винилацетатные клеи, а также клейкие каучуки, например полиизобутилен, полибутадиен, неопрен или полиизопрен, равно как и соответствующие смеси этих клеев.
В качестве контактных клеев особенно пригодны используемые в технологии изготовления пластырей полимерные клеи силиконового типа, акрилатного типа, SXS-типа и ЭВА-типа, известные из уровня техники. Свойства этих клеев более подробно рассмотрены ниже.
Дозировка предлагаемых в изобретении соединений зависит от возраста, веса и состояния пациента, а также от методики и временных интервалов их введения в организм. Обычно эффективная суточная доза составляет от 0,5 до 20 мг. При пероральном введении обычно назначают по меньшей мере 3 мг/сутки, например от 3 до 15 мг/сутки, предпочтительно от 4 до 12 мг/сутки. Обычная суточная доза, например, фезотеродина для трансдермального или трансмукозного введения взрослому пациенту может составлять по меньшей мере 3 мг, предпочтительно от 3 до 15 мг, особенно предпочтительно от 4 до 12 мг. Исходя из этого фармацевтическая композиция, предназначенная для одноразового применения в сутки, должна содержать предпочтительно от 3 до 15 мг высокочистого основания общей формулы I.
Если фармацевтическая композиция предназначена для трансдермального применения, то по соображениям надежности она обычно должна содержать вводимое действующее вещество в примерно двойном количестве. В соответствии с этим типичная предлагаемая в изобретении композиция для трансдермального введения в организм высокочистого соединения общей формулы I содержит по меньшей мере 6 мг действующего вещества, однако в зависимости от соответствующей дозировки и временного интервала между отдельными введениями может содержать и более 10, 20, 30, 40 или 50 мг высокочистого действующего вещества общей формулы I, например фезотеродина, из расчета на одну дозированную лекарственную форму. При пяти- или даже семидневном интервале между введениями содержание действующего вещества в дозированной лекарственной форме может превышать 70, 80, 90 и даже 100 мг.
Под понятием "дозированная лекарственная форма" согласно изобретению подразумевается фармацевтическая композиция, которая содержит определенное количество действующего вещества и из которой оно при одноразовом введении в организм пациента высвобождается в течение заданного промежутка времени в терапевтически эффективном количестве. Тем самым понятие "дозированная лекарственная форма" включает согласно изобретению как таблетки, рассчитанные на трехразовый прием в сутки, так и пластыри для недельного применения.
В соответствии с этим еще одним объектом настоящего изобретения является дозированная лекарственная форма, содержащая по меньшей мере 3 мг соединения общей формулы I
в которой А обозначает водород или дейтерий, a R представляет собой группу, выбранную из C1-С6алкила, С3-С6циклоалкила и фенила, каждый из которых может быть замещен C1-С3алкоксигруппой, фтором, хлором, бромом, иодом, нитрогруппой, аминогруппой, гидроксигруппой, оксогруппой, меркаптогруппой или дейтерием, и в которой помеченный символом * (звездочкой) С-атом может находиться в (R)-конфигурации, (S)-конфигурации или в смешанной конфигурации, а также по меньшей мере один фармацевтически приемлемый носитель, при этом свободное основание соединения формулы I имеет чистоту выше 97 мас.%, предпочтительно выше 98 мас.%, особенно предпочтительно выше 98,5 мас.%, наиболее предпочтительно выше 99 мас.%.
В других вариантах осуществления изобретения дозированная лекарственная форма содержит по меньшей мере 10, 20, 30, 40, 50, 70, 80, 90 и даже более 100 мг высокочистого действующего вещества общей формулы I.
В одном из предпочтительных вариантов осуществления изобретения предлагаемая в нем дозированная лекарственная форма содержит соединение общей формулы I, в которой R выбран из группы, включающей метил, этил, изопропил, 1-пропил, 1-бутил, 2-бутил, трет-бутил, изобутил, пентил и гексил, особенно предпочтительно представляет собой изопропил, а помеченный символом * (звездочкой) С-атом особенно предпочтительно находится в (R)-конфигурации.
В одном из наиболее предпочтительных вариантов осуществления изобретения дозированная лекарственная форма содержит (R)-2-[3-(