Способы индукции конечной дифференцировки
Иллюстрации
Показать всеНастоящее изобретение относится к твердой фармацевтической композиции для лечения злокачественных опухолей, включающих злокачественные опухоли гортани, щитовидной железы, потовых желез, почек, предстательной железы, болезни Ходжкина, не-ходжкинскую лимфому и лейкоз, содержащей эффективное количество кристаллической формы субероиланилида гидроксамовой кислоты (САГК), полученной способом, включающим стадию перекристаллизации неочищенного препарата САГК из смеси метанола и воды в соотношении примерно 2:1, и носитель. 2 н. и 7 з.п. ф-лы, 20 табл., 14 ил.
Реферат
ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на преимущества предварительной заявки на патент США No. 60/361759, поданной 4 марта 2002 года. Полное содержание предварительной заявки включено в описание в качестве ссылки.
ЗАЯВЛЕНИЕ ОБ УЧАСТИИ В РАЗРАБОТКАХ ПРАВИТЕЛЬСТВА
Настоящее изобретение выполнено полностью или частично при правительственной поддержке в рамках гранта номер 1R21 CA 096228-01, выданного National Cancer Institute. Правительство может иметь определенные права на настоящее изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам селективной индукции конечной дифференцировки, остановке роста клеток и/или апоптоза опухолевых клеток и/или ингибированию гистондезацетилаз (HDAC) путем введения фармацевтических композиций, содержащих ингибиторы HDAC. Пероральные формы фармацевтических композиций имеют благоприятные фармакокинетические профили по таким позициям, как высокая биодоступность, и неожиданно позволяют достигать высокого содержания активных соединений в крови в течение длительного периода времени.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Приведенные в заявке ссылки на различные публикации обозначены арабскими цифрами в скобках. Полное цитирование указанных публикаций приведено в конце описания непосредственно перед формулой изобретения. Полное содержание приведенных публикаций включено в настоящую заявку в качестве ссылки для более полной характеристики состояния в той области техники, к которой относится изобретение.
Злокачественная опухоль представляет собой заболевание, при котором популяция клеток становится в различной степени невосприимчивой к контрольным механизмам, которые в норме регулируют пролиферацию и дифференцировку клеток. В течение многих лет имелись две принципиальных стратегии химиотерапевтического лечения злокачественной опухоли: а) блокирование пролиферации гормонзависимых опухолевых клеток путем создания препятствий для образования или периферического действия половых гормонов; и b) лизис злокачественных клеток путем непосредственного воздействия на них цитотоксических веществ, которые повреждают популяции как опухолевых, так и нормальных клеток.
Терапия злокачественных опухолей также ставила целью индукцию конечной дифференцировки опухолевых клеток (1). Дифференцировка на моделях клеточных культур была показана в случае воздействия на клетки множества стимулов, включая циклический АМФ и ретиноевую кислоту (2,3), акларубицин и другие антрациклины (4).
Несмотря на многие достижения в области онкологии, большинство солидных опухолей все еще не поддается лечению на поздних стадиях заболевания. В большинстве случаев используют цитотоксическую терапию, однако она зачастую вызывает значительное болезненное состояние у пациента без значимого клинического успеха. Исходя из этого, проводятся поиски менее токсичных и более специфичных средств для лечения и подавления развернутых злокачественных новообразований.
Накоплено множество доказательств того, что неопластическая трансформация необязательно разрушает потенциал злокачественных клеток к дифференцировке (1,5,6). Имеется немало примеров опухолевых клеток, которые не реагируют на нормальные регуляторы пролиферации, так что создается впечатление, что в них блокирована экспрессия программы дифференцировки, и тем не менее в таких клетках можно индуцировать дифференцировку и остановить репликацию. Множество средств, включая некоторые относительно простые полярные соединения (5,7-9), производные витамина D и ретиноевой кислоты (10-12), стероидные гормоны (13), ростовые факторы (6,14), протеазы (15,16), опухолевые промоторы (17,18) и ингибиторы синтеза ДНК или РНК (4, 19-24), могут индуцировать в различных трансформированных клеточных линиях и первичных эксплантатах человеческих опухолей экспрессию более дифференцированных характеристик.
В более ранних исследованиях была идентифицирована серия полярных соединений, которые являются эффективными индукторами дифференцировки для большого числа трансформированных клеточных линий (8,9). Среди них наиболее эффективным индуктором является гибридное полярное/неполярное соединение бисацетамид N,N'-гексаметилена (БАГМ (HMBA)) (9). Использование указанного полярного/неполярного соединения для индукции эритродной дифференцировки в эритролейкозных клетках мышей (MELC) с подавлением онкогенности привело к созданию модели, применимой для изучения опосредованной индуктором дифференцировки трансформированных клеток (5,7-9). БАГМ-индуцированная конечная дифференцировка эритроидов в MELC представляет собой многоступенчатый процесс. При добавлении БАГМ в культуре к MELC (745А-DS19) наблюдается латентный период в течение 10-12 часов перед началом конечной дифференцировки. Детерминация определяется как способность клеток экспрессировать конечную дифференцировку несмотря на удаление индуктора (25). При продолжении воздействия БАГМ наблюдается прогрессирующий рекрутинг клеток к дифференцировке. Настоящие авторы показали, что клеточные линии MELC, приобретшие резистентность к относительно низким содержаниям винкристина, становятся заметно более чувствительными к индуцирующему действию БАГМ и могут быть индуцированы к дифференцировке, при наличии небольшого латентного периода или вообще в его отсутствие (26).
БАГМ способен индуцировать соответствующие дифференцировки фенотипические изменения в самых различных клеточных линиях (5). Характеристики эффекта, индуцируемого лекарственным соединением, широко изучались с использованием системы эритролейкозных клеток мышей (MELC) (5,25,27,28). Индукция MELC к дифференцировке зависит от времени и концентрации. Минимальная концентрация, необходимая для демонстрации эффекта in vitro у большинства штаммов, составляет 2-3 мМ; минимальная длительность непрерывной экспозиции, необходимой в основном для индукции дифференцировки в значительной части (>20%) клеток без продолжения воздействия лекарственного соединения, составляет примерно 36 часов.
Первичная мишень действия БАГМ неизвестна. Имеются данные, свидетельствующие о том, что протеинкиназа С участвует в механизме дифференцировки, опосредованной индуктором (29). Исследования in vitro дали основания рассматривать БАГМ в качестве средства, способствующего клеточной дифференцировке, применимого для лечения злокачественных опухолей человека (30). К настоящему времени завершен ряд клинический испытаний, проведенных с применением БАГМ на фазе I (31-36). Результаты проведенных клинических испытаний показали, что данное соединение может индуцировать терапевтический ответ у больных со злокачественной опухолью (35,36). Однако указанные клинические испытания на фазе I также показали, что потенциальная эффективность БАГМ ограничена, частично в связи с его токсичностью, зависимой от дозы, которая мешает достичь оптимальных содержаний данного соединения в крови, и в связи с необходимостью внутривенного введения больших количеств данного средства в течение длительных периодов времени.
Было показано, что множество близких к БАГМ соединений с полярными группами, разделенными неполярными связями, характеризуются, на молярной основе, такой же активностью (37) или в 100 раз большей активностью, чем БАГМ (38). Однако, что касается класса, то было показано, что симметричные димеры, такие как БАГМ и родственные соединения, являются не лучшими клеточными дифференцирующими средствами.
Неожиданно было обнаружено, что наилучшие соединения содержат две полярных концевых группы, разделенных гибкой цепью метиленовых групп, где одна или обе полярных концевые группы представляют собой крупную гидрофобную группу. Предпочтительно обе полярные концевые группы являются разными и лишь одна из них представляет собой крупную гидрофобную группу. Данные соединения, как неожиданно оказалось, обладают в тысячи раз большей активностью, чем БАГМ, и в десять раз большей активностью, чем соединения, родственные БАГМ.
Ингибиторы гистондезацетилазы, такие как субероиланилид гидроксамовой кислоты (САГК (SAHA)), принадлежат к классу соединений, которые обладают способностью индуцировать остановку роста опухолевых клеток, дифференцировку и/или апоптоз (39). Указанные соединения направлены на механизмы, придающие опухолевым клеткам способность становиться злокачественными, и по всей видимости, не обладают токсичностью в дозах, эффективных для ингибирования опухолевого роста у животных (40). Получено несколько доказательств того, что ацетилирование и дезацетилирование гистонов представляют собой механизмы, посредством которых в клетке достигается регуляция транскрипции (41). Считается, что указанные эффекты осуществляются через изменения структуры хроматина за счет изменения афинности гистоновых белков к скрученной ДНК в нуклеосоме. В нуклеосомах было идентифицировано пять типов гистонов (обозначенных как H1, H2A, H2B, H3 и H4). Каждая нуклеосома содержит в своем ядре два представителя каждого типа гистонов, за исключением Н1, который присутствует только во внешней части нуклеосомной структуры. Считается, что когда гистоновые белки гипоацетилированы, то такие гистоны обладают большей афинностью к фосфатному скелету ДНК. Афинность способствует более тесной связи ДНК с гистоном и делает такую ДНК недоступной для регуляторных элементов и механизмов транскрипции. Регуляция уровня ацетилирования происходит через баланс активности двух ферментных комплексов: гистонацетилтрансферазы (ГАТ (НАТ)) и гистондезацетилазы (HDAC). Считается, что гипоацетилированное состояние ингибирует транскрипцию соответствующей ДНК. Такое гипоацетилированное состояние достигается за счет катализа крупными мультибелковыми комплексами, которые содержат HDAC ферменты. В частности, было показано, что HDAC катализирует удаление ацетильных групп из ядерных гистонов хроматина.
Ингибирование HDAC под действием САГК происходит, как показано в исследованиях с использованием рентгеновской кристаллографии (42), через непосредственное взаимодействие с каталитическим сайтом фермента. Считается, что достигаемое ингибирование HDAC не оказывает генерализованный эффект на весь геном, а воздействует, скорее всего, на небольшую часть генома (43). Результаты, полученные с микрочипами ДНК при использовании линий злокачественных клеток, культивируемых с ингибитором HDAC, указывают на то, что имеется определенное (1-2%) число генов, продукты которых содержат изменения. Например, клетки, которые подвергают обработке ингибиторами HDAC в культуре, демонстрируют индукцию ингибитора циклинзависимой киназы р21 (44). Данный белок играет важную роль в остановке клеточного цикла. Считается, что ингибиторы HDAC повышают скорость транскрипции р21 за счет распространения гиперацетилированного состояния гистона на участке р21 гена, что делает данный ген доступным для механизмов транскрипции. Гены, экспрессия которых не подвергается воздействию ингибиторов HDAC, не демонстрируют изменений в уровне ацетилирования региональных ассоциированных гистонов (45).
В ряде случаев было показано, что потеря активности ГАТ или HDAC включается в развитие злокачественного фенотипа. Например, при остром промиелоцитарном лейкозе онкопротеин, образуемый при слиянии PML и RAR-альфа, по всей видимости, подавляет транскрипцию специфичного гена путем рекрутинга HDAC (46). В такой ситуации опухолевая клетка не способна завершить дифференцировку, что ведет к избыточной пролиферации клеток в лейкозной клеточной линии.
В патентах США NoNo. 5369108, 5932616, 5700811, 6087367 и 6511990, принадлежащих авторам настоящего изобретения, описываются соединения, применимые для целей селективной индукции конечной дифференцировки опухолевых клеток, где указанные соединения имеют две полярных концевых группы, разделенных гибкой цепью метиленовых групп или ригидной фенильной группой, причем одна или обе концевые полярные группы представляют крупную гидрофобную группу. Некоторые из таких соединений содержат дополнительную крупную гидрофобную группу на том же конце молекулы, что и первая гидрофобная группа, что также повышает дифференцирующую активность как в ферментном тесте, примерно в 100 раз, так и в тесте на клеточную дифференцировку, примерно в 50 раз. Способы синтеза соединений, используемых в способах и фармацевтических композициях настоящего изобретения, подробно раскрыты в указанных выше патентах, полное содержание которых включено в настоящее описание в качестве ссылки.
В указанных выше патентах не описываются конкретные пероральные композиции ингибиторов HDAC или конкретные дозировки и режим дозирования приведенных соединений. Важно, что указанные выше патенты не описывают пероральные композиции, которые обладали бы благоприятными фармакокинетическими профилями, такими как высокая биодоступность, которая позволяет достигать высокого содержания активных соединений в крови в течение длительного периода времени.
Класс, содержащий соединения по настоящему изобретению, может рассматриваться для использования с целью селективной индукции конечной дифференцировки опухолевых клеток и в этой связи, для лечения опухолей у пациентов. Таким образом, имеется острая потребность в определении подходящих дозировок, режима дозирования указанных соединений и в разработке композиций, предпочтительно пероральных композиций, которые бы позволили поддерживать стойкое терапевтическое эффективное содержание активных соединений в крови в течение длительного периода времени.
КРАТКОЕ ОПИСАНИЯ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам достижения в плазме крови средних значений концентрации ингибитора гистондезацетилазы (HDAC), способных ингибировать дезацетилирование гистонов in vivo у субъекта в течение длительного периода времени, равного по меньшей мере двум часам после введения, которые предусматривают введение указанному субъекту эффективного количества фармацевтической композиции, содержащей ингибитор HDAC или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение также относится к способам селективной индукции конечной дифференцировки, остановки роста клеток/или апоптоза опухолевых клеток, за счет чего достигается ингибирование пролиферации таких клеток, и к способам индукции дифференцировки опухолевых клеток за счет достижения средних значений концентрации в плазме крови ингибитора гистондезацетилазы (HDAC), способных ингибировать гистондезацетилазу in vivo у субъекта в течение длительного периода времени, равного по меньшей мере двум часам после введения, посредством введения указанному субъекту эффективного количества фармацевтической композиции, содержащей ингибитор HDAC или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение также относится к способам достижения в плазме крови среднего значения концентрации, равного по меньшей мере 10 нМ, субероиланилида гидроксамовой кислоты (САГК (SAHA)) in vivo у субъекта в течение длительного периода времени, равного по меньшей мере двум часам после введения, которые предусматривают введение указанному субъекту эффективного количества фармацевтической композиции, содержащей САГК или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение также относится к способам селективной индукции конечной дифференцировки, остановки роста клеток и/или апоптоза опухолевых клеток, за счет чего достигается ингибирование пролиферации таких клеток, к способам индукции дифференцировки опухолевых клеток за счет достижения в плазме крови средних значений концентрации, равных по меньшей мере 10 нМ САГК, in vivo у субъекта в течение длительного периода времени, равного по меньшей мере двум часам после введения, которые предусматривают введение указанному субъекту эффективного количества фармацевтической композиции, содержащей САГК или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение относится к фармацевтическим композициям, подходящим для перорального введения, которые содержат соединение, применимое для селективной индукции конечной дифференцировки, остановки роста клеток и/или апоптоза опухолевых клеток и/или которое относится к мощному ингибитору гистондезацетилазы (HDAC). Фармацевтические композиции также содержат микрокристаллическую целлюлозу, натрий-кросскармелозу и стеарат магния. Настоящее изобретение также относится к фармацевтическим композициям для перорального введения, содержащим САГК, микрокристаллическую целлюлозу, натрий-кросскармелозу и стеарат магния. Пероральная биодоступность активных соединений в композициях по настоящему изобретению удивительно высокая. Кроме того, композиции неожиданно позволяют достичь высоких терапевтически эффективных содержаний активных соединений в крови в течение длительного периода времени. Настоящее изобретение также относится к безопасному режиму ежедневного дозирования данных композиций, который легко применять и соблюдать.
Как показано в настоящем описании, авторы неожиданно обнаружили, что пероральные композиции, содержащие ингибиторы HDAC, в особенности субероиланилид гидроксамовой кислоты (САГК), характеризуются в случае перорального введения очень высокой общей биодоступностью активного соединения in vivo. Кроме того, композиции позволяют достичь высокого содержания активного соединения в крови, которые сохраняются неожиданно высокими в течение длительного периода времени, например, до 10-12 часов. Пероральные композиции по настоящему изобретению имеют массу преимуществ, особенно в сравнении с парентеральными композициями, поскольку они, с одной стороны, обеспечивают достижение высоких, стабильных и длительных терапевтически эффективных уровней ингибиторов HDAC в крови, а с другой стороны, могут легко применяться пациентами в обычном режиме перорального введения.
Соответственно, настоящее изобретение относится к фармацевтической композиции для перорального введения, содержащей ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, так что указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения. В предпочтительном варианте осуществления изобретения концентрация ингибитора HDAC эффективна для ингибирования HDAC в течение периода времени, равного по меньшей мере 10 часам после введения.
В предпочтительном варианте настоящее изобретение относится к фармацевтической композиции для перорального введения, содержащей САГК или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови САГК, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения. В предпочтительном варианте настоящего изобретения концентрация САГК эффективна для ингибирования HDAC в течение периода времени, равного по меньшей мере 10 часам после введения.
Композиции по настоящему изобретению используются для селективной индукции конечной дифференцировки, остановки роста клеток и/или апоптоза опухолевых клеток и в этой связи, способствуют лечению опухолей у пациентов.
Соответственно, настоящее изобретение также относится к способу селективной индукции конечной дифференцировки опухолевых клеток у субъекта и в этой связи, к ингибированию пролиферации таких клеток у субъекта, предусматривающему стадию перорального введения субъекту эффективного количества фармацевтической композиции, содержащей ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, так что указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение также относится к способу селективной индукции, остановки роста опухолевых клеток у субъекта и достижения при этом ингибирования пролиферации таких клеток у субъекта, предусматривающему стадию перорального введения субъекту эффективного количества фармацевтической композиции, содержащей ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение также относится к способу селективной индукции апоптоза опухолевых клеток у субъекта и в этой связи, к ингибированию пролиферации таких клеток у субъекта, предусматривающему стадию перорального введения субъекту эффективного количества фармацевтической композиции, содержащей ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение также относится к способу индукции дифференцировки опухолевых клеток у субъекта с опухолью, предусматривающему стадию перорального введения субъекту эффективного количества фармацевтической композиции, содержащей ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение также относится к способу ингибирования активности гистондезацетилазы у субъекта, предусматривающему стадию перорального введения субъекту эффективного количества фармацевтической композиции, содержащей ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение также относится к способу селективной индукции конечной дифференцировки, остановки роста клеток и/или апоптоза опухолевых клеток у субъекта и в этой связи, к ингибированию пролиферации таких клеток у субъекта, предусматривающему стадию введения субъекту эффективного количества фармацевтической композиции, содержащей САГК или его фармацевтически приемлемую соль или гидрат, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови САГК, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение также относится к способу индукции дифференцировки опухолевых клеток у субъекта с опухолью, предусматривающему стадию введения субъекту эффективного количества фармацевтической композиции, содержащей САГК или его фармацевтически приемлемую соль или гидрат, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови САГК, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
Кроме того, настоящее изобретение относится к способу ингибирования активности гистондезацетилазы, предусматривающему стадию перорального введения субъекту эффективного количества фармацевтической композиции, содержащей САГК или его фармацевтически приемлемую соль или гидрат и фармацевтически приемлемый носитель или разбавитель, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови САГК, эффективной для ингибирования гистондезацетилазы (HDAC) in vivo в течение периода времени, равного по меньшей мере 2 часам после введения.
В предпочтительном варианте осуществления изобретения САГК или любой другой ингибитор HDAC вводят пациенту в суммарной ежедневной дозе, равной 25-4000 мг/м2. В другом предпочтительном варианте осуществления изобретения САГК или любой другой ингибитор HDAC вводят пациенту в суммарной ежедневной дозе 200 мг. САГК или любой другой ингибитор HDAC вводят пациенту в суммарной ежедневной дозе 400 мг.
В одном предпочтительном варианте осуществления изобретения композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC (например, САГК), способной ингибировать гистондезацетилазу в течение периода времени, равного по меньшей мере 2 часам после введения, причем предпочтительно указанная концентрация составляет по меньшей мере примерно 10 нМ. В еще одном предпочтительном варианте осуществления изобретения данная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, равной по меньшей мере примерно 10 нМ, в течение периода времени, равного по меньшей мере 10 часам после введения.
В одном предпочтительном варианте осуществления настоящего изобретения композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC (например, САГК), способной селективно индуцировать конечную дифференцировку, остановку роста клеток и/или апоптоз опухолевых клеток или способной индуцировать дифференцировку опухолевых клеток в опухоли, где указанная концентрация поддерживается в течение периода времени, равного по меньшей мере 2 часам после введения, причем предпочтительно указанная концентрация составляет по меньшей мере примерно 2,5 мкМ. В еще одном предпочтительном варианте осуществления настоящего изобретения композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, равной по меньшей мере 2,5 мкМ, в течение периода времени, равного по меньшей мере 10 часам после введения.
Композиции по настоящему изобретению могут изготавливаться в любой стандартной дозированной форме (жидкой или твердой), подходящей для перорального введения, например, в виде гранулы, таблетки, таблетки, покрытой оболочкой, капсулы, желатиновой капсулы, раствора, суспензии или дисперсии. В предпочтительном варианте осуществления настоящего изобретения композиция имеет форму желатиновой капсулы.
В композициях может использоваться любой инертный наполнитель, который обычно выполняет функцию носителя или разбавителя, такой как, например, камель, крахмал, сахар, целлюлозный материал, акрилат или их смеси. Предпочтительным разбавителем является микрокристаллическая целлюлоза. Композиции могут также содержать разрыхлитель (например, натрий-кросскармелозу) и смазывающее вещество (например, стеарат магния) и, кроме того, они могут содержать одну или более добавок, выбранных из связующего вещества, буфера, ингибитора протеазы, поверхностно-активного вещества, солюбилизирующего средства, пластификатора, эмульгатора, стабилизатора, средства повышения вязкости, подсластителя, пленкообразующего средства или любого их сочетания. Кроме того, композиции по настоящему изобретению могут быть изготовлены в форме композиции с контролируемым высвобождением или с немедленным высвобождением.
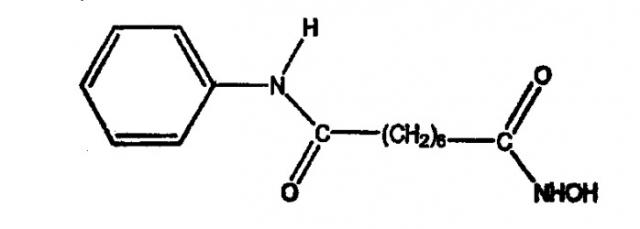
Широкое множество ингибиторов HDAC пригодно для использования в композициях по настоящему изобретению. В предпочтительном варианте осуществления настоящего изобретения ингибитор HDAC представляет собой субероиланилид гидроксамидной кислоты (САГК (SAHA)).
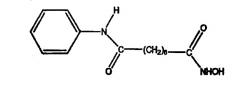
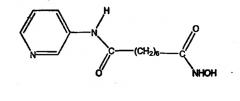
Другие неограничивающие примеры ингибиторов HDAC, которые подходят для использования в композициях по настоящему изобретению, содержат:
Пироксамид, описываемый структурой:
Соединение, описываемое структурой:
где R3 и R4 обозначают независимо замещенную или незамещенную, разветвленную или неразветвленную, алкильную, алкенильную, циклоалкильную, арильную, алкилокси, арилокси, арилалкилокси или пиридиновую группу, циклоалкильную, арильную, арилокси, арилалкилокси или пиридиновую группу, или R3 и R4, связанные вместе, образуют пиперидиновую группу; R2 обозначает гидроксиламино группу; и n равно целому числу от 5 до примерно 8.
Соединение, описываемое структурой:
где R обозначает замещенный или незамещенный фенил, пиперидин, тиазол, 2-пиридин, 3-пиридин или 4-пиридин и n равно целому числу от 4 до примерно 8.
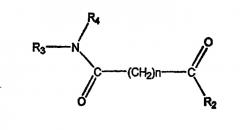
Соединение, описываемое структурой:
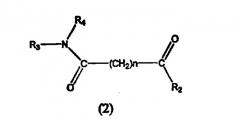
где А обозначает амидный фрагмент, R1 и R2, каждый, выбирают из замещенного или незамещенного арила (например, фенила), арилалкила (например, бензила), нафтила, пиридинамино, 9-пурин-6-амино, тиазоламино, арилокси, арилалкилокси, пиридила, хинолинила или изохинолинила; R4 обозначает водород, галоген, фенильный или циклоалкильный фрагмент и n равно целому числу от 3 до 10.
Кроме того, в соответствии с конкретными вариантами осуществления настоящего изобретения, в нем предлагается фармацевтическая композиция для перорального введения, содержащая ингибитор гистондезацетилазы (HDAC) или его фармацевтически приемлемую соль или гидрат, микрокристаллическую целлюлозу в качестве носителя или разбавителя, натрий-кросскармелозу в качестве разрыхлителя, и стеарат магния в качестве смазывающего вещества, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы in vivo в течение периода времени, равного по меньшей мере 2 часам после введения. В предпочтительном варианте осуществления настоящего изобретения ингибитор HDAC представляет собой субероиланилид гидроксамовой кислоты (САГК).
Кроме того, в соответствии с конкретными вариантами осуществления настоящего изобретения, в нем предлагается фармацевтическая композиция для перорального введения, содержащая субероиланилид гидроксамовой кислоты (САГК) или его фармацевтически приемлемую соль или гидрат, микрокристаллическую целлюлозу в качестве носителя или разбавителя, натрий-кросскармелозу в качестве разрыхлителя, и стеарат магния в качестве смазывающего вещества, где указанная композиция обеспечивает достижение среднего значения концентрации в плазме крови ингибитора HDAC, эффективной для ингибирования гистондезацетилазы in vivo в течение периода времени, равного по меньшей мере 2 часам после введения. В предпочтительном варианте осуществления настоящего изобретения композиция содержит 50-70 мас.% САГК или его фармацевтически приемлемой соли или гидрата, 20-40 мас.% микрокристаллической целлюлозы в качестве носителя или разбавителя, 5-15 мас.% натрий-кросскармелозы в качестве разрыхлителя и 0,1-5 мас.% стеарата магния в качестве смазывающего вещества. В другом предпочтительном варианте осуществления настоящего изобретения композиция содержит примерно 50-200 мг САГК. В особенно предпочтительном варианте осуществления настоящего изобретения композиция имеет форму желатиновой капсулы.
Настоящее изобретение также относится к безопасному режиму ежедневного введения доз указанных композиций, который легко применять и соблюдать. Композиции по настоящему изобретению применимы для селективной индукции конечной дифференцировки, остановки роста клеток и/или апоптоза опухолевых клеток и в этой связи способствуют лечению опухолей у пациентов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Приведенные выше и другие цели, особенности и преимущества настоящего изобретения станут понятными из прилагаемого ниже более подробного описания предпочтительных вариантов осуществления настоящего изобретения, проиллюстрированных в прилагаемых чертежах, в которых указанные цифры относятся к тем же частям в разных планах. Приведенные чертежи необязательно относятся к полному описанию изобретения, они не акцентируют внимание на каких-то его деталях, а даны лишь для иллюстрации принципов настоящего изобретения.
Фиг. 1 представляет собой иллюстрацию вестерн-блоттинга (верхний план), показывающую количества ацетилированного гистона-4 (α-AcH4) в плазме крови у пациента после перорального или внутривенного (в/в) введения дозы САГК. В/в САГК вводят в дозе 200 мг инфузией в течение двух часов. Перорально САГК вводят однократно в виде капсул по 200 мг. Количество α-AcH4 приведено в указанные временные точки. Нижний план: окрашивание красителем кумассиблю.
Фиг. 2 представляет собой иллюстрацию вестерн-блоттинга (верхние планы), показывающую количества ацетилированного гистона-4 (α-AcH4) в плазме крови у пациентов, имеющих солидные опухоли, после перорального или внутривенного (в/в) введения дозы САГК. В/в и пероральное введение САГК проводят по методике, проиллюстрированной на фиг. 1. Количество (α-AcH4) приведено в указанные временные точки. Эксперимент проведен с двойным повтором (фиг. 2А и фиг. 2B). Нижние планы: окрашивание красителем кумассиблю.
Фиг. 3 представляет собой иллюстрацию вестерн-блоттинга (верхние планы), показывающую количества ацетилированного гистона-4 (α-AcH4) (фиг. 3А) и ацетилированного гистона-3 (α-AcH3) (фиг. 3B-E) в плазме крови у пациентов, после перорального или внутривенного (в/в) введения дозы САГК на день 1 и день 21. В/в и пероральное введение САГК проводят по методике, проиллюстрированной на фиг. 1. Количество α-AcH4 или α-AcH3 приведено в указанные временные точки. Нижние планы: окрашивание красителем кумассиблю.
Фиг. 4 представляет собой иллюстрацию вестерн-блоттинга (верхние планы), показывающую количества ацетилированного гистона-3 (α-AcH3) в плазме крови у пациентов, имеющих солидные опухоли, после перорального или внутривенного (в/в) введения дозы САГК. В/в и пероральное введение САГК проводят по методике, проиллюстрированной на фиг. 1. Количество (α-AcH3) приведено в указанные временные точки. Нижний план: окрашивание красителем кумассиблю.
Фиг. 5 представляет собой иллюстрацию вестерн-блоттинга (верхние планы), показывающую количества ацетилированного гистона-3 (α-AcH3) в плазме крови у пациентов после перорального или внутривенного (в/в) введения дозы САГК. В/в САГК вводят в дозе 400 мг в течение двух часов. Пероральный САГК вводят однократно в виде капсулы с дозой 400 мг. Количество α-AcH4 приведено в указанные временные точки. Эксперимент проиллюстрирован в трех вариантах (фиг. 5А и B). Нижние планы: окрашивание красителем кумассиблю.
Фиг. 6 представляет собой иллюстрацию вестерн-блоттинга (верхний план), показывающую количества ацетилированного гистона-3 (α-AcH3) в плазме крови у пациентов, имеющих солидные опухоли, после перорального или внутривенного (в/в) введения дозы САГК. В/в и пероральное введение САГК проводят по методике, проиллюстрированной на фиг. 5. Количество α-AcH3 приведено в указанные временные точки. Нижний план: окрашивание красителем кумассиблю.
Фиг. 7 представляет собой иллюстрацию вестерн-блоттинга (верхние планы), показываю