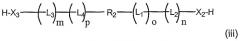Полимерные олигонуклеотидные пролекарства
Иллюстрации
Показать всеНастоящее изобретение относится к полимерным конъюгатам формулы (I), включающим нуклеотидный или олигонуклеотидный остаток, которые могут применяться для лечения рака, и способу их получения.
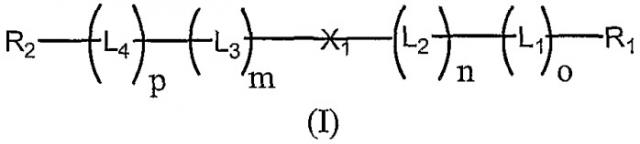
где R1 и R2 независимо представляют собой Н или полиалкиленоксид, необязательно имеющий кэппирующую группу, выбранную из ОН, NH2, SH, СО2Н, С1-6 алкилов, соединений формулы (II) и формулы (III)
и ,
и когда (o+n)≥2, n и o каждый является положительным целым числом, p и m каждый равен нулю и R2 представляет Н, и когда (p+m)≥2, p и m каждый является положительным целым числом, n и o каждый равен нулю и R1 представляет Н; X1, X2, X3 независимо выбраны из одноцепочечного или двухцепочечного олигонуклеотидного остатка; L1 и L4 независимо представляют собой высвобождаемые линкерные фрагменты; L2 и L3 независимо выбраны из бифункциональных спейсерных групп. Технический результат - разработка новых конъюгатов нуклеотидов с противоопухолевой активностью. 4 н. и 17 з.п. ф-лы, 7 табл., 12 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на приоритет по предварительной заявке на патент США № 60/462070, поданной 13 апреля 2003 г., содержание которой включено здесь в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к полимерным нуклеотидным пролекарствам, пригодным в качестве терапевтических агентов. Также предложены композиции и способы применения таких пролекарств.
УРОВЕНЬ ТЕХНИКИ
Хорошо известно, что на большую часть соматических состояний многоклеточных организмов, включая большинство болезненных состояний, оказывают влияние белки. Такие белки путем непосредственного воздействия или за счет своих ферментативных или других функций в большой степени вносят вклад во многие заболевания и регуляторные функции у животных и человека. В случае болезненных состояний классическая терапия обычно была сфокусирована на взаимодействии с такими белками в попытке ослабить их функции, вызывающие заболевания или усиливающие заболевания. В новейших терапевтических подходах желательно регулировать существующую продукцию таких белков. Оказывая влияние на продукцию белков, можно достичь максимального терапевтического эффекта при минимальных побочных эффектах. Таким образом, общая цель таких терапевтических подходов состоит во влиянии или модификации иным способом экспрессии генов, которые приводят к образованию нежелательного белка.
Один из способов такого ингибирования экспрессии специфического гена состоит в использовании олигонуклеотидов, в особенности олигонуклеотидов, которые комплементарны специфической последовательности информационной РНК (мРНК) мишени. Обычно последовательности нуклеиновых кислот, комлементарные продуктам генной транскрипции (например, мРНК) обозначают как «антисмысловые», а последовательности нуклеиновых кислот, содержащие ту же самую последовательность, что и транскрипт, или получаемые в качестве транскрипта обозначают здесь как «смысловые». См., например, Crooke, 1992, Annu. Rev. Pharmacol. Toxicol., 32: 329-376. Антисмысловой олигонуклеотид может быть выбран для гибридизации со всем геном или его частью, таким образом, чтобы модифицировать экспрессию этого гена. Транскрипционные факторы взаимодействуют с двухцепочечной ДНК в ходе регуляции транскрипции. Олигонуклеотиды могут служить в качестве конкурентных ингибиторов транскрипционных факторов для модификации их действия. Несколько недавних сообщений описывают такие взаимодействия (см. Bielinska, A., et al., 1990, Science, 250: 997-1000; и Wu, H., et al., 1990, Gene 89: 203-209).
Развиваются молекулярные стратегии понижающей регуляции экспрессии нежелательного гена. В последнее время использование модифицированных олигонуклеотидных соединений развилось в многообещающий способ терапии, направленный против таких заболеваний, как вирусные инфекции, воспалительные и генетические заболевания и, в значительной степени, рак. Антисмысловые ДНК были впервые предложены как алкилирующие комплементарные олигодезоксинуклеотиды, направленные против природных нуклеиновых кислот (Belikova, et al., Tetraxedron Lett. 37: 3557-3562, 1967). Zamecnik и Stephenson были первыми, кто предложил использовать синтетические антисмысловые олигонуклеотиды в терапевтических целях. (Zamecnik & Stephenson, 1978, Proc. Natl. Acad. Sci. U.S.A., 75: 285-289; Zamecnik & Stephenson, 1978, Proc. Natl. Acad. Sci. U.S.A., 75: 280-284). Они сообщили о применении 13-мера олигонуклеотида, комплементарного РНК вируса саркомы Рауса для ингибирования роста вируса в культуре клеток. С этого времени было опубликовано множество других исследований, показывающих эффективность in vitro антисмысловых олигонуклеотидов в ингибировании роста вирусов, например, вирусов везикулярного стоматита (Leonetti et al., 1988, Gene, 72: 323), вирусов простого герпеса (Smith et al., 1987, Proc. Natl. Acad. Sci. U.S.A., 83: 2787) и вируса гриппа (Seroa, et al., 1987, Nucleic Acids Res., 15: 9909).
Олигонуклеотиды также нашли использование, помимо прочих, в диагностических исследованиях, реактивах для исследований, например праймеры в технологии ПЦР (PCR) и других лабораторных операциях. Олигонуклеотиды можно синтезировать специально, чтобы они включали функции, которые приспособлены, чтобы подходить для желаемого применения. Таким образом, в олигомерные соединения были внедрены многочисленные химические модификации для усиления пригодности при диагностике, в качестве реагентов для исследований и в качестве элементов терапии.
Хотя олигонуклеотиды, в особенности антисмысловые олигонуклеотиды, подают надежды в качестве терапевтических агентов, они чрезвычайно подвержены действию нуклеаз и могут быть быстро разрушены перед тем и после того, как они попадают в клетки-мишени, что делает немодифицированные антисмысловые олигонуклеотиды непригодными для использования в in vivo системах. Поскольку ферменты, ответственные за их разрушение, присутствуют в большинстве тканей, были проведены модификации олигонуклеотидов в попытках стабилизировать соединения и исправить эту проблему. Наиболее широко изученные модификации относятся к остову олигонуклеотидных соединений. В общих чертах см. Uhlmann и Peymann, 1990, Chemical Reviews, 90 на страницах 545-561 и цитированные там ссылки. Среди многочисленных полученных остовов, только фосфоротиоат показал значительную антисмысловую активность. См., например, Padmapriya и Agrawal, 1993, Bioorg. & Med. Chem. Lett. 3, 761. Хотя введение атомов серы в остов замедляет скорость ферментативного разрушения, в то же время оно увеличивает токсичность. Другой недостаток введения атомов серы состоит в том, что это делает ахиральный остов хиральным, что приводит к 2n диастереомерам. Это может вызывать дополнительное побочное действие. Другие недостатки существующих антисмысловых олигонуклеотидов состоят в том, что они могут иметь отрицательный заряд на фосфатной группе, что ингибирует их способность проходить через преимущественно липофильную клеточную мембрану. Чем дольше соединение остается вне клетки, тем более оно разрушается и тем меньше активного соединения поступает к мишени. Дополнительный недостаток существующих антисмысловых соединений состоит в том, что олигонуклеотиды склонны к образованию в растворах вторичной структуры и структур более высокого порядка. Как только эти структуры образуются, они становятся мишенями для связывания с различными ферментами, белками, РНК и ДНК. Это приводит к неспецифическим побочным действиям и уменьшает количество активного соединения, связывающегося с мРНК. Другие попытки улучшения нуклеотидной терапии включили добавление линкерного фрагмента и полиэтиленгликоля. См., например, Kawaguchi et al., Stability, Specific Binding Activity, and Plasma Concentration in Mice of Oligonucleotide Modified at 5'-Terminal with Poly(ethylene glycol), Biol. Pharm. Bull., 18(3) 474-476 (1995), и патент США № 4904582. В обоих этих примерах модификации касаются использования линкерных фрагментов на постоянной основе с целью стабилизации олигонуклеотида от разрушения и увеличения клеточной проницаемости. Однако обе этих попытки оказались неэффективными.
Из-за неадекватности настоящих способов существует необходимость улучшить стабильность и устойчивость к разрушению нуклеазами, а также понизить токсичность и увеличить связывающее сродство по отношению к мРНК олигонуклеотидных соединений. Используемая олигонуклеотидная терапия является чрезвычайно дорогостоящей. Главным образом, это связано с проблемой разрушения. Таким образом, существует реальная необходимость в защите антисмысловых олигонуклеотидных соединений от разрушения, предотвращении образования структур высокого порядка и, в то же самое время, в доставке достаточных количеств активных антисмысловых олигонуклеотидных соединений к мишени. В настоящем изобретении предлагаются такие усовершенствования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предлагаются олигонуклеотидные пролекарства формулы (I):
в которой
R1 и R2 независимо представляют собой Н или полимерный остаток;
L1 и L4 независимо представляют собой высвобождаемые линкерные фрагменты;
L2 и L3 независимо представляют собой спейсерные группы;
Х1 представляет собой нуклеотидный остаток или олигонуклеотидный остаток;
m, n, o и р независимо представляют собой ноль или положительное целое число, при условии, что или (o+n), или (p+m)≥2.
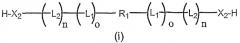
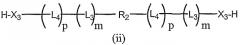
Другой аспект настоящего изобретения включает бифункциональные соединения, которые образуются когда R1 и/или R2 представляют собой полимерные остатки, которые одновременно включают альфа- и омега- терминальную линкерную группу, как здесь описано, так что два олигонуклеотида связаны с предусмотренными полимерными системами доставки. Примеры этого варианта осуществления включают олигонуклеотиды, связанные с полимерными системами через их соответствующие 3'-, 5'-терминальные группы, например 3'-бис-олигонуклеотидные конъюгаты или 5'-бис-олигонуклеотидные конъюгаты, или конъюгаты, образованные связыванием первого олигонуклеотида через 3'-конец к 5'-концу второго олигонуклеотида. Примеры таких полимерных конъюгатов проиллюстрированы ниже как формулы (i), (ii), (iii) и (iv):
бис-3'-олигонуклеотид,
бис-5'-олигонуклеотид,
бис-5',3'-олигонуклеотид и
бис-3',5'-олигонуклеотид,
где все переменные такие же, как описано выше.
В целях настоящего изобретения термин «остаток» следует понимать для обозначения того фрагмента биологически активного соединения, т.е. олигонуклеотида, более конкретно антисмыслового олигонуклеотида, который остается после того, как он вступил в реакцию замещения, в которой был присоединен носитель пролекарства.
В целях настоящего изобретения термин «остаток полимера» или «остаток PEG» следует понимать для обозначения той части полимера или полиэтиленгликоля (PEG), который остается после того, как он вступил в реакцию с модифицированным олигонуклеотидным соединением.
В целях настоящего изобретения термин «алкил» следует понимать, как включающий неразветвленные, разветвленные, замещенные, например, галоген-, алкокси-, нитро-, С1-12 алкилы, С3-8 циклоалкилы или замещенные циклоалкилы и т.д.
В целях настоящего изобретения термин «замещенный» следует понимать, как включающий добавление или замещение одного или нескольких атомов, содержащихся в функциональной группе или соединении с одним или несколькими различными атомами.
В целях настоящего изобретения замещенные алкилы включают карбоксиалкилы, аминоалкилы, диалкиламино, гидроксиалкилы и меркаптоалкилы; замещенные алкенилы включают карбоксиалкенилы, аминоалкенилы, диалкениламины, гидроксиалкенилы и меркаптоалкенилы; замещенные алкинилы включают карбоксиалкинилы, аминоалкинилы, диалкиниламины, гидроксиалкинилы и меркаптоалкинилы; замещенные циклоалкилы включают фрагменты, такие как 4-хлорциклогексил; арилы включают фрагменты, такие как нафтил; замещенные арилы включают фрагменты, такие как 3-бромфенил; арилалкилы включают фрагменты, такие как толуил; гетероалкилы включают фрагменты, такие как этилтиофен; замещенные гетероалкилы включают фрагменты, такие как 3-метокситиофен; алкокси включают фрагменты, такие как метокси; и фенокси включают фрагменты, такие как 3-нитрофенокси. Галоген следует понимать как включающий фтор, хлор, йод и бром.
Термин «достаточные количества» или «эффективные количества» в целях настоящего изобретения должен обозначать количество, которое приводит к терапевтическому эффекту, такому как эффект, подразумеваемый специалистами в данной области техники.
Некоторые из главных преимуществ настоящего изобретения включают новые полимерные олигонуклеотидные пролекарства, которые демонстрируют повышенную стабильность и устойчивость к разрушению нуклеазами, повышенную растворимость, повышенную клеточную проницаемость и пониженную токсичность.
Другое преимущество соединений по настоящему изобретению состоит в том, что к модифицированным олигонуклеотидным соединениям присоединяют с возможностью высвобождения разнообразные полимерные пролекарственные платформы. Это преимущество позволяет специалисту разрабатывать конъюгат лекарства, которым можно манипулировать, для включения различных фрагментов между полимерным остатком и присоединенным олигонуклеотидом, таким образом, чтобы влиять на скорость гидролиза пролекарства. Специалист, таким образом, обладает возможностью включать заместители, которые позволяют изменять скорость гидролиза пролекарства.
Представлены способы получения и применения этих соединений, такие как способы лечения рака или злокачественных образований, а также описанные здесь конъюгаты. Также предполагается, чтобы полимерные олигонуклеотидные пролекарства по изобретению назначали вместе с (одновременно и/или последовательно) любым другим подходящим антираковым агентом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 3 и 5.
Фиг.2 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 7 и 9.
Фиг.3 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 11, 12 (SEQ ID NO: 1) и 14 (SEQ ID NO: 1).
Фиг.4 схематически показывает способ получения полиэтиленгликолированного олигонуклеотида соединения 16 (SEQ ID NO: 1).
Фиг.5 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 17 (SEQ ID NO: 2), 18 (SEQ ID NO: 3) и 19 (SEQ ID NO: 4) из AS1 (SEQ ID NO: 2), AS2 (SEQ ID NO: 3) и AS3 (SEQ ID NO: 4).
Фиг.6 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 21 (SEQ ID NO: 1) и 22 (SEQ ID NO: 2).
Фиг.7 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 24 (SEQ ID NO: 1) и 26 (SEQ ID NO: 1).
Фиг.8 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 28 (SEQ ID NO: 1), 29 (SEQ ID NO: 2), 30 (SEQ ID NO: 3) и 31 (SEQ ID NO: 4) из AS1 (SEQ ID NO: 2), AS2 (SEQ ID NO: 3) и AS3 (SEQ ID NO: 4).
Фиг.9 схематически показывает способы получения полиэтиленгликолированных олигонуклеотидов соединений 33 (SEQ ID NO: 1) и 35 (SEQ ID NO: 1).
Фиг.10 показывает ингибирующий эффект соединения 14 и соединения 28 на рост РС3 клеток. 0,4×104 клеток высевали в 96-луночные планшеты, обрабатывали комплексами соединения 14 или соединения 28 (400 нМ) и липофектина (15 мкг/мл) в течение 24 часов в Opti-MEM и затем полной средой без комплексов. Жизнеспособность клеток определяли ежедневно и поглощение определяли при 570 нм. Данные представлены как среднее ± стандартное отклонение; n=4. Кривые представляют собой следующие:
контроль обозначен ♦ и точечной линией;
соединение 28 при 400 нМ обозначено и сплошной линией;
соединение 14 при 400 нМ обозначено ▲ и пунктирной линией;
соединение 28 при 200 нМ обозначено и пунктирной линией;
соединение 14 при 200 нМ обозначено ■ и точечной линией.
Фиг.11 А представляет анализ продукции ROS (из проточного цитометрического анализа) с помощью олигонуклеотидов соединения 14 и соединения 28, определением окисления проникающего в клетку 2',7'-дигидродихлорфлуоресцеин диацетата до флюоресцентного 2',7'-дихлорфлуоресцеина (DCF). РС3-клетки обрабатывали комплексами олигонуклеотид (400 нМ)/липофектин (15 мкг/мл) в течение 24 часов и анализировали через 3 дня, как описано. Кратные увеличения в среднем канале флуоресценции были нормализованы по сравнению с необработанными клетками. Эксперименты проводили трижды, и данные представлены как среднее ± стандартное отклонение (n=3).
Фиг.11В представляет анализ продукции ROS (из проточного цитометрического анализа) с помощью олигонуклеотидов соединения 14 и соединения 28, определением окисления гидроэтидия (НЕ) до этидия (Е), который затем включается в ДНK, флуоресцентно определяемого поточной цитометрией. РС3-клетки обрабатывали комплексами олигонуклеотид (400 нМ)/липофектин (15 мкг/мл) в течение 24 часов и анализировали через 3 дня, как описано. Кратные увеличения в среднем канале флуоресценции были нормализованы по сравнению с необработанными клетками. Эксперименты проводили трижды, и данные представлены как среднее ± стандартное отклонение (n=3).
Фиг.12 представляет собой результаты Вестерн-Блота, подтверждающие ингибирование экспрессии белка bcl-2 соединением 14 в присутствии липофектина. РС3-клетки обрабатывали олигонуклеотидным соединением 14 (200, 400 и 800 нМ) в присутствии (+Lipo) и в отсутствие (-Lipo) липофектина в течение 24 часов в Opti-MEM и затем в течение дополнительных 67 часов в полной среде. Образцы белков (30-40 мкг белка/полоса) анализировали вестерн-блоттингом, как описано в "Материалах и методах", с тубулином, используемым в качестве контроля протеиновых образцов. «С» обозначает контроль.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, настоящее изобретение предусматривает полимерно-связанные олигонуклеотидные пролекарства, имеющие большое число практических применений, включая использование в качестве диагностических и аналитических реагентов, в качестве инструментов для исследований и научных изысканий как in vitro, так и in vivo и в качестве терапевтических агентов. Для того чтобы более полно оценить область применения настоящего изобретения, определены следующие термины. Специалисту будет понятно, что термины «нуклеиновая кислота» или «нуклеотид» относятся к дезоксирибонуклеиновой кислоте (ДНК), рибонуклеиновой кислоте (РНК), одноцепочечной или двухцепочечной, если не оговорено специально, и к любым их химическим модификациям. «Олигонуклеотид» в общем представляет собой относительно короткий полинуклеотид, например, с размером в диапазоне от примерно 2 до примерно 200 нуклеотидов, или, более предпочтительно, от примерно 10 до примерно 30 нуклеотидов в длину. Олигонуклеотиды согласно изобретению в общем представляют собой синтетические нуклеиновые кислоты и являются одноцепочечными, если не оговорено специально. В качестве синонимов могут также использоваться термины «полинуклеотид» и «полинуклеиновая кислота».
Модификации олигонуклеотидов по изобретению необязательно включают, например, добавление к или замещение выбранных нуклеотидов функциональными группами или фрагментами, что делает возможным ковалентное связывание олигонуклеотида с заданным полимером, и/или добавление или замещение функциональными фрагментами, которые сообщают олигонуклеотиду дополнительный заряд, поляризуемость, водородные связи, электростатическое взаимодействие и функциональность. Такие модификации включают, но не ограничиваются перечисленным, модификации 2'-положения сахара, модификации 5-положения пиримидина, модификации 8-положения пурина, модификации экзоциклических аминов, замещение 4-тиоуридина, замещение 5-бром- или 5-йодурацила, модификации боковой цепи, метилирование, комбинации комплементарного спаривания оснований нуклеиновых кислот, такие как изооснования изоцитидин и изогуанидин и аналогичные комбинации. Олигонуклеотидные модификации также могут включать 3'- и 5'- модификации, такие как кэппирование.
Термин «антисмысловой» используется здесь по отношению к нуклеотидным последовательностям, которые комплементарны к определенной ДНК или РНК последовательности, кодирующей генный продукт или кодирующей контрольную последовательность. Термин «антисмысловая цепь» используется по отношению к цепи нуклеиновой кислоты, которая комплементарна «смысловой» цепи. При нормальном функционировании клеточного метаболизма смысловая цепь молекулы ДНК представляет собой цепь, которая кодирует полипептиды и/или другие генные продукты. Смысловая цепь служит в качестве матрицы для синтеза транскрипта информационной РНК («мРНК») (антисмысловая цепь), которая, в свою очередь, направляет синтез любого кодируемого генного продукта. Антисмысловые молекулы нуклеиновых кислот могут быть получены любым из способов, известных в данной области техники, включая синтез путем лигирования гена(ов), представляющего(их) интерес, в обратной ориентации к вирусному промотору, что делает возможным синтез комплементарной цепи. После введения в клетку эта транскрибированная цепь объединяется с природными последовательностями, синтезированными клеткой, с образованием дуплексов. Эти дуплексы затем блокируют дальнейшую транскрипцию или трансляцию. Таким образом могут быть генерированы мутантные фенотипы. Обозначения «отрицательная» или «-» также известны в данной области техники и относятся к антисмысловой цепи и «положительная» или «+» также известны в данной области техники и относятся к смысловой цепи.
Например, если необходима понижающая регуляция экспрессии мРНК транскрипта в клетке или клетках, в клетку вводят антисмысловой олигонуклеотид. После введения в клетку антисмысловой нуклеотид гибридизуется с соответствующей мРНК последовательностью за счет связывания Уотсона-Крика, образуя гетеродуплекс. Как только образуется дуплекс, ингибируется трансляция белка связанной мРНК, кодируемого последовательностью. Таким образом, антисмысловые олигонуклеотиды также используются в данной области техники в качестве зондов, например зондов гибридизации, обычно связанные с идентификатором или меткой, как и используются для обеспечения высокоточной понижающей регуляции экспрессии определенных клеточных продуктов или генетических регулирующих элементов, как для исследовательских, так и для терапевтических целей.
В целях настоящего изобретения использование единственного или множественного числа не означает ограничения до определенного численного значения в указываемом пункте или объекте. Таким образом, использование единственного числа по отношению к клетке, полимеру или лекарству не означает, что обрабатывают только одну клетку, только одну молекулу, получают или используют и/или применяют только одно лекарство, и использование множественного числа не исключает применение только к одному указываемому объекту, если не указано непосредственно.
В целях настоящего изобретения термин «остаток» следует понимать как часть биологически-активного соединения, такого как олигонуклеотид, которая сохраняется после того, как оно вступило в реакцию, в которой часть носителя пролекарства присоединили путем модификации, например, доступной гидроксильной или аминогруппы с образованием, например, сложноэфирной или амидной группы соответственно.
А. ОПИСАНИЕ ОЛИГОНУКЛЕОТИДОВ
Один из признаков изобретения состоит в способности обеспечить усовершенствованные нуклеотидные или олигонуклеотидные полимерные конъюгаты. Описанные здесь полимерные системы транспорта не ограничиваются одним типом олигонуклеотида, но, напротив, предназначены для работы с широким разнообразием подобных фрагментов, подразумевая, что полимерные системы транспорта могут быть присоединены к одному или нескольким 3'- или 5'-концам, обычно РО4 или SO4 группам нуклеотида. Последовательности нуклеотидов изображены здесь при использовании принятой номенклатуры, в которой последовательности считывают слева направо, от 5'-конца к 3'-концу (5'- → 3'-).
Х1-3 представляют собой одинаковые или различные нуклеотидные или олигонуклеотидные остатки, которые в целях настоящего изобретения включают олигодезоксинуклеотидные остатки. Более предпочтительно Х1-3 представляют собой независимо выбранные антисмысловые олигонуклеотидные остатки или олигодезоксинуклеотидные остатки.
Неограничивающий список потенциальных нуклеотидов, которые могут быть использованы исключительно или в качестве части олигонуклеотида (10-1000 нуклеотидов) включают
, ,
, , ,
,
, и
в которых
М представляет собой О или S;
B1 и В2 независимо выбирают из группы, состоящей из А (аденин), G (гуанин), С (цитозин), Т (тимин), U (урацил) и модифицированных оснований;
R100 и R101 независимо выбирают из группы, состоящей из Н, OR', в которой R' представляет собой Н, C1-6 алкил, замещенный алкил, нитро, галоген и арил.
Некоторые из данных олигонуклеотидов и олигодезоксинуклеотидов, используемых в способах по изобретению, включают, но не ограничиваются перечисленным, следующие:
олигонуклеотиды и олигодезоксинуклеотиды с природным фосфородиэфирным остовом или фосфоротиоатным остовом, или любыми другими модифицированными аналогами остова;
ЗНК (замкнутая нуклеиновая кислота);
ПНК (пептидная нуклеиновая кислота);
трицикло-ДНК;
ложный ОДН (двухцепочечный олигонуклеотид);
РНК (каталитическая последовательность РНК);
рибозимы;
зеркально-ориентированные олигонуклеотиды (spiegelmers) (олигонуклеотиды с L-конформацией);
CpG олигомеры и т.п., такие как олигомеры, описанные в:
Tides 2002, Oligonucleotide and Peptide Technology Conferences, 6-8 мая 2002 г., Las Vegas, NV, и
Oligonucleotide and Peptide Technology, 18 и 19 ноября 2003 г., Hamburg, Germany, содержание которых включено здесь в качестве ссылки.
Олигонуклеотиды по изобретению могут также необязательно включать любые пригодные известные в данной области техники нуклеотидные аналоги и производные, включая нуклеотидные аналоги и производные, приведенные в табл.1 ниже.
| Таблица 1 Представители нуклеотидных аналогов и производных | |
| 4-ацетилцитидин | 5-метоксиаминометил-2-тиоуридин |
| 5-(карбоксигидроксиметил)уридин | бета, D-маннозилквеуозин |
| 2'-О-метилцитидин | 5-метоксикарбонилметил-2-тиоуридин |
| 5-карбоксиметиламинометил-2-тиоуридин | 5-метоксикарбонилметилуридин |
| 5-карбоксиметиламинометилуридин | 5-метоксиуридин |
| Дигидроуридин | 2-метилтио-N6-изопентениладенозин |
| 2'-О-метилпсевдоуридин | N-((9-бета-D-рибофуранозил-2-метилтиопурин-6-ил) карбамоил)треонин |
| D-галактозилквеуозин | N-((9-бета-D-рибофуранозилпурин-6-ил)-N-метилкарбамоил)треонин |
| 2'-О-метилгуанозин | Метиловый сложный эфир уридин-5-оксиуксусной кислоты |
| Инозин | уридин-5-оксиуксусная кислота |
| N6-изопентениладенозин | вибутоксозин |
| 1-метиладенозин | псевдоуридин |
| 1-метилпсевдоуридин | квеуозин |
| 1-метилгуанозин | 2-тиоцитидин |
| 1-метилинозин | 5-метил-2-тиоуридин |
| 2,2-диметилгуанозин | 2-тиоуридин |
| 2-метиладенозин | 4-тиоуридин |
| 2-метилгуанозин | 5-метилуридин |
| 3-метилцитидин | N-((9-бета-D-рибофуранозилпурин-6-ил)-карбамоил)треонин |
| 5-метилцитидин | 2'-О-метил-5-метилуридин |
| N6-метиладенозин | 2'-О-метилуридин |
| 7-метилгуанозин | вибутозин |
| 5-метиламинометилуридин | 3-(3-амино-3-карбоксипропил)уридин |
Предпочтительно антисмысловой олигонуклеотид представляет собой олигонуклеотид, который понижает экспрессию белка, обуславливающего устойчивость опухолевых клеток к противораковой терапии. Например, белок BCL-2 ингибирует высвобождение цитохрома С и фактора, вызывающего апоптоз, из митохондрий и, таким образом, препятствует осуществлению апоптоза.
Раковые клетки, которые имеют высокие уровни BCL-2, таким образом, очень устойчивы как к химиотерапии, так и к радиотерапии. Патент США № 6414134, включенный здесь в качестве ссылки, описывает антисмысловые олигонуклеотиды, понижающие экспрессию белка Bcl-2, который связан с устойчивостью к противораковой терапии в большом числе раковых клеток, например, включая клетки рака предстательной железы, клетки миеломы и другие опухолевые клетки. Согласно упомянутому выше патенту США полагают, что ген bcl-2 способствует патогенезу рака, в первую очередь повышая коэффициент выживаемости опухолевых клеток, а не ускоряя клеточное деление. Патент США № 6414134 в общем виде описывает антисмысловые олигонуклеотиды длиной от 17 до 35 оснований, которые комплементарны мРНК bcl-2 и которые включают молекулу нуклеиновой кислоты, имеющую последовательность TACCGCGТGCGACCCTC (SEQ ID NO: 5). Они предпочтительно включают по крайней мере одну фосфоротиоатную связь.
Другие известные в данной области техники клеточные белки, которые рассматриваются различными компаниями в качестве мишеней для понижения их экспрессии антисмысловыми олигонуклеотидами, для противораковой терапии, приведены в следующей табл.2.
| Таблица 2 | |
| Антисмысловой агент | Белок-мишень |
| Affinitak (ISIS 3521) | PKC-alpha |
| ISIS 112989 (OGX 011) | Секреторный белок кластерин |
| ISIS 23722 | Сурвивин |
| AP 12009 | TGF-Beta2 |
| GEM 231 | Протеинкиназа А |
| GEM 240 | MDM2 |
| IGF-1R/AS ODN | Инсулиноподобный фактор роста |
| MG98 | ДНК метилтрансфераза |
| LErafAON | C-raf-1 |
| Ki-67 антисмысловой олигонуклеотид | Ki-67 |
| GTI-2040 | Рибонуклеотидредуктаза |
| ISIS 2503 | H-ras |
| AP11014 | TGF-Beta1 |
Антисмысловые олигонуклеотиды, пригодные для использования для понижающей регуляции экспрессии белков, связанных с выживаемостью раковых клеток, такой как экспрессия bcl-2, включают олигонуклеотиды, которые имеют от примерно двух до двухсот нуклеотидных кодонов, более предпочтительно от десяти до сорока кодонов и наиболее предпочтительно примерно от 17 до 20 кодонов. Эти олигонуклеотиды предпочтительно выбраны из олигонуклеотидов, комплементарных стратегическим сайтам в цепи предшественника мРНК bcl-2, таких как сайты инициации трансляции, донорные или сплайсинговые сайты, или сайты переноса или разрушения.
Блокировка трансляции в этих стратегических сайтах предотвращает образование функционального bcl-2 генного продукта. Следует понимать, однако, что любая комбинация или субкомбинация антикодирующих олигомеров, включая олигонуклеотиды, комплементарные или в значительной степени комплементарные по отношению к bcl-2 предшественнику мРНК или мРНК, которые ингибируют пролиферацию клеток, пригодна для использования в изобретении. Например, олигодезоксинуклеотиды, комплементарные частям последовальности на смежных или несмежных фрагментах bcl-2 РНК, могут ингибировать пролиферацию клеток и будут, таким образом, пригодны для использования в способах по изобретению.
Олигонуклеотиды, пригодные для понижающей регуляции экспрессии bcl-2, также включают олигонуклеотиды, комплементарные или в значительной степени комплементарные частям последовательности фланкирующей стратегические и другие сайты вдоль bcl-2 мРНК. Части фланкирующей последовательности предпочтительно находятся в диапазоне от примерно двух до примерно ста оснований до и после ранее указанных сайтов вдоль bcl-2 мРНК. Длина этих сайтов предпочтительно находится в диапазоне от примерно пяти до примерно двадцати кодонов. Также предпочтительно, чтобы олигонуклеотиды были комплементарны части последовательности предшественника мРНК или мРНК, которые обычно не содержатся в предшественнике мРНК или мРНК других генов, для того чтобы минимизировать гомологию олигонуклеотидов предшественника мРНК или мРНК кодирующих цепочек других генов.
Ряд предпочтительных антисмысловых или комплиментарных олигонуклеотидов для понижающей регуляции bcl-2 приведен в табл.3.
| Таблица 3 | |
| антисмысловой олигонуклеотид инициации трансляции (TI-AS) | 3'...CCCTTCCTACCGCGTGCGAC...5' (SEQ ID NO: 6) |
| bcl-2 | 5'...CTTTTCCTCTGGGAAGGATGGCGCACGCTGGGAGA...3' (SEQ ID NO: 7) |
| антисмысловой олигонуклеотид донора сплайсинга (SD-AS) | 3'...CCTCCGACCCATCCACGTAG...5' (SEQ ID NO: 8) |
| bcl-2 | 5'...ACGGGGTAC...GGAGGCTGGGTAGGTGCATCTGGT...3' (SEQ ID NO: 9) |
| антисмысловой олигонуклеотид акцептора сплайсинга (SA-AS) | 3'...GTTGACGTCCTACGGAAACA...5' (SEQ ID NO: 10) |
| bcl-2 | 5'...CCCCCAACTGCAGGATGCCTTTGTGGAACTGTACGG...3' (SEQ ID NO: 11) |
Будет понятно, что могут использоваться антисмысловые олигонуклеотиды, которые включают больше или меньше замещенных нуклеотидов и/или которые имеют большее протяжение вдоль bcl-2 мРНК цепи или в 3'- или в 5'-направлении, по отношению к олигонуклеотидам, перечисленным в табл.3 выше.
Предпочтительно, антисмысловые олигонуклеотиды, применяемые в пролекарствах по изобретению, имеют одну и ту же, или в значительной степени сходную нуклеотидную последовательность как имеет Genasense (a/k/a облимерсен натрия, производимый Genta Inc, Berkeley Heights, NJ). Genasense представляет собой 18-мерный фосфоротиоатный антисмысловой олигонуклеотид, TCTCCCAGCGTGCGCCAT (SEQ ID NO: 1), который комплементарен первым шести кодонам инициирующей последовательности bcl-2 мРНК человека (человеческая bcl-2 мРНК хорошо известна в данной области техники и описана, например, как SEQ ID NO: 19 в патенте США № 6414134, включенном здесь в качестве ссылки). Управление по контролю за продуктами и лекарствами США (FDA) придало Genasense статус «Orphan» в августе 2000 г. и приняло Заявку на новый препарат (NDA) для Genasense для лечения рака. NDA предлагает введение Genasense в комбинации с дакарбозином для лечения пациентов с генерализованной меланомой, которую ранее не лечили химиотерапией. Дополнительно FDA придала данной заявке статус приоритетной экспертизы (priority review), что имеет целью деятельность не позднее 8 июня 2004 г. См. также публикацию Chi et al., 2001, Clinical Cancer Research, vol. 7, 3920-3927, включенную здесь в качестве ссылки, подтверждающую активность Genasense в комбинированной терапии рака предстательной железы в ранних клинических испытаниях. Пролекарства по настоящему изобретению имеют такое же применение, как и идентифицированное для нативного (немодифицированного) 18-мера.
Было показано, что Genasense характеризуется понижением продукции белка Bcl-2 и улучшает чувствительность опухолевых клеток к терапии и в конечном счете вызывает смерть клеток. Ряд исследований показал многообещающие результаты при лечении нескольких видов рака Genasense в сочетании с противораковыми агентами. Фаза I/II испытания Genasense в комбинации с дакарбозином у пациентов с меланомой показал многообещающую активность и фаза III мультицентрового испытания проводится в настоящее время. Дополнительно, Genasense, используемый в комбинации с митоксантроном у пациентов с гормонорефрактерным раком предстательной железы, показал многообещающие результаты. Kim et al., 2001, там же.
Сочетание антисмысловых олигонуклетидов, таких как Genasense, с полимерами представляет собой пример одного предпочтительного варианта исполнения изобретения.
В альтернативных вариантах осуществления дополнительные пригодные антисмысловые олигонуклеотиды включают:
T-C-T-C-C-C-A-G-C-G-T-G-C-G-C-C-A-T (соединение 13, SEQ ID NO: 1);
T-C-T-C-C-C-A-G-C-A-T-G-Т-G-C-C-A-T (соединение 36, SEQ ID NO: 2);
A-T-C-C-T-A-A-G-C-G-T-G-C-G-C-C-T-T (соединение 37, SEQ ID NO: 3); и
T-C-T-C-C-C-A-G-X-G-T-G-X-G-C-C-A-T (соединение 38, SEQ ID NO: 4),
а также олигонуклеотиды, представленные в других примерах.
В. ФОРМУЛА (I)
В одном предпочтительном исполнении изобретения обеспечиваются олигонуклеотидные пролекарства формулы (I):
в которой
R1 и R2 независимо представляют собой Н или полимерный остаток;
L1 и L4 представляют собой независимо выбираемые высвобождаемые линкерные фрагменты;
L2 и L3 представляют собой независимо выбираемые спейсерные группы;
X1 представляет собой нуклеотидный остаток или олигонуклеотидный остаток;
m, n, o и p независимо выбирают из нуля или положительного целого числа, при условии, что (о+n) или (р+m)≥2.
Полимерная система транспорта по насто