Глюкоамилаза trichoderma reesei и ее гомологи
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой молекулу ДНК, кодирующую фермент, обладающий активностью глюкоамилазы, обладающую по меньшей мере 80% идентичности последовательности с глюкоамилазой из Trichoderma, обладающей последовательностью SEQ ID NO: 4. Изобретение также относится к векторам и клеткам-хозяевам со встроенными последовательностями ДНК, ферментным композициям и способам применения глюкоамилаз в различных приложениях. Изобретение позволяет расширить арсенал глюкоамилаз. 11 н. и 34 з.п. ф-лы, 20 ил., 10 табл.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет международной патентной заявки PCT/US05/18214, поданной 24 мая 2005, по которой испрашивается приоритет предварительной патентной заявки c серийным номером 60/647925, поданной 28 января 2005, международной патентной заявки PCT/US04/041276, поданной 9 декабря 2004; международной заявки PCT/US04/040040, поданной 30 ноября 2004; предварительной заявки с серийным номером 60/605437, поданной 30 августа 2004, в настоящее время оставленной без движения, и предварительной заявки с серийным номером 60/575175, поданной 27 мая 2004, в настоящее время оставленной без движения, и испрашивается приоритет международной патентной заявки PCT/US05/0018212, поданной 24 мая 2005, по которой испрашивается приоритет предварительных заявок с серийным номером 60/647925, поданной 28 января 2005, серийным номером 60/605437, поданной 30 августа 2004, в настоящее время оставленной без движения, и серийным номером 60/575175, поданной 27 мая 2004, в настоящее время оставленной без движения, и международной заявки PCT/US04/040040, поданной 30 ноября 2004.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым глюкоамилазам, пригодным для получения глюкозы и других конечных продуктов из крахмала. Глюкоамилазы пригодны для применения в разных процессах и являются, в частности, пригодными для применения в условиях общепринятой высокотемпературной переработки крахмала и в условиях без тепловой обработки или низкотемпературной переработки крахмала.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Глюкоамилазные ферменты (α-1,4-глюкан-глюкогидролазы, E.C.3.2.1.3.) являются карбогидразами экзодействия, гидролизующими крахмал. Глюкоамилазы катализируют удаление последовательных глюкозных единиц с невосстанавливающих концов крахмала или родственных олиго- и полисахаридных молекул и могут гидролизовать как линейные, так и разветвленные глюкозидные звенья крахмала (амилозу и амилопектин).
Глюкоамилазы продуцируются многочисленными штаммами бактерий, грибов, дрожжей и растений. В частности, интересными глюкоамилазами являются ферменты грибов, которые продуцируются внеклеточно, например, штаммами Aspergillus (Boel et al, (1984) EMBO J. 3:1097-1102; Hayashida et al (1989) Agric. Biol. Chem. 53:923-929; USP 5024941; USP 4794175 и WO 88/09795), Talaromyces (USP 4247637; USP 6255084 и USP 6620924), Rhizopus (Ashikari et al. (1986) Agric. Biol. Chem. 50:957-964; Ashikari et al. (1989) App. Microbiol. and Biotech. 32:129-133 и USP 4863864), Humicola (WO 05/052148 и USP 4618579) и Mucor (Houghton-Larsen et al., (2003) Appl. Microbiol. Biotechnol., 62:210-217). Многие из генов, которые кодируют данные ферменты, клонировали и экспрессировали в клетках дрожжей и грибов.
Коммерчески глюкоамилазы являются очень важными ферментами, которые применяют в широком спектре приложений, требующих гидролиза крахмала. Глюкоамилазы применяют для гидролиза крахмала для получения большого количества фруктозных подсластителей кукурузы, и подсластители кукурузы охватывают свыше 50% рынка подсластителей в США. Как правило, способы гидролиза крахмала включают использование альфа-амилаз для гидролиза крахмала до декстринов и глюкоамилаз для гидролиза декстринов до глюкозы. Глюкозу затем превращают во фруктозу другими ферментами, такими как глюкозоизомеразы. Глюкозу, продуцируемую глюкоамилазами, можно также кристаллизовать или использовать в брожениях для получения других конечных продуктов, таких как лимонная кислота, аскорбиновая кислота, глутаминовая кислота, 1,3-пропандиол и другие. Глюкоамилазы применяют в производстве алкоголя, таком как получение пива и получение сакэ. Глюкоамилазы также находят применение в получении этанола для топлива и для потребления. В последнее время глюкоамилазы применяют в низкотемпературном способе гидролиза гранулированного (без тепловой обработки) крахмала. Глюкоамилазы также применяют в получении кормов для животных в качестве пищевых добавок или в качестве жидких компонентов пищи для домашних животных.
Хотя глюкоамилазы успешно применяют в течение многих лет, все еще существует потребность в новых полезных глюкоамилазах. Настоящее изобретение основано на открытии новых глюкоамилаз, пригодных для применения в разнообразных приложениях и, в частности, способах гидролиза крахмала.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к выделенной последовательности ДНК, кодирующей глюкоамилазу, обладающую, по меньшей мере, 80% идентичности с SEQ ID NO: 4.
В другом варианте осуществления изобретение относится к ферменту, обладающему глюкоамилазной активностью, содержащему аминокислотную последовательность SEQ ID NO: 4 или последовательности, существенно ей гомологичные, и ее аллельные варианты и биологически функциональные фрагменты.
В другом варианте осуществления изобретение относится к выделенной последовательности ДНК, кодирующей глюкоамилазу Trichoderma reesei, включающей последовательность нативного гена и его биологически функциональные фрагменты.
В другом варианте осуществления изобретение относится к векторам, содержащим последовательность ДНК, кодирующую глюкоамилазы, относящиеся к изобретению.
В другом варианте осуществления изобретение относится к стабильно трансформированным грибным клеткам-хозяевам, в частности клеткам-хозяевам Trichoderma и Aspergillus, и способам экспрессии в них глюкоамилазы.
В другом варианте осуществления изобретение относится к культуральной среде, содержащей глюкоамилазу, относящуюся к изобретению, и ферментным препаратам, полученным из биомассы или культуры трансформированных хозяев, и применению ферментных препаратов.
В другом варианте осуществления изобретение относится к способам гидролиза крахмала с использованием ферментных препаратов по изобретению. В некоторых вариантах осуществления глюкоамилазу будут применять в способе гидролиза крахмала или частично гидролизованного крахмала в сироп, содержащий декстрозу. В других вариантах осуществления глюкоамилазу будут применять в способе получения специализированных сиропов. В дополнительных вариантах осуществления глюкоамилазу будут применять в брожении для получения конечных продуктов, таких как спирты и, в частности, этанол.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
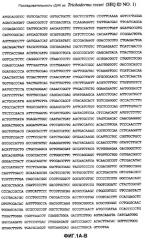
На фиг.1A-B показана последовательность геномной ДНК (SEQ ID NO: 1), кодирующая глюкоамилазу Trichoderma reesei фиг. 3.
На фиг.2A-B показана безинтронная последовательность ДНК (SEQ ID NO: 2), кодирующая глюкоамилазу Trichoderma reesei фиг. 3.
На фиг.3A показана выведенная аминокислотная последовательность (SEQ ID NO: 3) глюкоамилазы Trichoderma reesei, имеющая 632 аминокислоты, в которой
сигнальная последовательность (SEQ ID NO: 38) выделена полужирным шрифтом и представлена положениями остатков 1-20;
пропоследовательность (SEQ ID NO: 39) выделена полужирным шрифтом и подчеркнута, и представлена положениями остатков 21-33;
каталитический домен (SEQ ID NO: 40) представлен положениями остатков 34-486;
линкерная область (SEQ ID NO: 41) выделена курсивом и представлена положениями остатков 487-523; и
крахмал-связывающий домен (SEQ ID NO: 42) выделен курсивом и подчеркнут, и представлен положениями остатков 524-632.
N-концевой аминокислотный остаток зрелого белка, представленный положением остатка 34, является серином.
На фиг.3B показана выведенная последовательность зрелого белка (SEQ ID NO: 4) глюкоамилазы Trichoderma reesei фиг. 3A. Последовательность зрелого белка содержит каталитический домен, который подчеркнут (SEQ ID NO: 40), линкерную область (SEQ ID NO: 41) и крахмал-связывающий домен (SEQ ID NO: 42).
На фиг.4 показана последовательность геномной ДНК, обладающая 2154 п.н. (SEQ ID NO: 5), кодирующая глюкоамилазу Hypocrea citrina var. americana (GA102) (SEQ ID NO: 6).
На фиг.5 показана последовательность геномной ДНК, обладающая 2152 п.н. (SEQ ID NO: 7), кодирующая глюкоамилазу Hypocrea vinosa (GA104) (SEQ ID NO: 8).
На фиг.6 показана последовательность геномной ДНК, обладающая 2158 п.н. (SEQ ID NO: 9), кодирующая глюкоамилазу Trichoderma sp. (GA105) (SEQ ID NO: 10).
На фиг.7 показана последовательность геномной ДНК, обладающая 2144 п.н. (SEQ ID NO: 11), кодирующая глюкоамилазу Hypocrea gelatinosa (GA 107) (SEQ ID NO: 12).
На фиг.8 показана последовательность геномной ДНК, обладающая 2127 п.н. (SEQ ID NO: 13), кодирующая глюкоамилазу Hypocrea orientalis (GA108) (SEQ ID NO: 14).
На фиг.9 показана последовательность геномной ДНК, обладающая 2139 п.н. (SEQ ID NO: 15), кодирующая глюкоамилазу Trichoderma konilangbra (GA109) (SEQ ID NO: 16).
На фиг.10 показана последовательность геномной ДНК, обладающая 2088 п.н. (SEQ ID NO: 28), кодирующая глюкоамилазу Trichoderma sp. (GA113) (SEQ ID NO: 29).
На фиг.11 показана последовательность геномной ДНК, обладающая 2141 п.н. (SEQ ID NO: 30), кодирующая глюкоамилазу Trichoderma harzianum (GA103) (SEQ ID NO: 31).
На фиг.12 показана последовательность геномной ДНК, обладающая 2131 п.н. (SEQ ID NO: 32), кодирующая глюкоамилазу Trichoderma longibrachiatum (GA124) (SEQ ID NO: 33).
На фиг.13 показана последовательность геномной ДНК, обладающая 2151 п.н. (SEQ ID NO: 34), кодирующая глюкоамилазу Trichoderma asperellum (GA127) (SEQ ID NO: 35).
На фиг.14 показана последовательность геномной ДНК, обладающая 2142 п.н. (SEQ ID NO: 36), кодирующая глюкоамилазу Trichoderma strictipilis (GA128) (SEQ ID NO: 37).
На фиг.15A-I показаны предположительные аминокислотные последовательности глюкоамилаз, кодируемых последовательностями ДНК SEQ ID NO: 5, 7, 9, 11, 13, 15, 28, 30, 32, 34 и 36, которые соответствуют аминокислотным последовательностям SEQ ID NO: 6, 8, 10, 12, 14, 16, 29, 31, 33, 35 и 37 соответственно, в которых лидерный пептид выделен полужирным шрифтом, и пропоследовательность подчеркнута и выделена полужирным шрифтом для каждого белка. Последовательность зрелого белка, которая не включает лидерную и пропоследовательность для каждого белка, также представлена как SEQ ID NO: 17 для (1) GA102; SEQ ID NO: 18 для (2) GA104; SEQ ID NO: 19 для (3) GA105; SEQ ID NO: 20 для (4) GA107; SEQ ID NO: 21 для (5) GA108; SEQ ID NO: 22 для (6) GA109; SEQ ID NO: 43 для (7) GA113; SEQ ID NO: 44 для (8) GA103; SEQ ID NO: 45 для (9) GA124; SEQ ID NO: 46 для (10) GA127 и SEQ ID NO: 47 для (11) GA128.
На фиг.16 изображен гель SDS-PAGE, используемый для определения молекулярного веса очищенного TrGA, в котором на дорожке 1 представлен TrGA и на дорожке 2 представлен маркер молекулярного веса SeeBlue Plus 2 (Invitrogen).
Фиг.17A представляет собой плазмидную карту экспрессирующего вектора pTrex3g T. reesei.
Фиг.17B представляет собой плазмидную карту, которая содержит экспрессирующий вектор pNSP23 T. reesei, в котором ген TrGA клонирован в pTrex3g.
На фиг.18 показан (A) % относительной GA'-активности TrGA при 37°C при pH 3-8 и (B) % относительной GA-активности TrGA при pH 4,0 от 25°C до 78°C и сделана ссылка на пример 4.
На фиг.19 изображен гель SDS-PAGE, используемый для определения секреции по существу гомологичных глюкоамилаз в штамме-хозяине Trichoderma (1A52), в котором полоса приблизительно 62 кДа представляет собой глюкоамилазу, и дорожка 1 представляет собой GA104; дорожка 2 представляет собой GA105; дорожка 3 представляет собой GC107; дорожка 4 представляет собой GA109; дорожка 5 представляет собой TrGA; дорожка 6 представляет собой контрольный штамм-хозяин Trichoderma reesei (1A52) и дорожка 7 представляет собой стандартный маркер молекулярного веса.
На фиг.20 (A) изображена аминокислотная последовательность (SEQ ID NO: 26) глюкоамилазы Aspergillus niger, которая содержит лидерную последовательность. N-концевой аминокислотный остаток зрелого белка представлен положением остатка 25, A (аланин); линкерная область подчеркнута, и крахмал-связывающий домен выделен курсивом. На (B) изображена аминокислотная последовательность альфа-амилазы Aspergillus kawachi (SEQ ID NO: 27), которая содержит лидерную последовательность, где лидерная последовательность выделена полужирным шрифтом и подчеркнута, и представлена аминокислотными остатками 1-21; линкерная область подчеркнута, и крахмал-связывающий домен выделен курсивом. Зрелый белок содержит каталитический домен, линкер и крахмал-связывающий домен.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В некоторых аспектах настоящее изобретение основано на общепринятых методиках и способах, применяемых в области генной инженерии и молекулярной биологии. Следующие источники содержат описания общей методологии, пригодной в соответствии с изобретением: Sambrook et al. Eds., MOLECULE CLONING: A LABORATORY MANUAL (3rd Ed. 2000); Kriegler M. Ed., GENE TRANSFER AND EXPRESSION: A LABORATORY MANUAL (1990); и Ausubel et al. Eds., SHORT PROTOCOLS IN MOLECULAR BIOLOGY (5th Ed. 2002). Хотя в применении или тестировании по изобретению можно применять любые способы и материалы, аналогичные или эквивалентные тем, которые здесь описаны, ниже описаны предпочтительные способы и материалы.
Если здесь не определено по-другому, все технические и научные термины, используемые здесь, обладают таким же значением, как обычно понимает рядовой специалист в данной области, к которой относится изобретение. Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY 2nd Ed, John Wiley and Sons, NY (1994) и Hale and Margham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991) Addison Wesley Pub. Co. снабжает специалиста в данной области словарями со многими из терминов, используемых в описании данного изобретения.
Изобретение сейчас будет подробно описано посредством ссылки только с использованием следующих определений и примеров. Все патенты и публикации, включая все последовательности, описанные в таких упоминаемых здесь патентах и публикациях, явным образом приведены в качестве ссылки.
Формы единственного числа включают ссылки на множественное число, если только содержанием ясно не предписано обратное. Таким образом, например, ссылка на композицию, содержащую «соединение» включает смесь из двух или более соединений. Следует указать, что термин «или», как правило, употребляют в смысле, включающем «и/или», если только содержанием ясно не предписано обратное.
Числовые диапазоны включают числа из диапазонов.
Если не указано иначе, нуклеиновые кислоты написаны слева направо в ориентации от 5' к 3'; аминокислотные последовательности написаны слева направо в ориентации от N-конца к C-концу соответственно.
Заголовки, приведенные здесь, не ограничивают различные аспекты или варианты осуществления изобретения, которые можно получить посредством ссылки на описание в целом.
Определения
Термин «глюкоамилаза» относится к ферментам класса амилоглюкозидаз (E.C.3.2.1.3, глюкоамилаза, 1,4-альфа-D-глюкан-глюкогидролаза). Данные ферменты отщепляют глюкозильные остатки с невосстанавливающих концов молекул амилозы и амилопектина.
Фраза «обладающий активностью гидролизовать гранулярный крахмал» относится к ферменту, способному гидролизовать крахмал в гранулярной форме.
Фраза «группа семейства Trichoderma/Hypocrea» относится к члену семейства Hypocreaceae, включая некоторых анаморф, таких как Trichoderma и Gliocladium, подкласса Hypocreales, типа Ascomycota, и ссылается на главу 12, Alexopoulos, C.J., et al, в INTRODUCTORY MYCOLOGY 4th Edition, John Wiley & Sons, NY 1996.
Термины «последовательность нуклеиновой кислоты» и «полинуклеотид» можно здесь использовать взаимозаменяемо. Термин относится к геномной ДНК, безинтронной ДНК, синтетическим точкам начала репликации или их сочетаниям.
Термин «интрон» означает прерывающую последовательность ДНК, которая транскрибируется, но удаляется из транскрипта посредством совместного сплайсинга последовательностей, кодирующих зрелый белок.
Термин «выделенная последовательность нуклеиновой кислоты» означает последовательность нуклеиновой кислоты, которая по существу свободна от других последовательностей нуклеиновой кислоты.
Термин «биологически функциональные фрагменты последовательности» (например, биологически функциональные фрагменты SEQ ID NO: 4) означает полипептид, обладающий глюкоамилазной активностью и одним или несколькими аминокислотными остатками, удаленными с N- и/или C-конца аминокислотной последовательности.
Термин «вектор» означает полинуклеотидную последовательность, сконструированную для введения нуклеиновых кислот в клетки одного или нескольких типов.
Термин «экспрессирующий вектор» означает конструкцию ДНК, содержащую последовательность нуклеиновой кислоты, которая функционально связана с подходящей управляющей последовательностью, способную к эффективной экспрессии последовательности нуклеиновой кислоты в подходящем хозяине. Подходящие управляющие последовательности включают промоторы для осуществления транскрипции, операторные последовательности, последовательности, кодирующие подходящие участки связывания с рибосомой на мРНК, энхансеры и/или терминаторные последовательности.
Термин «промотор» означает регуляторную последовательность, вовлеченную в связывание с РНК-полимеразой для инициации транскрипции гена.
Термин «функционально связанный» относится к смежному расположению, при котором элементы находятся в расположении, позволяющим им являться функционально связанными. Например, промотор функционально связан с кодирующей последовательностью, если он управляет транскрипцией последовательности.
Термин «выделенный полипептид» означает полипептид, который по существу свободен от других неглюкоамилазных полипептидов. Выделенный полипептид может обладать, по меньшей мере, 20% чистоты, по меньшей мере, 40% чистоты, по меньшей мере, 60% чистоты, по меньшей мере, 70% чистоты, по меньшей мере, 80% чистоты, по меньшей мере, 90% чистоты, по меньшей мере, 95% чистоты при определении посредством SDS-PAGE.
Термин «сигнальная последовательность» означает последовательность аминокислот, связанную с N-концевой частью белка, которая облегчает секрецию зрелой формы белка из клетки. Определение сигнальной последовательности является функциональным. Зрелая форма внеклеточного белка утрачивает сигнальную последовательность, которая отщепляется в ходе процесса секреции. Термины «сигнальная последовательность», «сигнальный пептид» и «лидерный пептид» можно использовать здесь взаимозаменяемо. Как правило, «сигнальная последовательность» относится к нуклеотидной последовательности, и термин «лидерный пептид» относится к аминокислотной последовательности.
Термины «белок» и «полипептид» здесь используются взаимозаменяемо. Здесь используется общепринятый однобуквенный или трехбуквенный код для аминокислотных остатков.
Термин «каталитический домен» относится к структурной области полипептида, которая содержит активный участок для гидролиза субстрата.
Термин «линкер» относится к короткой аминокислотной последовательности, как правило, содержащей от 3 до 40 аминокислотных остатков, которая ковалентно связывает аминокислотную последовательность, содержащую крахмал-связывающий домен, с аминокислотной последовательностью, содержащей каталитический домен.
Термин «крахмал-связывающий домен» относится к аминокислотной последовательности, которая связывается предпочтительно с крахмальным субстратом.
Термин «аллельные варианты» означает любую из двух или более альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельное разнообразие возникает естественным образом посредством мутации и может приводить к полиморфизму между популяциями. Аллельный вариант полипептида представляет собой полипептид, кодируемый аллельным вариантом гена.
Термин «клетка-хозяин» или «штамм-хозяин» означает подходящего хозяина для экспрессирующего вектора или конструкции ДНК, содержащей полипептид, кодирующий глюкоамилазу, относящейся к изобретению. Подходящие клетки-хозяева успешно используют в рекомбинантном получении глюкоамилаз, относящихся к изобретению.
Как применяют здесь, термин «полученный из», используемый в связи с полинуклеотидом или полипептидом, означает полипептид или полинуклеотид, являющийся природным для микроорганизма.
Термин «гетерологичный» по отношению к полинуклеотиду или белку относится к полинуклеотиду или белку, который в природе не встречается в клетке-хозяине.
Термин «эндогенный» по отношению к полинуклеотиду или белку относится к полинуклеотиду или белку, который в природе встречается в клетке-хозяине.
Термин «экспрессия» означает процесс, посредством которого получается полипептид на основе последовательности нуклеиновой кислоты гена.
Термин «сверхэкспрессия» означает процесс экспрессии полипептида клеткой-хозяином, где полинуклеотид введен в клетку-хозяина.
Термин «введенный» в контексте введения последовательности нуклеиновой кислоты в клетку означает трансфекцию, трансформацию или трансдукцию и включает ссылку на включение последовательности нуклеиновой кислоты в клетку-хозяина.
Термин «гранулярный крахмал» относится к необработанному сырому крахмалу (например, гранулярному крахмалу, который не подвергали желатинизации).
Термин «крахмал» относится к любому веществу, содержащему сложные полисахаридные углеводы растений, содержащие амилозу и амилопектин с формулой (C6H10O5)x, где х может являться любым числом.
Термин «желатинизация» означает солюбилизацию молекулы крахмала при тепловой обработке с формированием вязкой суспензии. Фраза «ниже температуры желатинизации» относится к температуре ниже температуры, при которой начинается желатинизация.
Термин «культивирование» относится к выращиванию популяции микробных клеток в подходящих условиях в жидкой или твердой среде. В одном из вариантов осуществления культивирование относится к бродильной биоконверсии крахмального субстрата в конечный продукт (как правило, в котле или реакторе). Брожение представляет собой ферментативное и анаэробное расщепление органических веществ микроорганизмами с получением более простых органических соединений. Хотя брожение происходит в анаэробных условиях, не предполагается, что термин строго ограничен исключительно анаэробными условиями, поскольку брожение также происходит в присутствии кислорода.
Термин «конечный продукт» относится к молекулярному продукту, происходящему из любого источника углерода, который ферментативно получают из крахмального субстрата.
Термин «ферментативное превращение» относится к модификации субстрата под действием фермента.
Термин «удельная активность» означает единицу активности фермента, определенную как число молей субстрата, превращенного в продукт препаратом фермента за единицу времени в определенных условиях. Удельную активность выражают в единицах (ЕА)/мг белка.
Термин «моносахарид» означает мономерную единицу полимера, такого как крахмал, в котором степень полимеризации (DP) равна 1 (например, глюкоза, манноза, фруктоза и галактоза).
Термин «дисахарид» означает соединение, которое содержит две ковалентно связанные единицы моносахарида (DP2). Термин охватывает в качестве неограничивающих примеров такие соединения, как сахароза, лактоза и мальтоза.
Термин «DP>3» означает полимеры со степенью полимеризации больше 3.
Термин «олигосахарид» означает соединение, обладающее 2-10 единицами моносахарида, соединенными гликозидными связями.
Термин «полисахарид» означает соединение, обладающее многими единицами моносахарида, соединенными в линейную или разветвленную цепь. В некоторых вариантах осуществления термин относится к длинным цепям с сотнями или тысячами единиц моносахарида. Типичными примерами полисахаридов являются крахмал, целлюлоза и гликоген.
Как применяют здесь, термин «содержание твердых веществ (DS или ds)» относится к общему количеству твердых веществ в суспензии в % от массы сухого вещества.
Термин «измельчение» относится к разрушению зерен злаков на более мелкие частицы. В некоторых вариантах осуществления термин используют взаимозаменяемо с перемалыванием.
Термин «сухое измельчение» относится к измельчению сухого цельного зерна, при котором специально не удаляют такие фракции зерна, как зародыш и отруби.
Как применяют здесь, термины «высушенные вещества барды (DDG)» и «высушенные растворимые вещества барды (DDGS)» относятся к используемым побочным продуктам процессов брожения зерна.
Термин «DE» или «декстрозный эквивалент» является промышленным стандартом для измерения суммарной концентрации восстанавливающих сахаров, вычисляемым как количество D-глюкозы от массы сухого вещества. Негидролизованный гранулярный крахмал обладает DE, который равен по существу 0, и D-глюкоза обладает DE, равным 100.
Термин «сахарный сироп» относится к водной композиции, содержащей растворимые углеводы. В одном из вариантов осуществления сахарный сироп представляет собой сироп, содержащий глюкозу.
Аминокислотные последовательности глюкоамилазы Trichoderma reesei
Глюкоамилазу, полученную из Trichoderma reesei QM6a (ATCC, инвентарный № 13631), клонировали, как далее подробно описано в примере 1. Согласно изобретению полноразмерная глюкоамилаза, полученная из Trichoderma reesei, изображена на фиг.3 и обладает аминокислотной последовательностью SEQ ID NO: 3. Последовательность зрелого белка глюкоамилазы Trichoderma reesei (SEQ ID NO: 4) представлена аминокислотными остатками 34-632 на фиг.3.
Изобретение относится к выделенному ферменту, обладающему глюкоамилазной активностью, содержащему последовательность, показанную на SEQ ID NO: 4, или ферменту с глюкоамилазной активностью, являющейся по существу ей гомологичной.
В некоторых вариантах осуществления изобретение относится к глюкоамилазе, содержащей последовательность, показанную на SEQ ID NO: 3 или ферменту с глюкоамилазной активностью, являющейся по существу ей гомологичной. Глюкоамилаза SEQ ID NO: 3 содержит сигнальную последовательность глюкоамилазы, полученной из Trichoderma reesei.
В некоторых вариантах осуществления изобретение относится к полипептиду, обладающему глюкоамилазной активностью, содержащему каталитический домен глюкоамилазы SEQ ID NO: 4, который также представлен на SEQ ID NO: 40.
В других вариантах осуществления изобретение относится к крахмал-связывающему домену, идентичному, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 97% и, по меньшей мере, на 98% последовательности крахмал-связывающего домена глюкоамилазы, изображенной на SEQ ID NO: 4. В некоторых вариантах осуществления крахмал-связывающий домен содержит последовательность от положения остатка 524 до положения остатка 632 SEQ ID NO: 4, представленный на SEQ ID NO: 42.
В других вариантах осуществления крахмал-связывающий домен является фрагментом крахмал-связывающего домена SEQ ID NO: 4. Предпочтительно фрагмент будет содержать, по меньшей мере, 90, по меньшей мере, 80 или, по меньшей мере, 70 аминокислотных остатков крахмал-связывающего домена SEQ ID NO: 4.
Гомология последовательности белка
Гомологию между двумя глюкоамилазами можно определить как степень идентичности между аминокислотными последовательностями двух последовательностей белка. То, что полипептид или полинуклеотид обладает определенной процентной долей идентичности с другой последовательностью (т.е. 80%, 90% и 95%), означает, что при выравнивании эти процентные доли оснований или аминокислотных остатков являются одинаковыми при сравнении двух последовательностей. Это выравнивание и процентную долю гомологии или идентичности можно определить с использованием любого подходящего программного обеспечения, известного в данной области. Например, подходящие программы описаны в CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (Ausubel et al., eds 1995, глава 19). Предпочтительные программы включают программу GCG Pileup (Wisconsin Package, версия 8.1 и 10.0), FASTA, BLAST и TFASTA. Другой предпочтительной программой для выравнивания является ALIGN или ALIGN Plus (Dayhoff (1978) в ATLAS OF PROTEIN SEQUENCE AND STRUCTURE 5: Suppl. 3 (National Biomedical Research Foundation)). Можно использовать другие алгоритмы BLASTP, BLASTN и BLASTX (Altschul et al., (1990) J. Mol. Biol. 215:403-410). Другие полезные способы включают ClustralW (Thompson et al., (1997) Nucleic Acid Research 25:4876-4882) с использованием программного обеспечения, предоставленного DNASTAR (Madison WI). Также ссылки сделаны на Needleman et al., (1970) J. Mol. Biol. 48:443, Smith et al., (1981) Adv. Appl. Math. 2:482, Smith et al., (1997) Meth. Mol. Biol. 70:173-187 и Pearson et al., (1988) Proc. Natl. Acad. Sci. 85:24444.
Согласно изобретению «по существу гомологичная» аминокислотная последовательность демонстрирует глюкоамилазную активность и, по меньшей мере, идентичность на 80%, по меньшей мере, на 83%, по меньшей мере, на 85%, по меньшей мере, на 87%, по меньшей мере, на 90%, по меньшей мере, на 93%, по меньшей мере, на 95%, по меньшей мере, на 97%, по меньшей мере, на 98% и, по меньшей мере, идентичность на 99% с последовательностью, изображенной на SEQ ID NO: 4, или последовательностью, изображенной на SEQ ID NO: 3. Особенно предпочтительными, по существу гомологичными последовательностями глюкоамилазы являются последовательности зрелого белка, как показано на фиг.15, и которые соответствуют SEQ ID NO: 17, 18, 19, 20, 21, 22, 43, 44, 45, 46 и 47. Кроме того, предпочтительными, по существу гомологичными последовательностями глюкоамилазы являются последовательности, показанные на фиг.15, которые соответствуют SEQ ID NO: 6, 8, 10, 12, 14, 16, 29, 31, 33, 35 и 37 и содержат лидерную последовательность. Другие по существу гомологичные полипептиды включают аллельные варианты и природные мутанты, обладающие глюкоамилазной активностью.
Глюкоамилазы по настоящему изобретению, включающие по существу гомологичные полипептиды и биологически функциональные фрагменты, обладают, по меньшей мере, 20%, по меньшей мере, 40%, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95% и, по меньшей мере, 100% глюкоамилазной активности зрелого белка, полученного из Trichoderma reesei, обладающего последовательностью, изображенной на фиг.3 (SEQ ID NO: 4). В некоторых предпочтительных вариантах осуществления изобретения удельная активность глюкоамилаз, тестируемых в, по существу, одинаковых условиях, будет равна, по меньшей мере, 90%, по меньшей мере, 100%, по меньшей мере, 125%, по меньшей мере, 150%, по меньшей мере, 175% и также, по меньшей мере, 200% удельной активности зрелого белка, полученного из Trichoderma reesei, обладающего последовательностью, изображенной на фиг.3 (SEQ ID NO: 4). В некоторых вариантах осуществления удельную активность можно измерять у растворимого крахмального субстрата, и в других вариантах осуществления удельную активность можно измерять у гранулярного крахмального субстрата.
В некоторых вариантах осуществления аминокислотная последовательность, обладающая, по меньшей мере, 80% идентичности последовательности с последовательностью SEQ ID NO 3 или SEQ ID NO: 4, будет содержать консервативные аминокислотные замены с использованием L-аминокислот, где одна из аминокислот замещена другой биологически сходной аминокислотой. Консервативными аминокислотными заменами являются те, которые сохраняют суммарный заряд, гидрофобность/гидрофильность и/или пространственный размер замещаемой аминокислоты. Неограничивающие примеры консервативных замен включают замены между следующими группами: Gly/Ala, Val/Ile/Leu, Lys/Arg, Asn/Gln, Glu/Asp, Ser/Cys/Thr и Phe/Trp/Tyr. Другие консервативные замены можно получить из таблицы ниже.
| Таблица 1Консервативные аминокислотные замены | ||
| Для аминокислоты | Код | Заменить любой из |
| Аланин | А | D-Ala, Gly, бета-Ala, L-Cys, D-Cys |
| Аргинин | R | D-Arg, Lys, D-Lys, гомо-Arg, D-гомо-Arg, Met, Ile, D-Met, D-Ile, Orn, D-Orn |
| Аспарагин | N | D-Asn, Asp, D-Asp, Glu, D-Glu, Gln, D-Gln |
| Аспарагиновая кислота | D | D-Asp, D-Asn, Asn, Glu, D-Glu, Gln, D-Gln |
| Цистеин | C | D-Cys, S-Me-Cys, Met, D-Met, Thr, D-Thr |
| Глутамин | Q | D-Gln, Asn, D-Asn, Glu, D-Glu, Asp, D-Asp |
| Глутаминовая кислота | E | D-Glu, D-Asp, Asp, Asn, D-Asn, Gln, G-Gln |
| Глицин | G | Ala, D-Ala, Pro, D-Pro, b-Ala, Acp |
| Изолейцин | I | D-Ile, Val, D-Val, Leu, D-Leu, Met, D-Met |
| Лейцин | L | D-Leu, Val, D-Val, Leu, D-Leu, Met, D-Met |
| Лизин | K | D-Lys, Arg, D-Arg, гомо-Arg, D-гомо-Arg, Met, D-Met, Ile, D-Ile, Orn, D-Orn |
| Метионин | M | D-Met, S-Me-Cys, Ile, D-Ile, Leu, D-Leu, Val, D-Val |
| Фенилаланин | F | D-Phe, Tyr, D-Thr, L-Dopa, His, D-His, Trp, D-Trp, транс-3,4 или 5-фенилпролин, цис-3,4 или 5-фенилпролин |
| Пролин | P | D-Pro, L-I-тиоазолидин-4-карбоновая кислота, D- или L-1-оксазолидин-4-карбоновая кислота |
| Серин | S | D-Ser, Thr, D-Thr, алло-Thr, Met, D-Met, Met(O), D-Met(O), L-Cys, D-Cys |
| Треонин | T | D-Thr, Ser, D-Ser, алло-Thr, Met, D-Met, Met(O), D-Met(O), Val, D-Val |
| Тирозин | Y | D-Tyr, Phe, D-Phe, L-Dopa, His, D-His |
| Валин | V | D-Val, Leu, D-Leu, Ile, D-Ile, Met, D-Met |
В других вариантах осуществления аминокислотные замены не будут являться консервативными заменами.
В некоторых вариантах осуществления предполагается, что глюкоамилаза по изобретению будет получена из мицелиального штамма гриба и, в частности, по существу гомологичные последовательности будут получены из штаммов рода Aspergillus spp., Rhizopus spp., Humicola spp., Fusarium spp., Mucor spp., Trichoderma spp. и т.п. В предпочтительном варианте осуществления по существу гомологичные последовательности, обладающие глюкоамилазной активностью, будут получены из штаммов группы семейства Trichoderma/Hypocrea. Некоторые из этих видов включают T. stromaticum, H. citrina var. americana, H. citrina, H. lactea, H. hunua, T. fertile, T. tomentosum, H. vinosa, T. harzianum, T. inhamatum, T. oblongisporum, T. cf. aureoviride, T. cf. harzianum, T. fasciculatum, H. tawa, T. crassum, T. flavovirens, T. virens, T. longipilis, T. spirale, T. strictipilis, H. pilulifera, T. polysporum, T. croceum, T. minutisporum, T. hamatum, T. asperellum, T. atroviride, T. koningii, T. viride, H. gelatinosa, T. strigosum, T. pubescens, H. novazelandiae, T. saturnisporum, T. longibrachiatum, H. orientalis, T. citrinoviride, T. reesei, T. ghanense, T. pseudokonimgii, H. andinensis и H. aureoviride. Особенно предпочтительные штаммы рода Trichoderma и родственного Hypocrea spp. включают H. citrina var. americana, H. citrina, H. lactea, H. vinosa, T. harzianum, T. atroviride, T. koningii, T. viride, H. gelatinosa, T. saturnisporum, T. longibrachiatum, H. orientalis, T. citrinoviride, T. reesei и T. konilangbra.
Некоторые штаммы видов, описанных выше, общедоступны из коллекций культур, таких как American Type Culture Collection (ATCC) P. O. Box 1549, Manassas, VA 20108; Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSM); Agricultural Research Service Plant Culture Collection, Northern Regional Research Center (NRRL); the Centraalbureau voor Schimmelcultures (CBS), P. O. Box 85167, 3508 AD Utrecht, Нидерланды; Plant Research Institute, Department of Agriculture, Mycology, Ottawa, (DAOM) Канада, и International Mycological Institute (IMI), Genetic Resources Collection, Egham, Великобритания.
Биологически функциональные фрагменты глюкоамилазы
В некоторых вариантах осуществления изобретение относится к биологически функциональным фрагментам глюкоамилазы, показанным на SEQ ID NO: 3, SEQ ID NO: 4 или по существу гомологичным им последовательностям. В некоторых вариантах осуществления биологически функциональный фрагмент будет содержать каталитический домен глюкоамилазы, относящейся к изобретению. В других вариантах осуществления биологически функциональные фрагменты будут содержать, по меньшей мере, 400 аминокислотных остатков, по меньшей мере, 425 аминокислотных остатков, по меньшей мере, 450 аминокислотных остатков, и также, по меньшей мере, 460 аминокислотных остатков.
В некоторых предпочтительных вариантах осуществления фрагмент будет содержать, по меньшей мере, часть аминокислотной последовательности, представленной положениями остатков от 1 до 453 SEQ ID NO: 4, и в других вариантах осуществления фрагмент будет содержать положения от 1 до 453 SEQ ID NO: 4. В других предпочтительных вариантах осуществления фрагмент будет содержать аминокислотную последовательность, представленную положениями остатков от 1 до 453 SEQ ID NO: 17; положениями остатков от 1 до 452 SEQ ID NO: 18; положениями остатков от 1 до 454 SEQ ID NO: 19; положениями остатков от 1 до 452 SEQ ID NO: 20; положениями остатков от 1 до 453 SEQ ID NO: 21; положениями остатков от 1 до 453 SEQ ID NO: 22; положениями остатков от 1 до 452 SEQ ID NO: 43; положениями остатков от 1 до 452 SEQ ID NO: 44; положениями остатков от 1 до 453 SEQ ID NO: 45; положениями остатков от 1 до 452 SEQ ID NO: 46; или положениями остатков от 1 до 453 SEQ ID NO: 47.
Биологически функциональные фрагменты глюкоамилазы, относящиеся к изобретению, можно получить способом, известным в данной области.
Глюкоамилазы, обладающие, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности последовательности с фрагментом, который содержит аминокислотные остатки от 1 до 453 SEQ ID NO: 4, также относятся к изобретению.
В других вариантах осуществления биологически функциональные фрагменты будут содержать каталитический домен и линкерную последовательность глюкоамилазы, показанной на SEQ ID NO: 4.
Биологически функциональные фрагменты могут также содержать слитые полипептиды или расщепляемые слитые полипептиды, в которых другой полипептид слит с N-концом и/или C-концом полипептида. Способы получения слитых полипептидов известны в данной области.
Последовательности ДНК, клонированные из Trichoderma reesei, и по существу гомологичные
Изобретение также относится к клонированной последовательности ДНК, кодирующей полипептид, проявляющий глюкоамилазную активность по изобретению; где указан