Способ определения энантиомеров первичных аминосоединений
Иллюстрации
Показать всеИзобретение относится к определению энантиомеров первичных аминосоединений, в частности нефункционализированных аминов, аминоспиртов, аминокислот и их элементоорганических аналогов. Согласно изобретению аминосоединения общей формулы (I), , где R1, R2 и R3 могут быть соединены между собой, образуя (би)циклическую структуру вместе с атомом углерода, к которому присоединены, или не связаны между собой, и каждый из которых представляет Н, замещенный или незамещенный (цикло)алкильный, или арильный, или алкиларильный, или арилалкильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, N, S, Р, галоген, В, Si или функциональные группы Н, их основе, в присутствии воды и ОФА приводят в контакт с энантиомерно чистым тиолом из числа N-ацильных производных (S)-цистеина и олигопептидов и их миметиков, содержащих цистеин, следующей общей формулы (II), , где {Cys} - S-цистеин, природный или неприродный олигопептид или их миметик, содержащий S-цистеин со свободной сульфгидрильной группой, -Z0 - атом О, S или замещенная аминогруппа, - Z1 - атом Н, замещенный или незамещенный циклоалкильный, алкильный, арильный, алкиларильный, или арилалкильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, N, F, - Z2 - атом Н, замещенный или незамещенный алкильный или арильный радикал, - Z3 - атом Н, F, гидрокси-, алкокси-, -NHOH, замещенная аминогруппа, - m - число, выбранное из 0, 1, - n - число, выбранное из 0, 1, 2, - таким образом, что соединение (II), в сравнении с незамещенными N-ацильными производными S-цистеина, например N-ацетил-S-цистеином, содержит один и более дополнительных хиральных центров и/или один и более дополнительных гетероатомов О, N, F и называется "функционализированным" хиральным SH-реагентом, После этого производят количественное определение образующихся стереоизомерных изоиндолов одним из методов физико-химического анализа, например, из числа хроматографических методов анализа. Достигается повышение информативности определения. 5 з.п. ф-лы, 1 ил., 9 табл.
Реферат
Настоящее изобретение относится к способу определения энантиомеров первичных аминосоединений методом жидкостной хроматографии, основанного на разделении стереоизомерных изоиндолов, образующихся в результате дериватизации первичных аминогрупп соединений, подлежащих анализу, стандартным раствором орто-фталевого альдегида (ОФА) и хирального тиола (SH-реагент). Сущность изобретения состоит в том, что в качестве SH-реагента предлагается использовать полифункционализированные тиолы из числа N-ацильных производных S-цистеина, олигопептидов и их миметиков, содержащих S-цистеин. Изобретение позволяет достичь более эффективного разделения, чем в случае использования ранее описанных гомохиральных SH-реагентов.
Обоснование, уровень техники, область возможного применения: Энантиомеры аминосоединений являются ключевыми структурными элементами физиологически активных соединений, поэтому они представляют большой интерес как для фундаментальной науки, так и для многих отраслей промышленности - фармацевтической, агрохимической, пищевой, косметической и др. Мировой рынок хиральных соединений за 2006 г. по прогнозам аналитиков Frost&Sullivan Ltd. превысит 15 млр долларов США. Требования к оптической чистоте препаратов неуклонно растут, что обуславливает необходимость разработки и усовершенствования методов получения и контроля качества энантиомеров.
Наиболее широкое применение для определения энантиомерной чистоты нашли методы на основе высокоэффективной жидкостной хроматографии (ВЭЖХ). Одним из методов косвенного анализа является метод обращенно-фазовой ВЭЖХ с предколоночной дериватизацией аминогрупп стандартным раствором орто-фталевого альдегида (ОФА) и энантиомерно чистого сульфгидрильного реагента (SH-реагента) (J.Chromatogr. 315 (1984) 279. Патенты JP 60038652 от 28.02.1985, US 4670403 от 02.06.1987). В результате предварительной дериватизации аминогрупп препарата, содержащего два энантиомера, образуются два стереоизомерных изоиндола, которые могут быть разделены методами жидкосной хроматографии, например, методом ВЭЖХ на обычной обращенно-фазовой хроматографической колонке. До настоящего времени в качестве SH-реагента использовали тиосахара (J.Chromatogr. 558 (1991) 311. J.Chromatogr. 434 (1988) 417) и нефункционализированные гомохиральные тиолы - N-ацильные производные цистеина без функциональных групп в ацильной части, как, например, гомологический ряд от ацетил- до н-октаноил-, изовалерил-, пивалоил-, бензоил-, трет-бутилоксикарбонил-, N-изобутирил-S-цистеин (патент JP 60038652 от 28.02.1985, Anal. Biochem. 137 (1984) 405, J.Chromatogr. 315 (1984) 279, J.Chromatogr. 483 (1989) 239, J.Chromatogr. A 666 (1994) 259), N-ацетил-R-пеницилламин (J.Chromatogr. 387 (1987) 255), R-3-меркапто-2-метилпропионовая кислота (J.Chromatogr. 623 (1992) 237), что обуславливало достаточно низкую разрешающую способность и, тем самым, ограничивает их использование для хирального анализа. Поэтому метод применяли для решения более простой задачи - определения содержания только активных, S-энантиомеров аминокислот (J.Chromatogr. A 987 (2003) 311, J.Chromatogr. A 870 (2000) 271, J.Chromatogr. В. 666 (1995) 241).
Цель настоящего изобретения состоит в том, чтобы обеспечить способ, позволяющий количественно определять в препаратах первичных аминосоединений, таких как нефункционализированные амины, аминоспирты, аминокислоты и их элементоорганические аналоги, содержание каждого из оптических изомеров.
Сущность изобретения: Настоящее изобретение представляет собой способ количественного определения энантиомеров аминосоединений общей формулы (I)
где
- R1, R2 и R3 могут быть соединены между собой, образуя (би)циклическую структуру вместе с атомом углерода, к которому присоединены, или не связаны между собой, и каждый из которых представляет Н, замещенный или незамещенный (цикло)алкильный, или арильный, или алкиларильный, или арилалкильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, N, S, Р, галоген. В, Si или функциональные группы на их основе,
при котором энантиомерно чистый тиол из числа N-ацильных производных (S)-цистеина и олигопептидов и их миметиков, содержащих цистеин, следующей общей формулы (II),
где
- {Cys} - S-цистеин, природный или неприродный олигопептид или их миметик, содержащий S-цистеин со свободной сульфгидрильной группой,
- Z0 - атом О, S или замещенная аминогруппа,
- Z1 - атом Н, замещенный или незамещенный циклоалкильный, алкильный, арильный, алкиларильный, или арилалкильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, N, F,
- Z2 - атом Н, замещений или незамещенный алкильный или арильный радикал,
- Z3 - атом Н, F, гидрокси-, алкокси-, -NHOH, замещенная аминогруппа,
- m - число, выбранное из 0, 1,
- n - число, выбранное из 0, 1, 2,
- таким образом, что соединение (II) в сравнении с незамещенными N-ацильными производными S-цистеина, например N-ацетил-S-цистеином, содержит один и более дополнительных хиральных центров и/или один и более дополнительных гетероатомов О, N, F и называется далее по тексту "функционализированным" хиральным SH-реагентом,
приводится в контакт с препаратом, содержащим аминосоединения формулы (I), в присутствии воды и ОФА, после чего производится количественное определение образующихся стереоизомерных изоиндолов одним из методов физико-химического анализа, например, из числа хроматографических методов анализа (в частности, высокоэффективная жидкостная хроматография или капиллярный электрофорез).
Названный способ включает стадии:
- контакта препарата первичного аминосоединения в присутствии воды и/или растворителя органической или неорганической природы с ОФА и оптически активным SH-реагентом, приводящего к образованию стереоизомерных изоиндольных аддуктов и
- их разделения и определения методом хроматографического анализа.
Названный способ применителен для количественного определения аминосоединений общей формулы (I), которые могут содержать один или несколько хиральных центров, а также ахиральных первичных аминосоединений, удовлетворяющие формуле (I).
Применение описанного метода позволяет количественно анализировать энантиомеры различных классов аминосоединений благодаря высокой стереоизбирательности при использовании функционализированных хиральных тиолов.
Применение предложенных функционализированных SH-реагентов общей формулы (II) обеспечивает высокую стереоселективность (фактор разделения RS достигает величин более 0,9-1,0, преимущественно - более 1,3-1,5), чувствительность (предел обнаружения при спектрофотометрическом детектировании менее 1-3 пкмоль, при флюориметрическом детектировании - менее 1-3 fмоль) и воспроизводимость (sr, менее 0,3-1,0%) анализа, а также высокую растворимость и стабильность соответствующих изоиндолов в условиях хроматографического анализа, позволяющее анализировать различные аминосоединения общей формулы (I), включая гидрофобные амины. В настоящей заявке термин “хроматографическое разделение” должен пониматься как число и/или величина свойств, которыми различаются полученные стереоизомерные изоиндольные формы в ходе дериватизации аминогрупп. Так, их физическое разделение в пространстве не является непременным условием и может быть проведено в дальнейшем.
Предпочтительным вариантом осуществления заявляемого способа является использование набора аминосоединений, имеющих общую формулу (I), который может быть охарактеризован тем, что R1 это Н, R2 представляет собой карбокси-, амидную, сложноэфирную, гидрокси-, алкокси-, метальную группу, а R3 представляет группу, выбранную из набора, содержащего алкильный, циклоалкильный, арильный, алкиларильный, арилалкильный радикал, каждый из которых может содержать или не содержать один или несколько галоген атомов.
В качестве хирального SH-реагента для предколоночной модификации в случае определения энантиомеров ароматических аминосоединений предпочтительно использование реагентов общей формулы (II), содержащий один или несколько ароматических заместителей, как например S-NMC, R-NMC (см. табл.1), с элюированием при температуре предпочтительно выше комнатной, например, 25-60°С, а в случае определения энантиомеров алифатических аминосоединений предпочтительно использование реагентов общей формулы (II) с большим содержанием алифатических радикалов, как например соединений 1-Б, представленных в таблице 1, с ВЭЖХ анализом предпочтительно при температурах при 1-25°С.
Наиболее предпочтительным вариантом осуществления заявляемого способа является такой, когда испытуемым веществом является аминосоединение общей формулы (I), где R1 это Н, R2 представляет собой карбокси-, сложноэфирную, гидрокси- группу, R3 это замещенный или незамещенный алкильный, циклоалкильный или арильный радикал. Дериватизацию аминосоединений испытуемого образца предпочтительно проводить при высоком значении рН, например при рН в интервале 6 и 12, в частности 8 и 10.
Молярное отношение концентраций хирального SH-реагента и ОФА при дериватизации предпочтительно составляет от 1 до 100, в частности в пределах 2-10.
Молярное отношение ОФА и предполагаемой общей концентрации аминогрупп при дериватизации предпочтительно составляет от 1 до 100, в частности 2-10.
Температура, при которой проводится дериватизация аминогрупп, не играет решающего значения и может быть, например, в интервале от 0 до +90°С, предпочтительно между 0 и +50°С, в частности при комнатной температуре.
Время, за которое проводится дериватизация, предпочтительно составляет от 1 минуты до 100 часов, в частности 10 минут.
Испытуемый образец аминосоединений приводится в контакт с ОФА и хиральным SH-реагентом предпочтительно в присутствии воды/водного раствора, предпочтительно содержащего растворимые неорганические соединения, например борат, и/или смешивающиеся с водой органические соединения, например метанол, ацетон, диметилсулфоксид.
Хроматографический анализ смеси, полученной после дериватизации, предпочтительно проводить при использовании колонки для обращенно-фазовой высокоэффективной жидкостной хроматографии или капиллярного электрофореза.
В качестве подвижной фазы предпочтительно использовать воду или водные растворы, содержащие смешивающиеся с водой органические и/или неорганические соединения, например, такие как метанол, ацетонитрил, фосфат калия. Кислотность подвижной фазы может варьироваться в интервале рН от 1 до 11, предпочтительно рН 4-7, в частности pH 6-7.
Режим подачи подвижной фазы предпочтительно изократический, в частности градиентный.
Скорость подачи мобильной фазы может варьироваться в интервале от 0,01 до 3 мл/мин, предпочтительно 0,1-1,0 мл/мин.
Элюирование предпочтительно проводить при температуре от 0 до +70°С, в частности между +5 и +50°С.
Способ регистрации сигнала предпочтительно использовать флюориметрический или спектрофотометрический.
Настоящее изобретение продемонстрировано нижеследующими примерами, которые никоим образом не ограничивают его применение. В качестве SH-реагентов использовали, с одной стороны, гомохиральные тиолы, среди которых коммерчески доступный и традиционно используемый для этих целей N-ацетил-S-цистеин (NAC), а также новый NPC (таблица 1), и, с другой стороны, функционализированные N-ацильные производные S-цистеина и глутатиона.
ВЭЖХ-анализ проведен на хроматографической системе Perkin Elmer 200 Series при использовании различных колонок для обращенно-фазовой хроматографии. Изоиндольные стереоизомеры анализировали спектрофотометрически при 340 нм, и флюориметрически с возбуждением при 340 нм и эмиссией при 450 нм.
Хроматографические параметры рассчитывались по формулам: коэффициент селективности α=k2/k1, фактор разделения RS=1,18·(tR2-tR1)/(w2+w1), где k1, k2 - коэффициенты емкости определяемых веществ, рассчитанные по формуле kn=(tRn-tm)/tm, a tR2, tR1 - времена удерживания определяемых веществ, tm - мертвое время хроматографической системы, w2, w1 - полуширины пиков удерживаемых веществ.
| Таблица 1. | |||||||||
| Структура рассмотренных хиральных SH-реагентов. | |||||||||
| Структура хирального SH-реагента | N-ацильный радикал (R-)тиолов* | ||||||||
| I-A | NAC | S-NLC | NPC | NPOC | p-OH-NPC | R-NMC | S-NMC | R-NAPC | |
| I-Б | NAGSB | S-NLGSH | NPGSH | NPOGSH | p-OH-NPGSH | R-NMGSH | S-NMGSH | R-NAPC | |
| I-A - N-ацильные производные цистеина, | |||||||||
| I-Б - N-ацильные производные глутатиона (GSH) - природного трипептида, содержащего циотеин со свободной сульфгидрильной группой, | |||||||||
| * структуры функционализированных тиолов выделены жирным шрифтом. |
Отметим, что RS≥1,5 является условием полного разделения пиков двух энантиомерных форм (до базовой линии), а RS≈1,1-1,2 - условие удовлетворительного разделения пиков. Дериватизацию первичных аминогрупп можно проводить различными способами смешивая растворы анализируемого аминосоединения и реагентов, например: к 900 мкл раствора аминосоединения (общее содержание первичных аминогрупп не превышает 0,5 ммоль/л) в 0,2 М боратном буфере (рН 9,6) добавлять 50 мкл 60 мМ метанольного раствора SH-реагента и 50 мкл 20 мМ ОФА, полученную смесь перемешивать, через 15 мин после начала реакции разбавляли подвижной фазой, центрифугировали в течение 3 мин при 12000 об/мин и анализировали.
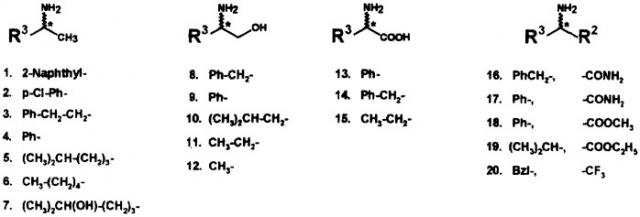
Изобретение иллюстрируется следующими примерами и чертежом, на котором изображена структура рассмотренных аминосоединений общей формулы (I), где R1 это Н.
Пример 1. Энантиомерный анализ ароматических аминов, аминоспиртов и аминокислот методом ВЭЖХ с предколоночной дериватизацией.
Предколоночную дериватизацию рацемататов (1, 3, 8, 11, 14) проводили согласно вышеописанной процедуре. ВЭЖХ анализ проводили при использовании колонки для обращенно-фазовой хроматографии Phenomenex Luna 5u С-18 (250×4,6 мм, 5 мкм), скорость потока 0,8 мл/мин. В качестве подвижной фазы использовали 6 мМ фосфатный буфер (рН 6,8), содержащий ацетонитрил (25-40% по объему). Элюирование проводили в изократическом режиме при 25°С. Данные показаны в таблице 2.
Пример 2. Определение энантиомеров ароматических и алифатических аминоспиртов и аминокислот (градиентное элюирование).
Предколоночную дериватизацию рацематов (9, 11, 14, 15) проводили согласно вышеописанной процедуре. ВЭЖХ анализ проводили при использовании колонки для обращенно-фазовой хроматографии Nucleosil С-18 Chrompack Varian (150×4,6 мм, 5 мкм), скорость потока 0,8 мл/мин. В качестве подвижной фазы использовали линейный градиент на основе 6 мМ фосфатного буфера, рН 6,8 (А) и ацетонитрила (Б): 0 мин - 5% Б, 90 мин - 50% Б.
Данные показаны в таблицах 3 и 4.
| Таблица 2 | ||||||||||||||||||||
| №А | NAC | NPC | NPOC | R-NMC | S-NMC | |||||||||||||||
| k1' | α | R | СЭБ | k1' | α | R | СЭ | k1' | α | R | СЭ | k1' | α | R | СЭ | k1' | α | R | СЭ | |
| 1 | 20 | 1,00 | 0 | В | 26 | 1,00 | 0 | Г | 30 | 1,04 | 0,71 | Г | 15 | 1,04 | 1,32 | Г | 20 | 1,05 | 1,50 | Г |
| 3 | 30 | 1,00 | 0 | Б | 15 | 1,03 | 1,14 | Г | 25 | 1,03 | 0,80 | Г | 20 | 1,05 | 1,42 | В | 35 | 1,06 | 1,77 | В |
| 8 | 20 | 1,03 | 1,15 | А | 7,7 | 1,06 | 1,46 | В | 12 | 1,04 | 1,06 | В | 15 | 1,07 | 1,70 | Б | 29 | 1,10 | 2,97 | Б |
| 11 | 4,7 | 1,08 | 1,93 | А | 4,4 | 1,00 | 0 | В | 5,3 | 1,06 | 1,41 | В | 8,1 | 1,08 | 2,28 | Б | 13 | 1,08 | 2,49 | Б |
| 14 | 2,3 | 1,13 | 2,16 | А | 3,8 | 1,17 | 3,75 | Б | 5,9 | 1,12 | 3,00 | Б | 2,2 | 1,27 | 4,37 | Б | 2,5 | 1,59 | 9,45 | Б |
| А структуры аминосоединений представлены на чертеже; БСЭ содержание ацетонитрила (V/V) в подвижной фазе (А - 25%, Б - 30%, В - 35%, Г - 40%).Примечание: Использование функционализированных SH-реагентов увеличивает стереоселективность и позволяет определять энантиомеры различных классов аминосоединений. |
| Таблица 3 | |||||||||||||||
| Опыт 2А. Энантиомерный анализ первичных аминосоединений (элюирование при 50°С) | |||||||||||||||
| №А | NAC | NPC | NPOC | R-NMC | S-NMC | ||||||||||
| k1' | α | R | k1' | α | R | k1' | α | R | k1' | α | R | k1' | α | R | |
| 9 | 20 | 1,00 | 0 | 27 | 1,00 | 0 | 28 | 1,01 | 0,51 | 23 | 1,02 | 1,23 | 26 | 1,02 | 2,07 |
| 11 | 15 | 1,03 | 1,84 | 24 | 1,01 | 0,88 | 24 | 1,02 | 0,95 | 19 | 1,02 | 1,35 | 22 | 1,02 | 1,82 |
| 14 | 11 | 1,00 | 0 | 17 | 1,07 | 4,87 | 18 | 1,01 | 0,55 | 13 | 1,10 | 5,76 | 15 | 1,16 | 10,4 |
| 15 | 6,1 | 1,06 | 1,64 | 13 | 1,10 | 5,45 | 15 | 1,07 | 5,97 | 9,4 | 1,16 | 5,38 | 11 | 1,19 | 9,85 |
| А структуры аминосоединений представлены на чертеже. |
| Таблица 4 | |||||||||||||||
| Опыт 2Б. Энантиомерный анализ первичных аминосоединений (элюирование при 8°С) | |||||||||||||||
| №A | NAC | R-NMC | S-NMC | NPGSH | R-NMGSH | ||||||||||
| k1' | α | R | k1' | α | R | k1' | α | R | k1' | α | R | k1' | α | R | |
| 9 | 23 | 1,01 | 0,42 | 27 | 1,02 | 1,58 | 27 | 1,02 | 1,58 | 23 | 1,01 | 1,39 | 20 | 1,01 | 1,38 |
| 11 | 19 | 1,03 | 3,05 | 23 | 1,02 | 1,40 | 23 | 1,02 | 1,40 | 20 | 1,01 | 1,53 | 17 | 1,02 | 1,72 |
| 14 | 15 | 1,00 | 0 | 16 | 1,17 | 9,22 | 16 | 1,17 | 9,22 | 17 | 1,27 | 26,6 | 14 | 1,01 | 0,65 |
| 15 | 11 | 1,03 | 1,71 | 13 | 1,21 | 6,85 | 13 | 1,21 | 6,85 | 14 | 1,01 | 0,82 | 11 | 1,05 | 3,28 |
| A структуры аминосоединений представлены на чертеже.Примечание: Использование функционализированных SH-реатентов увеличивает стереоселективность и позволяет определять энантиомеры алифатических и ароматических аминосоединений. |
Пример 3. Энантиомерный анализ аминов и аминоспиртов при использовании R-NMC и NAC.
Предколоночную дериватизацию рацематов аминов и аминоспиртов проводили согласно вышеописанной процедуре. ВЭЖХ анализ проводили при использовании колонки для обращенно-фазовой хроматографии Phenomenex Luna 5u C-18 (250×4,6 мм, 5 мкм), скорость потока 0,8 мл/мин. В качестве подвижной фазы использовали 6 мМ фосфатный буфер (рН 6,8), содержащий ацетонитрил (25-37% по объему). Элюирование проводили в изократическом режиме при 25°С.
| Таблица 5 | ||||||||
| №А | NAC | R-NMC | ||||||
| k1' | α | R | СЭБ | k1' | α | R | СЭБ | |
| 1 | 26 | 1,00 | 0 | 30% | 13 | 1,04 | 1,35 | 37% |
| 2 | 16 | 1,00 | 0 | 27% | 9,4 | 1,05 | 1,35 | 37% |
| 3 | 31 | 1,00 | 0 | 27% | 20 | 1,05 | 1,42 | 35% |
| 4 | 15 | 1,00 | 0 | 25% | 21 | 1,02 | 1,10 | 33% |
| 5 | 46 | 1,00 | 0 | 27% | 23 | 1,03 | 0,90 | 37% |
| 6 | 49 | 1,02 | 0,45 | 27% | 19 | 1,03 | 1,00 | 33% |
| 7 | 2,7 | 1,23 | 3,47 | 30% | 1,8 | 1,10 | 2,24 | 37% |
| 8 | 17 | 1,04 | 0,86 | 25% | 15 | 1,13 | 4,20 | 27% |
| 9 | 13 | 1,03 | 0,81 | 25% | 10 | 1,13 | 3,50 | 27% |
| 10 | 19 | 1,05 | 1,34 | 22% | 3,4 | 1,06 | 1,81 | 37% |
| 11 | 3,0 | 1,11 | 1,61 | 25% | 7,9 | 1,16 | 3,26 | 27% |
| 12 | 3,8 | 1,13 | 2,40 | 20% | 1,5 | 1,08 | 1,63 | 27% |
| 20 | 26 | 1,06 | 1,76 | 27% | 10 | 1,05 | 1,53 | 33% |
| А структуры аминосоединений представлены на чертеже, Б содержание ацетонитрила (V/V) в подвижной фазе.Примечание: Использование функционализированного R-NMC увеличивает стереоселективность разделения аминоспиртов и в отличие от гомохирального NAC, позволяет определять энантиомеры нефункционализированных аминов. |
Пример 4. Определение энантиомеров амидов и эфиров аминокислот.
Предколоночную дериватизацию рацемата (16 и 19) проводили согласно вышеописанной процедуре. ВЭЖХ анализ проводили при использовании колонки для обращенно-фазовой хроматографии Nucleosil С-18 Chrompack Varian (150×4,6 мм, 5 мкм), скорость потока 0,8 мл/мин. В качестве подвижной фазы использовали 6 мМ фосфатный буфер (рН 6,8), содержащий ацетонитрил (18-30% по объему). Элюирование проводили в изократическом режиме при 25°С.
| Таблица 6Б | ||||||
| Опыт 4А. | ||||||
| Определение энантиомеров амида фенилаланина | ||||||
| Аминосоединение А | SH-реагент | Хроматографические | параметры | СЭб | ||
| k1 | α | RS | ||||
| NAC | 9,5 | 1,04 | 1,02 | 25% | ||
| 16 | R-NMC | 8,5 | 1,11 | 3,06 | 30% | |
| S-NMC | 7,8 | 1,12 | 3,88 | 30% | ||
| А структуры аминосоединений представлены на чертеже, Б содержание ацетонитрила (V/V) в подвижной фазе. | ||||||
| Таблица 7 | ||||||
| Опыт 4Б. | ||||||
| Определение энантиомеров этилового эфира валина | ||||||
| Аминосоединение А | SH-реагент | Хроматографические параметры | Прорядок элюир. | СЭБ | ||
| k1 | α | RS | ||||
| NAC | 21 | 1,08 | 0,67 | R,S | 20% | |
| 19 | R-NMC | 15 | 1,09 | 0,60 | 22% | |
| NPGSH | 14 | 1,14 | 1,2 | S,R | 18% | |
| А структуры аминосоединений представлены на чертеже Б содержание ацетонитрила (V/V) в подвижной фазе.Примечание: Использование функционализированных SH-реагентов увеличивает стереоселективность разделения С-защищенных аминокислот. |
Пример 5. Метрологические характеристики метода при определении энантиомеров аминов, аминоспиртов и аминокислот.
Предколоночную дериватизацию рацематов (9 и 15) проводили согласно вышеописанной процедуре. ВЭЖХ анализ проводили при использовании колонки для обращенно-фазовой хроматографии Nucleosil С-18 Chrompack Varian (150×4,6 мм, 5 мкм), скорость потока 0,8 мл/мин. В качестве подвижной фазы использовали линейный градиент на основе 6 мМ фосфатного буфера, рН 6,8 (А) и ацетонитрила (Б): 0 мин - 5% Б, 90 мин - 50% Б. Элюирование проводили при 25°С.
Воспроизводимость анализа при использовании. R-NMGSH в качестве хирального SH-реагента (УФ-детектирование при 340 нм, n=3, Р=0,95)
| Таблица 8 | ||||||||
| Параметры пиков | Энантиомер | Номер анализа | Хср. A | Sx Б | Sr,%B | µГ | ||
| 1 | 2 | 3 | ||||||
| Высота, у.е. | S- | 22405 | 22725 | 22569 | 22566 | 160 | 0,71 | (22,6±0,5)·103 |
| R- | 21986 | 22392 | 22345 | 22241 | 222 | 1,00 | (22,2±0,6)·103 | |
| Площадь, у.е. | S- | 304947 | 305676 | 302867 | 304497 | 1458 | 0,48 | (30,4±0,4)·104 |
| R- | 286936 | 288943 | 290485 | 288788 | 1780 | 0,62 | (28,9±0,4)·104 | |
| Время элюирования, с | S- | 2380 | 2380 | 2378 | 2380 | 1,20 | 0,05 | 2380±3 |
| R- | 2409 | 2410 | 2407 | 2409 | 1,36 | 0,06 | 2409±3 | |
| А среднее значение единичных результатов серии анализов, Б размах варьирования, в относительное стандартное отклонение, Г истинное значение. |
Метрологические характеристики метода (УФ-детектирование при 340 нм, n=3, Р=0,95)
| Таблица 9 | |||
| Аминосоединение | SH-реагент | ε340 нм, М-1·см-1 | Относительное стандартное отклонение sr, % |
| 9 | R-NMGSH | 5900 | 0,5-1,0 |
| 9 | NPGSH | 5900 | 0,4-1,0 |
| 15 | S-NMC | 6000 | 0,5-1,0 |
| Примечание:Применение предложенных функционализированных SH-реагентов наряду с высокой стереоселективностью обеспечивает высокую чувствительность (предел обнаружения при спектрофотометрическом детектировании составляет 1-3 пмоль, при флюориметрическом детектировании 1-3 фмоль) и воспроизводимость (sr 0,5-1,0%) анализа.Линейная зависимость сигнала от концентрации энантиомера аминосоединения сохраняется в частности во всем исследуемом интервале 50 пмоль - 10 нмоль и 50 фмоль - 10 пкмоль аминогрупп с коэффициентом корреляции более 0,99 в случае спектрофотометрического и флюориметрического детектирования соответственно. |
1. Способ количественного определения энантиомеров первичных аминосоединений, в частности нефункционализированных аминов, аминоспиртов, аминокислот и их элементоорганических аналогов, характеризующийся тем, что аминосоединения общей формулы (I) где R1, R2 и R3 могут быть соединены между собой, образуя (би)циклическую структуру вместе с атомом углерода, к которому присоединены, или не связаны между собой, и каждый из которых представляет Н, замещенный, или незамещенный (цикло)алкильный, или арильный, или алкиларильный, или арилалкильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, N, S, Р, галоген, В, Si или функциональные группы на их основе, в присутствии воды и о-фталевого альдегида (ОФА) приводят в контакт с энантиомерно чистым тиолом из числа N-ацильных производных (5)-цистеина и олигопептидов и их миметиков, содержащих цистеин, следующей общей формулы (II) где {Cys} - 5-цистеин, природный или неприродный олигопептид или их миметик, содержащий S-цистеин со свободной сульфгидрильной группой,Z0 - атом О, S или замещенная аминогруппа,Z1 - атом Н, замещенный или незамещенный циклоалкильный, алкильный, арильный, алкиларильный или арилалкильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, N, F,Z2 - атом Н, замещений или незамещенный алкильный или арильный радикал,Z3 - атом Н, F, гидрокси-, алкокси-, -NHOH, замещенная аминогруппа,m - число, выбранное из 0, 1,n - число, выбранное из 0, 1, 2таким образом, что соединение (II), в сравнении с незамещенными N-ацильными производными S-цистеина, например N-ацетил-S-цистеином, содержит один и более дополнительных хиральных центров и/или один и более дополнительных гетероатомов О, N, F и называется "функционализированным" хиральным SH-реагентом, после чего производят количественное определение образующихся стереоизомерных изоиндолов одним из методов физико-химического анализа, например, из числа хроматографических методов анализа.
2. Способ по п.1, характеризующийся тем, что соединение (I) содержит функциональные группы, такие как -ОН, -OR4, -CN, -СООН, -CONH2, -CONHR4, -COOR4, -РО3Н2, -PO2HP4, -POR4R5, -РО2Н2, -POHR4, -NO2, -SO3H, -SO2R4, -BO2H2, где R4 и R5 могут быть тождественными или разными, и представляют замещенный или незамещенный алкильный, или циклоалкильный, или арильный, или алкиларильный, или арилалкильный радикал, содержащий или не содержащий один или несколько из вышеупомянутых гетероатомов,
3. Способ по п.2, характеризующийся тем, что Z1 представляет замещенный или незамещенный алкильный/фенильный/алкилфенильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, F, N; Z2 и Z3 - это Н; m=0, n=0-1; {Cys} - это ацилированный по аминогруппе S-цистеин.
4. Способ по п.3, характеризующийся тем, что m=1, n=1.
5. Способ по п.2, характеризующийся тем, что Z1 представляет замещенный или незамещенный алкильный/фенильный/алкилфенильный радикал, содержащий или не содержащий гетероатом/гетероатомы О, F, N; Z2 - это Н; Z3 - это атом F, гидрокси-, алкокси-, -NHOH, замещенная аминогруппа, замещенная/незамещенная амидная группа; m=0, n=0-1; {Cys} - это ацилированный по аминогруппе S-цисгеин.
6. Способ по пп.3-5, характеризующийся тем, что {Cys} - это ацилированный по аминогруппе глутатион.