Способ защиты поствакцинального иммунитета к столбнячному анатоксину от депрессии, индуцированной метотрексатом
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и может быть использовано для защиты поствакцинального иммунитета к столбнячному анатоксину от депрессии, индуцированной метотрексатом. Способ включает парентеральное введение милиацина в организм экспериментального животного в дозе 2 мг/кг массы. При этом милиацин вводят трехкратно ежедневно животным со сформированным поствакцинальным иммунитетом к столбнячному анатоксину, подвергшихся иммунодепрессивному воздействию цитостатика метотрексата. Использование изобретения позволяет защитить сформированный поствакцинальный иммунитет от иммунодепрессивного воздействия цитостатика за счет антикатаболического действия милиацина. 5 ил.
Реферат
Изобретение относится к медицине, а именно к иммунологии и эпидемиологии, и может найти применение при разработке подходов к предупреждению и (или) ограничению отрицательных последствий иммунодепрессивных воздействий на состояние поствакцинального иммунитета.
Ухудшение экологической обстановки и увеличение стрессорной нагрузки на население приводят к росту заболеваний, связанных с нарушениями в системе иммунитета (Хаитов P.M., Пинегин Б.В., Истамов Х.И., 1995; Хаитов P.M., Пинегин Б.В., 2000). Эти нарушения, затрагивая различные звенья клеточного и гуморального иммунитета, обусловливают в том числе и снижение резистентности организма к инфекции (Ruiz M.R., Quinones A.G., Diaz N.L., 2003; Sarid O., Anson O., Yaari A., Margalith M., 2001), что отрицательно сказывается на иммунологической и эпидемиологической эффективности вакцинопрофилактики (Каральник Б.В., Маркова С.Г., 1991; Першин Б.Б., Гелиев А.Б., Толстов Д.В. и др., 2002; Савилов Е.Д., 2008). Данное положение предопределяет необходимость разработки подходов к предупреждению и (или) ограничению последствий иммунодепрессивных воздействий на состояние антиинфекционной резистентности организма и прежде всего - поствакцинального иммунитета. Сегодня среди иммунокорригирующих средств, включающих чистые или охарактеризованные аналоги биологически активных веществ, рекомбинантные цитокины или индукторы их синтеза, синтетические иммуномодуляторы, не имеющие природных аналогов (полиэлектролиты), значительное внимание уделяется и химическим соединениям естественного происхождения, обладающим тропностью к иммунной системе (Хаитов P.M., Пинегин Б.В., 1996; 2000). Среди последних все более заметное место занимают природные тритерпеноиды - нетоксичные вещества растительного происхождения, обладающие широким спектром биологических эффектов, включая эффект иммуностимуляции (Ильичева Т.Н., Проняева Т.Р., Шульц Э.Э. и др., 2001). Такое иммуностимулирующее воздействие было установлено ранее у милиацина - тритерпеноида, выделенного из просяного масла.
На основании масс-, ЯМР- и ИК-спектров, хроматографической однородности и качественного состава препарат отнесен к группе пентациклических тритерпенов, имеющих структуру 3-β-метокси-Δ18-олеанена. Милиацин представляет собой вещество белого цвета с температурой плавления 285-286°С. Он оптически активен, нерастворим в воде, слабо растворим в этиловом спирте, диэтиловом эфире, ацетоне, хорошо растворим в хлороформе. Милиацин обладает хорошей переносимостью в диапазоне доз от 2 до 1000 мг/кг. ЛД50 этого соединения больше 1000 мг/кг, что свидетельствует об отсутствии у него токсических свойств (Олифсон Л.Е., Осадчая Н.Д., Нузов Б.Г. и др., 1991).
Химическая структура пентациклического тритерпеноида - милиацина (3-β-метокси-Δ18-олеанена)
Показано, что милиацин обеспечивал формирование более интенсивного иммунного ответа у животных как на первичное, так и на повторное введение столбнячного анатоксина (Кириллова А.В., Скачков М.В., Панфилова Т.В. и др., 2003). В последующем была выявлена способность милиацина ограничивать гормониндуцированный апоптоз лимфоцитов (Панфилова Т.В., Штиль А.А., Полосухина Е.Р., 2003) и оказывать протективное влияние в отношении структурных нарушений центральных и периферических органов иммуногенеза при воздействии метотрексата (Железнова А.Д., Железнов Л.М., Штиль А.А. и др., 2007). Несмотря на это, оценка способности милиацина предупреждать или ограничивать отрицательные последствия иммунодепрессивных влияний на состояние уже сформированного поствакцинального иммунитета не проводилась.
В качестве прототипа использована работа Кирилловой А.В., Скачкова М.В., Панфиловой Т.В. с соавт. «Стимуляция иммунитета к столбнячному анатоксину милиацином» (2003), в которой установлено, что растительный тритерпеноид милиацин усиливает формирование поствакцинального иммунитета у мышей к столбнячному анатоксину. Однако данные о способности милиацина защитить уже сформированный поствакцинальный иммунитет от иммунодепрессивных воздействий, в частности под влиянием цитостатиков, отсутствуют.
Новизной изобретения является обнаруженный эффект защиты милиацином поствакцинального иммунитета к столбнячному анатоксину от депрессии, индуцированной применением цитостатика - метотрексата.
Существенным отличием является то, что милиацин вводят трехкратно парентерально ежедневно животным со сформированным поствакцинальным иммунитетом к столбнячному анатоксину, подвергшимся иммунодепрессивному воздействию цитостатика метотрексата.
Описание эксперимента
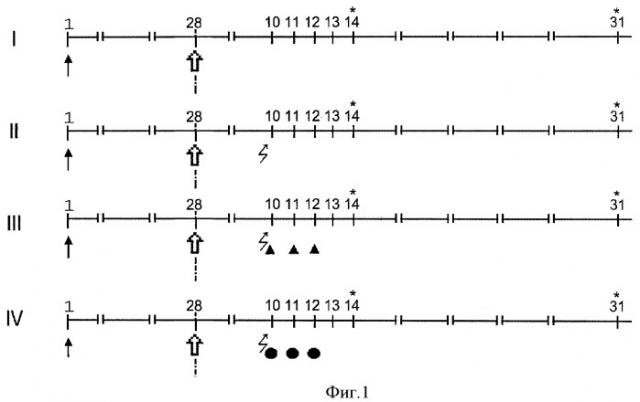
Эксперименты выполнены на 170 мышах-самцах (СВА×C57Bl6)F1, разделенных на 4 группы (фиг.1): I - иммунизированные столбнячным анатоксином мыши с повторной иммунизацией на 28 сутки (20 животных) - положительная группа сравнения; II - мыши, получавшие на 10 сутки после повторной иммунизации метотрексат (МТ) - отрицательная группа сравнения (50 животных); III - мыши, получавшие на 10 сутки после повторной иммунизации МТ с последующим введением растворителя милиацина - твина-21 в 0,9% растворе хлорида натрия (1,6×10-7 моль/кг) - контрольная группа (50 животных); IV - мыши, получавшие на 10 сутки после повторной иммунизации МТ с последующим введением милиацина - опытная группа (50 животных).
Для иммунизации животных использовали обогащенный столбнячный жидкий анатоксин (АС), сорбированный на гидроокиси алюминия производства ФГУП «НПО «Микроген» МЗ РФ (серия 197-5, контрольный номер 2421, срок годности до 08.2008 г). Мышей иммунизировали подкожно в надлопаточную область в разовой дозе 0,5 мл, содержащей 10 ЕС столбнячного анатоксина с повторным введением антигена в той же дозе на 28 сутки после первичной иммунизации. Оценка иммунного ответа у животных всех 4 групп проводилась на 14 и 31 сутки после реиммунизации (соответственно, на 4 и 21 сутки после введения МТ) путем определения титра антител микрометодом РНГА с использованием диагностикума эритроцитарного столбнячного антигенного жидкого - комплект №1 (предприятие-изготовитель АООТ «Биомед» им. И.И.Мечникова, активность 1:1280; серия №2; дата изготовления 09.07).
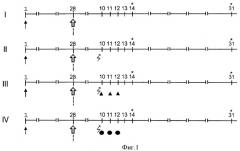
Для воспроизведения супрессивного эффекта в отношении поствакцинального иммунитета использовали МТ австрийской фирмы-производителя «Эбеве» (серия 700045; срок годности до 12.09). Препарат вводили на 10 сутки после повторной иммунизации однократно внутрибрюшинно в дозе 10 мг/кг массы тела. Основанием для выбора дозы и способа введения МТ послужили данные (Cetiner M., Sener G., Sehirli A.O. et al., 2005; Cetinkaya A., Bulbuloglu E., Kuratas E. et al., 2006), использовавших однократное внутрибрюшинное введение 20 мг/кг цитостатика при воспроизведении токсического поражения печени у крыс. Однако, проведенное нами предварительное испытание этой дозы на мышах (СВА×C57Bl6)F1 в двух сериях опытов (фиг.2; серии I и II) показало высокую летальность животных, составившую на протяжении 14 дней 85% и 65%. Аналогичный способ применения МТ в дозе 10 мг на кг массы приводил к ослаблению летального эффекта, находившемуся в диапазоне от 20% до 8,3% (фиг.2; серия III и IV). В связи с этим данная доза цитостатика (10 мг/кг) и была выбрана для проведения дальнейших экспериментов.
Для оценки влияния милиацина на супрессию поствакцинального иммунитета под действием МТ, тритерпеноид вводили трехкратно внутрибрюшинно в дозе 2 мг/кг массы тела: через 1 час после введения МТ и в последующие два дня. Доза тритерпеноида и кратность его введения соответствовали таковым, при которых в ранее проведенных исследованиях достигался положительный эффект, в том числе снижение выраженности морфологических нарушений в органах иммуногенеза на фоне применения МТ (Железнова А.Д., Железнов Л.М., Штиль А.А. и др., 2007).
Статистический анализ полученных данных проводили стандартными методами вариационной статистики. Достоверность различий оценивали по t-критерию Стьюдента.
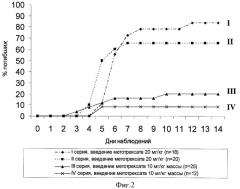
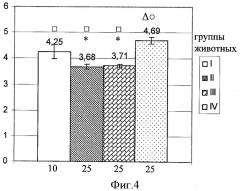
Полученные результаты представлены на фиг.3 и 4, отражающих средние значения десятичных логарифмов титров антител, выявленные у животных исследуемых групп в различные сроки (14 и 31 сутки) после повторной иммунизации. Как следует из представленных данных, применение МТ на 10 сутки после реиммунизации (фиг.3; группа II) сопровождалось значительным снижением титра антител по сравнению с группой повторно иммунизированных животных (фиг.3; группа I), не получавших цитостатик. Обращает внимание, что это снижение регистрировалось не только на ранних сроках после введения МТ: 4 сутки (14 сутки после повторной иммунизации), но и в более отдаленном периоде после его применения (фиг.4; группа II) - на 21 сутки (31 сутки после повторной иммунизации). Использование растворителя для милиацина не ослабляло выраженности иммуносупрессии под воздействием МТ в указанные сроки наблюдения (фиг.3 и 4; группа III). В противоположность этому, милиацин практически отменял эффект подавления поствакцинального иммунитета метотрексатом на 4 сутки после его применения (14 сутки после повторной иммунизации) - фиг.3; группа IV. Введение тритерпеноида обеспечивало у мышей опытной группы поддержание более высокого уровня поствакцинального иммунитета и на 21 сутки после МТ (31 сутки после повторной иммунизации). Более того, уровень антител у животных опытной группы на данном сроке наблюдения (фиг.4; группа IV) превосходил и таковой, регистрируемый у повторно иммунизированных животных без какого-либо последующего воздействия (фиг.4; группа I).
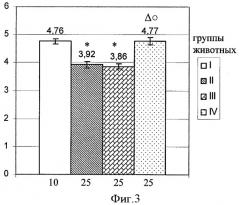
Обсуждая полученные результаты, можно полагать, что негативные последствия МТ на 4 сутки после его применения в отношении поствакцинального иммунитета могли быть обусловлены общетоксическим действием препарата, сопровождаемым катаболическим эффектом. Основанием для такого предположения служат полученные ранее данные (Железнова А.Д., О.В.Калинина, 2006) о снижении массы животных, а также показателей массы печени, селезенки, тимуса (и соответствующих индексов) к указанному сроку наблюдения под действием цитостатика (фиг.5; группа II). Применение растворителя для милиацина не отражалось на степени депрессии исследуемых показателей (фиг.5; группа III), тогда как милиацин значительно ограничивал эти сдвиги (фиг.5; группа IV). Следует отметить, что роль активации катаболических процессов в снижении гуморального иммунитета при экстремальных воздействиях обсуждалась и ранее (Першин Б.Б., Емельянов Б.А., Соколов Я.А. и др., 1987; Першин Б.Б., Гелиев А.Б., Толстов Д.В. и др., 2002). По мнению авторов, механизм такого снижения обусловлен как прямой деградацией белковых молекул, включая молекулы иммуноглобулинов, так и неспецифическим связыванием последних продуктами тканевого распада. То обстоятельство, что предотвращение милиацином снижения уровня антител в крови животных на 4 сутки после применения МТ сопровождалось ограничением падения показателей массы тела и органов животных, свидетельствует в пользу представления о том, что антикатаболическое действие тритерпеноида служит основным механизмом его защиты в отношении поствакцинального иммунитета в указанный период.
Состояние иммунитета в более отдаленном периоде после применения МТ (21 сутки; 31 сутки после повторной иммунизации) характеризуется снижением титра антител по отношению к предшествующему сроку как в группе только иммунизированных животных (фиг.4 и 3; группа I), так и в группах животных, получавших МТ (фиг.4 и 3; группа II) или МТ с последующим введением растворителя (фиг.4 и 3; группа III). Исключение составила опытная группа мышей, получавших на фоне введения МТ милиацин (фиг.4 и 3; группа IV), где такое снижение было выражено минимально. При оценке этих результатов представляется важной особенность милиацина не только ограничивать индуцированное МТ угнетение способности спленоцитов к продукции цитокинов: γ-ИФН; ИЛ-12; ИЛ-4, но и оказывать стимулирующее влияние на продукцию последнего в поздние сроки (21 сутки) после применения цитостатика (Железнова А.Д., Панфилова Т.В., Смолягин А.И. и др., 2008). Очевидно, что такая стимуляция, свидетельствующая об активации Тх 2 - клеток (Ярилин А.А., 1999), может иметь существенное значение в поддержании напряженности иммунитета у мышей опытной группы в этот отдаленный период.
Таким образом, однократное введение метотрексата (10 мг/кг) оказывает угнетающее воздействие на состояние поствакцинального иммунитета, сформировавшегося у животных в ответ на повторную иммунизацию столбнячным анатоксином. Депрессия сформировавшегося иммунитета к столбнячному анатоксину под влиянием метотрексата проявляется уже в раннем периоде после его применения (4 сутки) и носит продолжительный характер, удерживаясь на протяжении трех недель. Трехкратное (на протяжении 3 дней) введение милиацина после применения метотрексата предотвращает иммунодепрессивный эффект цитостатика как в раннем (4 сутки), так и в отдаленном (21 сутки) периоде наблюдения. Полученные данные служат экспериментальным обоснованием возможности использования милиацина как средства поддержания иммунологической и эпидемиологической эффективности вакцинопрофилактики в условиях воздействия на организм дестабилизирующих факторов.
Краткое описание чертежей
Фигура 1. Схема постановки эксперимента по изучению влияния милиацина на нарушение поствакцинального иммунитета к столбнячному анатоксину, индуцированное метотрексатом.
Сроки иммунизации (↑), реиммунизации введения метотрексата растворителя (▲), милиацина (●) и забора сыворотки (*) для определения титра антител.
Фигура 2. Динамика гибели мышей (CBA×C57BL6)F1 при однократном внутрибрюшинном введении метотрексата в дозах 20 мг/кг и 10 мг/кг массы тела.
Фигура 3. Lg титров антител в сыворотке крови у мышей (СВА×C57Bl6)F1 на 14 сутки после повторной иммунизации столбнячным анатоксином (I), а также после аналогичной иммунизации с последующим (на 10 сутки) введением МТХ (II), МТХ и растворителя (III), МТХ и милиацина (IV).
Фигура 4. Lg титров антител в сыворотке крови у мышей (СВА×C57Bl6)F1 на 31 сутки после повторной иммунизации столбнячным анатоксином (I), а также после аналогичной иммунизации с последующим (на 10 сутки) введением МТХ (II), МТХ и растворителя (III), МТХ и милиацина (IV).
Фигура 5. Влияние милиацина на показатели массы и индекса массы селезенки, тимуса и печени у мышей (СВА×C57Bl6)F1 на 4 сутки после воздействия МТ (М±σ).
интактные (положительная группа сравнения, I); - МТ (отрицательная группа сравнения, II); - растворитель для милиацина у животных, получавших МТ (контроль, III); - милиацин у животных, получавших МТ (опыт, IV).
Цифрами под столбцами указано количество животных.
* - достоверность по отношению к группе I
Δ - достоверность между группами II и IV
° - достоверность между группами III и IV
- достоверность с предшествующим сроком внутри группы
Литература
1. Железнова А.Д., О.В.Калинина. Экспериментальная оценка милиацина как средства реабилитации при вторичном иммунодефиците, индуцированном метотрексатом. // Вестник Уральской медицинской академической науки, №3-1 (14), 2006, с.63-66.
2. Железнова А.Д., Железнов Л.М., Штиль А.А. и др. Морфологические проявления защитного влияния милиацина в органах иммуногенеза при действии метотрексата. // Бюлл. экспер. биол. и медицины. - 2007. - Т.144. - №10. - С.458-463.
3. Железнова А.Д., Панфилова Т.В., Смолягин А.И. и др. Влияние милиацина на продукцию цитокинов спленоцитами мышей (СВА×C57Bl6)F1, подвергнутых воздействию метотрексата. // Российский иммунологический журнал. - 2008. - Т.2 (11). - №2-3. - С.313.
4. Ильичева Т.Н., Проняева Т.Р., Шульц Э.Э. и др. Иммуномодулирующая активность тритерпеноидов растительного происхождения и их производных. // Журнал микробиол. - 2001. - №2. - С.5-56.
5. Каральник Б.В., Маркова С.Г. Экологические аспекты АКДС-вакцинации. // ЖМЭИ. - 1991. - №12. - С.34-38.
6. Кириллова А.В., Скачков М.В., Панфилова Т.В. и др. Стимуляция иммунитета к столбнячному анатоксину милиацином. // Эпидемиология. Вакцинопрофилактика. 2003. - №6 (13). - С.36-38.
7. Олифсон Л.Е., Осадчая Н.Д., Нузов Б.Г. и др. Химическая природа и биологическая активность милиацина. // Вопросы питания. -1991. - №2. - С.57-59.
8. Панфилова Т.В., Штиль А.А., Полосухина Е.Р. и др. Влияние тритерпеноида милиацина на чувствительность лимфоцитов тимуса и селезенки к апоптозу, индуцированному дексаметазоном. // Бюлл. экспер. биол. и медицины. - 2003. - Т.136. - №10. - С.382-385.
9. Першин Б.Б., Емельянов Б.А., Соколов Я.А. и др. Изучение механизма феномена исчезающих иммуноглобулинов при стрессе в эксперименте. // Патол. физиол. и эксперим. терапия. - 1987. - №5. - С.41-44.
10. Першин Б.Б., Гелиев А.Б., Толстов Д.В. и др. Реакции иммунной системы на физические нагрузки. // Русский журнал иммунологии. - 2002. - Т.7. - №1. - С.1-24.
11. Савилов Е.Д. Теоретические аспекты управления инфекционной заболеваемостью в условиях техногенного загрязнения окружающей среды. // Бюлл. СО РАМН. - 2008. - №1. - С.43-46.
12. Скачкова М.А., Скачков М.В., Смолягин А.И. и др. Иммунный статус и состояние интерфероновой системы у школьников, проживающих в городах с различной антропогенной нагрузкой. // Бюлл. экспер. биол. и медицины. - 2001. - Т.131. - №4. - С.442-444.
13. Хаитов P.M., Пинегин Б.В., Истамов Х.И. Экологическая иммунология. М.: Из-во ВНИРО. - 1995. - 219 с.
14. Хаитов P.M., Пинегин Б.В. Основные представления об иммунотропных лекарственных средствах. // Иммунология. - 1996. - №6. - С.4-9.
15. Хаитов P.M., Пинегин Б.В. Современные иммуномодуляторы. Основные принципы их применения. // Иммунология. - 2000. - №5. - С.4-7.
16. Черешнев В.А., Кеворков Н.Н., Бахметьев Б.А. и др. Экология и иммунитет - патофизиологические аспекты. // Второй Российский симпозиум по патофизиологии с международным участием. 9-12.10. - М., 2000. - С.158.
17. Ярилин А.А. Основы иммунологии. - М.: Медицина, 1999. - 608 с.
18. Cetiner М., Sener G., Sehirli A.O. et al. Taurine protects against meth-otrexate - induced toxicity and inhibits leukocyte death. // Toxicol. Appl. Pharmacol. - 2005. - V.209. - №1. - P.39-50.
19. Cetinkaya A., Bulbuloglu E., Kuratas E. et al. N-acetylcystein ameliorates methotrexate - induced oxidative liver damage in rats. // Med. Sei Monit. - 2006. - V.12. - №8. - P.274-278.
20. Ruiz M.R., Quinones A.G., Diaz N.L. et al. Acute immobilization stress induces clinical and neuroimmunological alterations in experimental murine cutaneosus leishmaniasis. // Br. Dermatol. - 2003. - Vol.149. - №4. - P.731-738.
21. Sarid O., Anson O., Yaari A., Margalith М. Epstein-Barr virus specific salivary antibodies as related to stress caused by examinations. // J. Med. Virul. - 2001. - №64 (2). - P.149-156.
Способ защиты поствакцинального иммунитета к столбнячному анатоксину от депрессии, индуцированной метотрексатом, включающий парентеральное введение милиацина в организм экспериментального животного в дозе 2 мг/кг массы, отличающийся тем, что милиацин вводят трехкратно ежедневно животным со сформированным поствакцинальным иммунитетом к столбнячному анатоксину, подвергшимся иммунодепрессивному воздействию цитостатика метотрексата.