Имплантируемая нейроэндопротезная система, способ ее получения и способ проведения реконструктивной нейрохирургической операции
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к нейрохирургии и тканевой инженерии органов. Нейроэндопротезную систему получают путем перфузирования биокомпозиции аутологичных клеток в гетерогенный коллагенсодержащий матрикс для имплантации с получением упругоэластичной клеточно-биополимерной биологически активной массы. Биокомпозиция содержит находящиеся в растворе NaCl нейральные стволовые клетки (НСК), нейроглиальные обкладочные клетки (НГОК), эндотелиальные клетки с маркером CD34+(ЭК) и очищенные мононуклеары (МН). При проведении реконструктивной нейрохирургической операции осуществляют имплантацию в дефект нервной ткани нейроэндопротезной системы. Разработанная нейроэндопротезная система позволяет обеспечить стимуляцию регенерации и рост поврежденных аксонов нервных клеток при проведении реконструктивных нейрохирургических операций. 3 н. и 18 з.п. ф-лы, 3 табл., 2 ил.
Реферат
Изобретение относится к области нейрохирургии и тканевой инженерии органов и может быть использовано для замещения дефектов нервной ткани головного и спинного мозга при реконструктивно-восстановительном лечении последствий травматических повреждений, ишемических поражений и оперативных вмешательств на центральной нервной системе (ЦНС) и вегетативной нервной системе (ВНС) млекопитающего, например человека.
До конца XX века проблема протезирования дефектов нервной ткани считалась нереальной и практически нерешаемой задачей. Это было связано с канонизированными представлениями исследователей мозга, неврологов и нейрохирургов об ограниченных возможностях нервной ткани к регенерации и саногенезу, а также установленными в 1801 г.Рамоном Кохалем догматическими представлениями о принципиальной неспособности нервных клеток к восстановлению после повреждения. Однако в последнем десятилетии XX века эти представления существенно изменились в связи с накоплением новых научных фактов о регенераторном потенциале ЦНС, открытием репаративных возможностей нейральных стволовых клеток (НСК) и получением неопровержимых доказательств о возможности восстановления аксонов поврежденных нейронов.
Известен препарат гемопоэтических стволовых клеток (ГСК), представляющий собой аутологичные ГСК, полученные из периферической крови пациента, обогащенной клетками, содержащими антиген CD34, в конечной концентрации (40÷100)·106 клеток/мл. Терапевтическое лечение травматической болезни ГМ и СМ проводят путем интратекального или интравентрикулярного введения этого препарата пациенту (RU 2283119 C1, А61К 35/14, 2006). Однако использование препарата из одних лишь ГСК оказалось недостаточно эффективным при лечении дефектов нервной ткани ГМ и СМ.
Известен биополимерный протез «NeuroGel»™ для заполнения дефектов нервной ткани (S.Woerly, V.D.Doan, F.Evans-Martin, C.G.Paramore, J.D.Peduzzi, "Spinal cord reconstruction using NeuroGel™ implants and functional recovery after chronic injury", J. of Neurosciensce Res. 2001. Vol.66, P.1187-1197). Исследования показали, что через биополимерную композицию возможно прорастание в СМ млекопитающих поврежденных аксонов нервной ткани и восстановление утраченных функций мозга, а стволовые клетки способствуют созданию благоприятных условий для регенерации аксонов. Однако использование биополимерного протеза «NeuroGel»™ также недостаточно эффективно при лечении дефектов нервной ткани ГМ и СМ. Кроме того, биополимер «NeuroGel»™ имеет в своем составе запрещенные к применению для человека ингредиенты.
Известен также универсальный гетерогенный коллагеновый матрикс для имплантации, представляющий собой упругоэластичную массу, полученную из двух источников коллагена, причем один источник является тканью позвоночного животного одного класса, а второй - животного другого класса, и состоящий из двух фаз: твердой - в виде микрогранул из коллагена ткани млекопитающих и жидкой - из денатурированного коллагена ткани птиц. Этот гетерогенный коллагенсодержащий матрикс был предложен для восстановления повреждений мягких тканей и органов путем имплантации (RU 2249462 C1, А61К 38/39, 2005). Этот матрикс принят в качестве прототипа предложенной имплантируемой нейроэндопротезной системы. Имплантация в дефект нервной ткани данного коллагенсодержащего матрикса не позволила добиться полной активации регенераторного потенциала искусственного импланта из-за большого размера микрогранул (300-400 мкм) и их жесткости, что приводило к механической травме и гибели трансплантируемых стволовых клеток.
Технической задачей настоящего изобретения является разработка тканезамещаемой искусственной клеточно-биополимерной нейроэндопротезной системы (ИКБП НЭПС) для хирургической пластики дефектов нервной ткани ГМ и СМ, позволяющей обеспечить стимуляцию регенерации и роста поврежденных аксонов нервных клеток, а также разработка способа получения этой системы и способа проведения реконструктивной нейрохирургической операции для замещения дефектов ГМ, и/или СМ, и/или вегетативной нервной системы млекопитающего с использованием указанной системы, которая далее будет наименоваться имплантируемой нейроэндопротезной системой или сокращенно ИКБП НЭПС.
Указанная задача решается тем, что согласно настоящему изобретению предложена имплантируемая нейроэндопротезная система для замещения дефектов головного и спинного мозга и вегетативной нервной системы млекопитающего при реконструктивных нейрохирургических операциях, представляющая собой упругоэластичную клеточно-биополимерную биологически активную массу, полученную из гетерогенного коллагенсодержащего матрикса для имплантации и биокомпозиции клеточных препаратов из различных типов аутологичных клеток пациента.
Более конкретно, указанная биокомпозиция содержит находящиеся в растворе NaCl нейральные стволовые клетки (НСК), нейроглиальные обкладочные клетки (НГОК), эндотелиальные клетки с маркером CD34+(ЭК) и очищенные мононуклеары (МН) при следующем соотношении компонентов (в частях по количеству клеток): НСК - 0,8-1,2; НГОК - 1,6-2,4; ЭК - 4-6; МН - 4000-6000. Использован преимущественно 0,5-1,3%-ный раствор NaCl. В качестве гетерогенного коллагенсодержащего матрикса использована преимущественно композиция гетерогенного имплантируемого геля "Сферо®ГЕЛЬ".
Указанная биокомпозиция может дополнительно содержать стимуляторы клеточной регенерации и факторы роста нервов и сосудов. Наиболее оптимальным, эффективным и безопасным (с учетом коэффициента набухания матрикса "Сферо®ГЕЛЬ") является состав ИКБП НЭПС, когда она содержит следующее количество клеток в 0,5-1 мл 0,9%-ного раствора NaCl из расчета на 1 мл гетерогенного коллагенсодежащего матрикса: НСК - 106; НГОК - 2·106; ЭК - 5·106; МН - 5·109, а также 0,1-0,2 мл стандартного раствора стимулятора клеточной регенерации (метилурацил, лейкоген, АТФ, пентоксил и т.д.).
Указанная задача решается также тем, что предложен способ получения имплантируемой нейроэндопротезной системы для замещения дефектов головного и спинного мозга и вегетативной нервной системы млекопитающего при реконструктивных нейрохирургических операциях, включающий в себя перфузирование биокомпозиции клеточных препаратов из различных типов аутологичных клеток пациента в гетерогенный коллагенсодержащий матрикс для имплантации с получением упругоэластичной клеточно-биополимерной биологически активной массы.
Перфузирование проводят преимущественно путем центрифугирования. Центрифугирование проводят преимущественно в течение 1,5-2,5 минут при скорости 1500-2500 об/мин. Указанную биокомпозицию готовят из криоконсервированных клеточных препаратов, которые непосредственно перед получением имплантируемой нейроэндопротезной системы размораживают на водяной бане при температуре 37-40°С и затем не менее двух раз промывают в физиологическом растворе NaCl.
Более конкретно, указанная биокомпозиция содержит находящиеся в растворе NaCl нейральные стволовые клетки (НСК), нейроглиальные обкладочные клетки (НГОК), эндотелиальные клетки с маркером CD34+(ЭК) и очищенные мононуклеары (МН). Источником НСК и НГОК является преимущественно обонятельная выстилка носа пациента, а источником ЭК и МН - костный мозг пациента или лейкоконцентрат мобилизованных аутологичных стволовых клеток пациента, полученный при сепарации периферической крови после стимуляции пациента гранулоцитарным колониестимулирующим фактором. В указанную биокомпозицию могут быть добавлены стимуляторы регенерации тканей и факторы роста нервов и сосудов. Предложенный способ получения ИКБП НЭПС проводят в стерильных условиях или непосредственно в операционной (ex temporo) или в культуральной лаборатории (срок имплантации до 6 часов).
Указанная задача решается также тем, что предложен способ проведения реконструктивной нейрохирургической операции для замещения дефектов головного и/или спинного мозга и/или вегетативной нервной системы млекопитающего, включающий в себя имплантацию в дефект нервной ткани нейроэндопротезной системы в виде упругоэластичной клеточно-биополимерной биологически активной массы, полученной из гетерогенного коллагенсодержащего матрикса для имплантации и биокомпозиции клеточных препаратов из различных типов аутологичных клеток пациента.
Более конкретно, указанная биокомпозиция содержит находящиеся в растворе NaCl нейральные стволовые клетки (НСК), нейроглиальные обкладочные клетки (НГОК), эндотелиальные клетки с маркером CD34+(ЭК) и очищенные мононуклеары (МН). В качестве гетерогенного коллагенсодержащего матрикса используют преимущественно композицию гетерогенного имплантируемого геля "Сферо®ГЕЛЬ". Нейроэндопротезную систему имплантируют путем ее помещения в дефект по типу «пломбирования» с заполнением ею всего объема кисты или повреждения головного и/или спинного мозга. После помещения нейроэндопротезной системы в дефект ее закрывают аутологичной мышечной фасцией или искусственной твердой мозговой оболочкой и/или биодеградируемой синтетической полимерной оболочкой для ограничения контакта нейроэндопротезной системы с ликвором пациента. В качестве биодеградируемой синтетической полимерной оболочки используют преимущественно имплантируемую биополимерную мембрану "ЭластоПОБ"®. При полном анатомическом перерыве спинного мозга нейроэндопротезную систему имплантируют путем формирования кондуита из искусственного протеза артерии и нейроэндопротезной системы, которой по меньшей мере частично заполняют этот протез, помещения кондуита в зону диастаза между концами поврежденного спинного мозга и последующего подшивания мягкой оболочки дистального и проксимального концов поврежденного спинного мозга к стенкам кондуита. Длину искусственного протеза артерии выбирают равной длине диастаза, а ширину этого протеза - диаметру спинного мозга в месте повреждения. При интрамедуллярной или интрацеребральной имплантации нейроэндопротезную систему изолируют от прямого ударного воздействия спинномозговой жидкости.
Имплантируемая биополимерная мембрана "ЭластоПОБ"® изготавливается ЗАО «Биомир-сервис» (Москва) согласно ТУ 9398-002-54969743-2006, рег. уд. № ФС 01032006/5581-06 от 28.12.2006 г.
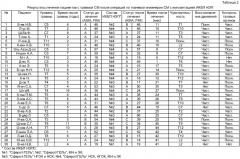
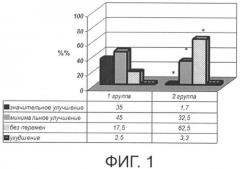
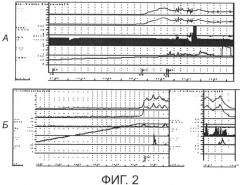
Эффективность использования ИКПБ НЭПС по настоящему изобретению поясняется диаграммами:
на фиг.1 изображена диаграмма, иллюстрирующая эффективность лечения больных с травматической болезнью ГМ и СМ способом по настоящему изобретению и традиционным способом;
на фиг.2 - урограммы больного до (А) и после (Б) имплантации ИКБП НЭП по настоящему изобретению.
Консистенция и биоструктура предложенной ИКБП НЭПС обеспечивают адекватное моделирование нейроимпланта в поврежденных участках мозга и локальную стимуляцию процессов регенерации в патологических зонах ГМ и СМ. Применение для биокомпозиции в ИКБП НЭПС препаратов только из аутологичных клеток позволяет избежать проблем гистосовместимости и иммунного конфликта, а также необходимости применения иммуносупрессоров. При этом отсутствуют этические, юридические и моральные ограничения, т.к. для лечения используются только собственные клетки пациента. Исключен риск заражения пациента инфекционными и вирусными заболеваниями. Также исключен риск заражения прионами, возможный при использовании ксеногенных донорских клеточных препаратов. Конкретное количество используемой ИКБП НЭПС определяется в зависимости от объема, характера и места повреждения мозга.
Базовым элементом создания предложенной ИКБП НЭПС явилась разработка и производство полимерного матрикса, который соответствовал бы специфичным требованиям "моста" между поврежденными участками ГМ или СМ, выполнял бы опорные и питательные функции для клеточных препаратов и направляющего вектора для аксонов пострадавших аутонейронов и нейроглиальных клеток, способствовал стимуляции регенерации поврежденных аксонов и обеспечивал их прорастание через зону дефекта нервной ткани, препятствуя процессам «спраутинга» (скручивания). Предлагаемый матрикс должен соответствовать критериям безопасности и биодеградировать в заданный интервал времени (8-12 месяцев) на безопасные компоненты, замещаясь восстановленной нервной тканью.
Предпочтительной для использования в предложенной ИКБП НЭПС является матрикс в виде композиции гетерогенного имплантируемого геля, имеющей торговое наименование "Сферо®ГЕЛЬ", защищенное свидетельством РФ на товарный знак №269774 и изготавливаемой ЗАО «Биомир сервис» (г.Москва) согласно ТУ 9398-001-54969743-2006 от 26.12.2006 г., рег. уд. № ФС 01032006/5580-06 от 28.12.2006 г.
Матрикс "Сферо®ГЕЛЬ" состоит из микрочастиц полученного от сельскохозяйственных животных сшитого коллагена VII типа, распределенных в упругом однородном геле, и представляет собой уникальный комплекс пептидов (30-50 мг/г), уроновых кислот (0,8-1,2 мг/г) и гексозаминов (2,0-3,0 мг/г). По аминокислотному составу он идентичен коллагену, но превосходит его по содержанию гексозаминов в 2 раза, а уроновых кислот более чем в 15 раз. Матрикс Сферо®ГЕЛЬ устойчив при длительном хранении и не склонен к явлениям синерезиса (выделение жидкой фазы). В таком состоянии он не смешивается с водой и гидрофобными жидкостями. При температуре 37°С этот гель превращается в жидкость, смешивающуюся во всех соотношениях с водой и микрочастицами сшитого коллагена. Размер микрочастиц в геле можно менять от 30 до 300 мкм. Набухаемость матрикса "Сферо®ГЕЛЬ" не менее 87%, рН 4,8-7,2. Среднее время биорезорбции в организме - от нескольких недель до 9 месяцев в зависимости от места имплантации и размера микрочастиц. Экспериментально доказаны и клинически подтверждены высокие биосовместимые и биостимулирующие свойства биополимерного имплантата "Сферо®ГЕЛЬ", способствующие восстановительным процессам в местах повреждения тканей. Доклинические и клинические исследования проводили ФГУ НИИ трансплантологии и искусственных органов, ЗАО Клиника «НейроВита», Больница РАН (г.Троицк), ГКБ Гражданской авиации, ГКБ им.Боткина СП.
Клинические исследования доказали высокие функциональные свойства матрикса "Сферо®ГЕЛЬ" в качестве:
- биоактивной искусственной синовиальной жидкости при терапевтическом лечении деформирующих артрозов коленных суставов;
- имплантатов при хирургическом лечении нарушений проводимости периферических нервов;
- имплантируемых носителей для трансплантации и локализации стволовых клеток при лечении травм спинного мозга.
Именно матрикс "Сферо®ГЕЛЬ" после трехлетних испытаний на животных в ЗАО Клиника «НейроВита» на экспериментальной модели травмы спинного мозга стал основой предложенной нейроэндопротезной системы. В последующем при экспериментальной и клинической апробации матрикса "Сферо®ГЕЛЬ" в него было предложено перфузировать определенный состав клеточных элементов, формируя клеточную композицию со стимуляторами тканевой регенерации. Главной проблемой создания ИКБП НЭПС была необходимость нахождения основных ингредиентов клеточной биокомпозиции и определения их количества в 1 мл биодеградируемого матрикса "Сферо®ГЕЛЬ".
Эндотелиальные клетки с маркером CD34+(ЭК) и нейральные стволовые клетки (НСК) обладают направленной миграцией к зонам повреждения. Трансплантированные клетки формируют кластеры прогенираторных клеток в ткани мозга. Этот феномен стал ключевым в решении вопроса регенерации поврежденного мозга. Однако только после длительного экспериментального этапа на животных и проведения 32 операций на человеке удалось найти необходимое сочетание биополимера с клеточным составом и стимуляторами регенерации, которое позволило добиться максимального клинического и нейрофизиологического эффекта от проведения операций по тканевой инженерии мозга, что и позволило говорить о создании открытых ИКБП НЭПС.
ИКБП НЭПС является искусственным аналогом нервной ткани, содержащим ее основные клеточные элементы (нейроны, нейроглиальные клетки, эндотелиоциты и т.д.) и полимерную матрицу с заданными параметрами биодеградации (от 8 до 12 месяцев). Консистенция и биопластичность ИКПБ НЭПС позволяют осуществить адекватное моделирование нейроимпланта в поврежденных анатомических структурах мозга, а также обеспечить локальную стимуляцию процессов регенерации в зоне повреждения. ИКПБ НЭПС способна выполнять опорные функции «моста» и «питательной среды» для прорастания поврежденных аксонов нервных клеток через патологически измененные участки ткани мозга.
НСК, находящиеся в биокомпозиции предложенной ИКПБ НЭПС, способны реконструировать поврежденную нервную ткань и в первую очередь обеспечить восстановление серого вещества спинного мозга, а НГОК могут стимулировать дифференцировку клеток предшественников крови в астроциты и олигодендроциты, которые могут воссоздавать белое вещество и быть источником клеток, способных осуществить ремиелинизацию поврежденных аксонов. Добавление в биокомпозицию гемопоэтических стволовых клеток (CD34+CD45-), получивших вектор дифференцировки в эндотелиоциты, т.е. являющихся источником ЭК, способствует образованию новых сосудов, позволяет быстро сформировать в эндопротезе микрокапиллярную сосудистую сеть, улучшить локальный кровоток. Применение в клеточной биокомпозиции стволовых негемопоэтических клеток, находящихся в мононуклеарной фракции (МН) периферической крови после стимуляции колониестимулирующими факторами, позволяет добиться продуцирования большого количества факторов роста, которые являются самым эффективным средством регенерации аксонов.
Практическое применение в клинической практике различных клеточных препаратов в матриксе "Сферо®ГЕЛЬ" показало, что наилучшие клинические и нейрофизиологические результаты получаются не при изолированном применении матрикса и интрацеребральной или интрамедуллярной трансплантации отдельных клеточных культур, а при определенном количественном соотношении этих клеточных препаратов в матриксе "Сферо®ГЕЛЬ", что позволило создать специфичное искусственное микроокружение поврежденным аксонам, близкое по клеточной структуре к естественной ткани развивающегося мозга.
Приготовление суспензии культивированных НГОК и НСК осуществляется по стандартной методике. Источником этих клеток является фрагмент обонятельной выстилки носа пациента, взятый путем отоларингологической эндоскопической хирургической манипуляции. Получение препарата гемопоэтических стволовых клеток, являющихся источником ЭК, а также негемопоэтических стволовых клеток, находящихся в мононуклеарной фракции (МН), осуществляется в соответствии с технологией, описанной в RU № 2283119 и в регистрационном удостоверении Федеральной службы по надзору в сфере здравоохранения и социального развития № ФС-2006-/151 от 01.07.2006.
Предложенные способ получения ИКБП НЭПС и способ проведения нейрохирургической операции могут осуществляться только в условиях нейрохирургической операционной хирургического отделения и отделения анестезиологии и реанимации многопрофильного лечебно-профилактического учреждения, имеющего лицензию на медицинскую деятельность по высоким технологиям в неврологии, нейрохирургии, забору гемопоэтических клеток и применению клеточных технологий специалистами-нейрохирургами и анестезиологами-реаниматологами, прошедшими подготовку по применению клеточных технологий. Лечебно-профилактическое учреждение должно быть оснащено современными средствами диагностики (МРТ, спиральная компьютерная томография, ангиографическая техника, цитофлуориметр, сепаратор крови) или иметь договора с учреждениями, имеющими эти средства. Лаборатория, в которой осуществляется сертификация и паспортизация аутологичных гемопоэтических стволовых клеток периферической крови (АГСКПК), НСК, НГОК и ЭК должна быть лицензирована как лаборатория, имеющая право на применение клеточных технологий, соответствовать требованиям GLP-стандарта (Good Laboratory Practice - надлежащая лабораторная практика) и иметь возможность для проведения полного анализа клеточного препарата в объеме, рекомендуемом европейским регистром трансплантации стволовых клеток костного мозга. Лаборатория должна иметь возможность проводить тесты на стерильность биопрепарата, токсичность, культуральные работы с данным биоматериалом, т.е. иметь в оснащении стерильный бокс с ламинарным шкафом, СО2-инкубатор, бифокальный микроскоп и набор реактивов для культуральных работ. Специалисты должны иметь дополнительную специализацию по трансфузиологии.
Технология использования предложенной ИКБП НЭПС складывается из выполнения ряда последовательных стадий:
I - специализированное обследование пациента;
II - забор и подготовка биоматериала (включает в себя предложенный способ получения ИКБП НЭПС) и
III - реконструктивная нейрохирургическая операция на СМ или ГМ с интраоперационной подготовкой ИКБП НЭПС и ее имплантацией.
Стадия 1. Специализированное обследование пациента
На этой стадии проводится обязательное клиническое и параклиническое обследование пациента по стандартному протоколу. Проводится анализ диагностических параметров патологического очага, разрабатывается стратегия проведения тканевой инженерии ГМ или СМ, устанавливаются показания и противопоказания для проведения имплантации ИКБП НЭПС, сроки проведения каждого этапа с учетом данных проведенного обследования. При необходимости осуществляется математическое моделирование клеточной трансплантации и планирование объема клеточного препарата для подготовки ИКБП НЭПС по данным МРТ. Данная стадия не должна носить характера формального проведения анализов и обследований. Именно на этой стадии определяются абсолютные и относительные противопоказания, четко определяется медицинский и социальный прогноз операции по тканевой инженерии ГМ и СМ для больного. Поскольку планируется интрамедуллярное и (или) интрацеребральное погружение клеточных препаратов НСК и НГОК, основное внимание должно быть уделено иммунохимическому состоянию крови и ликвора пациента. Дополнительное внесение нейроспецифических белков при трасплантации нейронов и нейроглиисодержащих клеток во время операции и исходное высокое наличие нейроспецифических антигенов в крови и ликворе пациента может способствовать усилению собственного деструктивного процесса мозга. В то же время привнесение нейроспецифических белков при трасплантации нейрональных и нейроглиисодержащих клеток во время операции и исходное наличие антител к нейроспецифическим антигенам в крови и ликворе пациента может способствовать запуску или усилению аутоиммунного процесса, а в ряде случаев и аутоиммунному лизису поврежденной ткани. Нецелесообразно рассматривать в качестве кандидатов на подобные операции пациентов с наличием антител к нейроспецифическим белкам и иммунологическим дефицитом.
Стадия II. Забор и подготовка биоматериала
Композиция гетерогенного имплантируемого геля Сферо®ГЕЛЬ
Композиция "Сферо®ГЕЛЬ" изготавливается по способу, описанному в указанном патенте РФ (RU 2249462). Выпускается в инъекционной форме в шприцах по 1, 2 и 5 мл.
При комнатной температуре гетерогенный матрикс "Сферо®ГЕЛЬ" представляет собой упругоэластичную массу, устойчивую при длительном хранении и не склонную к явлениям синерезиса (выделение жидкой фазы). При температуре 37°С вязкость биополимерного матрикса за счет слабо сшитого жидкого компонента резко уменьшается, при этом физическое состояние глобулярного (твердого) компонента не меняется. Полученный матрикс имеет достаточно низкую иммуногенность.
В качестве дополнительных компонентов, непосредственно перед операцией в матрикс можно вводить антибиотики, антисептики, стимуляторы регенерации и антисвертывающие препараты. Антибиотиками могут быть пенициллины (например, бензилпенициллин, клоксациллин, ампициллин), цефалоспорины (например, цефалоридин, цефуроксим, цефотетан, цефтазидин), карбопенемы (например, мерапенем), монобактамы (например, азтреонам), аминогликозиды (например, стрептомицин, гентамицин, амикацин), тетрациклины (например, тетрациклин, миноциклин), макролиды (например, эритромицин, азитромицин), линкозамиды (например, линкомицин), антибиотики пептидной группы (например, полимиксин В, полимиксин М, ристомицин, бацитрацин). В качестве стимуляторов клеточной регенерации можно использовать, например, метилурацил лейкоген, аденинтрифосфорную кислоту (АТФ), пентоксил, калия оротат, рибоксин, этаден.
В композицию "Сферо®ГЕЛЬ" можно дополнительно внести также антибактериальные и антивирусные компоненты, а также антиагрегационные препараты. Стимуляторы клеточной регенерации перфузируются в "Сферо®ГЕЛЪ" непосредственно в операционной в объеме не более 0,2 мкл на 1 мл матрикса.
Введенный непосредственно в зону дефекта матрикс "Сферо®ГЕЛЬ" со временем заменяется исходной тканью без образования рубцовой ткани.
Преимуществами матрикса "Сферо®ГЕЛЬ", используемого для имплантации в поврежденный головной и спинной мозг, являются:
- многофункциональность (опорная и трофическая функция для клеточных культур, стимулирует регенерацию аксонов и неоваскуляризацию);
- высокая биосовместимость на белковом и клеточном уровне как готового изделия, так и продуктов биодеградации;
- способность стимулировать пролиферацию и дифференциацию нервных клеток;
- регулируемое время биодеградации от нескольких недель до нескольких месяцев (конечными продуктами биодеградации являются углекислый газ и вода);
- способность к порообразованию непосредственно при контакте с биологическими средами, обеспечивающая процессы неоваскуляризации);
- возможность стерилизации без изменения медико-технических свойств.
Подготовка и получение биокомпозиции клеточных препаратов
Получение стволовых клеток
Процедуру условно разделяют на две части - мобилизацию стволовых клеток в периферическую кровь и сбор стволовых клеток.
Мобилизация стволовых клеток в периферическую кровь
С целью увеличения количества стволовых клеток в периферической крови донор получает 8 инъекций гранулоцитарного колониестимулирующего фактора (Г-КСФ), подкожно с интервалом в 10-12 часов в течение 4 дней. Г-КСФ представляет собой медицинский препарат, полученный путем генной инженерии, и является абсолютным аналогом человеческого фактора. В первые три дня доза препарата составляет 2,5 мкг/кг, в последний день доза удваивается. Ежедневно производят общий анализ крови и на 4-5-й день делается УЗИ брюшной полости.
Сбор стволовых клеток
Осуществляется на 5-й день от начала стимуляции Г-КСФ на сепараторе крови типа СОВЕ-спектра с использованием одноразовой системы для сепарации и стандартных растворов. Длительность процедуры 3-4 часа в зависимости от скорости процедуры, веса пациента и параметров анализа крови. Процедура проводится путем забора крови из одной вены, обработки крови внутри сепаратора, забора определенного объема стволовых клеток и возврата остальных компонентов крови донору через другую вену. Венозный доступ осуществляется путем пункции 2-х периферических вен или через двухпросветный центральный катетер, установленный в подключичную вену на время проведения сеанса. Средний объем собранного материала 300-400 мл. Собранный материал оценивают по двум параметрам: по общему количеству ядерных клеток (ЯК) в сепарате и по количеству СД34+ клеток на килограмм веса больного. ЯК в сепарате определяют путем подсчета в камере Горяева до проведения каких-либо манипуляций. Процент СД34+ клеток в клеточной суспензии, полученной в ходе цитафереза, определяют методом проточной цитофлуориметрии.
Определение периферических стволовых клеток
Установление субпопуляционного состава CD34+ клеток проводится цитофлуориметрически с применением метода тройной метки (одновременная окраска клеток антителами к 3-м разным антигенам, нагруженными различными флуорохромными красителями).
Стандартизация препарата
Определение количества клеток-предшественниц проводится
цитофлуориметрически, в прямой реакции иммунофлуоресценции (РИФ).
Используется метод двойной метки с одновременным окрашиванием клеточного субстрата моноклональными антителами (МКА) к антигену CD34 - основному маркеру клеток пула стволовых гемопоэтических клеток и к молекуле CD45 -общелейкоцитарному антигену, определяющему все гемопоэтические клетки. Подобная методика позволяет сразу рассчитать соотношение количества CD34+ клеток и всех гемопоэтических (CD45+) клеток в материале.
Для оценки уровней неспецифического связывания часть клеток окрашивают изотипическими контролями. В качестве изотипических контролей стандартно применяются мышиные иммуноглобулины IgGl изотипа (IgGl), меченные красителями, аналогичными метке используемых моноклональных антител (РЕ, FITC, PerСР).
Подготовка клеточных проб
Перед постановкой реакции клетки периферической крови и цитаферезного продукта освобождают от примеси эритроцитов путем стандартной процедуры лизиса и последующей отмывки в забуференном физиологическом растворе с добавлением бычьего сывороточного альбумина (ЗФР-БСА) центрифугированием при 1000 г в течение 5 минут.ЗФР-БСА может быть заменен средой Хенкса или 199.
Методика лизиса эритроцитов:
1. Добавить 2 мл лизирующего раствора к 0,2-0,5 мл клеточного осадка, перемешать, инкубировать до тех пор, пока раствор не станет прозрачным (лаковым).
2. Отмыть клетки 2 раза средой 199 центрифугированием (1000 г, 5-7 мин).
С выделенными клетками проводят прямую РИФ в 96-луночном планшете, при этом для определения количества АГСКПК в любом материале используется панель из 3-х лунок:
- неокрашенные клетки;
- клетки, окрашенные изотипическими контролями с меткой, соответствующей метке использованных МКА;
- клетки, окрашенные одновременно МКА к антигенам CD34 и CD45.
Следует обратить особое внимание на то, что МКА к CD34+ предпочтительнее использовать с фикоэритриновой (РЕ) или перидининхлорофиловой (PerСР) метками. Данные флуорохромы имеют более высокий уровень специфического сигнала по сравнению с флуоресцеинизотиоционатом (FITC).
Для определения количества CD34+клеток оптимальными являются антитела к антигену CD34 клона НРСА-2 (8G12), изотипа IgGl.
Таким образом, стандартная панель имеет вид:
1. контроль IgGl РЕ+ контроль IgGl FITC;
2. контроль IgGl РЕ+МКА к CD45 FITC;
3. МКА к CD34 РЕ (НРСА-2)+МКА к CD45 FITC.
Постановка РИФ
1. В лунки вносятся клетки в количестве не менее 500000 на лунку.
2. Далее в каждую лунку вносят коктейль антител в соответствии с панелью и аккуратно ресуспендируют пипеткой. Каждое МКА берут в количестве 10 мкл на лунку, суммарный объем МКА в лунке - 20 мкл.
3. Клетки инкубируют с антителами в течение 30 минут при 4°С (нижняя полка обычного холодильника).
4. По окончании времени инкубации клетки дважды отмывают от несвязавшихся антител путем центрифугирования в течение 5-7 минут при 1000 г.
5. Клетки переносят в специальные пластиковые пробирки для счета на проточном цитометре.
6. Объем клеточной суспензии в каждой пробирке доводят до 200-500 мкл путем добавления к клеткам ЗФР-БСА.
Счет должен быть осуществлен сразу после постановки реакции.
Счет и запись на проточном цитофлуориметре
Оценку реакции проводят на проточном 5-параметровом цитометре. Данная схема применима для проточного цитофлуориметра любой конфигурации.
CD34+ клетки в периферической крови представляют собой малую клеточную популяцию. Даже в условиях предварительной стимуляции кроветворения максимальный процент данных клеток составляет 1,0-3,0%. Поэтому при подсчете данных клеток в каждой анализируемой пробе следует накапливать не менее 20000 клеточных событий.
Сбор и анализ клеток осуществляется в гейте CD45+ клеток, который включает все гемопоэтические клетки. В данном контексте гейт подразумевает область накопления событий, ограниченную определенными параметрами. В данном случае SSC/FL-1 (CD45 FITC). То есть по оси абсцисс (FL-1) на точечной цитограмме будут видны все CD45+ события. По оси ординат (параметр SSC - боковое светорассеяние) клеточные события будут расположены в соответствии с их гранулярностью (цитометрический, а не морфологический термин).
Подсчет абсолютного числа СD34+ клеток в 1 мкл крови и цитоконцентрата проводили на основании числа лейкоцитов в гемограмме на день исследования.
Принцип определения CD34+ клеток в гемопоэтической ткани. Запись проб
1. Выбор области анализа - гейта.
В приборе открыто меню записи клеточных образцов Acquisition. На первом этапе в режиме setup (режим просмотра клеточного образца без записи) просматриваются пробы № 1 (IgGlPE+IgGl FITC) и № 2 (IgGl РЕ+CD45 FITC) и выявляются CD45+ события. Данные события расположены правее значений 101 (среднее пороговое значение уровня специфического сигнала для флуоресцеина FITC) по оси абсцисс - FL-1 (СВ45+ клетки) и достаточно четко визуализируются по сравнению с контрольной пробой № 1.
По пробе № 1 ограничивается вся область, расположенная правее основной клеточной плотности - гейт, включающий только CD45+ события в пробе № 2 и содержащий минимальное количество клеточных событий в пробе № 1.
2. Прибор переводится в режим записи образцов (normal) и проба № 1 собирается и записывается на 20000 клеточных событий без гейта (вся клеточная популяция). Запись данной пробы в гейте не имеет смысла, так как в ней отсутствуют МКА к CD45 антигену. Как указано выше, данная проба необходима для правильного выбора гейта, содержащего только CD45+события.
3. Пробы № 2, 3 собираются и записываются в гейте CD45+. Данный гейт идентичен и для 2-й, и для 3-й пробы, т.е. в процессе сбора изменения параметров гейта не происходит. Минимальное количество клеточных событий - 20000 для каждой пробы.
Анализ записанных проб
1. Переходим в меню анализа записанных образцов Analysis. Открываем цитограмму (dot-plot) пробы №2 в параметрах SSC/FL-2, в гейте R1 - CD45+ (гейт выбран нами ранее в момент записи сбора и автоматически перенесен в режим анализа). При этом по оси ординат будет отражен параметр SSC - гранулярность событий, попавших в анализируемый гейт, а по оси абсцисс FL-2 - детектор, отражающий уровни неспецифического связывания для фикоэритринового красителя, выявляемые антителами к иммуноглобулинам мыши IgGl РЕ.
2. По данной цитограмме устанавливается контрольный маркер таким образом, чтобы в правом нижнем квадранте практически не оказалось клеточных событий. В среднем, для вертикальной планки маркера, значения будут около 130 (правее 102), а для горизонтальной планки маркера средние значения составят 60, что соответствует понятию SSC-low, т.е. клетки с минимальным количеством клеточных включений. Таким образом, уровни неспецифического связывания будут равны или близки к нулю.
3. Автоматически переходим к пробе № 3. Все показания прибора, принятые для второй пробы, сохраняются. То есть цитограмма открыта в параметрах SSC/FL-2, сохранен гейт, выбранный ранее при сборе по CD45+клеточным событиям, и сохранены значения контрольного маркера, установленного по пробе №2. Только на данной цитограмме по оси абсцисс будут отражены не уровни неспецифического связывания, как во второй пробе, а специфичные CD34+ события. Процент CD34+ клеток выводится прибором автоматически.
Криоконсервирование АГСКПК
Выделение фракции АГСКПК
Сепарированные клетки концентрируются путем центрифугирования на скорости 2000 об/мин в течение 10 мин при +18°С. С помощью ручного плазмоэкстрактора из контейнера максимально удаляется плазма, клетки остаются в объеме 40-60 мл.
Добавление криопротектора
В качестве криопротектора кроветворных клеток используется высокоочищенный диметилсульфоксид (ДМСО). К полученным клеткам добавляют при постоянном перемешивании равный объем полиглюкина с ДМСО. Смешивание ДМСО с полиглюкином происходит по типу экзотермической реакции с выделением умеренного количества тепла. Концентрация ДМСО в полиглюкине - 10-12%. Таким образом, его конечная концентрация в замораживаемом материале составит 5-6%.
Применение полиглюкина позволило снизить количество ДМСО вдвое, до 5-6% конечной концентрации, так как полиглюкин способен дезагрегировать клетки и тем самым улучшать проникновение криофилактика в клетки, а кроме того, полиглюкин (6% декстран) сам по себе является криофилак