Лекарственные средства для лечения хронического респираторного заболевания
Иллюстрации
Показать всеПредложено применение теофиллина и стероида для изготовления композиции для лечения хронического обструктивного заболевания легких (ХОБЛ), где теофиллин вводят в дозе, которая достигает уровней в плазме ниже чем 5 мг/л (т.е. вводят орально в дозе 3 мг/кг или менее), и доза стероида ниже 0,5 мг/кг, а также соответствующие способ лечения, фармацевтическая композиция в стандартной лекарственной форме и набор того же назначения. Показан синергизм действия данной комбинации в дозах, которые отдельно неэффективны для лечения ХОБЛ, а концентрации в плазме крови ниже тех, что обычно ассоциируются с противовоспалительной активностью. 4 н. и 12 з.п. ф-лы, 7 ил., 2 табл.
Реферат
Настоящее изобретение относится к применению метилксантиновых производных, таких как теофиллин, и стероидных лекарственных средств в синергической комбинации для лечения хронического обструктивного заболевания легких (ХОБЛ). Введение стероидов и теофиллина в комбинации, в дозах, при которых каждый отдельный компонент не имеет противовоспалительного эффекта или имеет минимальный противовоспалительный эффект, приводит в результате к терапевтическому синергическому противовоспалительному ответу.
Введение
Теофиллин представляет собой недорогой белый кристаллический порошок, используемый в качестве перорального средства для лечения хронических респираторных заболеваний, таких как астма и ХОБЛ. Аминофиллин, или этилендиамин теофиллина, представляет собой комбинацию теофиллина и этилендиамина и имеет сходные свойства. Теофиллин, как известно, имеет бронходилатирующий эффект и мягкий противовоспалительный эффект, частично вследствие его активности в качестве слабого неселективного ингибитора фосфодиэстеразы (PDE). До настоящего времени данное лекарственное средство характеризовалось узким терапевтическим индексом, и токсичность данного средства, выраженная гастроинтестинальным расстройством, тремором, сердечными аритмиями и другими осложнениями, обычна в клинической практике. Другие лекарственные средства для лечения хронических респираторных заболеваний, таких как ингалируемые бета-агонисты и ингалируемые стероиды, часто назначаются вместо теофиллина, чтобы избежать его побочных эффектов.
Хотя теофиллин много лет имел клиническое применение, молекулярный механизм его действия и участок его действия оставаются неопределенными. Предложено несколько молекулярных механизмов его действия, включая следующие.
Теофиллин представляет собой слабый и неселективный ингибитор фосфодиэстераз, который расщепляет в клетке циклические нуклеотиды, таким образом, его действие приводит к повышению концентраций циклического АМФ и ГМФ. Теофиллин расслабляет гладкую мускулатуру воздушных путей путем ингибирования активности PDE (PDE3, PDE4 и PDE5), но для максимальной релаксации нужны относительно высокие концентрации (Rabe et al. Eur Respir J 1999, 8: 637-42). Степень ингибирования PDE очень мала при концентрациях теофиллина, которые терапевтически релевантны. Не имеется доказательств того, что теофиллин имеет какую-либо избирательность в отношении какого-либо конкретного изофермента, такого как, например, PDE4B, преобладающего изофермента PDE в воспалительных клетках, который опосредует противовоспалительные эффекты в воздушных путях.
Теофиллин представляет собой мощный ингибитор аденозиновых рецепторов в терапевтических концентрациях с антагонизмом в отношении А1- и А2-рецепторов, хотя он менее эффективен в отношении А3-рецепторов (Pauwels, R.A., Joos, G.F. Arch Int Pharmacodyn Ther 1995, 329: 151-60).
Теофиллин повышает высвобождение интерлейкина-10, который имеет широкий спектр противовоспалительных эффектов. Данный эффект может опосредоваться через ингибирование PDE, хотя он не наблюдался в дозах, которые эффективны при астме (Oliver et al. Allergy 2001, 56: 1087-90).
Теофиллин предотвращает транслокацию провоспалительного фактора транскрипции ядерного фактора κB (NF-κB) в ядро, таким образом, потенциально снижая экспрессию воспалительных генов при астме и COPD (Tomita et al. Arch Pharmacol 1999, 359: 249-55). Данные эффекты наблюдаются при высоких концентрациях и могут также опосредоваться ингибированием PDE.
Более того, теофиллин, как недавно было показано, активирует гистондезацетилазу (HDAC). Ацетилирование гистоновых белков ассоциировано с активацией функции гена, и полагают, что провоспалительные факторы транскрипции, которые активируют воспалительные гены, также вызывают повышение активности гистонацетилтрансферазы. Повышая активность HDAC и, таким образом, дезацетилируя гистоновые белки, теофиллин, как полагают, подавляет экспрессию воспалительных генов (см. Barnes (2003) Am J Respir Crit Care Med 167:813-818).
Глюкокортикоидные лекарственные средства (стероиды) стали терапией выбора при астме и широко используются при лечении COPD, обычно в ингалируемой форме. Однако, хотя ингалируемые стероиды эффективны у большинства пациентов с астмой, их применение при ХОБЛ спорно вследствие отсутствия их способности демонстрировать противовоспалительный эффект (Culpitt S.V. et al. (1999) Am. J. Respir. Crit. Care Med. 160, 5 Pt 1, 1635-1639), и явной неспособности влиять на прогрессию заболевания (Burge et al. (2000) BMJ 320: 1297-1303). Пациентам с астмой, которые не могут отвечать на низкие дозировки стероидов, вводят более высокую дозу, в случае будезонида до 1600 мкг ежесуточно.
Evans et al. (2004) NEJM 337:1412 предполагают, что высокие дозы ингалируемых стероидов могут замещаться введением нормальной дозы глюкокортикоидов, вместе с низкой дозой теофиллина для применения при астме. Пациентам вводили 400 мкг будезонида (стандартная доза) вместе с 250 или 375 мг теофиллина, или 800 мкг будезонида плюс плацебо, дважды в сутки. Концентрации теофиллина в плазме, которые достигались в данном исследовании, изменялись от 2,5 до 17,1 мг/л при среднем значении 8,7 мг/л - эфекты данных двух парадигм лечения имели сходные соображения, состоящие в том, что теофиллин имеет эффекты умеренных доз при введении со стероидом. Однако в используемых дозах пациенты страдали от связанных с лекарством побочных эффектов, включая гастроинтестинальные расстройства, сильные сердцебиения, боли в горле, и другие побочные эффекты, связанные с терапией стероидами и/или теофиллином. Более того, авторы не определили каких-либо эффектов лекарственного средства на воспаление. Сходные исследования, в которых бы изучалось потенциальное взаимодействие между ингалируемыми стероидами и пероральным теофиллином, на пациентах с ХОБЛ не проводились.
Таким образом, имеется необходимость в терапевтическом режиме для ХОБЛ, который предоставлял бы противовоспалительную активность и избегал бы побочных эффектов, ассоциированных с существующей терапией.
Краткое описание изобретения
Настоящее изобретение относится к тому, что стероиды и метилксантиновые соединения, введенные в дозах, которые сами по себе не эффективны при лечении воспаления, индуцированного курением табака (КТ) в модели ХОБЛ на животных, при совместном введении имели синергический эффект и были способны заметно снижать воспаление в указанных моделях на 50% или более, в тестах, описанных ниже. Воздействие КТ признано в качестве принципиальной причины ХОБЛ у людей.
Поэтому в первом аспекте предоставляется применение метилксантинового соединения и стероида для комбинированного использования при производстве композиции для лечения хронического респираторного заболевания, при котором метилксантиновое соединение вводится в дозе, которая отдельно не эффективна при лечении указанного респираторного заболевания, но вместе со стероидом эффективна для снижения воспаления в респираторном тракте. Предпочтительно хроническое заболевание представляет собой ХОБЛ. Предпочтительно хроническое заболевание может включать в себя тяжелую астму и кистозный фиброз.
Изобретение относится к синергической активности метилксантинового соединения и стероидных лекарственных средств, которая приводит к исключительно высокой противовоспалительной активности. Данный синергический эффект достигается с использованием доз лекарственных средств, не эффективных при введении по отдельности - эфект является не аддитивным, но синергическим в том смысле, что два лекарственных средства, не имеющие эффекта или имеющие малый эффект, могут вводиться одновременно с получением высоко значимого ингибирования воспалительной реакции.
Метилксантиновое соединение при использовании данного термина относится к теофиллину и фармакологически эквивалентным соединениям и солям, включая аминофиллин и окстрифиллин. Такие соединения представляют собой метилксантины, которые включают в себя кофеин, теобромин, фурафиллин, 7-пропилтеофиллин-дофамин, энпрофиллин, и тому подобное. Стероидные лекарственные средства включают в себя глюкокортикоиды, кортикостероиды и минералокортикоиды, такие как дексаметазон и будезонид, беклометазон, флунизолид, флутиказон, циклезонид, мометазон, гидрокортизон, преднизон, преднизолон, триамцинолон, бетаметазон, флудрокортизон и дезоксикортикостерон. Стероидные лекарственные средства могут, кроме того, включать в себя стероиды в клинической разработке для лечения ХОБЛ, такие как GW-685698, GW-799943, и соединения, указанные в заявках на выдачу международного патента WO0212265, WO0212266, WO02100879, WO03062259, WO03048181 и WO03042229. Стероидные лекарственные средства могут, кроме того, включать в себя молекулы следующего поколения, находящиеся в разработке, со сниженными профилями побочных эффектов, такие как селективные агонисты глюкокортикоидного рецептора (SEGRA), включая ZK-216348 и соединения, указанные в заявках на выдачу международного патента WO00032585, WO000210143, WO2005034939, WO2005003098, WO2005035518 и WO2005035502.
Предпочтительно, метилксантин представляет собой теофиллин.
По изобретению стероид может вводиться в стандартной дозе, или в дозе, которая не имеет эффекта при введении субъекту независимо от метилксантинового соединения.
Предпочтительно, стероид не эффективен в плане снижения воспаления при указанном респираторном заболевании в используемой дозе. Некоторые респираторные заболевания, включая ХОБЛ, устойчивы к лечению стероидами, и стероидные лекарственные средства неэффективны при снижении воспаления. Вместе с теофиллином, однако, наблюдается противовоспалительный эффект.
Введение может происходить подходящим путем, включая пероральное введение, введение путем ингаляции, путем инъекции, путем введения долгосрочных имплантатов, и тому подобное. Пероральное введение является предпочтительным, особенно в неразвитых странах, где манипуляции с препаратами для инъекций вызывают проблемы, и в применениях пациентом без медицинского надзора. Ингалируемые лекарственные средства, безусловно, знакомы пациентам с хроническими респираторными заболеваниями, такими как астма, где ингаляторы применяются обычно. Предпочтительно, теофиллин вводится перорально.
В другом аспекте изобретение относится к фармацевтической композиции в единичной дозированной форме, включающей метилксантиновое соединение в дозе, недостаточной для эффективности при лечении респираторного заболевания, если данное соединение вводится независимо, и стероид. Такие единичные дозировки могут упаковываться с получением набора для лечения респираторного заболевания, включающего метилксантиновое соединение и стероид в единичной дозированной форме, где метилксантиновое соединение находится в дозе, которой не достаточно для эффективности лечения респираторного заболевания при независимом введении.
Такой набор может включать, например, инструкции для применения, которые указывают пользователю, как вводить лекарственные средства, по существу, одновременно, так чтобы они присутствовали в организме пациента в одно и то же время.
Изобретение далее относится к метилксантиновому соединению и стероиду в единичной дозированной форме, где метилксантиновое соединение находится в дозе, которой не достаточно для эффективности лечения респираторного заболевания при независимом введении, для одновременного, одновременного отдельного или последовательного применения для лечения респираторного заболевания. В наборах или единичных дозировках по изобретению стероид предпочтительно присутствует в дозе, которой не достаточно для эффективности лечения респираторного заболевания при независимом введении.
Изобретение далее относится к метилксантиновому соединению и стероиду в единичной дозированной форме, где метилксантиновое соединение находится в дозе, которой не достаточно для эффективности лечения респираторного заболевания при независимом введении, для одновременного, одновременного отдельного или последовательного применения для лечения респираторного заболевания.
В последующих аспектах изобретения пероральная дозировка метилксантинового соединения, которая не имеет какого-либо терапевтического или фармакологического действия, предпочтительно составляет ниже 5 мг/кг, предпочтительно, от 0,1 до 4 мг/кг, наиболее предпочтительно, от 0,1 до 3 мг/кг. Предпочтительно, доза метилксантина составляет 3 мг/кг или менее. Уровни в плазме, достигаемые данными дозировками метилксантина, ниже, чем те, которые в настоящее время считаются необходимыми для клинической эффективности (10-20 мг/л) (Cazzola et al., (2004) Pulmonary Pharmacology & Therapeutics 17, 141-145).
В последующих аспектах изобретения, доза стероида, которая не проявляет какого-либо ясного фармакологического действия в модели ХОБЛ, предпочтительно, составляет ниже 0,5 мг/кг, предпочтительно, от 0,1 до 0,4 мг/кг, наиболее предпочтительно, от 0,1 до 0,3 мг/кг. Предпочтительно, доза стероида составляет 0,3 мг/кг или менее.
Эффективность лечения может анализироваться по изобретению любым способом, способным оценивать воспаление. В предпочтительном осуществлении лечение респираторного заболевания оценивается путем подсчета клеток, полученных путем бронхоальвеолярного лаважа (BAL). Воспаление также может оцениваться в мокроте или в биопсиях эпителия бронхов.
Предпочтительно клетки выбирают из группы, состоящей из макрофагов, эпителиальных клеток, нейтрофилов, эозинофилов и лимфоцитов. Изобретение относится, по существу, к снижению воспаления при респираторных заболеваниях. Предпочтительно, после введения соединения метилксантина и стероида количество клеток снижается на 50% или более, предпочтительно, на 70% или более.
В то же время, индивидуальные дозы метилксантинового соединения и стероида могут преимущественно снижать число клеток при совместном введении всего до 40% или менее, предпочтительно до 30% или менее, и в идеале до 20% или менее. Там, где синергическое снижение числа клеток после введения метилксантинового соединения и стероида составляет 70% или более, аддитивный эффект отдельных средств составляет предпочтительно 60% или менее, предпочтительно, 56% или менее.
Краткое описание фигур
Фиг.1 - эфект теофиллина и дексаметазона, введенных перорально (за 1 ч перед и через 6 ч после 11 следующих друг за другом воздействий КТ) отдельно или в комбинации на общее число клеток, полученных в БАЛ через 24 ч после конечного воздействия. Теофиллин вводили отдельно в дозе 3 мг/кг или в комбинации с дексаметазоном (0,3 мг/кг) при 3 и 1 мг/кг.
Фиг.2 - эфект теофиллина и дексаметазона, введенных перорально (за 1 ч перед и через 6 ч после 11 следующих друг за другом воздействий КТ) отдельно или в комбинации на число макрофагов, полученных в БАЛ через 24 ч после конечного воздействия. Теофиллин вводили отдельно в дозе 3 мг/кг или в комбинации с дексаметазоном (0,3 мг/кг) при 3 и 1 мг/кг.
Фиг.3 - эфект теофиллина и дексаметазона, введенных перорально (за 1 ч перед и через 6 ч после 11 следующих друг за другом воздействий КТ) отдельно или в комбинации на число эпителиальных клеток, полученных в БАЛ через 24 ч после конечного воздействия. Теофиллин вводили отдельно в дозе 3 мг/кг или в комбинации с дексаметазоном (0,3 мг/кг) при 3 и 1 мг/кг.
Фиг.4 - эфект теофиллина и дексаметазона, введенных перорально (за 1 ч перед и через 6 ч после 11 следующих друг за другом воздействий КТ) отдельно или в комбинации на число нейтрофилов, полученных в БАЛ через 24 ч после конечного воздействия. Теофиллин вводили отдельно в дозе 3 мг/кг или в комбинации с дексаметазоном (0,3 мг/кг) при 3 и 1 мг/кг.
Фиг.5 - эфект теофиллина и дексаметазона, введенных перорально (за 1 ч перед и через 6 ч после LPS) на индуцированное LPS повышение общего числа клеток в БАЛ через 24 ч после стимуляции.
Фиг.6 - эфект теофиллина и дексаметазона, введенных перорально (за 20 и 1 ч перед и через 6 ч после LPS) на индуцированное LPS повышение общего числа нейтрофилов в БАЛ через 24 ч после стимуляции.
Фиг.7 - концентрации теофиллина в плазме после перорального дозирования мышам A/J.
Подробное описание изобретения
В настоящем изобретении использованы стандартные способы фармакологии и биохимии, как более подробно описано ниже. В контексте изобретения некоторые термины имеют следующее конкретное значение.
Изобретение относится к введению метилксантиновых и стероидных лекарственных средств в комбинации, и в нем комбинированное введение противопоставляется индивидуальному введению указанных лекарственных средств по отдельности. «По отдельности», соответственно, относится к метилксантиновому соединению без стероида, или, наоборот, безотносительно того, вводится ли стероид до, одновременно или после метилксантинового соединения. Имеется намерение отделить ситуацию, когда метилксантиновое соединение и стероид вводят так, что они могут оказывать их фармакологические действия на организм-мишень одновременно, от ситуации, когда они оказывают их по отдельности.
«Комбинированное применение» или «комбинация» в пределах значения по настоящему изобретению следует понимать в том значении, когда отдельные компоненты могут вводиться одновременно (в виде комбинированного лекарственного средства), отдельно, но по существу одновременно (например, в отдельных дозах) или последовательно (непосредственно друг за другом или после подходящего интервала времени при обеспечении того, что оба средства активны в субъекте в одно и то же время).
Термин «эффективный» в отношении лечения воспалительных состояний и/или респираторных заболеваний относится к получению ответа в анализе, в котором измеряется воспаление в респираторном заболевании. Предпочтительный анализ представляет собой бронхоальвеолярный лаваж (БАЛ) с последующим подсчетом клеток, где присутствие клеток указывает на воспаление легких. У пациентов-людей БАЛ индуцируемая мокрота и биопсия бронхов являются предпочтительными способами оценки воспаления. Воспаление может индуцироваться любыми требуемыми средствами, такими как ингаляция табачного дыма, введения раздражающих агентов, таких как LPS, и тому подобное. Ингаляция табачного дыма является предпочтительной, поскольку, как показано здесь, применение LPS недостоверно воспроизводит воспалительную реакцию, которая устойчива к стероидам, как это наблюдается в ХОБЛ. В контексте анализа БАЛ/подсчета клеток, «эффективный» предпочтительно охватывает снижение числа клеток на 30%, 35%, 40%, 45%, 50%, 60%, 65%, 70% или более по сравнению с контролем, в котором агент не вводится.
«Неэффективный» означает, в том же анализе, намного более низкий уровень реакции. Предпочтительно в анализе БАЛ/подсчете клеток «неэффективный» означает, что снижение числа клеток составляет 30% или ниже, преимущественно, 28%, 27%, 26%, 25%, 24%, 23% 22% или 21% или ниже, и предпочтительно, 20% или ниже. В некоторых случаях «неэффективный» может охватывать повышение воспаления, например, наблюдаемое как повышение числа клеток.
«Синергический» означает, что эффективность двух средств больше, чем ожидается при суммировании соответствующих индивидуальных показателей эффективности в данном анализе. Например, если метилксантиновое соединение и стероид снижали число клеток в анализе БАЛ на 10% и 20% соответственно при введении по отдельности, синергический ответ имеет место, если снижение числа клеток составляло выше 30% при комбинированном введении тех же средств в то же время в тех же дозах.
«Введенный» относится к введению целой дозы средства, например, в болюсной дозе, субъекту, которому это назначено. В контексте настоящего изобретения дозировка предпочтительно выражается в терминах достигаемого уровня в плазме (< 5 мг/л; 6-9 мг/л; 10-20 мг/л) с уровнями в плазме предпочтительно от 1 до 9 мг/л, и наиболее предпочтительно, менее 1 мг/л.
«Доза» представляет собой количество средства введенного, как описано выше. Введение может осуществляться любым подходящим путем, включая пути, указанные выше. В общем, невозможно уравнять дозировки, введенные двумя путями введения; например, ингалируемые стероиды обычно вводят в более низких дозах, чем пероральные стероиды для достижения сравнительного эффекта, поскольку они доставляются непосредственно в участок действия, а не системно.
«Единичная дозированная» форма представляет собой препарат фармацевтической композиции в одном или нескольких упакованных количествах, каждое из которых содержит единичную дозировку по изобретению. Типичные единичные дозировки включают в себя таблетки, капсулы, суппозитории, одноразовые ампулы и тому подобное.
Теофиллин и стероиды
Теофиллин и аминофиллин
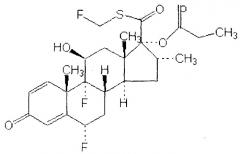
Теофиллин имеет структуру, показанную ниже:
и доступен коммерчески под разнообразными торговыми наименованиями, включая Аккурброн, Аэробин, Аэролат, Афонилум, Аквафиллин, Армофиллин, Асмаликс, Аустин, Билордил, Бронхоретард, Бронкодил, Цетрафиллин, Констант T, Дурафиллин, Диффумал, Эликсомин, Эликсофиллин, Этеофил, Эуфиллин, Эуфрилонг, LaBID, Ланофиллин, Ласма, Нуэлин, Фиспан, Про-Вент, ПульмиДур, Пульмо-Тимелетс, Квиброн, Респид, Сло-Бид, Сло-Филлин, Солозин, Сустаир, Талотрен, Теозона, Теобид, Теоклир, Теохрон, Тео-Дур, Теолэйр, Теон, Теофил, Теоград, Тео-Сав, Теоспан, Теостат, Теовент, T-Фил, Унифил, Унифиллин и Ксантиум. Химическое наименование теофиллина 3,7-дигидро-1,3-диметил-1H-пурин-2,6-дион или 1,3-диметилксантин, и его общая химическая формула представляет собой C7H8N4O2.
Аминофиллин
Производное теофиллина, которое является синонимом этилендиамина теофиллина. Аминофиллин представляет собой производное теофиллина, оба они являются метилксантинами и происходят от ксантинов. Лекарственное средство аминофиллин несколько отличается по своей структуре от теофиллина тем, что он содержит этилендиамин, а также больше молекул воды. Аминофиллин имеет тенденцию к более сильному и более короткому действию, чем теофиллин. Его структура показана ниже:
Теофиллин хорошо всасывается из желудочно-кишечного тракта с биодоступностью до 90-100 процентов. Пиковые уровни достигаются в пределах 1-2 часов после поглощения, но это замедляется присутствием пищи. Теофиллин примерно на 60 процентов связан с белками плазмы и имеет средний объем распределения 0,5 л/кг. Связывание с белками плазмы снижается у детей и у пациентов с циррозом печени. Средний период полужизни теофиллина в плазме составляет примерно 8 часов у взрослых, хотя он имеет большую изменчивость в одном субъекте и между разными субъектами, и также сильно меняется с возрастом, составляя примерно 30 часов у недоношенных новорожденных, 12 часов в течение первых 6 месяцев, 5 часов в пределах первого года жизни и примерно 3,5 часа к возрасту 20 лет, и данный период опять постепенно повышается после этого. По причине относительно короткого периода полужизни теофиллина в плазме имеется много доступных коммерчески препаратов с замедленным высвобождением. Они все различаются по своей биодоступности и по времени пика концентрации в плазме (см. далее ниже).
Теофиллин в основном метаболизируется в печени путем деметилирования или окисления с использованием системы цитохрома P450. Только малые количества экскретируются в неизмененном виде из почки, и при почечной недостаточности нет необходимости в коррекции дозировки. Однако необходимо соблюдать осторожность при использовании других лекарственных средств, которые также метаболизируются в цитохромной системе, причем следует проводить коррекцию дозы в соответствии с измерением уровня в плазме. Многие лекарственные средства могут препятствовать метаболизму теофиллина. Особую осторожность следует проявлять с некоторыми антибиотиками, поскольку пациенты с инфекционными обострениями обструкции их дыхательных путей могут неосторожно подвергаться воздействию антибиотиков без учета метаболизма теофиллина. Данные антибиотики включают в себя семейства антибиотиков макролиды (например, эритромицин) и хинолоны (например, ципрофлоксацин), которые снижают клиренс теофиллина в разной степени. Другие лекарственные средства, которые снижают клиренс теофиллина, включают в себя циметидин, аллопуринол и пропанолол (хотя это была бы довольно необычная терапевтическая комбинация). Лекарственные средства, которые повышают метаболизм теофиллина, включают в себя рифампицин, фенобарбитал и, особенно, фенитоин и карбамазепин, но не оральные контрацептивные таблетки. Скорость метаболизма теофиллина существенно повышается у курильщиков сигарет (период полужизни уменьшается вдвое), хотя это может быть незначительно у тех, кто курит менее 10/сутки. Курение марихуаны, также как и диета с высоким потреблением белка, имеет сходный эффект. Дисфункция печени, сердечная недостаточность и легочное сердце снижают элиминацию теофиллина, и состояния гипоальбуминемии снижают количество лекарственного средства, связанного с белками крови, приводя к тому, что уровень в плазме следует интерпретировать с осторожностью. Поэтому, как только клиническое состояние пациента с сердечной недостаточностью или респираторной недостаточностью с легочным сердцем улучшается, клиренс теофиллина изменяется, и может потребоваться коррекция дозировки.
Метилксантины
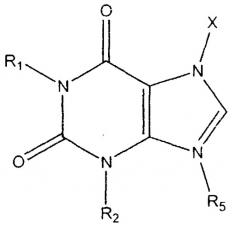
Метилксантиновые соединения, которые включают в себя теофиллин и аминофиллин, имеют следующую общую формулу
где
X представляет собой водород, алифатический углеводородный радикал или -CO-NR3R4;
R1, R2 и R3 представляют собой алифатические углеводородные радикалы;
R4 представляет собой водород или алифатический углеводородный радикал, и R3 и R4 вместе с атомом азота могут также представлять собой алкиленимино-радикал с 5-6 членами кольца или морфолино-радикал; и
R5 представляет собой водород или лифатический углеводородный радикал.
Все данные соединения относятся к объему настоящего изобретения; однако сам теофиллин особенно предпочтителен.
Стероиды
Стероидные лекарственные средства в общем подходят для применения по настоящему изобретению. Конкретные стероиды приведены ниже. Обычные ингалируемые стероиды включают в себя:
- Пульмикорт® (будезонид)
- Фловент® (флутиказон)
- Асманекс® (мометазон)
- Алвеско® (силсезонид)
- Аэробид® (флунизолид)
- Азмакорт® (триамцинолон)
- Квар® (беклометазон HFA)
- Стероиды также могут вводиться в виде комбинаций с бронходилататорами длительного действия с различными механизмами, включая бета-2-адренергические агонисты и/или мускариновые антагонисты. Бронходилататор, включенный в комбинацию со стероидами, может иметь активность бета-2-адренергического агониста и мускаринового антагониста в одной молекуле.
- Адвейр® (Фловент® и Серевент®). Примечание: Серевент® представляет собой бета-агонист длительного действия сальметерол.
- Симбикорт® (Пульмикорт® и Оксис®). Примечание: Оксис представляет собой бета-агонист длительного действия формотерол.
Обычные таблетки и сиропы стероидов включают в себя:
- Дельтазон® (преднизон)
- Медрол® (метилпреднизолон)
- Орапред®, Прелон®, Педиапред® (преднизолон)
Будезонид
Химическое наименование: C25H34O6: 430,54 (+)-[(RS)-16a,17a-бутилиденокси-11b,21-дигидрокси-1,4-прегнадиен-3,20-дион]
Регистрационный номер CAS: 51333-22-3
Будезонид исходно синтезировали из 16a-гидроксипреднизолона. Уникальная структура молекулы представляет собой ключ к сочетанию в нем сильного местного противоспалительного действия с относительно низким потенциалом для системных побочных эффектов. Кроме того, будезонид достаточно водорастворим для легкого растворения в жидкостях слизистой и достаточно жирорастворим для быстрого захвата слизистыми оболочками. Поскольку ацетальная группа асимметрична, будезонид существует в виде смеси 1:1 из двух эпимеров, известной в виде 22R и 22S.
Флутиказон
Торговые наименования: Кутивейт, Фликсоназе, Фликсотид, Флоназе, Фловент, Флуназе
Химическое наименование
S-(фторметиловый) эфир (6(,11(,16(,17()-6,9-дифтор-11-гидрокси-16-метил-3-оксо-17-(1-оксопропокси)андроста-1,4-диен-17-карботиоевой кислоты
Химическая формула: C25H31F3O5S
Номер CAS: 80474-14-2
Беклометазон
Химическое наименование
(11(,16()-9-хлор-11,17,21-тригидрокси-16-метилпрогна-1,4-диен-3,20-дион
Химическая формула
C22H29ClO5
Номер CAS 4419-39-0
Торговые наименования (Вариант)
Аэробек (дипропионат беклометазона), Альдецин (дипропионат беклометазона), Анцерон (дипропионат беклометазона), Андион (дипропионат беклометазона), Беклацин (дипропионат беклометазона), Беклофорте (дипропионат беклометазона), Бекломет (дипропионат беклометазона), Бехлоринол (дипропионат беклометазона), Бекловал (дипропионат беклометазона), Бекловент (дипропионат беклометазона), Беклодискс (дипропионат беклометазона), Беконазе (дипропионат беклометазона), Беконазол (дипропионат беклометазона), Бекотид (дипропионат беклометазона), Кленил-А (дипропионат беклометазона), Энтидерма (дипропионат беклометазона), Иналон (дипропионат беклометазона), Корбутон (дипропионат беклометазона), Пропадерм (дипропионат беклометазона), Квар (дипропионат беклометазона), Рино-Кленил (дипропионат беклометазона), Санастмакс (дипропионат беклометазона), Санастмил (дипропионат беклометазона), Ванценазе (дипропионат беклометазона), Ванцерил (дипропионат беклометазона), Виарекс (дипропионат беклометазона) и Виарокс (дипропионат беклометазона).
Триамцинолон
Торговые наименования
Аристокорт, Аристопан, Азмакорт, Кеналог Назакорт
Химическое наименование
(11(,16()-9-фтор-11,21-дигидрокси-16,17-[1-метилэтилиденбис (окси)]прегна-1,4-диен-3,20-дион
Химическая формула
C24H31FO6
Номер CAS
76-25-5
Сальметерол/Адвейр
Торговые наименования
*1-гидрокси-2-нафтоат *1-гидрокси-2-нафтоат: Ариал, Сальметедур, Серевент
Химическое наименование
(()-4-гидрокси-('-[[[6-(4-фенилбутокси)гексил]амино]метил]-1,3-бензолдиметанол
Химическая формула
C25H37NO4
Номер CAS
89365-50-4
Метилпреднизолон
Химическое наименование
(6(,11()-11,17,21-тригидрокси-6-метилпрегна-1,4-диен-3,20-дион
Химическая формула
C22H30O5
Номер CAS
83-43-2
Торговые наименования
Медрат, Медрол, Медрон, Метастаб, Метризон, Промакортин, Супраметил, Урбазон
Преднизон
Торговые наименования
Анкортон, Колизон, Кортанцил, Дакортин, Декортанцил, Декортин, Делькортин, Дельтакортон, Дельтазон, Дельтизон, Ди-Адрезон, Энкортон, Метикортен, Нуризон, Оразон, Паракорт, Преднилонга, Пронизон, Ректодельт, Зон, Ультракортен
Химическое наименование
17,21-дигидроксипрегна-1,4-диен-3,11,20-трион
Химическая формула
C21H26O5
Номер CAS
53-03-2
Получение препаратов
Производные ксантина, такие как теофиллин и аминофиллин, широко доступны в различных фармацевтических препаратах, включающих в себя средства чрескожной доставки с замедленным высвобождением, препараты для орального или ингаляторного (назального) применения. Также и стероидные лекарства широко доступны в различных препаратах. Препараты, использованные в примерах, описанных здесь, детализированы ниже, но в настоящем изобретении могут применяться любые препараты, которые позволяют доставлять лекарство субъекту в требуемой дозе.
В целом, фармацевтическим препаратом может быть любой, который может быть применен орально, внутривенно, через ингаляцию, ректально или чрескожно.
Предпочтительные композиции для использования в соответствии с изобретением могут, в зависимости от обстоятельств, быть в форме таблеток, капсул, гранул, сфероидов, порошков или жидких препаратов.
Таблетки и капсулы для орального введения могут быть получены общепринятыми способами с фармацевтически приемлемыми добавками, такими как связывающие агенты, наполнители, лубриканты, дезинтеграторы, увлажняющие агенты, красители и ароматизаторы. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в науке.
Преимущественно, композиции, полученные или используемые в соответствии с изобретением, применяются в единицах дозирования, например, в форме таблеток или заполненных капсул. Далее предусматривается, что активное вещество должно быть в форме с контролируемым высвобождением.
Подходящие материалы для включения в матрикс с контролируемым высвобождением включают в себя, например:
(a) Гидрофильные или гидрофобные полимеры, такие как смолы, эфиры целлюлозы, белковопроизводные материалы, нейлон, акриловые смолы, полимолочная кислота, поливинилхлорид, крахмалы, поливинилпиролидоны, ацетат-фталат целлюлозы. Из этих полимеров предпочтительны эфиры целлюлозы, особенно замещенные, такие эфиры целлюлозы, как алкилцеллюлозы (например, этилцеллюлоза), C1-6-гидроалкилцеллюлозы (такие как гидроксипропилцеллюлоза и, особенно, гидроксиэтилцеллюлоза) и акриловые смолы (например, метакрилаты, такие как кополимеры метакриловой кислоты). Матрикс с контролируемым высвобождением может содержать от 1% до 80% (по весу) гидрофильных или гидрофобных полимеров.
(b) Перевариваемые, длинноцепочечные (C8-C50, особенно C8-C40), замещенные или незамещенные углеводороды, такие как жирные кислоты, гидрогенизированные растительные масла, такие как Cutina™, жирные спирты (такие как лауриловый, миристиловый, стеариловый, цетиловый или, предпочтительно, цетоариловый спирт), жирнокислотные эфиры глицерина, например, минеральные масла моностеарата глицерина и воски (такие как пчелиный воск, гликовоск, сахарный воск или воск карнаубы). Углевододы, имеющие температуру плавления между 20°C и 90°C, предпочтительны. Из этих длинноцепочечных углеводов жирные (алифатические) спирты предпочтительны. Матрикс может содержать до 60% (по весу) один, по меньшей мере, перевариваемый длинноцепочечный углевод.
(c) Полиалкиленгликоли. Матрикс может содержать до 60% один, по меньшей мере, полиалкиленгликоля.
Содержащий лекарство матрикс с конролируемым высвобождением может быть легко получен путем растворения активного вещества в системе с контролируемым высвобождением, с использованием общепринятых фармацевтических способов, таких как влажное гранулирование, сухое измельчение, сухое гранулирование или соосаждение.
Средства по изобретению могут вводиться в ингаляционной форме. Получение аэрозолей может осуществляться, например, путем управляемой давлением струйной атомизации или ультразвуковой атомизации, но преимущественно, посредством направляемых пропеллентами дозированных аэрозолей или посредством не основанного на пропеллентах введения тонкодисперсных активных соединений из ингаляционных капсул.
Активные соединения дозируют в зависимости от используемой ингаляционной системы, кроме того, форма введения содержит необходимые добавки, такие как пропелленты (например, Frigen в случае воздушных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы, наполнители (например, лактоза, в случае порошкового ингалятора) или, при желании, другие активные компоненты.
В целях ингаляции, доступно большое количество аппаратов, с помощью которых могут быть получены и введены аэрозоли с оптимальным размером частиц, с использованием ингаляционного способа, приемлемого для пациента. В добавление к использованию адаптеров (спейсеров, расширителей) или грушевидных контейнеров (например, Nebulator®, Volumatic®), и автоматических устройств, испускающих струю тонкодисперсного порошка (Autohaler®), для дозированных аэрозолей, в частности, в случае порошковых ингаляторов, доступно большое количество технических решений (например, Diskhaler®, Rotadisk®, Turbohaler® или ингал