Комбинация соединений метилксантина и стероидов для лечения хронических респираторных заболеваний
Иллюстрации
Показать всеИзобретение относится к применению метилксантинового соединения, в частности теофиллина в суточной дозе от 0,1 до 25 мг, и глюкокортикоида в композиции для лечения хронического респираторного заболевания, как хроническая обструктивная болезнь легких, астма, причем композицию вводят в организм ингаляционным способом для ее доставки в легкие. Комбинация метилксантинового соединения в низкой дозе и глюкокортикоида обеспечивает синергетический эффект в отношении улучшения легочной функции и снижения воспаления. 6 н. и 13 з.п. ф-лы, 3 табл., 5 ил.
Реферат
Представленное изобретение предусматривает ингаляционное применение производных метилксантина, в частности теофиллина, и стероидных лекарственных средств в синергической комбинации для производства лекарственного средства, используемого при лечении хронических респираторных заболеваний, в частности хронической обструктивной болезни легких (ХОБЛ). Использование метилксантина и стероида в комбинации, вводимой ингаляционным путем в легкие, приводит к лечебной синергической противовоспалительной реакции.
Введение
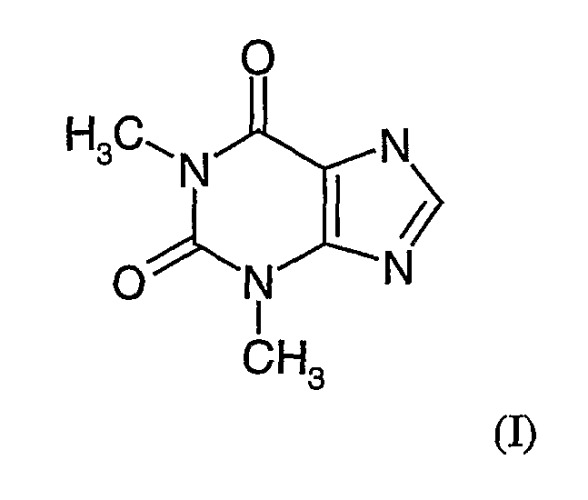
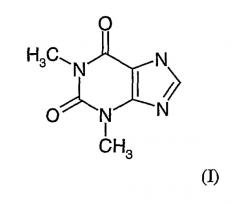
Теофиллин - это недорогой белый кристаллический порошок, используемый как оральное средство при хронических респираторных заболеваниях, в частности бронхиальной астме и ХОБЛ. Аминофиллин или теофиллин-этилендиамин представляет собой комбинацию теофиллина и этилендиамина, обладая сходными с обоими препаратами свойствами. Известно, что теофиллин обладает бронхорасширяющим эффектом и умеренным противовоспалительным эффектом, что отчасти связано с его активностью в качестве слабого неизбирательного ингибитора фосфодиэстеразы (ФДЭ). До настоящего времени это лекарственное средство, которое характеризовалось узким спектром терапевтического применения и токсичностью, проявлявшейся желудочно-кишечным расстройством, тремором, сердечными аритмиями и другими осложнениями, довольно широко используется в клинической практике. Для исключения этих неблагоприятных побочных эффектов при хронических респираторных заболеваниях вместо орального теофиллина часто назначают другие лекарственные средства, в частности ингаляционные бета-агонисты, ингаляционные антихолинергические средства и ингаляционные стероиды. Однако до сих пор было проведено очень мало исследований, посвященных изучению терапевтического потенциала ингаляционного теофиллина при лечении хронических респираторных заболеваний, в частности ХОБЛ и бронхиальной астмы.
Хотя теофиллин используется в клинической практике уже много лет, молекулярный механизм и место его действия в организме остаются неизвестными. Было предложено несколько молекулярных механизмов действия теофиллина, включая следующий.
Теофиллин - это слабый и неизбирательный ингибитор фосфодиэстераз, разрушающих циклические нуклеотиды в клетках, что приводит к увеличению концентраций внутриклеточного циклического АМФ и ГМФ. Теофиллин расслабляет гладкую мускулатуру дыхательных путей за счет угнетения активности ФДЭ (ФДЭ3, ФДЭ4 и ФДЭ5), но для максимального расслабления нужны относительно высокие концентрации (Rabe, et al., Eur Respir J 1999, 8:637-42). В терапевтически приемлемых концентрациях теофиллин ингибирует ФДЭ очень незначительно. Нет никаких данных о том, что теофиллин обладает избирательностью в отношении какого-либо изофермента, в частности ФДЭ4В, преобладающе изофермента ФДЭ в воспалительных клетках, опосредующего противовоспалительные эффекты в дыхательных путях.
Теофиллин способствует увеличению выброса интерлейкина-10, обладающего широким спектром противовоспалительных эффектов. Эти эффекты могут быть опосредованы ингибированием ФДЭ, хотя оно и не наблюдается при использовании тех доз, которые дают лечебный эффект при астме (Oliver, et al. Allergy 2001, 56: 1087-90).
Теофиллин препятствует перемещению провоспалительного фактора транскрипции, ядерного фактора κB (NF-κB) в ядро, что потенциально снижает экспрессию воспалительных генов при астме и ХОБЛ (Tomita, et al. Strategies 1999(359): 249-55). Эти эффекты наблюдаются при высоких концентрациях и также могут быть опосредованы ингибированием ФДЭ. Таким образом, вполне вероятно, что ингибирование ФДЭ не является механизмом действия теофиллина при его использовании в низких оральных дозах (<10 мг/л).
Теофиллин также является мощным ингибитором рецепторов аденозина в терапевтической концентрации с антагонизмом к рецепторам A1 и A2, хотя он менее эффективен против рецепторов типа A3 (Pauwels & Joos, Arch Int Pharmacodyn Ther 1995, 329: 151-60). Имеется сообщение о том, что ингаляционная монотерапия теофиллином может вступать в антагонизм с бронхосуживающим эффектом ингаляций аденозина у астматиков (Cushley et al., Am Rev Resp Disease 1984,129, 380-4). В дополнение к этому было установлено, что ингалируемый теофиллин (в виде аминофиллина) действует на больных с астмой как бронходилататор (Kokubu H. Arerugi. 1995, 44(12): 1379-86).
Кроме того, относительно недавно было установлено, что теофиллин активирует гистоновую диацетилазу (HDAC). Ацетилирование гистоновых протеинов связано с активацией функции гена, и принято считать, что факторы провоспалительной транскрипции, активирующие воспалительные гены, также вызывают увеличение активности гистоновой ацетилтрансферазы. Увеличивая активность HDAC, способствующую дезацетилированию гистоновых протеинов, теофиллин, по мнению исследователей, подавляет экспрессию воспалительных генов (см. Barnes PJ, Am J Respir Crit Care Med, 2003, 167:813-818). Считается, что теофиллин на молекулярном пути метаболизма взаимодействует с ключевой регуляторной киназой или ферментом фосфатазой, что приводит к повышению активности HDAC, хотя этот вопрос еще предстоит выяснить.
Минимальная, но достаточно значимая противовоспалительная активность теофиллина была продемонстрирована при оральной монотерапии у больных с ХОБЛ при использовании таких доз теофиллина, которые обусловливают его уровень в плазме ≤10 мг/л, но ≥5 мг/л (Culpitt et al., Am. J. Respir. Crit Care Med, 2002, 165(10): 1371-1376, Kobayashi et al., Respirology 2004, 9: 249-254).
Глюкокортикоидные лекарственные средства (стероиды) стали терапией выбора при астме и широко используются при лечении ХОБЛ, обычно в форме ингаляций. Ингаляционные стероиды обычно применяют один или два раза в день в фиксированной дозе, зависящей от свойств стероидного препарата. Например, для будесонида типичные дозы составляют 200 мкг, 400 мкг или 800 мкг один или два раза в день. Для флутиказона типичные дозы составляют 50 мкг, 100 мкг, 250 мкг или 500 мкг один или два раза в день. Для циклесонида типичные дозы составляют 80 мкг, 160 мкг или 320 мкг один или два раза в день. Абсолютная доза, попадающая в легкие, зависит от многих факторов, включая свойства используемого стероида, характеристики устройства для ингаляций, рецептуру ингаляционного лекарственного средства, особенности конкретного больного и методику ингаляции, но в норме эти факторы оказывают значительно меньшее влияние по сравнению с общей введенной дозой препарата.
Однако, хотя ингаляционные стероиды эффективны для большинства больных с астмой, их использование при ХОБЛ спорно из-за отсутствия противовоспалительного эффекта в образцах мокроты (Keatings et al., Am. J. Respir. Crit Care Med, 1997, 155(2): 542-8, Culpitt et al., Am. J. Respir. Crit Care Med-1999, 160, 5(1): 1635-1639, Loppow et at., Respir. Med. 2001, 95(2): 115-121) и их кажущейся неспособности влиять на развитие заболевания (Burge, et al (2000). BMJ 320: 1297-1303). Другие исследования, в которых изучалась мокрота, привели к предположению о том, что более длительные периоды лечения, особенно с использованием высоких доз ингаляционных стероидов, действительно производят у части больных поддающиеся измерению, но минимальные противовоспалительные эффекты (Confalonieri et al., Thorax, 1998, 53(7): 583-585, Mirici et al., Clinical Drug Investigation. 2001, 21:835-842, Yildiz et al., Respiration. 2000, 67:71-76).
Однако оценка противовоспалительной активности при исследовании материалов, полученных при бронхиальной биопсии, а не мокроты, также дала неутешительные результаты. В отличие от того, что было продемонстрировано на больных с астмой, Hattatowa et al. (Am J Respir Crit Care Med. 2002, 165:1592-1596) не выявили значительного снижения численности ключевых воспалительных клеток у больных ХОБЛ после трех месяцев лечения ингаляционными стероидами (500 мкг флутиказона два раза в день). Несмотря на минимальную общую противовоспалительную активность в легких ингаляционные кортикостероиды действительно снижают частоту обострений у больных ХОБЛ на 20-30%.
Вполне вероятно, что улучшение этой минимальной легочной противовоспалительной активности ингаляционных стероидов принесет больным с ХОБЛ большую пользу, заключающуюся в улучшении состояния здоровья, улучшении легочной функции, улучшении показателей диспноэ и дополнительном снижении частоты обострений.
Больным с астмой, не реагирующим на низкие дозы стероидов, назначают более высокие дозы, например для будесонида доза может быть повышена до 1600 мкг в день. В работе Evans et al., (2004) NEJM 337:1412, высказано предположение о том, что высокие дозы ингаляционных стероидов для больных с астмой можно заменить нормальными дозами глюкокортикоидов в сочетании с низкой дозой орального теофиллина. Больным назначали 400 мкг будесонида (стандартная доза) вместе с 250 или 375 мг теофиллина или 800 мкг будесонида в комбинации с плацебо два раза в день. Концентрации теофиллина в плазме, достигнутые в этом исследовании, составляли от 2,5 до 17,1 мг/л при среднем значении 8,7 мг/л. Эффекты обоих вариантов лечения оказались сходными, а это наводило на мысль о том, что теофиллин при совместном применении со стероидом дает эффект экономии дозы. Однако при тех дозах лекарственных средств, которые были использованы в этом исследовании, у больных отмечались побочные эффекты, включая желудочно-кишечные расстройства, усиленное сердцебиение, фарингит, а также другие побочные эффекты, связанные с лечением стероидами и/или теофиллином. Авторы не обнаружили никаких эффектов комбинации лекарственных средств в отношении воспаления. Аналогичных исследований по изучению возможного эффекта экономии дозы ингаляционных стероидов при назначении орального теофиллина на больных с ХОБЛ пока не проводилось.
В работе Cazzola et al, (2004) Pulm Pharm Ther 17:141-145, проводилось сравнение комбинации бронходилататора сальметерола и стероида флутиказона с комбинацией орального теофиллина и ингаляционного флутиказона (500 мкг два раза в день) при лечении больных с ХОБЛ в течение 4 месяцев. Дозу орального теофиллина титровали до достижения концентрации в плазме 10-20 мг/л, который необходим для клинически эффективной бронходилатации. Воспалительный статус у этих больных не изучали ни при одном из вариантов терапии.
Патент US20030134865 раскрывает метод скрининга для идентификации лекарственно-подобных соединений, которые можно использовать при лечении астмы или других воспалительных заболеваний. Он включает ксантин или родственное соединение, используемое для модуляции активности или экспрессии HDAC. Это изобретение описывает роль стероидов в репрессии воспалительных генов. Оно предсказывает, что теофиллин должен усиливать действие глюкокортикоидов, придавая им способность задействовать HDAC с повышенной активностью. Теофиллин используют in vitro для синергического эффекта со стероидами дексаметазоном и будесонидом в целях усиления клеточной активности HDAC и репрессии воспалительных генов.
Патент US6025360 раскрывает использование теофиллина в качестве дополнительной терапии или для полной либо частичной замены кортикостероидов при хроническом, профилактическом, противовоспалительном лечении астмы с обеспечением уровня в плазме в стабильной фазе от 1 до менее 5 мг/л. Указанный уровень в плазме достигается при использовании теофиллина в оральных формах в дозе от 50 до 600 мг в день.
В публикации Barnes (Am J Respir Crit Care Med, 2003, 167:813-818) обсуждается использование теофиллина и стероидов в комбинации при лечении ХОБЛ и высказывается предположение о том, что эта комбинация обладает синергическим эффектом в снижении воспаления. Однако в этой работе не предлагается ни схема дозирования препаратов, ни использование теофиллина посредством ингаляций.
Для ясности в таблице 1 представлена сводка известных данных в отношении назначаемых оральных доз метилксантинов и соответствующего уровня теофиллина в плазме, определяемого у больных.
Для ясности в таблице 2 представлена сводка ограниченных данных в отношении назначаемых ингаляционных доз метилксантинов и соответствующего уровня теофиллина в плазме, определяемого у больных с астмой.
| Таблица 1 | ||||
| Публикация | Продолжительность исследования | Лекарственное средство | Суточная доза | Средний уровень теофиллина в плазме |
| Alexander et al. (1980), J. Am. Med. Assoc., 244: 2286-90 | 4 недели | Теофиллин | 400 мг | 15,1 мг/л |
| Iversen et al. (1992), Eur. Respir. J. 5 Suppl (15): 137 | 4 недели | Теофиллин | 600 мг | 7,l мг/л |
| Ito et al. (2002), Proc. Natl. Acad. Sci. USA, 99(13): 8921-8926 | 4 недели | Эуфилонг (теофиллин) | 500 мг | 4,3 мг/л |
| Culpitt et al. (2002), Am. J. Respir. Crit. Care Med., 165(10): 1371-1376 | 4 недели | Теофиллин | 300-600 мг | 9,5 мг/л |
| Kobayashi et al. (2004), Respirology, 9:249-254 | 4 недели | Теодур (теофиллин) | 400 мг | 7,9 мг/л |
| Evans et al. (2004), NEJM, 337:1412 | 12 недель | Эуфилонг (теофиллин) | 500-750 мг | 8,7 мг/л |
| US6025360 (1995) | 4 недели | Филлоконтин или унифиллин (теофиллин) | 562-573 мг | Средний уровень не приводится, но у 20 больных из 25 уровень составлял ≥5 мг/л |
| Таблица 2 | ||||
| Публикация | Продолжительность исследования | Лекарственное средство | Доза | Чистый пиковый уровень теофиллина в плазме |
| Bohadana et al. (1980),Bull. Eur. Physiopathol. Respir., 16(1): 13-24. | Единственная ингаляция | Аминофиллин (теофиллин) | 187,5 мг | 0,91 мг/л |
Таким образом, существует медицинская потребность в схеме медикаментозной терапии при ХОБЛ, которая обеспечит достаточную противовоспалительную активность и позволит избежать побочных эффектов, присущих современным методам лечения. Комбинация ингаляционного теофиллина с ингаляционным стероидом в производстве лекарственного средства раскрыта в находящейся на одновременном рассмотрении международной патентной заявке PCT/GB05/003039 авторов настоящего изобретения, но пока не описана в доступных литературных публикациях. Такое лекарственное средство обеспечивает комбинированную терапию при ХОБЛ и других хронических респираторных заболеваниях, которая способна повысить легочную противовоспалительную активность ингаляционного стероида. Такая ингаляционная комбинация дает минимальный системный контакт с метилксантином (уровень в плазме менее 1 мг/л), что придает ей намного более привлекательный профиль побочных эффектов по сравнению с хроническим оральным введением этих лекарственных средств.
Краткое описание изобретения
Авторы представленного изобретения определили, что стероиды, введенные в организм вместе с соединениями метилксантина ингаляционным способом в таких дозах, которые по отдельности неэффективны при лечении воспаления, индуцированного табачным дымом (ТД) на животной модели ХОБЛ, проявляют синергический эффект и способны значительно ослабить воспаление на упомянутых моделях, в частности, на 44% и более в тестах, описанных ниже. Воздействие ТД широко признано как главная причина ХОБЛ у человека.
Поэтому в первом аспекте данное изобретение предлагает использование метилксантинового соединения и стероида в производстве лекарственного состава для лечения хронического респираторного заболевания, выбранного из группы, в состав которой входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма человека, причем упомянутый лекарственный состав вводят в организм ингаляционным способом для его доставки в легкие, а метилксантиновое соединение вводят в суточной дозе от 0,1 до 25 мг.
Преимущественным образом ингаляционный стероид вводят в такой дозе, которая, взятая в отдельности, неэффективна для снижения воспаления, связанного с упомянутым респираторным заболеванием. Ингаляционный стероид можно также вводить в такой дозе, которая, взятая в отдельности, проявляет минимальную эффективность в отношении улучшения функции легких и уменьшения воспаления при лечении упомянутого респираторного заболевания.
Данное изобретение также предлагает использование ингаляционной комбинации, в которой ингаляционный стероид вводят в более низкой дозе по сравнению с изолированным применением стероида, причем такая комбинация проявляет значительную эффективность в отношении улучшения легочной функции и снижения воспаления при лечении упомянутого респираторного заболевания (экономия стероида).
Улучшение этой минимальной легочной противовоспалительной активности ингаляционных стероидов (таких как будесонид, флутиказон или циклесонид) при их использовании в комбинации с ингаляционным метилксантином (в частности, теофиллином) приносит значительную пользу больным, страдающим хроническими респираторными заболеваниями, например ХОБЛ, приводя к улучшению их общего состояния здоровья, улучшению функции легких, уменьшению одышки и снижению частоты обострений.
В данном изобретении открывается и используется синергическая активность при взаимодействии между метилксантиновым соединением и стероидными лекарственными средствами, приводящая к исключительно высокой легочной противовоспалительной активности. Эта синергия может быть достигнута при использовании лекарственных средств в таких дозах, которые неэффективны, если те же лекарственные средства используются поодиночке. Эффект комбинации не аддитивен, а синергичен в том отношении, что два лекарственных средства, которые поодиночке вообще не проявляют эффекта или проявляют слабый эффект, могут применяться одновременно и давать высокозначимое подавление воспалительной реакции в организме.
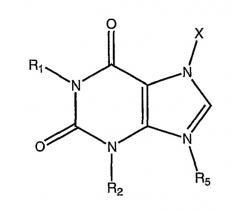
Под метилксантиновым соединением, используемым в данном изобретении, подразумевается теофиллин и фармакологически эквивалентные соединения и соли, включая аминофиллин и окстрифиллин. Такими соединениями являются метилксантины, включая кофеин, ацепифиллин, бамифиллин, буфиллин, кафаминол, кафедрин, дипрофиллин, дигидроксипропилтеофиллин, доксофиллин, энпрофиллин, этамифиллин, этофиллин, проксифиллин, суксамидофиллин, теобромин, фурафиллин, 7-пропил-теофиллин-допамин, пентоксифиллин, репротерол, денбуфиллин, IBMX, арофиллин, ципамфиллин, HWA 448, SDZ MKS 492, BB-1502 и т.п.
Стероидные лекарственные средства включают глюкокортикоиды, кортикостероиды и минералокортикоиды, в частности дексаметазон и будесонид, беклометазон, беклометазон дипропионат, флунизолид, флутиказон, циклесонид, мометазон, гидрокортизон, преднизон, преднизолон, метил преднизолон, нафлокорт, дефлазакорт, галопредон ацетат, флуоцинолон ацетонид, флуоцинонид, клокортолон, типредан, предникарбат, алклометазон дипропионат, галометазон, римексолон, депродон пропионат, триамсинолон, бетаметазон, флудрокоритизон, дезоксикортикостерон, рофлепонид, этипренднол диклоацетат и т.п. Стероидные лекарственные средства дополнительно могут включать стероиды для лечения респираторных заболеваний, находящиеся на клинической или доклинической стадии разработки, в частности, GW-685698, GW-799943, NCX-1010, NCX-1020, NO-дексаметазон, PL-2146, NS-126 (ранее ST-126), также соединения, упоминаемые в международных патентных заявках WO0212265, WO0212266, WO02100879, WO03062259, WO03048181 и WO03042229. Стероидные лекарственные средства также дополнительно могут включать молекулы следующего поколения на стадии разработки с улучшенным профилем побочных эффектов, в частности селективные агонисты глюкокортикоидных рецепторов (САГР), включая ZK-216348 и соединения, упоминаемые в международных патентных заявках WO-00032585, WO-000210143, WO-2005034939, WO-2005003098, WO-2005035518 и WO-2005035502.
Предпочтительный метилксантин представляет собой теофиллин.
Предпочтительный стероид представляет собой будесонид, флутиказон или циклесонид.
В соответствии с изобретением стероид может вводиться в стандартной дозе или в такой дозе, которая давала бы минимальный эффект при введении больному без метилксантинового соединения.
Преимущественно, стероид неэффективен в снижении воспаления при упомянутом респираторном заболевании, если используется в упомянутой дозе один. Некоторые респираторные заболевания, включая ХОБЛ, не поддаются лечению стероидами, а стероидные лекарственные средства минимально эффективны в снижении воспаления в легких. Однако при совместном применении с метилксантиновым соединением, в частности теофиллином, наблюдается противовоспалительный эффект в легких.
Введение лекарственных средств осуществляется посредством ингаляции, что дает больному дополнительное удобство, заключающееся в возможности получать целевые дозы ингаляционных лекарственных средств (метилксантинового соединения и стероида) без бронходилататора длительного действия из одного и того же устройства. В типичном варианте бронходилататор длительного действия - это либо бета-агонист с длительным эффектом, например сальметерол или формотерол, или противомускариновый агент, например тиотропиум. Стероид также можно вводить в организм оральным путем, тогда как метилксантиновое соединение всегда вводят посредством ингаляции.
Комбинации изобретения могут по выбору включать одно или более дополнительных активных веществ, заведомо полезных при лечении респираторных заболеваний, в частности ингибиторы ФДЭ4, ингибиторы ФДЭ5, ингибиторы ФДЭ7, ингибиторы лейкотриена D4, ингибиторы лейкотриена B4, ингибиторы egfr-киназы, ингибиторы p38 MAP киназы, ингибиторы пути NF-κB, в частности, ингибиторы IκK, агонисты рецепторов аденозина A2A, сигнальные ингибиторы TNFα (в частности, агенты связывания лиганда, антагонисты рецепторов), сигнальные ингибиторы интерлейкина-1, антагонисты рецепторов CRTH2, ингибиторы протеаз (в частности, ингибиторы нейтрофилэластазы, ингибиторы MMP, ингибиторы катепсина), сигнальные молекулы IL-8, ингибиторы CXCR1, ингибиторы CXCR2, модуляторы iNOS, агонисты PPAR, антиоксиданты (включая N-ацетилцистеин и миметики супероксиддисмутазы) и/или антагонисты рецепторов NK-1.
В другом аспекте данное изобретение предлагает фармацевтический состав, включающий метилксантиновое соединение и стероид для использования при лечении хронического респираторного заболевания, выбранного из группы, в состав которой входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма; причем упомянутый лекарственный состав адаптирован для введения в организм ингаляционным способом с целью его доставки в легкие, а метилксантиновое соединение вводится в суточной дозе от 0,1 до 25 мг.
Кроме того, данное изобретение предлагает метилксантиновое соединение и стероид для совместного, одновременного (по отдельности) или последовательного введения в организм с целью лечения хронического респираторного заболевания, выбранного из группы, в состав которой входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма, причем упомянутый лекарственный состав адаптирован для введения в организм ингаляционным способом с целью его доставки в легкие, а метилксантиновое соединение вводится в суточной дозе от 0,1 до 25 мг.
В предпочтительном варианте метилксантиновое соединение вводится в лекарственный состав в количестве от 0,1 до 25 мг или от 0,05 до 13 мг, или от 0,033 до 9 мг на разовую дозу состава, причем упомянутые разовые дозы используются для лечения один раз в день, два раза в день или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 1 до 24 мг, 23 мг, 22 мг, 21 мг или 20 мг. Например, суточная доза может составлять 5, 10, 15, 16, 17, 18 или 19 мг. Разовые дозы могут быть рассчитаны с учетом приема лекарственных средств один, два или три раза в день.
В предпочтительном варианте метилксантиновое соединение представляет собой теофиллин. Теофиллин преимущественно назначают в таких дозах, которые указаны выше.
Другие метилксантины, кроме теофиллина, можно назначать в указанных выше дозах или в таких дозах, которые могут быть адаптированы исходя из упомянутых доз специалистом, компетентным в данной области.
Стероид можно назначать, в целом, в дозах приблизительно от 40 мкг до 1600 мкг, применяя его или в разовой суточной дозе или в нескольких дробных дозах, которые суммарно соответствуют упомянутой дозе. Например, стероид можно назначать в суточной дозе 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 750, 800, 900 или 1000 мкг.
В предпочтительном варианте стероид - это будесонид, который назначают в дозе от 200 до 1600 мкг или от 100 до 800 мкг, или от 65 до 525 мкг на разовую дозу лекарственного состава, причем упомянутые разовые дозы используются для лечения один раз в день, два раза в день или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 200 мкг до 1600, 1500, 1400, 1300, 1200, 1100 или 1000 мкг. Например, суточная доза составляет 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850 или 900 мкг. Разовые дозы можно рассчитать с учетом приема лекарственных средств один, два или три раза в день.
В другом варианте стероид это флутиказон, который вводят в лекарственный состав в количестве от 44 до 1000 мкг или от 22 до 500 мкг, или от 15 до 335 мкг в расчете на разовую дозу, которая используется в схеме лечения с приемом лекарственного средства один, два или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 44 мкг до 900, 880, 800, 700, 660, 600 или 500 мкг, например, доза может составлять 50, 60, 88, 100, 110, 125, 150, 200, 220, 250, 300, 350, 375, 400, 440 или 450 мкг. Разовые дозы можно рассчитать с учетом приема лекарственного средства один, два или три раза в день.
Кроме того, в качестве стероида может использоваться циклесонид, который вводят в лекарственный состав в количестве от 40 до 500 мкг или от 20 до 250 мкг, или от 17 до 170 мкг в расчете на разовую дозу, которая используется в схеме лечения с приемом лекарственного средства один, два или три раза в день соответственно. Предпочтительная суточная доза находится в диапазоне от 40 мкг до 480, 450, 400, 350, 320 или 300 мкг, например, доза может составлять 80, 100, 120, 150, 160, 200 или 250 мкг. Разовые дозы можно рассчитать из расчета приема лекарственного средства один, два или три раза в день.
Такие разовые дозы можно упаковать, составляя набор для лечения упомянутого респираторного заболевания, включающий метилксантиновое соединение и стероид в виде разовых доз, причем лекарственный состав вводят в организм посредством ингаляции для его доставки в легкие. Например, набор в соответствии с данным изобретением может представлять собой смесь метилксантинового соединения и стероида в правильном соотношении для одновременного введения. В альтернативных вариантах отдельные компоненты лекарственного состава могут использоваться самостоятельно для раздельного (одновременного или последовательного) введения.
В наиболее предпочтительном варианте метилксантиновое соединение и стероид используются в виде ингалятора для их введения в организм ингаляционным способом. Ингалятор может представлять собой объединенный баллон, в котором компоненты находятся в виде смеси, или спаренный баллон с раздельными компонентами, ингаляция которых происходит одновременно.
Такой набор может сопровождаться, например, инструкциями по применению, которые наставляют пользователя вдыхать оба компонента практически одновременно, чтобы они попадали в организм больного, особенно в его/ее легкие в одно и то же время.
В соответствии с изобретением в упомянутых наборах или разовых дозах стероид преимущественно представлен в такой дозе, которая недостаточна для лечебного эффекта при лечении только этим препаратом.
Важно отметить, что уровень активного вещества в плазме, достигаемый при использовании упомянутых доз метилксантинового соединения, в частности теофиллина (общая суточная доза 0,1-25 мг), бывает ниже того уровня, который в настоящее время считается необходимым для нужного клинического эффекта (10-20 мг/л) (Cazzola et al, Pulmonary Pharmacology & Therapeutics, 2004, 17, 141-145), и ниже того уровня, при котором удается продемонстрировать противовоспалительную активность (5 мг/л) (Culpitt et al., Am. J. Respir. Crit Care Med, 2002, 165(10): 1371-1376, Kobayasbi et al., Respirology, 2004, 9:249-254). Номинальная доза, которая попадает в легкие, может превышать эту цифру в зависимости от характеристик устройства и конкретного используемого лекарственного состава, однако изобретение предусматривает, что эффективная доза, приводящая к уровню метилксантина в плазме от 1 пг/л до 1 мг/л через 1 час после введения лекарственного средства, достаточна для лечения упомянутых респираторных заболеваний, если метилксантиновое соединение вводится в организм посредством ингаляции для доставки в легкие в комбинации со стероидным лекарственном средством.
Предпочтительный уровень метилксантинового соединения в плазме, который достигается так, как это описано выше, находится в диапазоне от 1 мкг/л до 1 мг/л, преимущественно 100 мкг/л - 1 мг/л, 250 мкг/л - 1 мг/л, 500 мкг/л - 1 мг/л или 750 мкг/л - 1 мг/л. В преимущественном варианте он составляет 950 мкг/л или менее, 900 мкг/л или менее, 850 мкг/л или менее либо 800 мкг/л или менее.
В вышеупомянутых аспектах изобретения дозировка стероида, которая не вызывает какого-либо заметного фармакологического эффекта на животной модели ХОБЛ, преимущественно составляла менее 0,5 мг/кг, предпочтительно - от 0,1 до 0,4 мг/кг, наиболее предпочтительно - от 0,1 до 0,3 мг/кг. В преимущественном варианте доза стероида составляет 0,1 мг/кг или менее.
Кроме того, изобретение обеспечивает способ лечения хронического респираторного заболевания, выбираемого из группы болезней, в которую входят хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз, астма, не поддающаяся лечению стероидами, тяжелая астма и педиатрическая астма, а суть этого способа заключается во введении больному человеку лекарственного состава, соответствующего вышеупомянутым аспектам изобретения.
В соответствии с изобретением эффективность лечения может быть проанализирована с использованием любой методики, способной оценивать воспаление. В предпочтительном варианте лечение респираторного заболевания оценивают путем подсчета клеток, восстановленных в бронхоальвеолярном смыве (БАС). Воспаление также можно оценивать в мокроте или в материале, полученном при биопсии бронхиального эпителия (Rutgers et al., Eur. Respir. J., 2000, 15(1):109-15). Возможна также и неинвазивная оценка легочного воспаления, которую осуществляют по методике позитронной эмиссионной томографии и поглощения
18F-фтордезоксиглюкозы (Jones et al., Eur. Respir. J., 2003, 21: 567-573).
Предпочтительно, легочные клетки выбираются из группы, в которую входят макрофаги, нейтрофилы и лимфоциты.
Данное изобретение способно значительно снижать воспаление при респираторных заболеваниях. Количество клеток при ингаляционном лечении метилксантиновым соединением и стероидом преимущественно снижается на 40% или более, предпочтительно на 44%, 50%, 60% или более.
В то же время индивидуальные дозы метилксантинового соединения и стероида, если оценивать их эффекты аддитивно, преимущественно могут снизить количество клеток в целом на 31% или менее, предпочтительно на 30% или менее, а в идеальном варианте на 20% или менее. С другой стороны, синергическое уменьшение количества клеток при совместном введении метилксантинового соединения и стероида составляет 40% или более, предпочтительно 44% и в идеальном варианте 50% или более, тогда как аддитивный эффект индивидуальных агентов предпочтительно составляет 31% или менее, а в преимущественном варианте 20% и менее.
Краткое описание чертежей
Фиг.1. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на общее количество клеток, восстанавливаемых в БАС через 24 часа после последнего контакта.
Фиг.2. Уровень теофиллина в плазме через 1 час после орального или интраназального введения в комбинации с дексаметазоном мышам, контактировавшим с ТД.
Фиг.3. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на количество макрофагов, восстанавливаемых в БАС через 24 часа после последнего контакта.
Фиг.4. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на количество нейтрофилов, восстанавливаемых в БАС через 24 часа после последнего контакта.
Фиг.5. Влияние теофиллина, дексаметазона или их комбинации при оральном или интраназальном введении на количество лимфоцитов, восстанавливаемых в БАС через 24 часа после последнего контакта.
Подробное описание изобретения
Данное изобретение использует стандартные методики фармакологии и биохимии, как это описано ниже с большими подробностями. В контексте изобретения некоторые термины имеют следующее специальное значение.
Изобретение описывает введение теофиллина и стероидных лекарственных средств в комбинации и противопоставляет комбинированное введение индивидуальному введению упомянутых лекарственных средств по отдельности. Таким образом, словосочетание "по отдельности" означает введение теофиллина без стероида (или наоборот) независимо от того, вводится ли стероид до теофиллина, параллельно с ним или после него. Изобретение проводит грань между применением теофиллина и стероида таким образом, что они проявляют свою фармакологическую активность в целевом организме одновременно или порознь.
"Комбинированное применение" или "комбинацию" в контексте данного изобретения необходимо понимать в том смысле, что индивидуальные компоненты могут вводиться в организм совместно (в виде комбинированного лекарственного средства), по отдельности, но почти одновременно (например, отдельными дозами) или вслед друг за другом (подряд или с подходящим интервалом по времени, при том условии, что оба средства будут активны в организме субъекта в одно и то же время).
Термин "эффективность" применительно к лечению воспалительных состояний и/или респираторного заболевания означает получение позитивного результата в анализе, при помощи которого измеряется воспаление при респираторном заболевании. Предпочтительным анализом считается подсчет клеток в бронхоальвеолярном смыве (БАС), причем наличие клеток свидетельствует о воспалительном процессе в легких. У больных людей предпочтительными методиками/материалами для оценки воспаления считаются БАС, индуцированная мокрота и бронхиальная биопсия. Воспаление можно индуцировать любыми уместными средствами, например вдыханием табачного дыма, введением раздражителей, в частности ЛПС и т.п. Предпочтительным вариантом является вдыхание табачного дыма, поскольку, как было ранее продемонстрировано в британской патентной заявке 0417481.9, использование ЛПС неточно воспроизводит резистентную к стероидам воспалительную реакцию, которая наблюдается при ХОБЛ. В контексте БАС/анализа с подсчетом клеток термин "эффективность" предпочтительно означает снижение количества клеток на 30%, 35%, 40%, 45%, 50%, 60%, 65%, 70% или более по сравнению с контролем, в котором не было использовано лекарственное средство.
Термин "неэффективность" в том же анализе означает намного более слабую ответную реакцию. В контексте БАС/анализа с подсчетом клеток термин "неэффективность" предпочтительно означает снижение количества клеток на 30% или менее, предпочтительно 28%, 27%, 26%, 25%, 24%, 23%, 22% или 21% или менее, еще предпочтительнее 20% или менее. В некоторых случаях понятие "неэффективность" охватывает ситуации, связанные с увеличением воспаления, о чем может свидетельствовать, например, увеличение количества клеток в анализируемом материале.
Термин "синергизм" означает, что эффективность двух средств больше ожидаемой при простом суммировании их индивидуального эффекта в рамках данного анализа. Например, если теофиллин и стероид снижают количество клеток в анализе БАС на 10% и 20% соответственно, в том случае, когда они используются по отдельности, то синергический эффект будет наблюдаться, если при комбинированном применении тех же средств в тех же дозах снижение клеток превысит 30%, предпочтительно превысит 35%, 40%, 50% или более.
Термин "введенный" означает введение всей дозы средства, например, в виде болюсной дозы, определенному субъекту. В контексте данного изобретения дозировка предпочтительно выражается в смысле достигаемого уровня активного вещества в плазме (<5 мг/л, 6-9 мг/л, 10-20 мг/л), причем уровень в плазме предпочтительно составляет менее 5 мг/л или еще более предпочтительно менее 1 мг/л.
"Доза" означает количество средства, введенного так, как это описано выше.
Форма "разовой дозы" означает подготовку фармацевтического состава в одной или более упакованных