Способ лечения распространенного рака яичников с отдаленными метастазами
Иллюстрации
Показать всеИзобретение относится к медицине, а именно онкологии, и может быть использовано для лечения распространенного рака яичников с отдаленными метастазами. Для этого проводят тотальное облучение тела в сочетании с локальной лучевой терапией. Тотальное облучение выполняют через 10-14 дней после хирургического вмешательства на линейном ускорителе электронов 2 раза в неделю в разовой дозе 0,1 Гр до суммарной дозы 1,0 Гр последовательным ротационным и статическим облучением переднезадними полями. Ротационное облучение выполняют при размещении больной непосредственно под изоцентром облучателя. Угол ротации α определяют по формуле α=2агс ctg (2(L+P0)/A), где А - рост; L - расстояние от изоцентра до середины переднезаднего размера, Р0 - половина переднезаднего размера на уровне середины тела. Статическое облучение осуществляют с использованием клиновидного фильтра. Углы наклона консоли от вертикали β со стороны нижних конечностей и со стороны головы определяют по формуле β=Аrс tg (A/4(L+P)), где Р - половина переднезаднего размера на уровне входа статического поля облучения. Дозу D с каждого поля рассчитывают по формуле D=Dr(1-((R+L+P)/(R+(L+P)/tgβ))2), где Dr - доза, отпускаемая с ротационного поля, R - расстояние от источника до центра ротации. Локальную лучевую терапию на манифестированные очаги осуществляют с разовыми дозами 3 Гр или 2 Гр и суммарными дозами от 40 Гр до 50 Гр. Химиотерапию выполняют через 1-2 месяца после окончания лучевой терапии в виде 6-9 курсов с интервалами между ними 2-3 месяца. Заявленный способ позволяет увеличить продолжительность жизни больных, снизить вероятность осложнений и побочных реакций. 3 ил.
Реферат
Изобретение относится к медицине, а именно к онкологии, и может найти применение при лечении первичного рака яичников и рецидивов заболевания с отдаленными метастазами за пределами брюшной полости.
Традиционным способом лечения первично-распространенного рака яичников в настоящее время является комбинированный метод, включающий операцию и химиотерапию, а при лечении рецидивов заболевания используется, как правило, только химиотерапия [«Вместе против рака», 2006, №1, с.23-33]. В отдельных случаях в лечении первичных больных и больных с рецидивами применяется локальная лучевая терапия.
Операцией выбора при раке яичников III-IV стадий считается надвлагалищная ампутация матки с придатками и большим сальником, однако, на практике в силу распространенности опухолевого процесса нередко выполняется лишь циторедуктивная операция. Химиотерапия проводится в виде 6-9 курсов преимущественно препаратами платины, таксанами, алкилирующими агентами.
Результаты современного химиохирургического лечения остаются весьма ограниченными. Частота объективного эффекта (полная ремиссия, частичная ремиссия, стабилизация опухолевого процесса), по данным различных авторов, составляет 24-60% при средней продолжительности жизни больных 8-24 мес. [Русский медицинский журнал, спец. выпуск «Онкология», 1998, Т.6, №10, с.671-676]. Показатели пятилетней выживаемости больных распространенным раком яичников варьируют от 5 до 25% [Материалы IX Российского онкологического конгресса, Москва, 2005, с.22-24].
Лучевая терапия рака яичников имеет длительную предысторию и в настоящее время с определенным успехом используется в комбинации с операцией и химиотерапией лишь в лечении локализованных форм, в основном, при I-II стадиях заболевания в виде равномерного облучения малого таза [Тез. II съезда онкологов стран СНГ.- Киев. - 2000. - с.1027: Eur. J. of Cancer 1997, V.33 (1), P.12-19]. При III стадии заболевания применение локальной лучевой терапии, по мнению ряда авторов, возможно в случаях микроскопических или минимальных макроскопических опухолевых остатков после радикальных операций, когда облучение малого таза и брюшной полости проводится в адъювантных суммарных дозах не более 20-30 Гр в сочетании с химиотерапией [Eur. J. Gynaecol Oncol., 1993, V.14(9), P.133-139; Radiother Oncol., 1993, V.26(l), Р.26-32]. Однако средняя продолжительность жизни больных даже с минимальными остатками опухоли не превышает 26 месяцев, что объясняется высокой частотой осложнений и в связи с этим недостаточной дозой облучения [Int. J. Radiat. Ongol. Biol. Phys., 1991, V.20(4), P.661-665]. В большинстве же случаев рака яичников III-IV стадий, в силу высокой степени распространения опухолевого процесса, невозможно выполнение радикальной операции. Операция носит циторедуктивный характер и требуется облучение всей брюшной полости в туморицидных дозах. Как показала клиническая практика, низкая толерантность органов брюшной полости чаще всего не позволяет это осуществить. В 30-40% наблюдений лучевую терапию вынужденно прекращают либо ограничиваются облучением малого таза [Int. J. Radiat. Ongol. Biol. Phys., 1991, V.21(9), P.835-845; Eur. J. Gynaecol Oncol., 1993, V.14(9), P.133-139; Int. J. Radiat. Oncol. Biol. Phys., 1999, V.128(6), P.617-665]. При этом пятилетняя выживаемость больных после операции, облучения и химиотерапии колеблется от 2,5 до 8,8%. Авторы приходят к мнению, что лучевая терапия при раке яичников III-IV стадий может выполнять лишь роль консолидирующего лечения при микроскопических опухолевых остатках.
Учитывая неудовлетворительные результаты традиционного химио-хирургического лечения и ограниченные возможности локального облучения при раке яичников, продолжаются поиски новых вариантов комбинированного лечения этой тяжелой категории больных.
В последние годы в ряде клиник изучается методика применения локальной лучевой терапии в качестве заключительного компонента комбинированного лечения рака яичников III-IV стадий после выполнения циторедуктивной операции, 4-6 курсов химиотерапии таксанами и/или препаратами платины и операции «Sekond-look» [Ann. Oncol., 1996, V.7(1), P.65-70; Cancer J. Sci. Am., 1997, V.3(6), Р.358-363]. На лучевую терапию отбираются больные, находящиеся, практически, в состоянии ремиссии. Выполняется облучение брюшной полости в суммарной дозе 25-30 Гр. Однако в 30-40% наблюдений лучевую терапию завершить не удается в связи с осложнениями со стороны органов желудочно-кишечного тракта и гематологической токсичностью. Пятилетняя выживаемость больных с разными стадиями (I-IV) заболевания при данной методике лечения составляет 11-33%, при этом в разработку не включаются пациенты с опухолевыми остатками после первой операции 3 см и более, в то время как при III и особенно IV стадии, таких больных большинство.
Наиболее близким к предлагаемому является способ комплексного лечения диссеминированного рака яичников с применением хирургического вмешательства, полихимиотерапии и локальной лучевой терапии [Ю.М.Крейнина «Современная лекарственная и автоматизированная лучевая терапия местнораспространенных и диссеминированных форм рака яичников». Автореф. канд. дисс., Москва, 1999, 28 с] (прототип). Среди 110 пролеченных больных 72% имели III-IV стадии заболевания. Все больные после операции получали полихимиотерапию препаратами платины и таксанами, по окончании которой у 49,3% были остаточные опухолевые очаги более 5 см в малом тазу, в подкожной клетчатке, в культе большого сальника, в брюшной полости или обширная диссеминация по брюшине с формированием асцита.
Лучевая терапия выполнялась дистанционно на аппарате РОКУС-АСПЕКТ. Облучалась не вся брюшная полость, а конкретные очаги опухоли. Максимальное соответствие терапевтического изодозного контура форме и объему облучаемой опухоли достигалось с помощью компьютерного выбора планов облучения в условиях многоцентрового статического и подвижного облучения с использованием радиационных пучков различных размеров. Суммарные поглощенные дозы составили: на опухолевые очаги, расположенные в малом тазу, 30-40 Гр, на переднюю брюшную стенку и париетальную брюшину - 20-30 Гр, на множественные очаги опухоли более 3 см в малом тазу и брюшной полости, а также на конгломераты более 6 см в брюшной полости - 20-30 Гр. При остаточной опухоли в дугласовом пространстве, культе шейки матки или влагалище выполнялась внутриполостная лучевая терапия на аппарате АГАТ-ВУ в дозе до 30 Гр.
Лучевая терапия либо последовательно комбинировалась с химиотерапией по схемам CAP/CP (препараты платины, доксорубицин, циклофосфан/платина, циклофосфан), Т (таксаны), TP (таксаны, платина), либо облучение и химиотерапия выполнялись одновременно с использованием нетрадиционных режимов дробления курсовой дозы таксола и платины.
Сочетанное применение лучевой и химиотерапии у больных распространенным раком яичников с наличием крупных опухолевых очагов и диссеминации в брюшной полости позволило добиться положительного эффекта у 15 из 23 (65,2%) больных, которым традиционно проводится лишь симптоматическое лечение. При этом частичная ремиссия достигнута у 4 (17,4%), стабилизация опухолевого процесса - у 11 (47,8%) больных. В 8 (34,8%) наблюдениях эффекта не было, отмечено прогрессирование заболевания. При прослеживании больных установлено, что одногодичная выживаемость составила 33,3%, двухлетняя - 18,3%. Для сравнения традиционное лечение подобных больных без лучевой терапии позволяет достичь одногодичной выживаемости 31,6%, двухлетней - 11,4%.
Таким образом, несмотря на отмеченный непосредственный эффект применения лучевой терапии при раке яичников III-IV стадий, сравнительно небольшое количество наблюдений не позволяет установить статистически достоверного преимущества отдаленных результатов. Кроме того, проведение химиолучевого лечения сопровождалось большим количеством осложнений: со стороны желудочно-кишечного тракта (тошнота/рвота в 83,3%, диарея в 38,3%), угнетение гемопоэза (анемия в 71,7%, лейкопения в 73,3%, тромбоцитопения в 41,6%), нарушение функции почек - у 41,7% больных.
Задача настоящего изобретения - увеличение продолжительности жизни больных и снижение числа осложнений за счет использования в схеме лечения тотального облучения тела (ТОТ) больной.
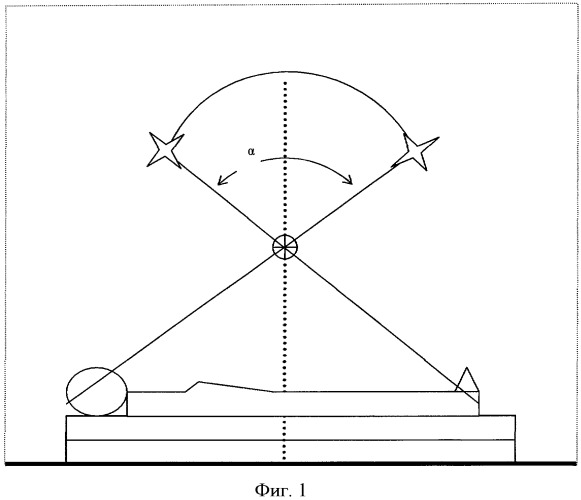
Эта задача решена тем, что в известном способе лечения распространенного рака яичников с отдаленными метастазами, включающем хирургическое вмешательство в доступном объеме, химиотерапию и лучевую терапию, согласно изобретению лучевую терапию осуществляют путем тотального облучения тела в сочетании с локальным на манифестированные опухолевые очаги, причем ТОТ выполняют через 10-14 дней после хирургического вмешательства на линейном ускорителе электронов 2 раза в неделю в разовой дозе 0,1 Гр до суммарной дозы 1,0 Гр путем последовательного ротационного и статического облучения переднезадними полями, при этом ротационное облучение выполняют при размещении больной непосредственно под изоцентром облучателя (фиг.1) с углом ротации α, определяемым по формуле
α=2arc ctg (2 (L+P0)/A),
где А - рост больной;
L - расстояние от изоцентра до середины переднезаднего размера больной,
Р0 - половина переднезаднего размера больной на уровне середины ее тела,
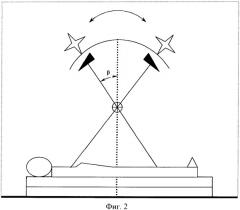
статическое облучение осуществляют с использованием клиновидного фильтра, направляя основание его к середине тела больной (фиг.2), при этом углы наклона консоли от вертикали (β) со стороны нижних конечностей и со стороны головы облучаемой больной определяют по формуле
β=Arc tg (A/4(L+P)),
где Р - половина переднезаднего размера больной на уровне входа статического поля облучения,
отпускаемую дозу D с каждого поля рассчитывают индивидуально по формуле
D=Dr(1-((R+L+P)/(R+(L+P)/tg β))2),
где Dr - доза, отпускаемая с ротационного поля,
R - расстояние от источника до центра ротации,
локальную лучевую терапию на манифестированные очаги осуществляют одновременно или непосредственно после ТОТ в режиме среднего или обычного фракционирования с разовыми дозами соответственно 3 Гр или 2 Гр и суммарными дозами от 40 Гр до 50 Гр, а химиотерапию выполняют через 1-2 мес. после окончания лучевой терапии традиционно применяемыми препаратами (алкилирующие агенты, препараты платины) в виде 6-9 курсов с интервалами между ними 2-3 мес.
Несмотря на то, что в последние годы ТОТ находит применение в онкологии, в частности, при лечении неоперабельного рака легких, злокачественных лимфом Ходжкина поздних стадий, при лечении распространенного рака яичников ТОТ не использовался. Это вызвано, на наш взгляд, общим мнением о бесперспективности лучевого лечения при этой патологии, поскольку, как было сказано выше, при раке яичников III-IV стадий опухолевый процесс распространяется по всей брюшной полости и за ее пределами, облучение же указанной зоны в туморицидных дозах практически невозможно в связи с низкой толерантностью органов брюшной полости и костного мозга. Как показывает клинический опыт, в 30-40% наблюдений лучевую терапию вынужденно прекращают в связи с выраженными осложнениями со стороны органов желудочно-кишечного тракта и гематологической токсичностью. При этом пятилетняя выживаемость больных после операции, облучения и химиотерапии колеблется от 2,5 до 8,8%.
В 90-е годы в отдельных исследованиях были предприняты попытки использования лучевой терапии при раке яичников III-IV стадий после операции и нескольких курсов химиотерапии на единичные остаточные опухолевые очаги (например, в способе-прототипе) или фактически в состоянии клинической ремиссии. Однако существенного увеличения продолжительности жизни больных достигнуто не было, а число осложнений как со стороны желудочно-кишечного тракта, так и органов кроветворения, оставалось значительным. В последние 10 лет количество исследований по применению лучевой терапии в лечении больных раком яичников резко сократилось, и онкологами был сделан выбор в пользу комбинации хирургического вмешательства лишь с химиотерапией.
В РНЦ РХТ Росмедтехнологий (ранее ЦНИРРИ) в течение нескольких десятилетий проводилось изучение воздействия на живой организм тотального облучения, в том числе при наличии онкопатологии. Ученые считают, что отличительной особенностью ТОТ от других видов лучевой терапии является то, что прямое воздействие радиации на опухоль, метастатические очаги и отдельные опухолевые клетки сопровождается полным облучением кроветворной и лимфоидной систем. При этом терапевтический эффект ТОТ может обеспечиваться как путем непосредственного радиационного воздействия на опухолевые клетки, так и по опосредованному механизму, состоящему в сокращении трофического снабжения опухоли недифференцированными лимфоцитами за счет либо частичной ингибиции лимфопоэза, либо отвлечения части трофических клеток от опухоли на регенерацию здоровых тканей организма опухоленосителя, поврежденных в процессе ТОТ. В связи с тем, что, как показали проводимые исследования, ТОТ, в отличие от полихимиотерапии, менее токсичен и достаточно легко переносится больными, в клинике института были сделаны попытки использования ТОТ при лечении онкологических больных с распространенным опухолевым процессом.
Однако широкое применение ТОТ в клинических условиях ограничивается серьезными техническими трудностями, связанными, в первую очередь, с необходимостью получения в теле больного равномерного распределения поглощенной дозы. Это при использовании неподвижных источников излучения требует либо больших помещений для осуществления облучения полями, соизмеримыми с ростом больных (расстояние от источника излучения до облучаемой поверхности тела 4-5 м) и применения блоков-компенсаторов для выравнивания поглощенной дозы (билатеральная схема ТОТ, авторское свидетельство №1769418 А61N 5/10), либо использования движущегося с заданной скоростью под головкой облучателя терапевтического стола (тележки) с пациентом. Но такие условия облучения все же связаны с неравномерностью распределения поглощенной дозы в пределах 5-20%.
В дальнейшем в РНЦ РХТ Росмедтехнологий был разработан новый способ выполнения ТОТ путем ротации источника ионизирующего излучения над пациентом с применением для равномерного распределения поглощенной дозы в теле больного поглотителя излучения [патент РФ №2159131, A61N 5/10 на «Способ тотального облучения тела пациента», БИ №32, 2000 г.]. Предложенный авторами патента способ ТОТ путем ротации источника излучения над пациентом с использованием поглотителя излучения связан с другими трудностями, а именно необходимостью изготовления такого поглотителя (по разработанным авторами формулам) для каждого пациента с учетом его роста и конституции, что длительно и очень трудоемко. Кроме того, изготавливаемый поглотитель ослабляет ионизирующее излучение, что приводит к уменьшению поглощенной дозы облучения и увеличению длительности процедуры, при этом возможно в определенной степени усиление неравномерности распределения дозы излучения в теле больных.
Все сказанное выше очень ограничивает возможности применения ТОТ в медицинской практике, ибо предлагаемые методики выполнения ТОТ доступны лишь крупным научным центрам.
Нами впервые предпринята попытка использования ТОТ в лечении больных раком яичников IV стадии и с распространенными рецидивами заболевания. Предлагаемый нами способ устраняет вышеперечисленные трудности осуществления ТОТ, не требуя больших процедурных помещений и индивидуального изготовления поглотителей ионизирующего излучения, и, вместе с тем, с высокой степенью достоверности обеспечивает равномерное распределение поглощенной дозы в теле больных. Это обеспечивается за счет комбинации ротационного облучения со статическим, причем последнее позволяет компенсировать возникающую при ротационном облучении неравномерность распределения дозы вдоль тела больной.
Использование ТОТ в лечении больных раком яичников, как показали наши наблюдения за пролеченными больными, по эффективности в полной мере заменяет и даже, учитывая высокие отдаленные результаты, превосходит курс химиотерапии и легче переносится больными. Отсутствие серьезных осложнений при проведении ТОТ сделало возможным проведение одновременно или непосредственно после ТОТ локальной лучевой терапии на манифестированные очаги с последующей (через 1-2 мес.) химиотерапией в виде 6-9 курсов. Возможность осуществления комплексного лечения, включающего операцию, ТОТ, локальное облучение и химиотерапию, способствовала увеличению продолжительности жизни больных. Из пяти пролеченных таким способом пациенток с IV стадией первичного рака яичников или с распространенным рецидивом заболевания три прожили более 2 лет, одна - 4 года 5 мес., а одна живет 17 лет и продолжает наблюдаться.
Поскольку ТОТ, как свидетельствуют полученные нами результаты, оказывается более эффективным способом лечения по сравнению с курсом химиотерапии за счет, как было отмечено выше, комбинации прямого цитостатического воздействия на опухоль и опосредованного системного воздействия через систему лимфопоэза, даже однократное применение ТОТ позволяет в дальнейшем использовать менее токсичные схемы химиотерапии с возможностью их повторения, обеспечивая тем самым длительный контроль опухолевого процесса, предупреждая возможность рецидивирования. Использование же химиотерапии непосредственно после хирургического вмешательства, а тем более в сочетании с локальной лучевой терапией, сопровождается выраженными гематологическими реакциями (анемией, лейко- и тромбоцитопенией) и осложнениями со стороны желудочно-кишечного тракта, что нередко препятствует продолжению комбинированного лечения больных и, тем самым, сокращает продолжительность их жизни.
Применение ТОТ, как показал наш опыт, в лечении больных раком яичников IV стадии с наличием отдаленных метастазов обеспечивает также усиление системного компонента комплексного лечения за счет комбинации системного лучевого и системного химиотерапевтического воздействия.
Режимы осуществления способа лечения распространенного рака яичников с отдаленными метастазами найдены нами опытным путем, а предлагаемые условия выполнения ротационного и статического тотального облучения с использованием приведенных формул позволяют проводить облучение быстро, точно и эффективно.
Сущность способа поясняется следующими примерами:
ПРИМЕР 1. Больная К., 1922 г.р., и/б №2413, впервые поступила в клинику ЦНИРРИ 23.12.92 г. с диагнозом: Рак яичников с метастазами по брюшине, в поясничные и правые надключичные лимфоузлы, стадия - IV T3cN1M1.
При клиническом обследовании в ЦНИРРИ было обнаружено:
- 25.12.92 г. при гинекологическом осмотре установлено: матка не увеличена, смещена влево бугристым образованием, исходящим из правого яичника и выполняющим малый таз с выходом в брюшную полость с верхней границей на уровне пупка. В дугласовом пространстве - опухолевый узел 3×5 см. В области большого сальника пальпировалась бугристость 8×5 см.
25.12.92 г. при общем осмотре был выявлен конгломерат надключичных лимфатических узлов справа 3×3,5 см;
- 29.12.92 г. по данным УЗИ в малом тазу и брюшной полости обнаружено кистозно-солидное образование 14,4×8 см, исходящее из правого яичника. Вокруг аорты в поясничной области имелся конгломерат лимфатических узлов, каждый из которых был 2,5 см в диаметре.
Лечение начато с хирургического вмешательства. 14.01.93 г. была выполнена операция в объеме - надвлагалищной ампутации матки с придатками с обеих сторон, удаление большого сальника. При ревизии во время операции выявлено: матка и левые придатки не увеличены, без опухоли. Правый яичник превращен в кистозно-солидное образование 18×15×12 см с опухолево-измененной маточной трубой. Обнаружено метастатическое поражение брюшины малого таза и брюшной полости. Большой сальник - плотная бугристая опухоль 10×5×3 см. Забрюшинно на уровне L3-L4 имелся плотный, бугристый, несмещаемый конгломерат поясничных лимфатических узлов 5×5 см.
При гистологическом исследовании операционного материала было установлено: «Серозная цистаденокарцинома правого яичника с метастазами в большой сальник, маточную трубу и лимфатические узлы» (№О-85930-37).
Послеоперационный период протекал без осложнений.
При гинекологическом осмотре 02.02.93 г. было отмечено: Культя шейки матки не увеличена. В дугласовом пространстве определялась мелкая бугристость 4×3 см, переходящая в плотный тяж в левом своде, 4×2×2 см. Через переднюю брюшную стенку определялся конгломерат поясничных лимфатических узлов 5×5 см. В надключичной области по-прежнему пальпировался несмещаемый пакет метастатически измененных лимфатических узлов.
Учитывая распространенность опухолевого процесса, было принято решение о проведении сочетано-лучевой терапии, включающей тотальное облучение тела и локальное облучение надключичных и поясничных лимфоузлов.
Тотальное облучение тела осуществлялось с 18.02.93 г. до 23.03.93 г. на линейном ускорителе электронов СЛ 75-5МТ путем последовательного ротационного и статического облучения переднезадними полями 2 раза в неделю в разовой дозе 0,1 Гр и суммарной 1,0 Гр.
Предварительно была проведена предлучевая подготовка.
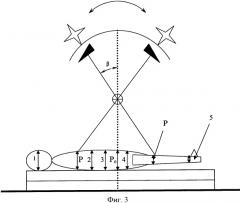
Перед облучением были замерены топометрические данные больной (фиг.3): рост 160 см, переднезадние размеры тела на уровне центра головы (1) - 16 см, диафрагмы (2) - 19,5 см, центра малого таза (3) - 21,5 см, середины бедра (4) - 13,5 см, на уровне голеностопного сустава (5) - 9 см. Эти данные использованы при определении половины переднезаднего размера на уровне середины тела (Р0) и в местах входа статических полей облучения (Р) путем линейной интерполяции между двумя ближайшими значениями, при этом Р=10 см и 9,5 см, Р0=10,5 см.
Затем для подготовки ротационного облучения был определен угол ротации α по формуле
α=2arc ctg (2 (L+P0)/A),
где А - рост пациентки, равный 160 см;
L - расстояние от изоцентра до поверхности пациентки по вертикали,
Р0 - половина переднезаднего размера больной на уровне середины тела, полученного путем линейной интерполяции анатомических данных.
В данном примере L+Р0 равно 84,5 см (74+10,5). При этом биссектриса угла ротации проходит через центр тела больной.
Угол ротации равен α=2arc ctg (2×84,5/160)=93°. Сектор ротационного облучения таким образом ограничен следующими параметрами: от 318,5° (360°-41,5° с учетом перехода сектора ротации через нулевое значение) до 41,5° и составил 93°.
Для планирования статического облучения, также направленного на центр больной, был определен угол наклона консоли ускорителя с использованием стандартного клиновидного фильтра с направлением основания его к середине тела больной, при этом углы наклона консоли от вертикали со стороны нижних конечностей и со стороны головы определяли по формуле
β=Arctg(A/4 (L+P)=Arctg(160/(4(70+10))=26,5°,
где Р - половина переднезаднего размера больной на уровне входа статического поля облучения, также полученного путем линейной интерполяции анатомических данных.
Затем определяли дозу излучения, необходимую для статического облучения по формуле
D=Dr(1-((R+L+P)/(R+(L+P)/tg β))2),
где Dr - доза, отпускаемая с ротационного поля при заданной дозе облучения 0,05 Гр.
При статическом облучении таким образом отпускаемая доза у пациентки со стороны головы при половине переднезаднего размера 10 см составила D=0,05(1-((100+70+10)/(100+(70+10)/tg β))2)=2,65 сГр, а со стороны ног при половине переднезаднего размера в этой зоне 9,5 см - 2,6 сГр.
Тотальное облучение осуществляли на линейном ускорителе электронов путем последовательного ротационного и статического облучения переднезадними полями. Больную располагали на терапевтическом столе так, чтобы центр тела находился непосредственно под изоцентром головки облучателя при вертикальном положении консоли. Облучение начинали в ротационном режиме с сектором качаний от 318° до 42° (с учетом округления до целого значения величины углов). При этом биссектриса угла ротации проходила через центр тела больной. Доза отпускалась из расчета 0,05 Гр на срединную ось в центре тела пациентки спереди и сзади.
Далее проводили облучение в статическом режиме с использованием клиновидного фильтра. При наклоне консоли ускорителя под углом 26,5° осуществляли облучение со стороны ног, затем со стороны головы с отпускаемыми дозами 2,6 сГр и 2,65 сГр соответственно.
Больной с 18.02.93 г. до 23.03.93 г. было проведено 10 сеансов ТОТ в суммарной поглощенной дозе на срединную плоскость тела 1,0 Гр.
Тотальное облучение тела сочеталось с локальным облучением поясничных лимфатических узлов. Облучение проводилось с 24.02.93 г. по 26.03.93 г. на линейном ускорителе электронов СЛ 75-5МТ по традиционной методике: в статическом режиме, передним и заднебоковым полями 6×8 см с разовой дозой 3 Гр 3 раза в неделю до суммарной дозы 42 Гр. Дополнительно с 26.02.93 г. по 19.03.93 г. было осуществлено облучение правых надключичных лимфатических узлов полем 6×6 см в стандартном статическом режиме с разовой дозой 3 Гр в неделю до суммарной дозы 30 Гр.
Лучевую терапию больная перенесла хорошо. Жалоб не было. Отмечена лишь умеренная лейкопения с 19.03.93 г. (2,1×109/л).
Больная была осмотрена гинекологически 26.03.93 г. после завершения облучения. Обнаружено: Культя шейки матки не увеличена. В дугласовом пространстве определялась легкая бугристость без четких контуров. В области поясничных лимфатических узлов пальпировался плоский тяж 2,5×1 см, в зоне надключичных - бугристость 1×1,5 см. Отмечена частичная ремиссия.
29.03.93 г. больная была выписана в удовлетворительном состоянии домой под наблюдение онколога по месту жительства.
Повторное поступление в клинику ЦНИРРИ с 05.05.93 г. по 25.05.93 г., и/б №423. Поступила в удовлетворительном состоянии, без жалоб. При гинекологическом осмотре 06.05.93 г. было выявлено: Культя шейки матки не увеличена, в дугласовом пространстве - легкая бугристость без четких контуров, в области поясничных лимфатических узлов - плоский тяж 2,5×1 см. Надключичные лимфоузлы не пальпировались. Состояние частичной ремиссии сохранялось. По данным УЗИ от 06.05.93 г. в малом тазу и брюшной полости опухолевых образований не обнаружено, в дугласовом пространстве - лишь рубцовая ткань 2,5×1 см. С 11.05.93 г. по 24.05.93 г. был проведен курс адъювантной химиотерапии по схеме CMF препаратами: циклофосфан по 200 мг в/м ежедневно 14 дней, метотрексат по 25 мг в/м в 1, 5, 9, 13 дни курса и 5-фторурацил по 500 мг в/в в 1 и 8 дни. Химиотерапию перенесла хорошо. С 20.05.93 г. были отмечены умеренная анемия (эритроциты 91×1012/л), лейкопения (2,1×109/л) и тромбоцитопения (118×109/л), которые не требовали медикаментозной коррекции. Больная выписана 25.05.93 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
Повторная госпитализация в клинику ЦНИРРИ с 1.07.93 г. по 26.07.93 г., и/б №1407. Пациентка поступила в удовлетворительном состоянии, без жалоб. При гинекологическом осмотре 02.07.93 г. в малом тазу и брюшной полости опухолевых образований выявлено не было. При общем осмотре 02.07.93 г. надключичные лимфатические узлы не пальпировались. По данным УЗИ от 02.07.93 г. в малом тазу и брюшной полости опухолевые образования не обнаружены. 02.07.93 г. была установлена полная клиническая ремиссия. С 5.07.93 г. по 18.07.93 г. проведен 2-й курс химиотерапии по схеме CMF (циклофосфан 2800 мг, метотрексат 100 мг и 5-фторурацил 1000 мг). Химиотерапию пациентка перенесла хорошо. Гематологическая реакция выражалась в лишь умеренной лейкопении (2,3×109/л) и тромбоцитопении (109×109/л). Больная была выписана 26.07.93 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
Повторное поступление в клинику ЦНИРРИ - с 21.10.93 г. по 16.11.93 г. (и/б 2097) без жалоб. Пациентка поступила в удовлетворительном состоянии. При гинекологическом осмотре 22.10.93 г. в малом тазу и брюшной полости опухолевых образований выявлено не было. При общем осмотре 22.10.93 г. надключичные лимфатические узлы не пальпировались. По данным УЗИ от 29.10.93 г. в малом тазу и брюшной полости опухолевых образований обнаружено не было. Полная клиническая ремиссия сохранялась. С 1.11.93 г. по 14.11.93 г. был проведен 3-й курс химиотерапии по схеме CMF, больная получила циклофосфан (2800 мг), метотрексат (100 мг) и 5-фторурацил (1000 мг). Химиотерапию перенесла хорошо, лишь с 11.11.93 г. была отмечена умеренная тромбоцитопения (105×109/л), не требующая медикаментозного лечения. Пациентка выписана 16.11.93 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
Повторная госпитализация в клинику ЦНИРРИ была с 14.01.94 г. по 07.02.94 г., и/б №403. Больная поступила в удовлетворительном состоянии, без жалоб. При гинекологическом осмотре 17.01.94 г. в малом тазу и брюшной полости опухолевых образований выявлено не было, поясничные и надключичные лимфатические узлы не пальпировались. По данным УЗИ от 18.01.94 г. в малом тазу и брюшной полости опухолевые образования не обнаружены. Ремиссия продолжалась. С 20.01.94 г. по 02.02.94 г. был проведен 4-й курс химиотерапии по схеме CMF (циклофосфан 2800 мг, метотрексат 100 мг и 5-фторурацил 1000 мг). Химиотерапию больная перенесла хорошо, реакций и осложнений не было, выписана домой 07.02.94 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
Повторное поступление в ЦНИРРИ - с 01.04.94 г. по 22.04.94 г., и/б №1347. Жалоб при поступлении не было. При гинекологическом осмотре 01.04.94 г. и по данным УЗИ от 04.04.94 г. опухолевых очагов в малом тазу и брюшной полости не выявлено, поясничные и надключичные лимфатические узлы не пальпировались. Ремиссия продолжалась. С 05.04.94 г. по 18.04.94 г. был проведен 5-й курс химиотерапии по схеме CMF (циклофосфан 2800 мг, метотрексат 100 мг и 5-фторурацил 1000 мг). Химиотерапию пациентка перенесла хорошо, реакций и осложнений не было, выписана 22.04.94 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
С 20.06.94 г. по 08.07.94 г. - повторная госпитализация в ЦНИРРИ, и/б №1125. При поступлении жалоб не было. При осмотре 21.06.94 г. и по данным УЗИ от 22.06.94 г. опухолевых очагов в малом тазу и брюшной полости не вывялено, лимфатические узлы не пальпировались, ремиссия продолжалась. В плановом порядке с 23.06.94 г. по 06.07.94 г. был проведен 6-й курс химиотерапии по схеме CMF, больная получила циклофосфан (2800 мг), метотрексат (100 мг) и 5-фторурацил (1000 мг). Химиотерапию перенесла хорошо, реакций и осложнений не было. Выписана 08.07.94 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
В дальнейшем пациентка регулярно 1 раз в 2-3 месяца наблюдалась амбулаторно в ЦНИРРИ. По результатам гинекологических осмотров и УЗИ состояние расценивалось как полная клиническая ремиссия.
При амбулаторном осмотре 16.07.96 г. больная предъявила жалобы на слабость. Пальпаторно и по данным УЗИ был обнаружен опухолевый конгломерат в культе большого сальника 10×8×6 см. Зафиксирован рецидив заболевания. Таким образом ремиссия продолжалась 3 года 1 месяц. Учитывая отпуск в клинике ЦНИРРИ, пациентка была направлена на лечение в Городской онкологический диспансер, где в дальнейшем и наблюдалась. По сообщению родственников больная умерла от генерализации рака яичников 14.06.97 г. Продолжительность жизни от начала лечения составила 4 года 5 месяцев.
ПРИМЕР 2. Больная К., 1939 г.р., и/б №2199, впервые поступила в клинику ЦНИРРИ 29.11.94 г. с диагнозом: Рак яичников IV T3cNxM1. Рецидив после операции и 6 курсов химиотерапии.
Из анамнеза известно:
28.03.90 г. в Городском онкодиспансере (ГОД) выполнена операция - надвлагалищная ампутация матки с придатками и большим сальником по поводу рака яичников (гистологически - «Серозная цистаденокарцинома яичников с метастазами в сальник»). В 1990-1992 гг. больная получила 6 курсов химиотерапии препаратами ТИО-ТЭФ с курсовой дозой 240 мг, 5-фторурацил в дозе 6,0 г и циклофосфан - в дозе 1,0 г. Наблюдалась в ГОД, где при очередном осмотре 24.11.94 г. был обнаружен рецидив рака яичников в виде конгломерата тазовых лимфатических узлов справа 4,5×3,5 см. Больная направлена в ЦНИРРИ для консультации и дальнейшего лечения.
При клиническом обследовании в ЦНИРРИ было обнаружено:
- 09.12.94 г. при гинекологическом осмотре справа от неувеличенной культи шейки матки на стенке малого таза выявлено плотное, бугристое образование 6×6 см, представляющее собой конгломерат тазовых лимфатических узлов;
- 09.12.94 г. при общем осмотре обнаружен конгломерат надключичных лимфатичееких узлов слева 3×3 см;
- 09.12.94 г. по данным УЗИ: В малом тазу на правой стенке определялись 2 гипоэхогенных очага 3,7×4,0 и 1,3×2,0 см - метастатически пораженные тазовые лимфоузлы;
- клинические анализы крови и мочи - в пределах нормы.
В процессе клинического обследования диагноз был подтвержден - Рак яичников IV Т3сNxM1. Рецидив с метастатическим поражением тазовых и надключичных лимфатических узлов.
Лечение было начато с сочетанной лучевой терапии, включающей тотальное облучение тела и локальное облучение манифестируемых опухолевых очагов.
Тотальное облучение тела осуществлялось с 15.12.94 г. по 17.01.95 г. на линейном ускорителе электронов СЛ 75-5МТ так же, как и в примере №1, путем последовательного ротационного и статического облучения переднезадними полями 2 раза в неделю в разовой дозе 0,1 Гр и суммарной 1,0 Гр.
Предварительно также была проведена предлучевая подготовка:
- замерены топометрические данные больной (как и в примере №1): рост, переднезадние размеры тела на разных уровнях с целью определения половины переднезаднего размера на уровне середины тела и в местах входа статических полей облучения,
- для подготовки ротационного облучения рассчитан начальный угол ротации α, который составил 90°, и определен сектор ротации, ограниченный параметрами: от 315° до 45°;
- рассчитан угол наклона станины β, равный 28°, и доза излучения D для проведения статического облучения, которая составила как со стороны ног, так и со стороны головы 1,4 сГр.
Тотальное облучение выполнялось по той же технологии как и в примере №1, проведено 10 сеансов до суммарной дозы 1,0 Гр.
Тотальное облучение тела сочеталось с локальной лучевой терапией на область правых тазовых и поясничных лимфатических узлов. Облучение проводилось с 23.12.94 г. по 27.01.95 г. на линейном ускорителе электронов СЛ 75-5МТ по традиционной методике: в статическом режиме, фигурным полем, с разовой дозой 3 Гр 3 раза в неделю до суммарной дозы 45Гр. Дополнительно с 23.12.94 г. по 16.01.95 г. осуществлялось облучение правых надключичных лимфатических узлов в стандартном режиме с разовой дозой 3 Гр в неделю до суммарной дозы 30 Гр.
Лечение перенесла хорошо, жалоб не предъявляла, состояние удовлетворительное. С 01.02.95 г. отмечена лишь умеренная лейкотромбоцитопения: лейкоциты 2,15×109/л, тромбоциты 95×109/л. Пациентка была выписана из стационара 03.02.95 г. в удовлетворительном состоянии без жалоб под наблюдение онколога по месту жительства с рекомендациями по режиму и диете для нормализации показателей крови.
Повторное поступление в клинику ЦНИРРИ с 01.03.95 г. по 27.03.95 г., и/б №379. Поступила в удовлетворительном состоянии, без жалоб. При гинекологическом осмотре 02.03.95 г. на правой стенке малого таза пальпировалась плоская, уплотненная (рубцовая) площадка 4×2,5 см, культя шейки матки не увеличена, дугласово пространство свободно. При общем осмотре 02.03.95 г. надключичные лимфатические узлы не определялись. По данным УЗИ от 02.03.95 г. в малом тазу и брюшной полости опухолевые образования не обнаружены. Состояние было расценено как стабилизация опухолевого процесса. С 10.03.95 г. по 23.03.95 г. проведен курс адъювантной химиотерапии по схеме CMF препаратами: циклофосфан по 200 мг в/м ежедневно 14 дней, метотрексат по 25 мг в/м в 1, 5, 9, 13 дни курса и 5-фторурацил по 500 мг в/в в 1 и 8 дни. Химиотерапию пациентка перенесла хорошо, лишь с 16.03.95 г. была отмечена умеренная тромбоцитопения (114×109/л). Больная выписана 27.03.95 г. в удовлетворительном состоянии под наблюдение онколога по месту жительства.
При амбулаторном осмотре 25.04.95 г. опухолевых образований в малом тазу и брюшной полости обнаружено не было. На правой стенке таза пальпировалась рубцовая площадка 3×1,5 см. Надключичные лимфоузлы не определялись. Состояние было расценено как частичная ремиссия.
Повторная госпитализация в клинику ЦНИРРИ с 03.05.95 г. по 25.05.95 г., и/б №2078. Больная поступила в удовлетворительном состоянии, без жалоб. При гинекологическом осмотре 03.05.95 г. в малом тазу и брюшной полости опухолевых образований не выявлено, на правой стенке малого таза определялась рубцовая площадка без четких контуров. При общем осмотре 03.05.95 г. надключичные лимфатические узлы не пальпировались.