Трихлорцинкат лития
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Трихлорцинкат лития получен взаимодействием хлорида лития с хлоридом цинка в среде диэтилового эфира и соответствует химической формуле LiCl·ZnCl2·4Et2O. Указанное химическое соединение пригодно для использования в качестве реагента для очистки нефтепродуктов и природного газа от меркаптанов и сероводорода, катализатора в процессах хлорметилирования ароматических углеводородов, исходного вещества при получении гидридов металлов. 5 табл.
Реферат
Изобретение относится к получению нового соединения - трихлорцинката лития в среде диэтилового эфира LiCl·ZnCl2·Et2O, которое может быть использовано в качестве реагента для очистки нефтепродуктов и природного газа от сероводорода и меркаптанов, катализатора в процессах хлорметилирования ароматических углеводородов, исходного вещества при получении гидридов металлов.
В литературе отсутствуют сведения о хлоридных комплексах лития с хлоридом цинка, получаемых в среде диэтилового эфира.
Задачей настоящего изобретения является получение нового соединения - трихлорцинката лития в среде диэтилового эфира LiCl·ZnCl2·Et2O, которое может быть использовано в качестве реагента для очистки нефтепродуктов и природного газа от сероводорода и меркаптанов, катализатора в процессах хлорметилирования ароматических углеводородов, исходного вещества при получении гидридов металлов.
Поставленная задача достигается тем, что для получения данного соединения проводят взаимодействие хлорида цинка с хлоридом лития в среде диэтилового эфира.
Типичный опыт заключается в следующем. К взвеси LiCl в диэтиловом эфире добавляли эфират хлорида цинка (ZnCl2·Et2O) при перемешивании в соотношении реагентов (LiCl·Et2O):(ZnCl2·Et2O)=1:2 и общим объемом эфира 200 мл.
Взаимодействие реагентов проводили в трехгорлой колбе вместимостью 500 мл при комнатной температуре и обычном перемешивании в течение 6 часов по схеме:
Признаком взаимодействия служит небольшое разогревание (до 30°С) реакционной массы, при этом происходит уменьшение объема осадка и появление в растворе ионов лития, хлорид которого нерастворим в диэтиловом эфире. Процесс ведут до постоянства элементов в растворе. Из прозрачного эфирного послереакционного раствора путем испарения 3/4 части растворителя в вакууме при 25°С с последующим вымораживанием насыщенного раствора азотом выделяют соединения состава: LiCl·ZnCl2·4Et2O.
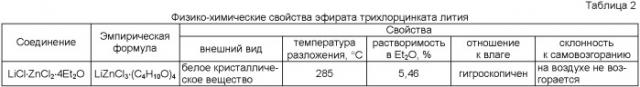
В таблице 1 приведены результаты опытов взаимодействия хлоридов лития и цинка в среде диэтилового эфира. Полученное соединение представляет собой кристаллический порошок, быстро расплывающийся на воздухе, вследствие сильной гигроскопичности. Поэтому рекомендовано хранить его в эксикаторе или закрытой посуде. В таблице 2 приведены физико-химические характеристики полученного соединения.
Выделенное из раствора комплексное соединение обладает реакционной способностью и легко подвергается диссоциации в растворе при обработке большим количеством диэтилового эфира. Полученное соединение стабилизировано молекулами диэтилового эфира, которые в комплексе координированы по донорно-акцепторному механизму, и относится к оксониевым комплексным соединениям.
Новое соединение было идентифицировано совокупностью физико-химических методов: рентгенографией, термографией, ИК-спектроскопией, хроматографией и методом химического анализа. При изучении растворимости в тройной системе LiCl-ZnCl2-Et2O, 25°С, обнаружена область кристаллизации соединения LiCl·ZnCl2·4Et2O, построены изотермы растворимости. Установлено, что полихлорцинкат лития отвечает индивидуальному соединению.
Полученные экспериментальные данные по термической устойчивости трихлорцинката лития в среде диэтилового эфира позволяют предположить следующие схемы его распада:
I LiCl·ZnCl2·4Et2O→LiCl·ZnCl2+4Et2O↑
II LiCl·ZnCl2→LiCl+ZnCl2
Рентгенографические исследования исходных веществ ZnCl2, LiCl и трихлорцинката лития в среде диэтилового эфира показывают, что наборы рефлексов отражения эфирата трихлорцинката лития отличаются от составляющих. Исследование полученного соединения методом ИК-спектроскопии установило, что колебательные частоты трихлорцинката лития в среде диэтилового эфира также отличны от спектров составляющих хлоридов металлов. Для трихлорцинката лития в среде диэтилового эфира обнаружена новая полоса поглощения, вызванная колебаниями L1-O связи в области 200-500 см-1, а также изменения частот валентных колебаний Li-Cl и С-О-С связей.
Трихлорцинкат лития в среде диэтилового эфира формулы LiCl·ZnCl2·4Et2O нашел применение в качестве реагента для очистки нефти и природного газа от серы и меркаптанов. Например,
LiCl·ZnCl2·4Et2O+4H2S=LiCl·ZnCl2·4H2S+4Et2O↑
LiCl·ZnCl2·4Et2O+4RSH=LiCl·ZnCl2·4RSH+2Et2O↑
Реакцию проводят при температуре 25±5°С при мольном соотношении реагентов LiCl·ZnCl2·4Et2O: H2S (RSH)=1:4, где R - углеводородный радикал.
В таблице 3 приведены условия протекания взаимодействия комплексного соединения с молекулами сероводорода и меркаптанов на примере метил-, этил- и пропилмеркаптанов. Так, использование в качестве реагента эфирата трихлорцинката лития LiCl·ZnCl2·4Et2O при вышеназванных условиях обеспечивает связывание сероводорода до 88,5%, метил-, этил- и пропилмеркаптанов до 85%, 83% и 80% соответственно.
Для очистки газов от серосодержащих примесей используют фильтры, содержащие в себе гранулы, состоящие из мелкодисперсных комплексных соединений на субстрате (оксидах металлов d-элементов). Поверхность гранулы реагента эффективно сорбирует из потока газа серосодержащие соединения. Газы, не содержащие в своем составе серы, на поверхности гранул не задерживаются и с комплексным соединением не реагируют. Сероводород и меркаптаны, проходя через фильтр, в процессе комплексообразования активно конкурируют с кислородсодержащими соединениями (Et2O), вытесняя их из комплексного соединения.
Важным направлением очистного действия комплексными соединениями цинка заключается в связывании или переработке сернистых соединений дистиллата. Так, сероводород, почти всегда присутствующий в крекинг-дистиллате, реагирует с соединениями цинка с образованием соответствующих комплексных соединений. Очистка нефтяных дистиллатов необходима перед проведением каталитических процессов дегидрирования и парциального окисления, ибо сера и ее соединения являются одними из самых сильных ядов, отравляющих поверхность катализаторов.
Кроме того, при наличии небольших количеств воды в дистиллате и даже в водных растворах вышеназванное соединение будет давать также комплексное соединение типа аквакислоты, способное диссоциировать с выделением иона водорода, например,
LiCl·ZnCl2·4Et2O+2Н2O↔[ZnCl2OH]H+[LiClOH]H+4Et2O↑
Эта аквакислота имеет сильные кислотные свойства, но при разбавлении водой разрушается. Зато в концентрированных водных растворах, а также в твердом виде с содержанием небольших количеств влаги, аквакислота реагируют подобно минеральной кислоте, например серной, обладая к тому же рядом преимуществ перед ней. Так, известную в литературе очистку дистиллата серной кислотой, во избежание разрушения отдельных ценных частей дистиллата, приходится вести при низких температурах. Очистку же комплексными соединениями цинка можно проводить при повышенных температурах, усиливая тем самым ее эффективность.
Эфират трихлорцинката лития используют в качестве катализатора в тонком органическом синтезе, в частности в процессах хлорметилирования ароматических углеводородов. Так, при взаимодействии бензола с муравьиным альдегидом в присутствии хлороводорода при использовании в качестве катализатора эфирата трихлорцинката лития получают хлористый бензил:
Реакцию проводят при 60°C, пропуская хлористый водород через смесь бензола, параформальдегида и трихлорцинката лития в диэтиловом эфире до прекращения абсорбции газов. В таблице 4 приведены условия протекания данной реакции. Так, использование 5%-ного содержания эфирата трихлорцинката лития, взятого от массы бензола, приводит к образованию хлористого бензила с выходом 70%. Увеличение его содержания до 10% и более приводит к повышению выхода продукта до 87%. Таким образом, наиболее оптимальным количеством используемого катализатора является его 10%-ное содержание, взятое от массы бензола.
Значение этой реакции велико, особенно если учитывать особенность легкого превращения группы -СН2Сl в другие, например в группы -СН3, -CH2CN, -СНО,
-CH2NH2, -СН2ОН.
Кроме того, трихлорцинкат лития в среде диэтилового эфира используют как исходное вещество для получения гидридных соединений металлов, например:
LiCl·ZnCl2·4Et2O+3NaAlH4→LiAlH4+ZnH2+2AlH3+3NaCl+4Et2O↑
Реакцию проводят при температуре 25°С в среде диэтилового эфира при мольном соотношении реагентов (LiCl·ZnCl2·4Et2O):NaAlH4=1:3.
В таблице 5 приведены условия проведения данной реакции. Согласно полученным данным при использовании трихлорцинката лития в среде диэтилового эфира выход гидридов металлов достигает 85%.
Таким образом, по совокупности физико-химических свойств полученное соединение - трихлорцинкат лития в среде диэтилового эфира - является новым соединением.
| Таблица 1Получение трихлорцинката лития в среде диэтилового эфира, Et2O=(C2H5)2O (V=200 мл, τ=6 часов) | ||||||||||
| Условия проведения синтеза взято, г (моль) | Состав раствора, г/л (моль) | Состав твердого вещества, % (моль) | Выход, % | Брутто-формула соединения | ||||||
| LiCl | ZnCl2 | Li | Zn | Cl | Li | Zn | Cl | Et2O | ||
| 5(0,117) | 16(0,117) | 3,74 (0,53) | 35,19 (0,538) | 56,36 (1,589) | 1,4(0,2) | 13,5 (0,206) | 22,1 (0,622) | 63,4 (0,85) | 54,8 | LiCl·ZnCl2·4Et2O |
| 10(0,235) | 16(0,117) | 3,85 (0,55) | 35,9 (0,548) | 57,4 (1,63) | 1,39 (0,189) | 13,2 (0,201) | 21,85 (0,615) | 64,07 (0,865) | 92,01 | LiCl·ZnCl2·4Et2O |
| Таблица 3Условия взаимодействия эфирата трихлорпинката лития с серосодержащими соединениями | |||||||
| № опыта | Формула соединения LiCl·nAlCl3·2Et2O (КС) | Условия проведения опыта | Получено, г(%) LiCl·ZnCl2·4H2S | Условия проведения опыта | Получено, г(%) LiCl·ZnCl2·4RSH | ||
| Взято, г (моль) | Взято, г (моль) | ||||||
| КС | H2S | КС | RSH | ||||
| 1 | LiCl·ZnCl2·4Et2O | 474,9 (1) | 136 (4) | 278,1 (88,3) | 474,9 (1) | 192 (4) MM | 315,3 (85,0) |
| 2 | LiCl·ZnCl2·4Et2O | - | - | - | 474,9 (1) | 248 (4) ЭМ | 350,0 (82,0) |
| 3 | LiCl·ZnCl2·4Et2O | - | - | - | 474,9 (1) | 304 (4) ПМ | 388,7 (80,5) |
| 4 | LiCl·ZnCl2·4Et2O | 474,9 (0,5) | 136(2) | 278,7 (88,5) | 237,5 (0,5) | 96 (2) MM | 158,0(85,2) |
| 5 | LiCl·ZnCl2·4Et2O | - | - | - | 237,5 (0,5) | 124 (2) ЭМ | 178,0(83,4) |
| 6 | LiCl·ZnCl2·4Et2O | - | - | - | 237,5 (0,5) | 304 (4) ПМ | 195,0 (80,8) |
| Примечание: | |||||||
| ММ - метилмеркаптан | |||||||
| ЭМ - этилмеркаптан | |||||||
| ПМ - пропилмеркаптан |
| Таблица 4Условия получения хлористого бензила с участием эфирата трихлорцинката лития | ||||||
| № опыта | Взято, г (моль) | LiCl·ZnCl2·4Et2O | Получено С6Н5СН2Сl, г(%) | |||
| С6Н6 | НСl | CH2O | г (моль) | % (по бензолу) | ||
| 1 | 78 (1) | 36,5 (1) | 38 (1) | 11,7 (0,068) | 15 | 110(87) |
| 2 | 39 (0,5) | 18,25 (0,5) | 19 (0,5) | 3,9 (0,008) | 10 | 55 (87) |
| 3 | 19,5 (0,25) | 9,2 (0,25) | 9,5 (0,25) | 0,975 (0,002) | 5 | 22 (70) |
| Таблица 5Условия получения гидридов металлов с участием трихлорцинката лития в среде диэтилового эфира, Et2O=(C2H5)2O | ||||
| № опыта | Взято, г (моль) | Получено, г(%) | ||
| LiCl·ZnCl2·4Er2O | NaAlH4 | ZnH2 | АlН3 | |
| 1 | 474,9 (1) | 162 (3) | 57,3 (85) | 51 (85) |
| 2 | 237,45 (0,5) | 81 (1,5) | 28,6 (85) | 25,5 (85) |
| 3 | 118,73 (0,25) | 40,05 (0,25) | 14,3 (85) | 12,75 (85) |
Трихлорцинкат лития в среде диэтилового эфира LiCl·ZnCl2·4Et2O, полученный взаимодействием хлоридов лития и цинка в среде диэтилового эфира, в качестве реагента для очистки нефтепродуктов и природного газа от сероводорода, катализатора в процессах хлорметилирования ароматических углеводородов, исходного вещества при получении гидридов металлов.