Полихлоралюминаты щелочноземельных металлов
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Полихлоралюминаты щелочноземельных металлов получены взаимодействием хлоридов щелочноземельных металлов с хлоридом алюминия в среде диэтилового эфира и соответствуют общей химической формуле МСl2·4АlСl3·nЕt2O, в которой при М=Са n=4,5; при М=Sr n=1, 1,5; при М=Ва n=2,5. Указанные химические соединения пригодны для использования в качестве реагентов для очистки нефтепродуктов и природного газа от меркаптанов и сероводорода, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов. 6 табл.
Реферат
Изобретение относится к получению новых соединений - полихлоралюминатов щелочноземельных металлов в среде диэтилового эфира общей формулы
МСl2·4АlСl3·nЕt2O, в которой
при М=Са n=4,5; M=Sr n=1, 1,5; при М=Ва n=2,5, которые могут быть использованы в качестве реагентов для очистки нефтепродуктов и природного газа от сероводорода и меркаптанов, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов.
В литературе отсутствуют сведения о хлоридных комплексах щелочноземельных металлов с хлоридами алюминия, получаемых в среде диэтилового эфира.
Задачей настоящего изобретения является получение новых соединений - полихлоралюминатов щелочноземельных металлов в среде диэтилового эфира общей формулы МСl2·4АlСl3·nЕt2O, в которой при М=Са n=4,5; M=Sr n=1, 1,5; при М=Ва n=2,5, которые могут быть использованы в качестве реагентов для очистки нефтепродуктов и природного газа от сероводорода и меркаптанов, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов.
Поставленная задача достигается тем, что для получения вышеназванных соединений проводят взаимодействие хлоридов алюминия с хлоридами щелочноземельных металлов в среде диэтилового эфира.
Типичный опыт заключается в следующем. К взвеси МСl2 (где М=Са, Sr, Ва) в диэтиловом эфире добавляли эфират хлорида алюминия (АlСl3·Еt2O) при перемешивании в соотношении реагентов (MCl2·Et2O):(AlCl3·Et2O)=1:1,5 и общим объемом эфира 100-150 мл.
Взаимодействие реагентов проводили в трехгорлой колбе вместимостью 250 мл при комнатной температуре и обычном перемешивании в течение 5-6 часов по схеме:
Независимо от количества исходных веществ в растворе мольное соотношение элементов в комплексах щелочноземельных металлов составляло М(Са, Sr, Ва):Аl:Сl=1:4:14.
Признаками взаимодействия служат небольшое разогревание (до 30°С) реакционной массы, резкое уменьшение объема осадка и появление в растворе ионов щелочноземельных металлов, хлориды которых нерастворимы в диэтиловом эфире. Процесс ведут до постоянства элементов в растворе. Из прозрачного эфирного послереакционного раствора путем испарения 3/4 части растворителя в вакууме при 25°С с последующим вымораживанием насыщенного раствора азотом выделяют соединения брутто-состава: МСl2·4АlСl3·nEt2O, в которой при М=Са n=4,5; M=Sr n=1, 1,5; при М=Ва n=2,5.
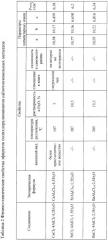
В таблице 1 приведены результаты опытов взаимодействия хлоридов щелочноземельных металлов с хлоридами алюминия в среде диэтилового эфира. Полученные соединения представляют собой кристаллические порошки, со временем расплывающиеся на воздухе, поэтому рекомендовано хранить их в эксикаторе или закрытой посуде. В таблице 2 приведены физико-химические характеристики полученных соединений.
Выделенные из раствора комплексные соединения реакционноспособны и легко подвержены диссоциации в растворе при обработке большим количеством диэтилового эфира. Полученные соединения стабилизированы молекулами диэтилового эфира, которые в комплексе координированы по донорно-акцепторному механизму и относятся к оксониевым соединениям.
Новые соединения были идентифицированы совокупностью физико-химических методов: рентгенографией, термографией, ИК-спектроскопией, хроматографией и методом химического анализа. Установлено, что полихлоралюминаты щелочноземельных металлов в среде диэтилового эфира отвечают индивидуальным соединениям.
При изучении термической устойчивости полихлоралюминатов щелочноземельных металлов в среде диэтилового эфира установлено, что термические кривые имеют сложный характер разложения, отличный от составляющих: АlСl3 и МСl2, где М=Са, Sr, Ba. Обнаружено, что частичная десольватация происходит при температуре 50-200°С, а разложение комплексов происходит ступенчато, с предварительным плавлением. Анализ термоэффектов показывает, что наиболее устойчивыми комплексами в среде диэтилового эфира являются бариевые комплексы.
Полученные экспериментальные данные по термической устойчивости полихлоралюминатов щелочноземельных металлов в среде диэтилового эфира позволяют предположить следующие схемы их распада:
I SrCl2·4AlCl3·1,5Et2O→SrCl2·4AlCl3+1,5Et2O↑
II SrCl2·4AlCl3→SrCl2+4AlCl3
Рентгенографические исследования исходных веществ АlСl3, МСl2 (где М=Са, Sr, Ва) и полихлоралюминатов щелочноземельных металлов в среде диэтилового эфира показывают, что наборы рефлексов отражения отличаются от составляющих. Исследование полученных соединений методом ИК-спектроскопии установило, что колебательные частоты полихлоралюминатов в среде диэтилового эфира отличны от спектров составляющих хлоридов металлов. Так, во всех ИК-спектрах эфиратов полихлоралюминатов встречается полоса с частотой 400 см-1, которая характерна для иона . У эфиратов полихлоралюминатов кальция, стронция и бария полоса симметрична, что, по-видимому, указывает на увеличение ионности связи. Следует также отметить, что кроме отмеченных выше изменений, имеются сдвиги полос, отвечающих за валентные колебания С-О-С.
Полихлоралюминаты брутто-формулы MCl2·AlCl3·nEt2O, в которой при М=Са n=4,5; M=Sr n=1, 1,5; при М=Ва n=2,5, нашли применение в качестве реагентов для очистки нефти и природного газа от сероводорода и меркаптанов. Например,
CaCl2·4AlCl3·4,5Et2O+4,5H2S=CaCl2·4AlCl3·4,5H2S+4,5Et2O↑
CaCl2·4AlCl3·4,5Et2O+4,5RSH=CaCl2·4AlCl3·4,5RSH+4,5Et2O↑
Реакцию проводят при температуре 25±5°С при мольном соотношении реагентов (MCl2·AlCl3·nEt2O):nH2S (nRSH)=1:n, в котором при М=Са n=4,5; M=Sr n=1, 1,5; при М=Ва n=2,5; R - углеводородный радикал.
В таблице 3 приведены условия протекания взаимодействия комплексных соединений с молекулами сероводорода и меркаптанов на примере метил-, этил- и пропилмеркаптанов. Так, например, использование в качестве реагента эфирата полихлоралюмината кальция при вышеназванных условиях обеспечивает связывание сероводорода до 85,2%, метил-, этил- и пропилмеркаптанов до 80,1%, 76,2% и 73,5% соответственно.
Для очистки газов от сероводорода и меркаптанов используют фильтры, содержащие в себе гранулы, состоящие из мелкодисперсных комплексных соединений на субстрате (оксидах металлов d-элементов). Поверхность гранулы реагента эффективно сорбирует из потока газа сероводород и меркаптаны. Газы, не содержащие в своем составе соединений серы, на поверхности гранул не задерживаются и с комплексным соединением не реагируют. Сероводород и меркаптаны, проходя через фильтр, в процессе комплексообразования активно конкурируют с кислородсодержащими соединениями, вытесняя их из комплексного соединения.
Важным направлением очистного действия комплексными соединениями алюминия заключается в связывании или переработке сернистых соединений дистиллата. Так, сероводород, почти всегда присутствующий в крекинг-дистиллате, реагирует с соединениями алюминия с образованием соответствующих комплексных соединений. Очистка нефтяных дистиллатов необходима перед проведением каталитических процессов дегидрирования и парциального окисления, ибо сера и ее соединения являются одними из самых сильных ядов, отравляющих поверхность катализаторов.
Кроме того, при наличии небольших количеств воды в дистиллате и даже в водных растворах полихлоралюминаты щелочноземельных металлов в среде диэтилового эфира будут давать также комплексные соединения типа аквакислот, способных диссоциировать с выделением иона водорода, например,
BaCl2·4AlCl3·2,5Et2O+5H2O↔4([AlCl3OH]Н)+[BaCl2OH]H+2,5Et2O↑
Эти аквакислоты имеют сильные кислотные свойства, но при разбавлении водой разрушаются. Зато в концентрированных водных растворах, а также в твердом виде с содержанием небольших количеств влаги, эти аквакислоты реагируют подобно минеральной кислоте, например, серной, обладая к тому же рядом преимуществ перед ней. Так, известную в литературе очистку дистиллата серной кислотой, во избежание разрушения отдельных ценных частей дистиллата, приходится вести при низких температурах. Очистку же комплексными соединениями алюминия в диэтиловом эфире можно проводить при повышенных температурах, усиливая тем самым ее эффективность.
Полихлоралюминаты щелочноземельных металлов в среде диэтилового эфира используют в качестве катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов. Так, непредельные углеводороды, входящие в состав нефти, легко конденсируются с бензолом и его гомологами в присутствии эфиратов полихлоралюминатов щелочноземельных металлов, при этом образуются гомологи бензола предельного характера, например, с амиленом - амилбензол:
В таблице 4 приведены условия протекания данной реакции. Так, например, использование эфирата полихлоралюмината кальция, взятого в количестве 5% от массы бензола, приводит к образованию хлористого бензила с выходом 70%. Увеличение его содержания до 10% и более приводит к повышению выхода продукта до 82%. Таким образом, наиболее оптимальным количеством используемого катализатора является его 10%-ное содержание, взятое от массы бензола.
При взаимодействии бензола с муравьиным альдегидом в присутствии хлороводорода при использовании в качестве катализатора эфиратов полихлоралюминатов щелочноземельных металлов получают хлористый бензил:
Реакцию проводят при 60°С, пропуская хлористый водород через смесь бензола, параформальдегида и эфиратов полихлоралюминатов щелочноземельных металлов до прекращения абсорбции газов. В таблице 5 приведены условия проведения данной реакции. Так, использование в качестве катализатора, например, эфирата полихлоралюмината бария, взятого в количестве 10% от массы бензола, позволяет получить конечный продукт - хлористый бензил с выходом 80%; применение эфирата полихлоралюмината стронция - 87% С6Н5-СН2Сl.
Значение этой реакции велико, особенно если учитывать особенность легкого превращения группы -СН2Сl в другие, например, в группы -СН3, -CH2CN, -CHO,
-CH2NH2, -CH2OH.
Кроме того, полихлоралюминаты щелочноземельных металлов в среде диэтилового эфира используют как исходные вещества для получения алюмогидридных соединений металлов, например:
Суммируя левые и правые части уравнений 1 и 2 получаем:
CaCl2·4AlCl3·4,5Et2O+14LiAlH4→Са(AlH4)2+16AlH3+14LiCl+4,5Et2O↑
Реакцию проводят при температуре 25°С в среде диэтилового эфира при мольном соотношении реагентов (MCl2·4AlCl3·nEt2O):LiAlH4=1:14 (где при М=Са n=4,5; M=Sr n=1, 1,5; при М=Ва n=2,5).
В таблице 6 приведены условия проведения данной реакции. Согласно полученным данным при использовании эфиратов полихлоралюминатов кальция, стронция и бария выход гидридов металлов составляет 80; 85 и 78% соответственно.
Таким образом, по совокупности физико-химических свойств полученные соединения - полихлоралюминаты щелочноземельных металлов в среде диэтилового эфира - являются новыми соединениями.
| Таблица 3Условия взаимодействия эфиратов полихлоралюминатов щелочноземельных металлов с серосодержащими соединениями | |||||||
| № опыта | Формула соединения MCl2·4AlCl3·nEt2O (КС) | Условия проведения опыта | Получено, г(%) МСl2·4АlСl3·nН2S | Условия проведения опыта | Получено,г(%) MCl2·4AlCl3·nRSH | ||
| Взято, г (моль) | Взято, г (моль) | ||||||
| КС | H2S | КС | RSH | ||||
| 1 | CaCl2·4AlCl3·4,5Et2O | 489 (0,5) | 76,5 (2,25) | 320 (85,2) | 489 (0,5) | 108,0 (2,25) MM | 348,7(81,0) |
| 2 | CaCl2·4AlCl3·4,5Et2O | - | - | - | 489 (0,5) | 139,5 (2,25) ЭМ | 352,0 (76,2) |
| 3 | CaCl2·4AlCl3·4,5Et2O | - | - | - | 489 (0,5) | 171,0 (2,25) ПМ | 362,7 (73,5) |
| 4 | SrCl2·4AlCl3·Et2O | 383,3 (0,5) | 17(0,5) | 319,7(88,0) | 383,3 (0,5) | 24,0 (0,5) MM | 303,6 (82,0) |
| 5 | SrCl2·4AlCl3·Et2O | - | - | - | 383,3 (0,5) | 31,0(0,5) ЭМ | 284,5 (75,4) |
| 6 | SrCl2·4AlCl3·Et2O | - | - | - | 383,3 (0,5) | 38,0 (0,5) ПМ | 277,5 (72,2) |
| 7 | SrCl2·4AlCl3·1,5Et2O | 401,8(0,5) | 24 (0,75) | 310,1 (83,8) | 401,8 (0,5) | 36,0(0,75) MM | 306,6 (80,2) |
| 8 | SrCl2·4AlCl3·1,5Et2O | - | - | - | 401,8(0,5) | 46,2 (0,75) ЭМ | 290,0 (73,8) |
| 9 | SrCl2·4AlCl3·1,5Et2O | - | - | - | 401,8(0,5) | 57,0(0,75) ПМ | 290,4 (72,0) |
| 10 | BaCl2·4AlCl3·2,5Et2O | 463,5 (0,5) | 106,25 (1,25) | 330,8 (80) | 463,5 (0,5) | 60,0(1,25) MM | 322,0 (74,7) |
| 11 | BaCl2·4AlCl3·2,5Et2O | - | - | - | 463,5 (0,5) | 77,5 (1,25) ЭМ | 313,9(70,0) |
| 12 | BaCl2·4AlCl3·2,5Et2O | - | - | - | 463,5 (0,5) | 95 (1,25) ПМ | 319,2(68,5) |
| Примечание: | |||||||
| MM - метилмеркаптан | |||||||
| ЭМ - этилмеркаптан | |||||||
| ПМ - пропилмеркаптан |
| Таблица 4Условия получения амилбензола с участием эфиратов полихлоралюминатов щелочноземельных металлов | ||||||
| № опыта | Условия проведения опыта | Получено С6Н5·С5Н11, г (%) | ||||
| Формула соединения | Взято, г (моль) | MCl2·4AlCl3·nEt2O | ||||
| С6Н6 | С5Н10 | г (моль) | % (по бензолу) | |||
| 1 | CaCl2·4AlCl3·4,5Et2O | 78(1) | 70(1) | 7,8 (0,008) | 10 | 125,8 (85) |
| 2 | CaCl2·4AlCl3·4,5Et2O | 39 (0,5) | 35 (0,5) | 5,85 (0,006) | 15 | 62,9 (85) |
| 3 | CaCl2·4AlCl3·4,5Et2O | 19,5 (0,25) | 17,5 (0,25) | 0,975 (0,001) | 5 | 25,9 (70) |
| 4 | SrCl2·4AlCl3·1,5Et2O | 78(1) | 70(1) | 7,8 (0,001) | 10 | 130,2 (88) |
| 5 | SrCl2·4AlCl3·1,5Et2O | 39 (0,5) | 35 (0,5) | 5,85 (0,007) | 15 | 65,1 (88) |
| 6 | SrCl2·4AlCl3·1,5Et2O | 19,5 (0,25) | 17,5 (0,25) | 0,975 (0,001) | 5 | 27,7 (75) |
| 7 | BaCl2·4AlCl3·2,5Et2O | 78(1) | 70(1) | 7,8 (0,008) | 10 | 118,4(80) |
| 8 | BaCl2·4AlCl3·2,5Et2O | 39 (0,5) | 35 (0,5) | 5,85 (0,006) | 15 | 56 (80) |
| 9 | BaCl2·4AlCl3·2,5Et2O | 19,5 (0,25) | 17,5 (0,25) | 0,975 (0,001) | 5 | 24,1 (65) |
| Таблица 5Условия получения хлористого бензила с участием эфиратов полихлоралюминатов щелочноземельных металлов | |||||||
| № опыта | Условия проведения опыта | Получено C6H5CH2Cl, г (%) | |||||
| Формула соединения | Взято, г (моль) | MCl2·4AlCl3·nEt2O | |||||
| С6Н6 | НСl | СН2O | г (моль) | % (по бензолу) | |||
| 1 | CaCl2·4AlCl3·4,5Et2O | 78(1) | 36,5 (1) | 38(1) | 7,8 (0,008) | 10 | 103,7(82) |
| 2 | CaCl2·4AlCl3·4,5Et2O | 39 (0,5) | 18,25(0,5) | 19(0,5) | 5,85 (0,006) | 15 | 51,9(82) |
| 3 | CaCl2·4AlCl3·4,5Et2O | 19,5 (0,25) | 9,2 (0,25) | 9,5 (0,25) | 0,975 (0,001) | 5 | 22,1 (70) |
| 4 | SrCl2·4AlCl3·1,5Et2O | 78(1) | 36,5(1) | 38(1) | 7,8 (0,001) | 10 | 110,1(87) |
| 5 | SrCl2·4AlCl3·1,5Et2O | 39 (0,5) | 18,25(0,5) | 19 (0,5) | 5,85 (0,007) | 15 | 55,0 (87) |
| 6 | SrCl2·4AlCl3·1,5Et2O | 19,5 (0,25) | 9,2 (0,25) | 9,5 (0,25) | 0,975 (0,001) | 5 | 23,7 (75) |
| 7 | BaCl2·4AlCl3·2,5Et2O | 78(1) | 36,5(1) | 38(1) | 7,8 (0,008) | 10 | 101,2 (80) |
| 8 | BaCl2·4AlCl3·2,5Et2O | 39 (0,5) | 18,25 (0,5) | 19(0,5) | 5,85 (0,006) | 15 | 50,6 (80) |
| 9 | BaCl2·4AlCl3·2,5Et2O | 19,5 (0,25) | 9,2 (0,25) | 9,5 (0,25) | 0,975 (0,001) | 5 | 22,1 (70) |
| Таблица 6Условия получения гидридов металлов с участием полихлоралюминатов щелочноземельных металлов в среде диэтилового эфира, Et2O=(C2H5)2O | ||||
| № опыта | Условия проведения опыта | Получено АlН3, г (%) | ||
| Наименование соединения | Взято, г (моль) | |||
| MCl2·4AlCl3·nEt2O | LiAlH4 | |||
| 1 | CaCl2·4AlCl3·4,5Et2O | 978 (1) | 476 (14) | 384 (80) |
| 2 | CaCl2·4AlCl3·4,5Et2O | 489 (0,5) | 238 (7) | 192 (80) |
| 3 | CaCl2·4AlCl3·4,5Et2O | 244,5 (0,25) | 119(3,5) | 96 (80) |
| 4 | SrCl2·4AlCl3·1,5Et2O | 803,6 (1) | 476 (14) | 408 (85) |
| 5 | SrCl2·4AlCl3·1,5Et2O | 401,8 (0,5) | 238 (7) | 204 (85) |
| 6 | SrCl2·4AlCl3·1,5Et2O | 200,9 (0,25) | 119(3,5) | 102 (85) |
| 7 | BaCl2·4AlCl3·2,5Et2O | 927 (1) | 476 (14) | 374,4 (78) |
| 8 | BaCl2·4AlCl3·2,5Et2O | 463,5 (0,5) | 238 (7) | 115,2(78) |
| 9 | BaCl2·4AlCl3·2,5Et2O | 231,75 (0,25) | 119(3,5) | 93,6 (78) |
Полихлоралюминаты щелочноземельных металлов в среде диэтилового эфира общей формулыМСl2·4АlСl3·nЕt2O, в которойпри М=Са n=4,5; при М=Sr n=1, 1,5; при М=Ва n=2,5,полученные взаимодействием хлоридов щелочноземельных металлов с хлоридом алюминия в среде диэтилового эфира, в качестве реагентов для очистки нефтепродуктов и природного газа от сероводорода, катализаторов в процессах хлорметилирования и алкилирования ароматических углеводородов, исходных веществ при получении гидридов металлов.