Новый пиримидиновый нуклеозид или его соль
Иллюстрации
Показать всеИзобретение относится к пиримидиновому нуклеозидному соединению общей формулы (1), в которой один из Х и Y является цианогруппой, а другой - водородом; R1 представляет собой водород, (R3)(R4)(R5)Si- или карбонильную группу, включающую алкил, монозамещенный аминогруппой; R2 представляет собой водород или (R6)(R7)(R8)Si- при условии, что по меньшей мере один из R1 и R2 не является водородом; или R1 и R2 вместе образуют 6-членную циклическую группу -Si(R9)(R10)-, где каждый R9 и R10 представляет собой линейный или разветвленный алкил; R3, R4 и R5 представляют собой линейный или разветвленный алкил, необязательно замещенный алкокси, или циклоалкил; R6, R7 и R8 представляют собой линейный или разветвленный алкил, необязательно замещенный алкокси, циклоалкил или фенил, или к его фармакологически приемлемой соли. Изобретение относится также к ряду конкретных соединений формулы (1) или к их фармакологически приемлемым солям: 5'-O-триизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 5'-O-диэтилизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 5'-О-диметилтексилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 5'-O-(диметил-н-октилсилил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 3'-О-диметилтексилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 3'-О-диэтилизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 3'-О-(трет-бутилдиметилсилил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 3'-O-триизопропил-силил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; 3'-D-диметил-тексилсилил-5'-O-(L-валил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозил-цитозин; 5'-O-(L-валил)-3'-O-(трет-бутилдиметилсилил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; и 3'-O-циклопропилдиизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин. Изобретение относится также к применению соединений формулы (1) или их фармакологически приемлемых солей для производства лекарственного средства для лечения опухоли. Кроме того, изобретение относится к противоопухолевому агенту на основе соединений формулы (1) или их фармакологически приемлемых солей и к способу лечения опухоли. 5 н. и 4 з.п. ф-лы, 20 табл., 1 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к 2'-дезокси-2'-цианопиримидиновому нуклеозидному соединению или его соли, которые проявляют превосходный противоопухолевый эффект.
УРОВЕНЬ ТЕХНИКИ
В настоящее время раковые опухоли, характеризуемые аномальной пролиферацией клеток, все еще являются заболеваниями, которые наиболее трудно поддаются лечению. Поэтому существует острая потребность в разработке эффективного средства для лечения раковых опухолей. Так как пролиферация клеток в значительной мере зависит от биосинтеза нуклеиновых кислот, до настоящего времени обширные исследования были направлены на разработку лекарственных средств-антагонистов метаболизма нуклеиновых кислот, которые ингибируют метаболизм нуклеиновых кислот.
Среди указанных лекарственных средств, в результате обширных исследований, были разработаны антагонисты метаболизма нуклеиновых кислот на основе производных цитидина. Например, были разработаны цитарабин (непатентный документ 1), анцитабин (непатентный документ 2), цитарабин ocfosfate (непатентный документ 3), гемцитабин (патентный документ 1) и т.д., и теперь указанные лекарственные средства используются в клинической терапии.
Указанные соединения проявляют противоопухолевый эффект, основанный на ингибировании ДНК-полимеразы или рибонуклеотид редуктазы, что приводит к ингибированию синтеза ДНК. Указанные лекарственные средства достигают клинических терапевтических результатов на определенном уровне. Однако цитарабин, анцитабин и цитарабин ocfosfate, как известно, не проявляют никакой активности по отношению к солидным опухолям (непатентный документ 4). Кроме того, гемцитабин может быть применен к ограниченному ряду типов рака (непатентный документ 4). Таким образом, указанные лекарственные средства никогда не демонстрировали удовлетворительной противоопухолевой активности.
Чтобы решить вышеупомянутые проблемы, был разработан 2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин (CNDAC), обладающий способностью разрывать цепь ДНК. Противоопухолевая активность CNDAC отличается от соответствующей активности цитидиновых соединений, которые были разработаны (патентный документ 2 и непатентные документы 5 и 6). Кроме того, в качестве пероральных лекарственных средств были разработаны 4-N-пальмитоил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин (P-CNDAC, Патентный документ 3 и непатентные документы 7 и 8), и 5'-фосфатидилпиримидиновый нуклеотид (патентный документ 4). Обнаружено, что указанные CNDAC соединения проявляют интересные противоопухолевые эффекты (непатентные документы 5 и 8).
Однако существующие CNDAC соединения еще не были на рынке. Поэтому есть острая потребность в разработке и коммерциализации противоопухолевых лекарственных средств на основе производных цитидина, проявляющих повышенный противоопухолевый эффект и подходящих для перорального введения.
[Патентный документ 1] японская патентная публикация (kokoku) No. 6-37394
[Патентный документ 2] японский патент No. 2559917
[Патентный документ 3] японский патент No. 2569251
[Патентный документ 4] японская опубликованная заявка на патент (kokai) No. 7-179491
[Непатентный документ 1] Evance, J. S. et al. Proc. Soc. Exp. Bio. Med., 106, 350 (1961)
[Непатентный документ 2] Hoshi, A. et al. Gann, 67, 725 (1972)
[Непатентный документ 3] Kodama, K. et al. Jpn. J. Cancer Res., 80, 679-685 (1989)
[Непатентный документ 4] Matsuda, A., et al. Cancer Sci., 95, 105-111 (2004)
[Непатентный документ 5] Matsuda, A., et al. J. Med. Chem., 34, 2919-2922 (1991)
[Непатентный документ 6] Azuma, A., et al. J. Med. Chem., 36, 4183-4189 (1993)
[Непатентный документ 7] Matsuda, Akira and Takuma, Sasaki, Protein, Nucleic Acid, and Enzyme, 43, 1981-1989 (1998)
[Непатентный документ 8] Katz, M. H. et al. Cancer Res., 64, 1828-1833 (2004)
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задачи, решаемые настоящим изобретением
Настоящее изобретение направлено на обеспечение нового пиримидинового нуклеозидного соединения, которое проявляет превосходный противоопухолевый эффект по сравнению с существующими пиримидиновыми нуклеозидными соединениями.
Способы осуществления настоящего изобретения
Чтобы решить указанную задачу, авторы настоящего изобретения провели обширные исследования и обнаружили, что пиримидиновое нуклеозидное соединение, представленное следующей формулой (1), или его соль проявляет превосходную биодоступность при пероральном введении и имеет превосходную противоопухолевую активность по сравнению с существующими CNDAC соединениями. Настоящее изобретение было разработано на основе указанного открытия.
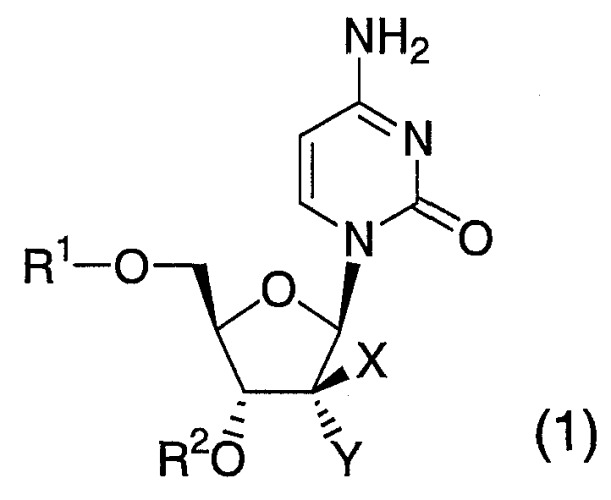
Соответственно, настоящее изобретение обеспечивает новое пиримидиновое нуклеозидное соединение, представленное формулой (1):
[F1]
(где один из X и Y представляет собой цианогруппу, а другой представляет собой атом водорода; один из R1 и R2 представляет собой атом водорода, карбонильную группу, включающую C1-C6 алкильную группу, которая монозамещена аминогруппой, или группу (R3)(R4)(R5)Si-, а другой представляет собой группу (R6)(R7)(R8)Si-, или R1 и R2 вместе образуют 6-членную циклическую группу -Si(R9)(R10)-; каждый R3, R4, R5, R6, R7 и R8 представляет собой C1-C10 линейную или разветвленную алкильную группу, которая может быть замещена, C3-C6 циклоалкильную группу, которая может быть замещена, C6-C14 арильную группу, которая может быть замещена, или C1-C6 алкильную группу, которая замещена одним или двумя C6-C14 арильными группами и которая может быть замещена; и каждый R9 и R10 представляет собой C1-C6 линейную или разветвленную алкильную группу, которая может быть замещена) или его соль.
Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую эффективное количество соединения, представленного формулой (1), или его соли и фармацевтически приемлемый носитель.
Настоящее изобретение также обеспечивает противоопухолевый агент, включающий эффективное количество соединения, представленного формулой (1), или его соли и фармацевтически приемлемый носитель.
Настоящее изобретение также обеспечивает применение соединения, представленного формулой (1), или его соли для производства лекарственного средства.
Настоящее изобретение также обеспечивает способ лечения опухоли, включающий введение эффективного количества соединения, представленного формулой (1), или его соли.
Технический результат изобретения
Новые пиримидиновые нуклеозидные соединения настоящего изобретения и их соли обладают превосходной противоопухолевой активностью и хорошей абсорбируемостью при пероральном введении и, таким образом, применимы в качестве противоопухолевого агента.
Краткое описание чертежа
На чертеже представлен график, показывающий изменение объема опухоли при использовании эквитоксического количества соединения 19, CNDAC, или P-CNDAC против клеток рака толстой кишки человека штамма KM20C.
Наиболее предпочтительный вариант осуществления изобретения
Новое пиримидиновое нуклеозидное соединение настоящего изобретения и его соли имеют химическую структуру, которая представлена вышеупомянутой формулой (1) и которая характеризуется наличием силильной группы в 3'- и 5'-положениях.
Некоторые промежуточные соединения для синтеза вышеупомянутых CNDAC соединений, как известно, имеют силильные группы в 3'- и 5'-положениях (например, патентные документы 2 и 3). Однако CNDAC соединение настоящего изобретения, представленное формулой (1), не было раскрыто. Кроме того, противоопухолевая активность промежуточных соединений для синтеза вышеупомянутых CNDAC соединений не была известна.
В формуле (1) примеры "C1-C6 алкильной группы" "карбонильной группы, имеющей C1-C6 алкильную группу, которая монозамещена аминогруппой", представленной группами R1 или R2, включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, н-пентил и н-гексил, причем предпочтительной группой является изобутил.
В формуле (1) примеры "C1-C10 линейной или разветвленной алкильной группы", представленной группами R3, R4, R5, R6, R7 или R8, включают метил, этил, н-пропил, изопропил, n-бутил, трет-бутил, н-гексил, н-октил и тексил. Предпочтительно, " C1-C10 линейная или разветвленная алкильная группа" является C1-C8 линейной или разветвленной алкильной группой. Более предпочтительно, любой из R3, R4 и R5 и любой из R6, R7 и R8, среди которых некоторые могут быть одинаковыми или отличными друг от друга, являются C3-C8 линейной или разветвленной алкильной группой, а другие группы, которые могут быть одинаковыми или отличными друг от друга, являются C1-C4 линейными или разветвленными алкильными группами.
В формуле (1) примеры "C3-C6 циклоалкильной группы", представленной группами R3, R4, R5, R6, R7 или R8, включают циклопропил, циклобутил, циклопентил и циклогексил. Из них предпочтительны циклопропил и циклогексил, а наиболее предпочтителен циклопропил.
В формуле (1) примеры "C6-C14 арильной группы", представленной группами R3, R4, R5, R6, R7 или R8, включают фенил и нафтил.
В формуле (1) "C6-C14 арильная группа" "C1-C6 алкильной группы, которая замещена одной или двумя C6-C14 арильными группами", представленная группами R3, R4, R5, R6, R7 или R8, представляет собой группу, соответствующую вышеупомянутой C6-C14 арильной группе, а "C1-C6 алкильная группа" является группой, соответствующей вышеупомянутой C1-C6 алкильной группе. Конкретные примеры включают бензил, фенетил, бензгидрил и нафтилметил.
В формуле (1) "заместители", которые могут быть связаны с R3, R4, R5, R6, R7, R8, R9 или R10, могут быть одинаковыми или отличными друг от друга (количество замещений: один-три). Примеры заместителей включают C1-C3 линейные или разветвленные алкильные группы, такие как метил, этил и изопропил; гидроксил; C1-C6 алкоксигруппы, такие как метокси, этокси, изопропокси и трет-бутокси; аминогруппу; атомы галогенов, такие как хлор и бром; цианогруппу; и нитрогруппу.
В формуле (1) примеры "(R3)(R4)(R5)Si-" и " (R6)(R7)(R8)Si-" представленные группами R1 и R2, включают трет-бутилдиметилсилил, триизопропилсилил, триизобутилсилил, диметил-н-октилсилил, диметилтексилсилил, триметилсилил, триэтилсилил, три-н-пропилсилил, три-н-бутилсилил, три-н-гексилсилил, н-пропилдиметилсилил, н-бутилдиметилсилил, изобутилдиметилсилил, н-пентилдиметилсилил, н-гексилдиметилсилил, диметил-трет-гексилсилил, н-децилдиметилсилил, (3,3-диметилбутил)диметилсилил, 2,3-диметилпропилдиметилсилил, ди-трет-бутилметилсилил, ди-н-бутилметилсилил, диэтилизопропилсилил, н-октилдиизопропилсилил, н-октилдиизобутилсилил, циклогексилдиметилсилил, дициклогексилметилсилил, изопропилдифенилсилил, трифенилсилил, диметилфенилсилил, трет-бутилдифенилсилил, метилдифенилсилил, дифенил(дифенилметил)силил, п-толилдиметилсилил, бифенилдиметилсилил, м-феноксифенилдиметилсилил, бифенилдиизопропилсилил, три(2-бифенил)силил, три(о-толил)силил, три(2-метоксифенил)силил, трибензилсилил, бензилдиметилсилил, фенетилдиметилсилил, (3-фенилпропил)диметилсилил, п-(трет-бутил)фенетилдиметилсилил, фенетилдиизопропилсилил, неофилдиметилсилил, бромметилдиметилсилил, хлорметилдиметилсилил, 4-хлорбутилдиметилсилил, (дихлорметил)диметилсилил, 3-хлорпропилдиметилсилил, 3,3,3-трифторпропилдиметилсилил, 1H,1H,2H,2H-перфтор-н-децилдиметилсилил, 1H,1H,2H,2H-перфтор-н-октилдиметилсилил, 3,3,4,4,5,5,6,6,6-нонафтор-н-гексилдиметилсилил, бис(хлорметил)метилсилил, пентафторфенилдиметилсилил, пентафторфенилпропилдиметилсилил, 3,5-бис(трифторметил)фенилдиметилсилил, [3-(хлорметил)фенилэтил]диметилсилил, [4-(хлорметил)фенилэтил]диметилсилил, ацетоксиэтилдиметилсилил, 3-ацетоксипропилдиметилсилил, 3-метакрилоксипропилдиметилсилил, 3-цианопропилдиизопропилсилил, [3-(триметилсилокси)пропил]диметилсилил, н-бутилдиизопропилсилил, диизопропил-н-пропилсилил, диизопропил(2,2-диметилпропил)силил, (3-метилбутил)диизопропилсилил, (2-этилбутил)дициклопропилсилил, трет-амилдиэтилсилил, трет-бутилдиизобутилсилил, диэтил(3-метилпентан-3-ил)силил, изобутилдиизопропилсилил, диэтил(2-метилпентан-2-ил)силил, циклопропилдиизопропилсилил, дициклопропилизобутилсилил, диизопропил(3-метоксипропил)силил, (3-этоксипропил)диизопропилсилил, [3-(трет-бутилокси)пропил]диизопропилсилил, трет-бутилди(3-этоксипропил)силил и 3-феноксипропилдиметилсилил. Предпочтительно обе группы "(R3)(R4)(R5)Si-" и "(R6)(R7)(R8)Si-" представляют собой трет-бутилдиметилсилил, триизопропилсилил, диэтилизопропилсилил, циклогексилдиметилсилил, триизобутилсилил, трифенилсилил, трибензилсилил, диметилфенилсилил, диметил-н-октилсилил, дициклопропил(2-этилбутил)силил, диэтил(3-метилпентан-3-ил)силил, трет-бутилдиизобутилсилил, циклопропилдиизопропилсилил или диметилтексилсилил, более предпочтительно трет-бутилдиметилсилил, триизопропилсилил, диэтилизопропилсилил, диметил-н-октилсилил, циклопропилдиизопропилсилил или диметилтексилсилил, особенно предпочтительно триизопропилсилил, циклопропилдиизопропилсилил или диметилтексилсилил.
В формуле (1) " C1-C6 линейная или разветвленная алкильная группа", представленная группой R9 или R10, включает метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и н-гексил.
Предпочтительное пиримидиновое нуклеозидное соединение
Соединение настоящего изобретения предпочтительно является соединением, представленным формулой (1), в которой один из X и Y представляет собой цианогруппу, а другой представляет собой атом водорода; один из R1 и R2 является атомом водорода, группой (R3)(R4)(R5)Si- или карбонильной группой, имеющей C1-C6 алкильную группу, которая монозамещена аминогруппой, а другой представляет собой группу (R6)(R7)(R8)Si-, или R1 и R2 вместе образуют 6-членную циклическую группу -Si(R9)(R10)-; R3, R4, R5, R6, R7 и R8, которые могут быть одинаковыми или отличными друг от друга, индивидуально представляют собой C3-C6 циклоалкильную группу, фенильную группу, бензильную группу или C1-C8 линейную или разветвленную алкильную группу, которая может иметь C1-C6 алкоксигруппу.
Соединение настоящего изобретения более предпочтительно является соединением, представленным формулой (1), в которой один из X и Y представляет собой цианогруппу, и другой представляет собой атом водорода; R1 является атомом водорода, валильной группой или группой (R3)(R4)(R5)Si-; R2 является атомом водорода или группой (R6)(R7)(R8)Si- (в том случае, когда R1 является атомом водорода или валильной группой, R2 не является атомом водорода); а R3, R4, R5, R6, R7 и R8, которые могут быть одинаковыми или отличными друг от друга, являются C1-C8 линейной или разветвленной алкильной группой или C3-C6 циклоалкильной группой.
Соединение настоящего изобретения еще более предпочтительно является соединением, представленным формулой (1), в которой один из X и Y представляет собой цианогруппу, а другой представляет собой атом водорода; R1 является атомом водорода, L-валильной группой или группой (R3)(R4)(R5)Si-; R2 представляет собой атом водорода или группу (R6)(R7)(R8)Si- (в том случае, когда R1 является атомом водорода или L-валильной группой, R2 не является атомом водорода); а любой из R3, R4 и R5 и любой из R6, R7 и R8, из которых некоторые могут быть одинаковыми или отличными друг от друга, индивидуально являются C3-C8 линейной или разветвленной алкильной группой или циклопропильной группой, а другие группы, которые могут быть одинаковыми или отличными друг от друга, являются C1-C4 линейными или разветвленными алкильными группами.
Соединение настоящего изобретения наиболее предпочтительно является соединением, представленным формулой (1), в которой один из X и Y представляет собой цианогруппу, а другой представляет собой атом водорода; R1 является атомом водорода, L-валильной группой, триизопропилсилильной группой, диэтилизопропилсилильной группой, диметилтексилсилильной группой или диметил-н-октилсилильной группой; R2 является атомом водорода, трет-бутилдиметилсилильной группой, триизопропилсилильной группой, диэтилизопропилсилильной группой, циклопропилдиизопропилсилильной группой или диметилтексилсилильной группой (в том случае, когда R1 является атомом водорода или L-валильной группой, R2 не является атомом водорода).
Предпочтительные примеры пиримидинового нуклеозидного соединения включают следующие (a)-(k):
(a) 5'-O-триизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(b) 5'-O-диэтилизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(c) 5'-O-диметилтексилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(d) 5'-O-(диметил-н-октилсилил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(e) 3'-O-диметилтексилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(f) 3'-O-диэтилизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(g) 3'-O-(трет-бутилдиметилсилил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(h) 3'-O-триизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(i) 3'-O-диметилтексилсилил-5'-O-(L-валил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин;
(j) 5'-O-(L-валил)-3'-O-(трет-бутилдиметилсилил)-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин; и
(k) 3'-O-циклопропилдиизопропилсилил-2'-циано-2'-дезокси-1-β-D-арабинофуранозилцитозин.
На соль пиримидинового нуклеозидного соединения настоящего изобретения не накладывается никаких специфических ограничений, если указанная соль является фармакологически приемлемой. Примеры солей, которые могут быть образованы, включают соли минеральных кислот, такие как гидрохлорид, гидробромид, сульфат, нитрат и фосфат; и соли органических кислот, такие как ацетат, пропионат, тартрат, фумарат, малеат, малат, цитрат, метансульфонат, п-толуолсульфонат и трифторацетат. В зависимости от типа заместителя(ей), пиримидиновое нуклеозидное соединение настоящего изобретения может образовывать оптические или геометрические изомеры. Пиримидиновое нуклеозидное соединение настоящего изобретения охватывает такие оптические и геометрические изомеры. Указанные изомеры могут быть разделены или использоваться в виде смеси. Пиримидиновое нуклеозидное соединение настоящего изобретения также охватывает аморфные разновидности, полиморфы и сольваты, такие как гидраты.
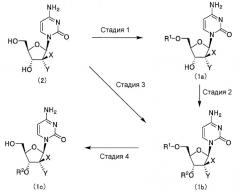
Пиримидиновое нуклеозидное соединение настоящего изобретения или его соль могут быть получены в соответствии со следующей схемой реакции, включающей стадии 1-11.
[F2]
[F3]
X, Y, R1 и R2, приведенные на стадиях 1-11, имеют те же значения, как описано выше. Каждый из R11 и R14 представляет собой защитную группу для аминогруппы. На защитную группу не накладывается никаких специфических ограничений, и может быть использована любая стандартная защитная группа. Например, приемлемые защитные группы включают перечисленные в документе (T.W. Greene, “Protective groups in Organic Synthesis”, A Wiley-Interscience Publication, John-Wiley & Sons, New-York, 1981, р. 218-287). Конкретные примеры включают замещенные оксикарбонильные группы, такие как трет-бутоксикарбонильная и бензилоксикарбонильная группы. R12 является защитной группой для гидроксильной группы, и примеры включают трифенилметильную группу, 4-метокситрифенилметильную группу и 4,4'-диметокситрифенилметильную группу. Группа R13-CO2H представляет собой аминомонозамещенную карбоновую кислоту, и примеры включают такие аминокислоты, как глицин, L-аланин, β-аланин, L-валин, L-лейцин, L-изолейцин, L-лизин и D-аланин.
(Стадия 1)
На стадии 1 пиримидиновое нуклеозидное соединение, представленное формулой (2), или его соль взаимодействуют с общеизвестным силилирующим агентом, таким как триалкилсилил галогенид, триалкилсилилтрифлат или триалкилсилилацетамид, представленным как (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z (где Z представляет собой атом галогена, трифторметансульфонилокси группу, ацетаминогруппу и т.д.), с помощью которых может быть получено соединение, представленное формулой (1a). Реакция может быть проведена в соответствии с любым известным методом. На растворитель, используемый в реакции, не накладывается никаких определенных ограничений, пока растворитель является инертным по отношению к реакции. Примеры растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, N,N-диметилформамид и диметилсульфоксид. Указанные растворители могут использоваться отдельно или в комбинации. В реакции, в случае необходимости, может также использоваться основание. Примеры оснований включают органические амины, такие как имидазол, 1-метилимидазол, триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия и карбонат калия. Растворитель может полностью состоять из основания. В реакции вышеупомянутые (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z используются в количестве приблизительно 1-10 моль, предпочтительно приблизительно 1-5 моль, а основание используется в количестве приблизительно 1-100 моль, предпочтительно приблизительно 1-10 моль, относительно 1 моля соединения, представленного формулой (2). Значения температуры и времени реакции составляют от -30 до 100°C и от 0,1 до 100 часов, предпочтительно от 0 до 30°C и от 1 до 20 часов. Соединение, представленное формулой (1a) и полученное в результате реакции, может быть выделено и очищено при необходимости. Альтернативно, соединение может также использоваться на последующей стадии без дальнейшей очистки. Триалкилсилил галогенид, используемый в реакции и представленный как (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z, может быть получен с помощью стандартного метода. Например, тригалогенсилан, моноалкилдигалогенсилан или диалкилмоногалогенсилан взаимодейтсвуют с соответствующим алкиллитием или реактивом Гриньяра, в результате чего образуется триалкилсилан, представленный как (R3)(R4)(R5)Si-H или (R6)(R7)(R8)Si-H, и далее продукт взаимодействует с галогенирующим агентом, таким как N-хлорсукцинимид, N-бромсукцинимид, N-йодсукцинимид, хлор, бром, йод или 1,3-дихлор-5,5-диметилгидантоин, в результате чего образуется триалкилсилил галогенид. В процессе получения триалкилсилана, представленного как (R3)(R4)(R5)Si-H, может использоваться такая добавка, как бромид меди. Триалкилсилан, представленный как (R3)(R4)(R5)Si-H или (R6)(R7)(R8)Si-H, и триалкилсилил галогенид, представленный как (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z, может быть выделен и очищен в случае необходимости. Альтернативно, соединения могут также использоваться на стадии 1 в том же виде, в каком получали.
(Стадия 2)
На стадии 2 пиримидиновое нуклеозидное соединение, представленное формулой (1a), взаимодействует с вышеупомянутым (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z в присутствии основания, в результате чего образуется соединение, представленное формулой (1b). Стадия 2 проводится таким же способом, как и стадия 1.
(Стадия 3)
На стадии 3 пиримидиновое нуклеозидное соединение, представленное формулой (2), взаимодействует с вышеупомянутым (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z или с таким соединением, как диалкилсилил дигалогенид или диалкилсилил дитрифлат, представленный как Z-Si(R9)(R10)-Z (где Z имеет такое же значение, как упомянуто выше), в присутствии основания, в результате чего, таким же способом, как и на стадии 1, может быть получено соединение, представленное формулой (1b). Значения температуры и времени реакции составляют от -30 до 150°C и от 0,1 до 100 часов, предпочтительно от 0 до 100°C и от 1 до 40 часов. Соединение, представленное формулой (1b) и полученное в результате реакции, может быть выделено и очищено в случае необходимости. Альтернативно, соединение можно также использовать на последующей стадии без дальнейшей очистки.
(Стадия 4)
На стадии 4 пиримидиновое нуклеозидное соединение, представленное формулой (1b), обрабатывают в кислотных условиях, в результате чего образуется соединение, представленное формулой (1c). На кислоту, используемую на стадии 4, не накладывается никаких специфических ограничений, пока кислота применима для удаления заместителя R1. Примеры кислоты включают минеральные кислоты, например соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту; и органические кислоты, например трифторуксусную кислоту, уксусную кислоту, пропионовую кислоту, муравьиную кислоту, метансульфоновую кислоту и п-толуолсульфоновую кислоту. Указанные кислоты могут быть смешаны с водой, причем в случае необходимости может также использоваться растворитель. Примеры используемого растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, N,N-диметилформамид, диметилсульфоксид, метанол, этанол, н-пропанол, изопропанол и воду. Указанные растворители могут использоваться отдельно или в комбинации. Значения температуры и времени реакции составляют от -30 до 150°C и от 0,1 до 100 часов, предпочтительно от 0 до 100°C и от 1 до 20 часов.
(Стадия 5)
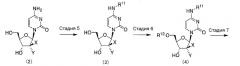
На стадии 5 пиримидиновое нуклеозидное соединение, представленное формулой (2), взаимодействует с защищающим аминогруппу реагентом, в результате чего образуется соединение, представленное формулой (3). На растворитель, используемый в реакции, не накладывается никаких специфических ограничений, пока растворитель является инертным по отношению к реакции. Примеры растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, N,N-диметилформамид и диметилсульфоксид. Указанные растворители могут использоваться отдельно или в комбинации. В реакции, в случае необходимости, может также использоваться основание. Примеры основания включают органические амины, такие как имидазол, 1-метилимидазол, триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия и карбонат калия. Растворитель может полностью состоять из основания. На используемый защищающий аминогруппу реагент не накладывается никаких специфических ограничений, пока защитная группа может быть удалена в кислых или нейтральных условиях, и примеры включают алкоксикарбонил галогениды, такие как трет-бутоксикарбонилхлорид; ангидриды алкилугольной кислоты, такие как ди-трет-бутилдикарбонат; и аралкилоксикарбонил галогениды, такие как бензилоксикарбонилхлорид. Значения температуры и времени реакции составляют от -30 до 150°C и от 0,1 до 100 часов, предпочтительно от 0 до 100°C и от 1 до 40 часов. Соединение, представленное формулой (3) и полученное в результате реакции, может быть выделено и очищено в случае необходимости. Альтернативно, соединение может также использоваться на последующей стадии без дальнейшей очистки.
(Стадия 6)
На стадии 6 пиримидиновое нуклеозидное соединение, представленное формулой (3), взаимодействует с реагентом, защищающим гидроксильную группу, в присутствии основания, в результате чего образуется соединение, представленное формулой (4). Примеры основания включают органические амины, такие как имидазол, 1-метилимидазол, триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин и коллидин; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия и карбонат калия. Растворитель может полностью состоять из основания. На растворитель, используемый в реакции, не накладывается никаких специфических ограничений, пока растворитель является инертным по отношению к реакции. Примеры растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, N,N-диметилформамид и диметилсульфоксид. Указанные растворители могут использоваться отдельно или в комбинации. На используемый реагент, защищающий гидроксильную группу, не накладывается никаких специфических ограничений, пока защитная группа может селективно защитить 5'-гидроксильную группу в молекуле сахара и может быть удалена в кислых или нейтральных условиях, и примеры включают триарилметил галогениды, такие как трифенилметилхлорид, 4-метокситрифенилметилхлорид и 4,4'-диметокситрифенилметилхлорид. Значения температуры и времени реакции составляют от -30 до 150°C и от 0,1 до 100 часов, предпочтительно от 0 до 100°C и от 1 до 40 часов. Соединение, представленное формулой (4) и полученное в результате реакции, может быть выделено и очищено в случае необходимости. Альтернативно, соединение может также использоваться на последующей стадии без дальнейшей очистки.
(Стадия 7)
На стадии 7 пиримидиновое нуклеозидное соединение, представленное формулой (4), взаимодействует с вышеупомянутым (R3)(R4)(R5)Si-Z или (R6)(R7)(R8)Si-Z в присутствии основания, в результате чего образуется соединение, представленное формулой (5). Примеры основания включают органические амины, такие как имидазол, 1-метилимидазол, триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия и карбонат калия. Растворитель может полностью состоять из основания. На растворитель, используемый в реакции, не накладывается никаких специфических ограничений, пока растворитель является инертным по отношению к реакции. Примеры растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, N,N-диметилформамид и диметилсульфоксид. Указанные растворители могут использоваться отдельно или в комбинации. Соединение, представленное формулой (5) и полученное в результате реакции, может быть выделено и очищено в случае необходимости. Альтернативно, соединение может также использоваться на последующей стадии без дальнейшей очистки.
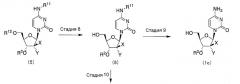
(Стадия 8)
На стадии 8 пиримидиновое нуклеозидное соединение, представленное формулой (5), взаимодействует с реагентом для снятия защитных групп, в результате чего образуется соединение, представленное формулой (6). В том случае, когда защитной группой для 5'-гидроксильной группы в молекуле сахара является триарилметильная группа, примеры используемого растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, ацетон, N,N-диметилформамид, диметилсульфоксид, метанол, этанол, н-пропанол, изопропанол и воду. Указанные растворители могут использоваться отдельно или в комбинации. На используемый реагент для снятия защитных групп не накладывается никаких специфических ограничений, и могут использоваться соответствующие стандартные реагенты. Например, в том случае, когда защитной группой для 5'-гидроксильной группы в молекуле сахара является триарилметильная группа, примеры реагента для снятия защитных групп включают минеральные кислоты, например соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту; и органические кислоты, например трифторуксусную кислоту, уксусную кислоту, пропионовую кислоту, муравьиную кислоту, метансульфоновую кислоту и п-толуолсульфоновую кислоту. Значения температуры и времени реакции составляют от -30 до 150°C и от 0,1 до 100 часов, предпочтительно от 0 до 100°C и от 1 до 40 часов. Соединение, представленное формулой (6) и полученное в результате реакции, может быть выделено и очищено в случае необходимости. Альтернативно, соединение может также использоваться на последующей стадии без дальнейшей очистки.
(Стадия 9)
На стадии 9 пиримидиновое нуклеозидное соединение, представленное формулой (6), взаимодействует с реагентом для снятия защитных групп, в результате чего образуется соединение, представленное формулой (1c). В том случае, когда защитная группа для 4-аминогруппы является трет-бутоксикарбонильной группой, примеры используемого растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, ацетон, N,N-диметилформамид, диметилсульфоксид, метанол, этанол, н-пропанол, изопропанол и воду. Указанные растворители могут использоваться отдельно или в комбинации. На используемый реагент для снятия защитных групп не накладывается никаких специфических ограничений, и могут использоваться соответствующие стандартные реагенты. Например, в том случае, когда защитная группа для 4-аминогруппы является трет-бутоксикарбонильной группой, примеры реагента для снятия защитных групп включают минеральные кислоты, например соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту; и органические кислоты, например трифторуксусную кислоту, уксусную кислоту, пропионовую кислоту, муравьиную кислоту, метансульфоновую кислоту и п-толуолсульфоновую кислоту. Значения температуры и времени реакции составляют от -30 до 150°C и от 0,1 до 100 часов, предпочтительно от 0 до 100°C и от 1 до 40 часов. Следует отметить, что стадии 8 и 9 могут быть проведены как одна единственная стадия вместо двух отдельных стадий.
(Стадия 10)
На стадии 10 пиримидиновое нуклеозидное соединение, представленное формулой (6), конденсируют с соответствующей карбоновой кислотой с защищенной аминогруппой, в результате чего образуется эфир карбоновой кислоты, представленный формулой (7). На тип реакции конденсации не накладывается никаких специфических ограничений, пока конденсация проходит между обычной карбоновой кислотой и спиртом таким образом, что в результате образуется эфир. Например, может использоваться смешанный ангидрид, конденсирующий агент и т.д. Когда используется смешанный ангидрид, примеры основания включают органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия и карбонат калия. Примеры реагента, используемого для образования смешанного ангидрида кислоты с аминокислотой с защищенной аминогруппой, включают изобутилхлоркарбонат и пивалоилхлорид. Примеры конденсирующего агента включают карбодиимидные соединения, такие как дициклогексилкарбодиимид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида и N,N'-карбонилдиимидазол. Примеры конденсирующих вспомогательных веществ включают 1-гидроксибензотриазолгидрат, N-гидроксисукцинимид, N-гидрокси-5-норборнен-2,3-дикарбоксимид и 4-диметиламинопиридин. На растворитель, используемый в реакции, не накладывается никаких специфических ограничений, пока растворитель является инертным по отношению к реакции. Примеры растворителя включают дихлорметан, хлороформ, этилацетат, тетрагидрофуран, диоксан, диэтиловый эфир, бензол, толуол, N,N-диметилформамид и диметилсульфоксид. Указанные растворители могут использоваться отдельно или в комбинации. Соединение, представленное формулой (7) и полученное в результате реакции, может быть выделено и очищено в случае необходимости. Альтернативно, соединение может также использоваться на последующей стадии без дальнейшей очистки.
(Стадия 11)
На стадии 11 пиримидиновое нуклеозидное соединение, представленное формулой (7), взаимодействует с реагентом для снятия защитных групп, в результате чего образуется соединение, представленное формулой (1d). В том случае, когда каждая из защитных групп для 5'-амино- и 4-аминогрупп является трет-бутоксикарбонильной группой, пример