Способ детекции микроорганизма и набор для детекции микроорганизма
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ детекции живых клеток микроорганизма путем дифференцирования живых клеток от мертвых клеток или поврежденных клеток в тестируемом образце. Способ предусматривает стадию обработки тестируемого образца ядом топоизомеразы или ядом ДНК-гиразы, стадию экстракции ДНК из тестируемого образца и амплификацию мишеневого участка экстрагированной ДНК методом ПНР, где длина мишеневого участка составляет от 900 до 3000 нуклеотидов, и стадию анализа продукта амплификации. Изобретение позволяет определять наличие живых организмов с высокой степенью точности. 4 н. и 48 з.п. ф-лы, 18 ил., 6 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу детекции микроорганизма, присутствующего в продуктах питания или клинических образцах, а также к набору для детекции микроорганизма. Более конкретно, настоящее изобретение относится к способу и набору, с помощью которых можно избирательно детектировать живые клетки микроорганизма, присутствующие в продуктах питания или клинических образцах.
УРОВЕНЬ ТЕХНИКИ
Для определения количества живых бактерий в пищевых продуктах, клинических образцах или окружающей среде обычно используют метод культивирования на чашках. Однако при использовании этого метода для получения результата требуется приблизительно два дня.
Вследствие усовершенствования методов стерилизации и обработки пищевых продуктов увеличивается потребность в способах, позволяющих различить живое и мертвое состояние микроорганизмов, присутствующих в тестируемых образцах, даже в тех случаях, когда количество клеток является предельно низким. В частности, в областях санитарной инспекции пищевых продуктов и клинического тестирования предпринимаются попытки разработать способ быстрой детекции бактерий, позволяющий определить присутствие или отсутствие бактерий и их количество, путем амплификации методом ПЦР генов, специфичных для бактерий, с получением такого их количества, которое можно визуально обнаружить. Однако при использовании в качестве матрицы бактериальной ДНК также детектируется шум, обусловленный мертвыми клетками, изначально присутствующими в тестируемом образце, и, следовательно, положительный результат, полученный методом ПЦР, не позволяет сделать однозначный вывод о наличии живых бактерий. Поэтому в настоящее время метод ПЦР не находит широкого применения в областях санитарной инспекции пищевых продуктов и клинического тестирования, хотя он является высокочувствительным и быстрым методом.
В настоящее время предпринимаются попытки разработать способ детекции и количественного определения только живых клеток в тестируемом образце путем получения кДНК методом ПЦР с использованием обратной транскриптазы, мРНК в качестве матрицы и праймеров, специфичных для разных бактерий. Однако в таком способе обратная транскрипция мРНК мертвых клеток не ингибируется и, если в тестируемом образце присутствует 104 кое/мл, или 104 кое/г, или больше мертвых клеток, детектируется шум, обусловленный присутствием мертвых клеток. Следовательно, этот способ не позволяет однозначно проводить различие живого и мертвого состояния.
Способ, позволяющий различать живое и мертвое состояние микроорганизмов, таких как бактерии, с помощью метода ПЦР, описан в патентных документах 1 и 2. Однако способы дифференциальной детекции живого и мертвого состояний микроорганизмов, таких как бактерии, с помощью метода ПЦР имеют указанные ниже проблемы.
Для иллюстрации способа, раскрытого в патентном документе 1, приводятся примеры детекции мертвых клеток в пищевых продуктах, подвергавшихся высокотемпературной стерилизации в течение длительного времени, 100°C в течение 10-30 минут, и микроорганизмов, присутствующих в пищевых продуктах, подвергавшихся стерилизации этанолом или формальдегидом. Однако в действительности такие методы, особенно последний, не используются для пастеризации пищевых продуктов. Более того, не приведены примеры детекции только живых организмов в продуктах, подвергавшихся методам пастеризации, широко использующимся в настоящее время в пищевой промышленности, которые включают низкотемпературную длительную пастеризацию (пастеризация LTLT), высокотемпературную кратковременную пастеризацию (пастеризация HTST) или пастеризацию при сверхвысокой температуре (пастеризация UHT), а также детекции только живых конкретных патогенных бактерий в клинических образцах пациентов с инфекционным заболеванием, получающих антибиотики. Кроме того, в случае тестируемого образца пищевого продукта или клинического образца, содержащего мертвые клетки в концентрации 104 кое/мл или выше, количество конечных продуктов амплификации ПЦР, полученных из мертвых клеток, превышает предел чувствительности способа патентного документа 1, и, следовательно, нельзя определить, от живых или от мертвых клеток получен положительный ответ при анализе тестируемого образца методом ПЦР.
Затем в патентном документе 2 раскрывается способ, позволяющий дифференциально детектировать живые и мертвые клетки, который основан на том, что молярное соотношение РНК/ДНК в мертвых клетках ниже, чем в живых. Этот способ проводят следующим образом: экстрагируют общую РНК, с помощью реакции обратной транскрипции получают комплементарную ей ДНК, затем проводят ПЦР, чтобы рассчитать значение Ct, и определяют молярную концентрацию РНК, используя полученную заранее калибровочную кривую. Отдельно методом ПЦР амплифицируют участок хромосомальной ДНК, соответствующий упомянутой РНК, с получением значения Ct, рассчитывают с помощью калибровочной кривой концентрацию хромосомальной ДНК и определяют молярное соотношение РНК/ДНК. То есть для осуществления вышеуказанного способа требуется проведение сложной экстракции общей РНК, двух стадий реакции обратной транскрипции и ПЦР. Следовательно, с точки зрения количественных показателей и затрат времени этот способ хуже обычного метода ПЦР с использованием ДНК в качестве матрицы. Кроме того, в живых клетках РНК продуцируется постоянно, тогда как в мертвых клетках РНК разлагается на ранней стадии. Следовательно, указанному способу не хватает стабильности. Кроме того, в пищевом продукте или клиническом образце, содержащем большое количество мертвых клеток, с помощью этого способа можно определить живые клетки, только если их количество составляет 1/10 от количества мертвых клеток. Таким образом, этот способ нежелательно использовать в областях санитарной инспекции пищевых продуктов и клинического тестирования, где требуются скорость, высокая чувствительность и точность.
Патентный документ 1: Международная патентная заявка, не рассмотренная публикация в Японии № 2000-530118.
Патентный документ 2: Международная патентная публикация WO2002/052034, брошюра.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачи, решаемые изобретением
Целью настоящего изобретения является создание способа селективной детекции живых клеток (жизнеспособных и пригодных к культивированию) микроорганизма, присутствующего в пищевом продукте или клиническом образце, на фоне мертвых или поврежденных клеток (поврежденные клетки, другими словами, называют жизнеспособные, но не пригодные к культивированию клетки (клетки VNC)), то есть создание способа быстрой детекции, альтернативного методу культивирования, но превосходящего его по характеристикам, а также набор, используемый для проведения указанного способа.
Способы решения задач
Авторы настоящего изобретения провели тщательные исследования по созданию способа детекции живых и мертвых клеток, применимому к разным методам стерилизации, который обладает высокой чувствительностью, подходит для санитарной инспекции пищевых продуктов и, кроме того, позволяет детектировать конкретные патогенные бактерии у пациентов с инфекционным заболеванием в больницах или клинических центрах. В результате авторы обнаружили, что способ дифференциальной детекции живых и поврежденных клеток микроорганизма в тестируемом образце путем обработки такого образца ядом топоизомеразы и/или ядом ДНК-гиразы или путем обработки тестируемого образца моноазидом этидия, облучения видимым светом и обработки ядом топоизомеразы и/или ядом ДНК-гиразы, отличным от моноазида этидия, позволяет селективно амплифицировать хромосомную ДНК живых клеток методом ПЦР, и создали быстрый способ, являющийся альтернативным методу культивирования. Таким образом, авторы осуществили настоящее изобретение.
Таким образом, настоящее изобретение относится к способу детекции живых клеток микроорганизма в тестируемом образце, который включает следующие стадии:
a) стадию обработки тестируемого образца ядом топоизомеразы и/или ядом ДНК-гиразы,
b) стадию экстракции ДНК из тестируемого образца и амплификацию мишеневого участка экстрагированной ДНК методом ПЦР и
c) стадию анализа продукта амплификации.
В предпочтительном варианте осуществления вышеуказанного способа продукт амплификации анализируют с помощью стандартной кривой, отражающей взаимоотношение количества микроорганизма и продукта амплификации, полученной с использованием стандартных образцов микроорганизма.
В предпочтительном варианте осуществления вышеуказанного способа ПЦР проводят в режиме реального времени с одновременным анализом продукта.
В предпочтительном варианте осуществления вышеуказанного способа тестируемый образец может представлять собой молоко, молочный продукт, пищевой продукт, полученный с использованием молока или молочного продукта в качестве сырья, образец крови, образец мочи, образец спинномозговой жидкости, образец синовиальной жидкости и образец плевральной жидкости.
В предпочтительном варианте осуществления вышеуказанного способа микроорганизм представляет собой бактерию.
В предпочтительном варианте осуществления вышеуказанного способа мишеневый участок представляет собой ген рРНК 23S. В этом варианте осуществления ПЦР предпочтительно проводят с использованием набора праймеров, содержащего праймеры SEQ ID NO: 1 и 2, или набора праймеров, содержащего праймеры SEQ ID NO: 3 и 4.
В предпочтительном варианте осуществления вышеуказанного способа микроорганизм представляет собой патогенную бактерию. В этом варианте осуществления мишеневый участок предпочтительно представляет собой патогенный ген. Кроме того, в этом варианте осуществления ПЦР предпочтительно проводят с использованием набора праймеров, содержащего праймеры SEQ ID NO: 7 и 8.
В предпочтительном варианте осуществления вышеуказанного способа яд топоизомеразы выбран из амсакрина, камптотецина, доксорубицина, эллиптицина, этопозида, митоксантрона, саинтопина, топотекана и CP-115953.
В предпочтительном варианте осуществления вышеуказанного способа яд ДНК-гиразы выбран из ципрофлоксацина, офлоксацина, эноксацина, пефлоксацина, флероксацина, норфлоксацина, налидиксовой кислоты, оксолиновой кислоты и пиромидиновой кислоты.
В предпочтительном варианте осуществления вышеуказанного способа яд топоизомеразы и/или яд ДНК-гиразы представляет собой моноазид этидия, а способ включает стадию облучения тестируемого образца, к которому добавлен моноазид этидия, видимым светом.
В предпочтительном варианте осуществления вышеуказанного способа тестируемый образец обрабатывают моноазидом этидия и ядом топоизомеразы и/или ядом ДНК-гиразы, отличным от моноазида этидия.
В предпочтительном варианте осуществления вышеуказанного способа перед вышеупомянутой стадией a) проводят:
d) стадию обработки тестируемого образца топоизомеразой и/или ДНК-гиразой.
Также настоящее изобретение относится к набору для детекции живых клеток микроорганизма в тестируемом образце методом ПЦР, который содержит следующие компоненты: яд топоизомеразы и/или яд ДНК-гиразы и праймеры для амплификации мишеневого участка ДНК микроорганизма, детектируемого методом ПЦР.
В предпочтительном варианте осуществления вышеуказанный набор содержит топоизомеразу и/или ДНК-гиразу.
В предпочтительном варианте осуществления вышеуказанного набора яд топоизомеразы выбран из амсакрина, камптотецина, доксорубицина, эллиптицина, этопозида, митоксантрона, саинтопина, топотекана и CP-115953.
В предпочтительном варианте осуществления вышеуказанного набора яд ДНК-гиразы выбран из ципрофлоксацина, офлоксацина, эноксацина, пефлоксацина, флероксацина, норфлоксацина, налидиксовой кислоты, оксолиновой кислоты и пиромидиновой кислоты.
В предпочтительном варианте осуществления вышеуказанный набор содержит моноазид этидия и яд топоизомеразы и/или яд ДНК-гиразы, отличный от моноазида этидия.
В предпочтительном варианте осуществления вышеуказанного набора упомянутые праймеры включают праймеры SEQ ID NO: 1 и 2 или праймеры SEQ ID NO: 3 и 4.
В другом предпочтительном варианте осуществления вышеуказанного набора упомянутые праймеры включают праймеры SEQ ID NO: 7 и 8.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
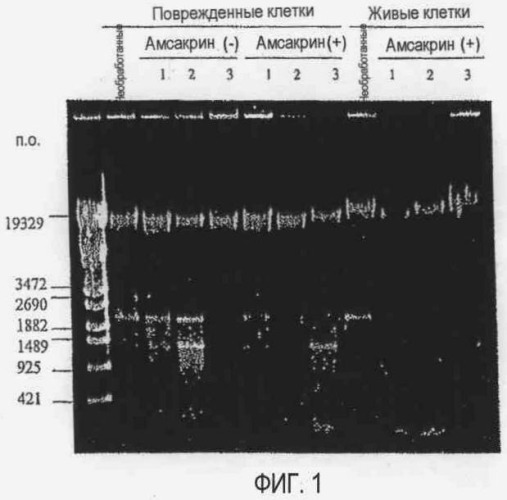
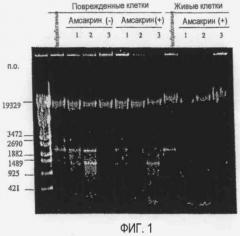
[Фиг. 1] Фотографии электрофореза, демонстрирующие влияние внутриклеточной ДНКазы поврежденных клеток на хромосомную ДНК Listeria (поврежденные клетки), влияние амсакрина на хромосомную ДНК Listeria (поврежденные клетки) и влияние амсакрина на хромосомную ДНК Listeria (живые клетки):
Non: необработанные.
Амсакрин(-): амсакрин не добавляют,
Амсакрин(+): амсакрин добавляют,
1: Инкубация при 30°C в течение 24 часов,
2: Инкубация при 30°C в течение 48 часов,
3: Инкубация при 30°C в течение 72 часов.
[Фиг. 2] Фотографии электрофореза, демонстрирующие влияние внутриклеточной ДНКазы поврежденных клеток на хромосомную ДНК Enterobacter (поврежденные клетки):
Non: необработанные.
1: Инкубация при 37°C в течение 24 часов,
2: Инкубация при 37°C в течение 48 часов,
3: Инкубация при 37°C в течение 72 часов.
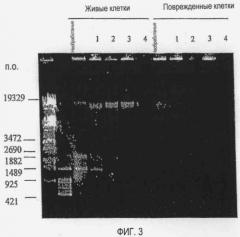
[Фиг. 3] Фотографии электрофореза, демонстрирующие влияние ципрофлоксацина на хромосомную ДНК Enterobacter (живые клетки и поврежденные клетки):
Non: необработанные.
1: Инкубация при 37°C в течение 1,5 часов,
2: Инкубация при 37°C в течение 3,5 часов,
3: Инкубация при 37°C в течение 5 часов,
4: Инкубация при 37°C в течение 72 часов.
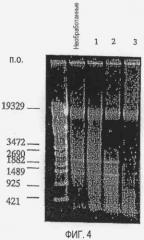
[Фиг. 4] Фотографии электрофореза, демонстрирующие влияние внутриклеточной ДНКазы поврежденных клеток на хромосомную ДНК Listeria (поврежденные клетки):
Non: необработанные.
1: Инкубация при 30°C в течение 24 часов,
2: Инкубация при 30°C в течение 48 часов,
3: Инкубация при 30°C в течение 72 часов.
[Фиг. 5] Фотографии электрофореза, демонстрирующие влияние ципрофлоксацина на хромосомную ДНК Listeria (живые клетки и поврежденные клетки):
Non: необработанные.
1: Инкубация при 30°C в течение 1,5 часов,
2: Инкубация при 30°C в течение 3,5 часов,
3: Инкубация при 30°C в течение 5 часов,
4: Инкубация при 30°C в течение 72 часов.
[Фиг. 6] Кривая амплификации методом ПЦР в режиме реального времени с использованием в качестве матрицы гена рРНК 23S Enterobacter (живые клетки), обработанного ципрофлоксацином (полутоновая фотография).
[Фиг. 7] TM-график (кривая плавления) продукта амплификации методом ПЦР в режиме реального времени с использованием в качестве матрицы гена рРНК 23S Enterobacter (живые клетки), обработанного ципрофлоксацином (полутоновая фотография).
[Фиг. 8] Кривая амплификации методом ПЦР в режиме реального времени с использованием в качестве матрицы гена рРНК 23S Enterobacter (поврежденные клетки), обработанного ципрофлоксацином (полутоновая фотография).
[Фиг. 9] TM-график (кривая плавления) продукта амплификации методом ПЦР в режиме реального времени с использованием в качестве матрицы гена рРНК 23S Enterobacter (поврежденные клетки), обработанного ципрофлоксацином (полутоновая фотография).
[Фиг. 10] Кривая амплификации методом ПЦР в режиме реального времени с использованием в качестве матрицы гена рРНК 23S Listeria (живые клетки), обработанного ципрофлоксацином (полутоновая фотография).
[Фиг. 11] Кривая амплификации методом ПЦР в режиме реального времени с использованием в качестве матрицы гена рРНК 23S Listeria (поврежденные клетки), обработанного ципрофлоксацином (полутоновая фотография).
[Фиг. 12] График зависимости температуры клеточной суспензии, содержащейся в микропробирке, от времени погружения микропробирки в кипящую воду.
[Фиг. 13] Фотографии электрофореза продуктов амплификации генов методом ПЦР с использованием в качестве матрицы генов рРНК 16S семи видов бактерий (живые клетки и поврежденные клетки), обработанных или не обработанных EMA, которые для каждой бактерии показаны в следующем порядке: суспензия живых клеток, не обработанных EMA, суспензия живых клеток, обработанных EMA, суспензия поврежденных клеток, не обработанных EMA, и суспензия поврежденных клеток, обработанных EMA. Такой же порядок используется на фиг. 14 и 15.
[Фиг. 14] Фотографии электрофореза продуктов амплификации генов методом ПЦР с использованием в качестве матрицы генов рРНК 23S четырех видов бактерий (живые клетки и поврежденные клетки), обработанных или не обработанных EMA.
[Фиг. 15] Фотографии электрофореза продуктов амплификации генов методом ПЦР с использованием в качестве матрицы генов рРНК 23S Listeria (живые клетки и поврежденные клетки), обработанных или не обработанных EMA.
[Фиг. 16] Фотографии электрофореза продуктов амплификации генов методом ПЦР с использованием в качестве матрицы гена hlyA Listeria (живые клетки и поврежденные клетки), обработанного или не обработанного EMA и затем обработанного ядом ДНК-гиразы или ядом топоизомеразы:
Non: необработанные,
E: EMA,
1: EMA/ципрофлоксацин,
2: EMA/камптотецин,
3: EMA/этопозид,
4: EMA/эллиптицин,
5: EMA/митоксантрон,
6: EMA/амсакрин.
[Фиг. 17] Фотографии электрофореза продуктов амплификации генов методом ПЦР с использованием в качестве матрицы гена рРНК 16S Listeria (живые клетки и поврежденные клетки), обработанного или не обработанного EMA и затем обработанного ядом ДНК-гиразы или ядом топоизомеразы:
Non: необработанные,
E: EMA,
1: EMA/ципрофлоксацин,
2: EMA/камптотецин,
3: EMA/этопозид,
4: EMA/эллиптицин,
5: EMA/митоксантрон,
6: EMA/амсакрин.
[Фиг. 18] Фотографии электрофореза продуктов амплификации генов методом ПЦР с использованием в качестве матрицы гена рРНК 23S Listeria (живые клетки и поврежденные клетки), обработанного или не обработанного EMA и затем обработанного ядом ДНК-гиразы или ядом топоизомеразы:
Non: необработанные,
E: EMA,
1: EMA/ципрофлоксацин,
2: EMA/камптотецин,
3: EMA/этопозид,
4: EMA/эллиптицин,
5: EMA/митоксантрон,
6: EMA/амсакрин.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее приводится подробное описание предпочтительных вариантов осуществления настоящего изобретения. Тем не менее, настоящее изобретение не ограничивается нижеследующими предпочтительными вариантами осуществления, которые можно свободно модифицировать в пределах объема формулы изобретения. В этом описании, если не указано иначе, проценты приводятся в виде массового отношения.
<1> Способ по настоящему изобретению
Способ по настоящему изобретению представляет собой способ детекции живых клеток микроорганизма в тестируемом образце, который включает следующие стадии:
a) стадию обработки тестируемого образца ядом топоизомеразы и/или ядом ДНК-гиразы,
b) стадию экстракции ДНК из тестируемого образца и амплификации мишеневого участка экстрагированной ДНК методом ПЦР и
с) стадию анализа продукта амплификации.
В описании под "тестируемым образцом" понимают объект, в котором детектируют живые клетки микроорганизма, этот термин не имеет конкретных ограничений при условии, что присутствие живых клеток можно детектировать путем амплификации конкретного участка хромосомной ДНК методом ПЦР. Примеры включают пищевые продукты, такие как молоко, молочные продукты, пищевые продукты, полученные с использованием молока или молочных продуктов в качестве сырья, образцы крови, образцы мочи, образцы спинномозговой жидкости, образцы синовиальной жидкости, образцы плевральной жидкости и тому подобное. Молоко, молочные продукты, пищевые продукты, полученные с использованием молока или молочных продуктов в качестве сырья, являются особенно предпочтительными. В настоящем изобретении тестируемый образец может представлять собой один из вышеуказанных продуктов и биологических образцов как есть, или он может быть получен путем разбавления или концентрирования одного из вышеуказанных продуктов и биологических образцов или путем обработки одного из вышеуказанных продуктов и биологических образцов отличной от обработки по способу по настоящему изобретению. Примеры обработки включают тепловую обработку, фильтрацию, центрифугирование и тому подобное.
"Микроорганизм" представляет собой объект, который можно детектировать способом по настоящему изобретению, этот термин не имеет конкретных ограничений при условии, что его можно детектировать методом ПЦР и что яд топоизомеразы и яд ДНК-гиразы действуют на живые клетки микроорганизма иначе, чем на мертвые и поврежденные клетки микроорганизма. Предпочтительные примеры включают бактерии, гифомицеты, дрожжи и тому подобное. Бактерии включают как грамположительные, так и грамотрицательные бактерии. Примеры грамположительных бактерий включают бактерии Staphylococcus, такие как Staphylococcus epidermidis, бактерии Streptococcus, бактерии Listeria, такие как Listeria monocytogenes, бактерии Bacillus, такие как Bacillus cereus, бактерии Mycobacterium и тому подобное. Примеры грамотрицательных бактерий включают кишечные бактерии, например бактерии Escherichia, такие как Escherichia coli, бактерии Enterobacter, такие как Enterobacter sakazakii, бактерии Citrobacter, такие как Citrobacter koseri, бактерии Klebsiella, такие как Klebsiella oxytoca, а также бактерии Salmonella, бактерии Vibrio, бактерии Pseudomonas и тому подобное.
В настоящем изобретении термин "живая клетка" относится к клетке, которая способна пролиферировать и обладает метаболической активностью микроорганизма (состояние живой и пригодной к культивированию клетки) при культивировании в обычных условиях и которая практически не имеет повреждений клеточной стенки. Примером упомянутой выше метаболической активности может служить АТФ-активность, эстеразная активность и др.
Термин "мертвая клетка" относится к клетке, которая не способна пролиферировать и не обладает метаболической активностью микроорганизма (состояние мертвой клетки), даже если ее культивируют в оптимальных условиях. Кроме того, стенка такой клетки имеет значительные повреждения, хотя ее структура в целом сохраняется, и ядерный краситель, который обладает плохой проникающей способностью, такой как иодид пропидия, может проникать через клеточную стенку.
Термин "поврежденная клетка" (поврежденная клетка или живая, но не пригодная к культивированию клетка) относится к клетке, которая плохо пролиферирует, даже если ее культивируют в оптимальных условиях, поскольку она имеет повреждения, вызванные искусственными факторами или воздействием окружающей среды, и обладает более низкой метаболической активностью, чем живая клетка, но сохраняет значительный уровень метаболической активности в отличие от мертвой клетки.
Детекции бактерий, находящихся в состоянии поврежденной клетки, путем тепловой обработки среднего уровня или введения антибиотиков уделяется большое внимание, особенно в областях санитарной инспекции пищевых продуктов и клинического тестирования, и настоящее изобретение относится к способу детекции микроорганизма, который позволяет не только детектировать живые клетки, но и отличать живые клетки от мертвых или поврежденных клеток.
Единицей измерения количества живых, поврежденных и мертвых клеток является число клеток/мл. Число живых клеток можно приблизительно определить как число колоний (кое/мл (колониеобразующих единиц/мл)), образованных при культивировании клеток в оптимальных условиях на подходящей культуральной среде. Стандартный образец поврежденных клеток можно получить путем тепловой обработки суспензии живых клеток, например путем тепловой обработки в кипящей воде. В таком образце число поврежденных клеток можно приблизительно определить как число кое/мл в суспензии живых клеток до тепловой обработки. Хотя время тепловой обработки в кипящей воде, необходимое для получения поврежденных клеток, изменяется в зависимости от типа микроорганизма, поврежденные клетки бактерий, описанных в примерах, можно получить, например, путем тепловой обработки в течение приблизительно 50 секунд. Кроме того, стандартный образец поврежденных клеток можно получить путем обработки антибиотиком. В этом случае число поврежденных клеток можно приблизительно определить как число колоний (кое/мл), образованных при культивировании клеток в оптимальных условиях на подходящей культуральной среде после удаления антибиотика из суспензии живых клеток путем измерения коэффициента пропускания видимого света (длина волны: 600 нм), то есть мутности, и сравнения полученного значения с мутностью суспензии живых клеток с известной плотностью живых клеток.
Способ по настоящему изобретению предназначен для детекции живых клеток, а клетки, отличающиеся от живых, могут быть поврежденными или мертвыми клетками.
В настоящем изобретении под "детекцией живых клеток" понимают определение присутствия или отсутствия, а также количества живых клеток в тестируемом образце. Количество живых клеток не ограничивается абсолютным значением и может представлять собой относительное количество, полученное при сравнении с контрольным образцом.
Далее способ по настоящему изобретению описывается постадийно.
(1) Стадия a)
Тестируемый образец обрабатывают ядом топоизомеразы и/или ядом ДНК-гиразы.
В настоящем изобретении используют яд топоизомеразы и яд ДНК-гиразы, которые не ингибируют активность топоизомеразы и ДНК-гиразы, соответственно, связанную с расщеплением ДНК, однако ингибируют повторное лигирование ДНК или увеличивают прямую скорость расщепления ДНК. Предпочтительно, яд топоизомеразы и яд ДНК-гиразы представляют собой яды, которые способны связываться с хромосомной ДНК микроорганизма путем ковалентного присоединения, встраиваться в хромосомную ДНК и связываться с ней путем ковалентного присоединения при облучении видимым светом, просто встраиваться в хромосомную ДНК или образовывать комплекс с топоизомеразой или ДНК-гиразой.
Можно использовать и яд топоизомеразы, и яд ДНК-гиразы или один из них.
Предпочтительно, яд топоизомеразы и яд ДНК-гиразы представляют собой яды, которые оказывают различное действие на живые клетки и поврежденные клетки, мертвые клетки, соматические клетки, такие как бычьи лейкоциты, лейкоциты, тромбоциты и тому подобное, более конкретно, они представляют собой яды, которые легче проникают через клеточные стенки поврежденных и мертвых клеток и через клеточные мембраны соматических клеток, таких как бычьи лейкоциты, лейкоциты, тромбоциты и тому подобное, чем через клеточные стенки живых клеток.
Примеры ядов топоизомеразы включают амсакрин, камптотецин, доксорубицин, эллиптицин, этопозид, митоксантрон, саинтопин, топотекан, CP-115953 и тому подобное. Можно использовать один вид яда топоизомеразы или сочетание двух или более видов данного яда.
Примеры яда ДНК-гиразы включают ципрофлоксацин, офлоксацин, эноксацин, пефлоксацин, флероксацин, норфлоксацин, налидиксовую кислоту, оксолиновую кислоту, пиромидиновую кислоту и тому подобное. Можно использовать независимо один вид яда ДНК-гиразы или сочетание двух или более видов.
Перед проведением обработки ядом топоизомеразы или ядом ДНК-гиразы подбирают подходящие условия. Например, чтобы подобрать условия, позволяющие легко отличать живые клетки от мертвых и поврежденных клеток, к суспензиям живых клеток и мертвых или поврежденных клеток детектируемого микроорганизма добавляют яд топоизомеразы или яд ДНК-гиразы в разных концентрациях, инкубируют в течение разных промежутков времени, затем клетки собирают центрифугированием или другим способом и анализируют методом ПЦР. Затем, чтобы подобрать условия, позволяющие легко отличать живые клетки детектируемого микроорганизма от соматических клеток, таких как бычьи лейкоциты, тромбоциты и тому подобное, к суспензиям живых клеток и вышеуказанных других клеток добавляют яд топоизомеразы в разных концентрациях, инкубируют в течение заранее установленного времени, затем живые клетки и вышеуказанные другие клетки собирают центрифугированием или другим способом и анализируют методом ПЦР. Примеры таких условий конкретно включают в случае амсакрина - конечную концентрацию от 1 до 100 мкг/мл, температуру от 25 до 37°C и время обработки от 5 минут до 48 часов, в случае эллиптицина - конечную концентрацию от 0,05 до 5 мкг/мл, температуру от 25 до 37°C и время обработки от 10 минут до 48 часов, в случае камптотецина - конечную концентрацию от 1 до 100 мкг/мл, температуру от 25 до 37°C и время обработки от 10 минут до 48 часов, в случае ципрофлоксацина - конечную концентрацию от 0,4 до 40 мкг/мл, температуру от 25 до 37°C и время обработки от 10 минут до 48 часов, в случае этопозида - конечную концентрацию от 1 до 100 мкг/мл, температуру от 25 до 37°C и время обработки от 5 минут до 48 часов и в случае митоксантрона - конечную концентрацию от 0,1 до 10 мкг/мл, температуру от 25 до 37°C и время обработки от 10 минут до 48 часов. Обработку тестируемого образца в заранее определенных условиях завершают путем выведения яда разбавлением и/или путем разделения компонентов смеси центрифугированием или другим способом.
Вышеупомянутые яд топоизомеразы и яд ДНК-гиразы легче проникают через стенки поврежденных и мертвых клеток, чем через стенки живых клеток. Следовательно, считается, что при обработке в течение указанных выше промежутков времени яды практически не проникают через стенки живых клеток, но проникают через стенки поврежденных клеток, мертвых клеток и живых соматических клеток, как мертвых клеток. Считается также, что они могут проникать даже в живые соматические клетки, поскольку у них нет клеточных стенок, а есть только клеточные мембраны. Установлено, что в результате яд топоизомеразы или яд ДНК-гиразы проникает в мертвые соматические клетки, мертвые бактерии и поврежденные бактерии, затем беспорядочно связывается с хромосомной ДНК путем ковалентного присоединения, встраивается в ДНК или образует комплекс с топоизомеразой и затем ингибирует повторное лигирование ДНК под действием топоизомеразы II или топоизомеразы I в соматических клетках, или топоизомеразы IV или топоизомераз I и III, или ДНК-гиразы в мертвых или поврежденные клетках или увеличивает прямую скорость расщепления ДНК, вызывая фрагментацию хромосомной ДНК.
Поскольку хромосомная ДНК в поврежденных и мертвых клетках в отличие от живых клеток преимущественно находится во фрагментированном состоянии, мишеневый участок хромосомной ДНК живых клеток можно амплифицировать методом ПЦР, тогда как расщепление мишеневого участка в поврежденных или мертвых клетках приводит к ингибированию амплификации методом ПЦР. Кроме того, при использовании, например, амсакрина или камптотецина происходит поперечная сшивка, которая также приводит к ингибированию амплификации методом ПЦР. Следовательно, метод ПЦР позволяет избирательно детектировать живые клетки на фоне поврежденных или мертвых клеток.
В мертвых клетках активность внутриклеточной топоизомеразы и/или ДНК-гиразы может отсутствовать. Кроме того, в поврежденных клетках активность указанных ферментов может быть снижена или может отсутствовать. Поэтому в предпочтительном варианте осуществления настоящего изобретения тестируемый образец перед стадией a) обрабатывают топоизомеразой и/или ДНК-гиразой (стадия d)). Подробное описание стадии d) приведено ниже.
В другом предпочтительном варианте осуществления настоящего изобретения яд топоизомеразы или яд ДНК-гиразы представляет собой моноазид этидия, а способ включает стадию облучения тестируемого образца видимым светом после добавления моноазида этидия. Моноазид этидия (EMA) легче проникает через клеточные стенки поврежденных или мертвых клеток, чем через стенки живых клеток микроорганизмов. Следовательно, считается, что EMA практически не проникает через клеточные стенки живых бактерий, но проникает через клеточные стенки поврежденных и мертвых бактерий, а также через клеточные мембраны соматических клеток, как мертвых клеток. Если лейкоциты и тромбоциты в крови представляют собой живые клетки, то EMA легче проникает через клеточные мембраны в стерильной воде или в гипотоническом солевом растворе. EMA проникает в соматические клетки, как мертвые клетки, поврежденные бактерии и мертвые бактерии, беспорядочно встраивается в хромосомную ДНК, затем под действием видимого света встроенный EMA превращается в нитрен и связывается с хромосомной ДНК путем ковалентного присоединения. Установлено, что после этого EMA ингибирует повторное лигирование ДНК под действием топоизомеразы II в соматических клетках, топоизомеразы IV или ДНК-гиразы в поврежденных или мертвых бактериях, вызывая фрагментацию хромосомной ДНК.
Перед обработкой EMA подбирают подходящие условия. Например, чтобы подобрать условия, позволяющие легко отличать живые клетки от поврежденных клеток, к суспензиям живых клеток и мертвых или поврежденных клеток детектируемого микроорганизма добавляют EMA в разных концентрациях, инкубируют в течение разных промежутков времени, облучают видимым светом и затем клетки собирают центрифугированием или другим способом и анализируют методом ПЦР.
Предпочтительные условия облучения видимым светом также подбирают путем проведения эксперимента, подобного описанному выше, с использованием разных периодов облучения. А именно, обработку EMA предпочтительно проводят с использованием конечной концентрации от 0,5 до 100 мкг/мл при температуре от 4 до 10°C в течение от 5 минут до 48 часов. Кроме того, обработку EMA предпочтительно проводят с использованием защиты от света. Видимый свет предпочтительно используют в диапазоне от 500 до 700 нм. Конкретные примеры условий облучения видимым светом включают облучение мощностью от 100 до 750 Вт в течение от 5 минут до 2 часов на расстоянии от 10 до 50 см от тестируемого образца. Облучение видимым светом предпочтительно проводят при низкой температуре, например при охлаждении образца на льду.
В особенно предпочтительном варианте осуществления настоящего изобретения тестируемый образец подвергают обработке EMA, облучению видимым светом и обработке ядом топоизомеразы и/или ядом ДНК-гиразы, отличным от EMA. В данном случае порядок обработки EMA, облучения видимым светом и обработки ядом топоизомеразы и/или ядом ДНК-гиразы, отличным от EMA, конкретно не ограничивается, причем указанные обработки можно проводить одновременно.
(2) Стадия b)
ДНК экстрагируют из тестируемого образца, обработанного по способу стадии a), после чего мишеневый участок экстрагированной ДНК амплифицируют методом ПЦР (White T.J. et al., Trends Genet., 5, 185 (1989)).
Способ экстракции ДНК из тестируемого образца конкретно не ограничивается при условии, что экстрагированную ДНК можно будет использовать в качестве матрицы для ПЦР, причем экстракцию можно проводить с помощью традиционных способов экстракции ДНК микроорганизмов.
Способ экстракции ДНК описан, например, в Maniatis T., Fritsch E.F., Sambrook J. "Molecular Cloning: A Laboratory Manual", 3rd edn., Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 2001.
В настоящем изобретении "мишеневый участок" конкретно не ограничивается при условии, что он представляет собой участок хромосомной ДНК, который можно амплифицировать методом ПЦР с использованием праймеров по настоящему изобретению, и позволяет проводить детекцию микроорганизма, этот участок выбирают в зависимости от поставленной задачи. Например, если в тестируемом образце присутствуют клетки, отличные от детектируемого микроорганизма, то мишеневый участок, предпочтительно, содержит последовательность, специфичную для микроорганизма, являющегося объектом детекции. Кроме того, в зависимости от поставленной задачи мишеневый участок может содержать последовательность, общую для нескольких видов микроорганизмов. Мишеневый участок может состоять из одного участка или из двух или более участков. Используя набор праймеров, подходящий для мишеневого участка детектируемого микроорганизма, и набор праймеров, подходящий для хромосомных ДНК широкого ряда микроорганизмов, можно одновременно определить число живых клеток детектируемого микроорганизма и число живых клеток широкого ряда микроорганизмов. Длина мишеневого участка обычно составляет, например, от 80 до 3000 нуклеотидов, предпочтительно, от 900 до 3000 нуклеотидов, особенно предпочтительно, от 2000 до 3000 нуклеотидов. Конкретные примеры включают ген рРНК 16S и ген рРНК 23S. Из них предпочтительным является ген рРНК 23S.
Праймеры, используемые для ПЦР, конкретно не ограничиваются при условии, что они обеспечивают специф