Определение хромосомных аномалий в клетках, полученных из фолликулярной жидкости
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ идентификации аномалии репродуктивной системы, представляющей собой анеуплоидию, включающий в себя получение соматических клеток из фолликулярной жидкости у человека и выполнение генетического анализа указанных клеток, где идентификация по меньшей мере одной хромосомной аномалии в части клеток указывает на слабовыраженный гонадный мозаицизм. Представлен способ анализа повышенного риска бесплодия, вызванного анеуплоидией, у млекопитающего, предпочтительно, человека, включающий в себя получение соматических клеток из фолликулярной жидкости животного и выполнение генетического анализа клеток, где идентификация по меньшей мере слабовыраженного гонадного мозаицизма в части клеток указывает на наличие повышенного риска бесплодия. Изобретение позволяет идентифицировать и диагностировать хромосомные аномалии, например, слабо выраженный мозаицизм. 2 н. и 18 з.п. ф-лы, 10 ил., 7 табл.
Реферат
Перекрестные ссылки на родственную заявку
В настоящей заявке испрашивается приоритет по предварительной индийской заявке на патент № 642/MUM/2004, зарегистрированной 11 июня 2004 г.
Область изобретения
Настоящее изобретение относится к способу определения у индивидуума в клетках, полученных из фолликулярной жидкости хромосомных аномалий, включая гонадный мозаицизм.
Описание смежной области
Представленные в ядре эукариотических клеток хромосомы несут генетическую информацию клетки. Как правило, в каждой диплоидной клетке человека присутствует 23 пары хромосом с общим количеством 46 хромосом. Аномалии в структуре или количестве хромосом могут приводить к физиологическим и связанным с развитием аномалиям. Структурные аномалии хромосом могут представлять собой транслокации (реципрокные и робертсоновские), делеции, инверсии (парацентрические и перицентрические), кольцевые хромосомы и изохромосомы. Структурные хромосомные аномалии также включают в себя реаранжировку хромосом, возникающую в результате разрыва хромосомы и последующей сборки с различной сбалансированной или несбалансированной конфигурацией (Mueller RF and Young ID; Emery's Elements of Medical Genetics Ninth Edition, 1995, p. 37).
Количественные хромосомные аномалии представляют собой потерю или увеличение на одну или несколько хромосом (анеуплоидия), потерю полного набора хромосом (моноплоидия) или увеличение на один или несколько полных наборов хромосом (полиплоидия). Анеуплоидия может встречаться в форме нуллисомии (потери пары гомологичных хромосом, 2n-2), моносомии (потери одной хромосомы, 2n-1), трисомии (увеличении на одну хромосому, 2n+1) или тетрасомии (увеличении на пару гомологов, 2n+2). Анеуплоидия может быть результатом отсутствия расхождения, когда парные хромосомы не разделяются друг с другом во время деления клетки. Если нерасхождение происходит во время гаметогенеза, половина (нерасхождение при мейозе II) или все (нерасхождение при мейозе I) образующиеся гаметы будут являться анеуплоидными. Нерасхождение также может происходить при митозе, образуя две клеточные линии с различным количеством хромосом.
Следовательно, отдельный индивидуум может иметь две или несколько клеточных популяций с различными кариотипами или генетическим составом, который можно назвать мозаицизмом, хромосомным мозаицизмом или гонадным мозаицизмом. Здесь мозаичным является организм, состоящий из клеток с двумя или несколькими различными генотипами. Различные части тела индивидуума могут иметь клетки с различным общим количеством хромосом или содержанием хромосом, если явление нерасхождения происходит на этапе раннего развитии индивидуума. Мозаицизм также может являться следствием событий генных мутаций. Аналогичным образом, если мутация происходит на этапе раннего эмбрионального развития, некоторые, но не все, клетки индивидуума могут иметь мутацию.
Хромосомный мозаицизм может возникать в любом количестве тканей, в зависимости от временного интервала явления нерасхождения и типа клеток, в которых оно происходит. Следовательно, трудно предсказать тип или тяжесть симптомов у индивидуума с хромосомным мозаицизмом. Если мозаицизм ограничен гонадами, он известен как гонадный мозаицизм (Goldstein et al., J. Pediatrics, 1977, 90:604). Гонадный мозаицизм может возникать в результате происходящей в гонадах развивающегося эмбриона мутации.
Также известно, что хромосомные аномалии влияют на развитие и функционирование яичников в зависимости от доли аномальных клеток в яичниках (Cunniff et al., Hum Genet., 1991, 86: 553-556). Например, показано, что женщины с потерей копии X-хромосомы (45,X) или обладающие дополнительной копией X-хромосомы (46,XX) имеют повышенный риск преждевременного угасания функции яичников (Cunniff et al., Hum. Genet., 1991, 86: 553-556; Zinn et al., Trends Genet. 1993, 9: 90-93). Исследования показали, что до 99% оплодотворений с моносомией 45,X приводят к преждевременному прерыванию беременности (Hook and Warburton, Hum. Genet., 1983, 64: 24-27; Hassold et al., Am. J. Hum. Genet., 1988, 42: 534-541). Мозаичная X-хромосомная моносомия (45,X/46,XX) ассоциирована с атрезией фолликулов, гонадной дисгенезией, а также отчасти является причиной прерывания беременности на ранних сроках (Zinn et al., Trends Genet., 1993, 9: 90-93; Shreck et al., Emery and Rimoni's Principles of Practice of Medical Genetics, Vol. 1, Churchill Livingstone, 2002, 982-97).
Женщины с гонадным мозаицизмом могут иметь ооциты с хромосомными аномалиями, которые могут являться причиной бесплодия или хромосомных аномалий у развивающегося эмбриона. Данные возможные эффекты служат основанием для консультации или лечебных действий, как, например, донорство ооцитов/эмбрионов, предимплантационная генетическая диагностика или пренатальная диагностика. Следовательно, усовершенствование определения или диагностики гонадного мозаицизма улучшат обслуживание больных.
Существующие способы идентификации и диагностики хромосомных аномалий ограничены гонадным мозаицизмом, а при обнаружении слабо выраженного мозаицизма доступные способы являются инвазивными или неэффективными. Например, подозрение на хромосомную аномалию у индивидуума можно подтвердить или исключить посредством анализа образца крови. Однако данное исследование необязательно определяет мозаицизм, ограниченный одним органом или тканью или даже ограниченной части клеток в данной ткани. Например, анализ образца крови может не определить гонадный мозаицизм. Кроме того, люди с гонадным мозаицизмом могут оставаться в значительной степени бессимптомными в течение жизни, что дополнительно снижает возможности диагностики.
Для диагностики ограниченного одной тканью мозаицизма должны быть проанализированы клетки данной конкретной ткани. Обнаружение мозаицизма в данной ткани зависит от количества пораженных клеток и количества проанализированных клеток. Кариотипирование представляет собой часто применяемый генетический тест для хромосомного анализа, при котором исследуют полный хромосомный состав клетки индивидуума посредством визуализации хромосом и подсчета хромосом. Подверженные кариотипированию клетки предпочтительно культивируют и останавливают митоз на стадии метафазы клеточного деления, так как хромосомы лучше всего визуализируются на стадии метафазы клеточного деления. Это делает кариотипирование длительной и трудоемкой процедурой и не позволяет анализировать очень большое количество клеток. Следовательно, при помощи кариотипирования можно не определить слабо выраженный мозаицизм, при котором поражена лишь небольшая часть клеток в органе или ткани.
В настоящее время для определения гонадного мозаицизма гонадную ткань выделяют посредством биопсии гонад. Биопсия гонад не является обычной процедурой, ее выполняют посредством тонкоигольной пункционно-аспирационной биопсии или клинообразной биопсии с применением лапаротомии или лапароскопии. После этого полученный образец ткани кариотипируют, что может не выявить слабо выраженный гонадный мозаицизм. Следовательно, существующие исследования для определения хромосомных аномалий имеют ограниченные возможности в определении гонадного мозаицизма, конкретно слабовыраженного гонадного мозаицизма.
Следовательно, желательно предоставить миниинвазивный способ для определения хромосомных аномалий, включая гонадный мозаицизм, предпочтительно определяющий даже слабовыраженный гонадный мозаицизм.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам определения по меньшей мере одной хромосомной аномалии в клетках, полученных из фолликулярной жидкости, включающим в себя
a) получение клеток из фолликулярной жидкости;
b) генетический анализ клеток;
где часть клеток имеет по меньшей мере одну хромосомную аномалию. В конкретных вариантах осуществления, настоящее изобретение относится к способам идентификации аномалий репродуктивной системы, где идентификация по меньшей мере одной хромосомной аномалии в части полученных из фолликулярной жидкости клеток является характерной аномалией репродуктивной системы. Другие варианты осуществления настоящего изобретения относятся к способам идентификации гонадного мозаицизма посредством идентификации по меньшей мере одной хромосомной аномалии в клетках, полученных из фолликулярной жидкости с применением тех же способов. В конкретных вариантах осуществления гонадный мозаицизм представляет собой слабовыраженный гонадный мозаицизм, где предпочтительно менее 10% клеток, более предпочтительно, менее чем 5%-10% клеток в ткани или органе имеют хромосомную аномалию. В предпочтительных вариантах осуществления фолликулярную жидкость получают от животного, более предпочтительно, от человека. Полученные из фолликулярной жидкости клетки могут происходить из репродуктивных тканей и в конкретных вариантах осуществления представляют собой соматические клетки. В предпочтительных вариантах осуществления, фолликулярную жидкость получают во время процедуры оплодотворения или процедуры внутрицитоплазматической инъекции сперматозоида in vitro. В других вариантах осуществления, фолликулярную жидкость не получают в связи с любой из данных процедур. Предпочтительно фолликулярную жидкость получают из одного или обоих яичников субъекта.
Настоящее описание изобретения также относится к способам анализа повышенного риска бесплодия у животных, включающим в себя
a) получение клеток из фолликулярной жидкости животного; и
b) генетический анализ клеток,
где определение по меньшей мере одной хромосомной аномалии в части клеток является характерным указанием на повышенный риск бесплодия. В предпочтительных вариантах осуществления животным является человек. Полученные из фолликулярной жидкости клетки могут происходить из репродуктивных тканей и в конкретных вариантах осуществления представляют собой соматические клетки. В предпочтительных вариантах осуществления фолликулярную жидкость получают во время процедуры оплодотворения или процедуры внутрицитоплазматической инъекции сперматозоида in vitro. В других вариантах осуществления фолликулярную жидкость получают способом, не связанным с любой из указанных процедур. Предпочтительно фолликулярную жидкость получают из одного или обоих яичников животного. В предпочтительных вариантах осуществления, когда идентифицируют, что животное имеет повышенный риск бесплодия, и подвергают животное процедуре оплодотворения in vitro, эмбрион, полученный из выделенных у животного ооцитов, можно подвергать предимплантационному генетическому анализу. В более предпочтительных вариантах осуществления, когда генетический анализ показывает, что эмбрион не имеет хромосомной аномалии, эмбрион предпочтительно пересаживают в матку животного.
Любой из описанных здесь способов можно применять в качестве хорошо известных специалисту в данной области способов генетического анализа для определения хромосомных аномалий в клетках, полученных из фолликулярной жидкости. В предпочтительных вариантах осуществления, генетический анализ представляет собой флуоресцентную гибридизацию in situ, кариотипирование или секвенирование ДНК. В других предпочтительных вариантах осуществления генетический анализ представляет собой сравнительную геномную гибридизацию (CGH) (например, выполненную с метафазными хромосомами или CGH-матрицей), многоцветный бэндинг (MCB), количественную FISH (Q-FISH), полимеразную цепную реакцию (PCR), технологию GBA (минитипирование), мультиплексное секвенирование, SNaPshot, MassEXTEND, MassArray, лигирование на миниматрицах, минисеквенирование на микроматрицах, маркерные миниматрицы, удлинение праймеров на матрицах (APEX), удлинение праймеров на микроматрицах, GOOD-анализ, кодированные микросферы, анализ полиморфизма длины рестрикционных фрагментов (RFLP), аллель-специфический анализ олигонуклеотидов (ASO), специфичную к метилированию ПЦР (MSPCR), способ пиросеквенирования, анализ acycloprime, обратный дот-блот, микроматрицы GeneChip, динамическую аллель-специфическую гибридизацию (DASH), пептидные зонды нуклеиновых кислот (PNA) и запирающие зонды нуклеиновых кислот (LNA), TaqMan, Molecular Beacons, интеркалирующее окрашивание, праймеры FRET, AlphaScreen, SNPstream, Invader assay, управляемое матрицей включение (TDI), флуоресцентную поляризацию, анализ олигонуклеотидного лигирования и выделение кодированных последовательностей, лигазную цепную реакцию, запирающие зонды, амплификацию по типу катящегося кольца или колориметрический анализ олигонуклеотидного лигирования (OLA).
В выделенных из фолликулярной жидкости клетках можно идентифицировать любое количество хромосомных аномалий, которые могут являться характерными для гонадного мозаицизма или слабо выраженного гонадного мозаицизма. В конкретных вариантах осуществления, хромосомная аномалия, идентифицированная во всех клетках или в части клеток из фолликулярной жидкости, представляет собой анеуплоидию, транслокацию, делецию, микроделецию, инверсию или удвоение. Идентифицированная анеуплоидия может представлять собой полную или частичную трисомию, например, трисомию 13, трисомию 16, трисомию 18, трисомию 21, трисомию 22, XXY, XYY или XXX; полную или частичную моносомию, например, моносомию X, моносомию 13, моносомию 16, моносомию 18, моносомию 21 или моносомию 22; или полную или частичную нуллисомию, например, для хромосом 13, 16, 18, 21, 22, X или Y.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Сопровождающие фигуры являются частью настоящего изобретения и включены для дополнительной демонстрации конкретных аспектов настоящего изобретения. Описание изобретения можно лучше понять со ссылкой на одну или несколько данных фигур в сочетании с подробным описанием представленных здесь конкретных вариантов осуществления.
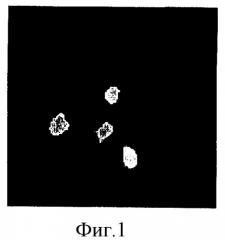
Фигура 1. Микрофотография анализа FISH нормальной диплоидной человеческой женской клетки, полученной из фолликулярной жидкости. Применяют специфичные для хромосом X (зеленый), Y (оранжевый) и 18 (голубой) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны два голубых сигнала для хромосомы 18 и два зеленых сигнала для хромосомы X, обозначающие нормальную диплоидную женскую клетку.
Фигура 2. Микрофотография анализа FISH полученной из фолликулярной жидкости человеческой женской клетки с моносомией 18. Применяют специфичные для хромосом X (зеленый), Y (оранжевый) и 18 (голубой) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны один голубой сигнал для хромосомы 18 и два зеленых сигнала для хромосомы X, обозначая в женской клетке моносомию 18.
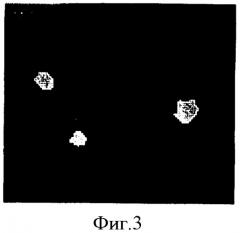
Фигура 3. Микрофотография анализа FISH полученной из фолликулярной жидкости человеческой женской клетки с моносомией X. Применяют специфичные для хромосом X (зеленый), Y (оранжевый) и 18 (голубой) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны два голубых сигнала для хромосомы 18 и один зеленый сигнал для хромосомы X, обозначая в женской клетке моносомию X.
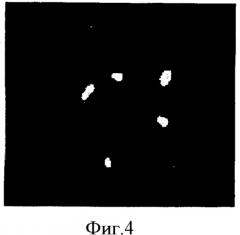
Фигура 4. Микрофотография анализа FISH полученной из фолликулярной жидкости человеческой женской клетки с трисомией 18. Применяют специфичные для хромосом X (зеленый), Y (оранжевый) и 18 (голубой) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны три голубых сигнала для хромосомы 18 и два зеленых сигнала для хромосомы X, обозначая в женской клетке трисомию 18.
Фигура 5. Микрофотография анализа FISH полученной из фолликулярной жидкости человеческой женской клетки с трисомией X. Применяют специфичные для хромосом X (зеленый), Y (оранжевый) и 18 (голубой) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны два голубых сигнала для хромосомы 18 и три зеленых сигнала для хромосомы X, обозначая в женской клетке трисомию X.
Фигура 6. Микрофотография анализа FISH нормальной полученной из фолликулярной жидкости человеческой женской клетки. Применяют специфичные для хромосом 13 (зеленый) и 21 (оранжевый) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны два зеленых сигнала для хромосомы 13 и два оранжевых сигнала для хромосомы 21, обозначая диплоидную клетку с нормальным набором хромосом 13 и 21.
Фигура 7. Микрофотография анализа FISH полученной из фолликулярной жидкости человеческой женской клетки с трисомией 13. Применяют специфичные для хромосом 13 (зеленый) и 21 (оранжевый) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны три зеленых сигнала для хромосомы 13 и два оранжевых сигнала для хромосомы 21, обозначая трисомию 13 женской клетки.
Фигура 8. Микрофотография анализа FISH полученной из фолликулярной жидкости человеческой женской клетки с трисомией 21. Применяют специфичные для хромосом 13 (зеленый) и 21 (оранжевый) зонды, а докрашивают клетки темно-синим контрастирующим красителем DAPI. Видны два зеленых сигнала для хромосомы 13 и три оранжевых сигнала для хромосомы 21, обозначая трисомию 21 женской клетки.
Фигура 9. Кариотипический анализ полученной из фолликулярной жидкости человеческой женской клетки с моносомией X. В данном кариотипе видна одна хромосома X, обозначая моносомию X данной клетки. При анализе дополнительных клеток из того же образца фолликулярной жидкости, 3 из 20 проанализированных клеток продемонстрировали аналогичный профиль, означающий гонадный мозаицизм при моносомии X.
Фигура 10. Кариотипический анализ полученной из фолликулярной жидкости человеческой женской клетки с трисомией 21. В данном кариотипе показаны три 21 хромосомы, обозначая трисомию 21 данной клетки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании изобретения описаны способы идентификации хромосомных аномалий у субъекта посредством получения клеток из фолликулярной жидкости и анализа данных клеток, например, генетического анализа хромосомных аномалий. Предпочтительно посредством описанного способа выявляют субъектов с гонадным мозаицизмом или слабовыраженным гонадным мозаицизмом. Слабовыраженным гонадный мозаицизм является, если мозаичность субъекта составляет предпочтительно менее 10% клеток, а более предпочтительно, менее чем от 5% до 1% клеток в ткани или органе. В одном варианте осуществления проанализированные посредством описанных здесь способов клетки происходят из репродуктивной ткани субъекта, от которого выделяют образец фолликулярной жидкости. В еще одном варианте осуществления клетки, проанализированные посредством описанных здесь способов, являются соматическими клетками субъекта, от которого выделяют образец фолликулярной жидкости, и исключают любые присутствующие в фолликулярной жидкости половые клетки, как, например, ооциты. Хромосомные аномалии можно идентифицировать с применением любого одного из ряда известных специалисту в данной области способов генетического анализа. Здесь выражение "генетический анализ" относится к любому анализу на основании хромосом, ДНК или РНК, с помощью которого можно определить в клетках индивидуума, или предпочтительно в полученных из фолликулярной жидкости клетках аномалии хромосом, ДНК или экспрессии генов.
Полученные из фолликулярной жидкости клетки также можно подвергать анализу ДНК для идентификации повреждений отдельных генов вместо аномалий хромосомного уровня. Идентификация повреждений отдельных генов, нарушений импринтинга или предрасположенности к злокачественной опухоли можно выполнять с применением любого способа, приемлемого для определения по меньшей мере одной замены нуклеиновой кислоты, например, однонуклеотидного полиморфизма (SNP). Тогда как перечисленные выше способы генетического анализа являются предпочтительными, другие способы, способные использовать клетки из фолликулярной жидкости для идентификации хромосомных аномалий, включающих в себя гонадный мозаицизм или слабовыраженный мозаицизм, находятся в рамках объема настоящего изобретения и известны специалисту в данной области.
Хромосомные аномалии являются общей причиной бесплодия и врожденных пороков развития и включают в себя структурные и количественные аномалии. Организм может иметь мозаицизм при хромосомных аномалиях, обнаруженных только в конкретных клеточных популяциях или линиях в организме, тогда как другие клетки являются нормальными. Наряду с тем, что целостный организм может являться мозаичным, также мозаицизм может быть ограничен конкретными органами или тканями, как, например, гонадный мозаицизм. Гонадный мозаицизм может оставаться необнаруженным из-за преимущественного отсутствия симптомов у пораженных индивидуумов. Однако, если гонадный мозаицизм представляет собой предполагаемую причину бесплодия, существующие способы для идентификации или определения гонадного мозаицизма требуют хирургического вмешательства для забора образца ткани для анализа. Таким образом, существующие аналитические способы являются продолжительными и ограничивают количество клеток, которые можно проанализировать, ограничивая тем самым определение слабо выраженного гонадного мозаицизма.
В настоящем описании изобретения анализируют полученные из фолликулярной жидкости клетки посредством генетического анализа для определения хромосомных аномалий и для диагностики гонадного мозаицизма, например, слабо выраженного гонадного мозаицизма. Например, фолликулярную жидкость выделяют у подверженного сбору ооцитов для оплодотворения in vitro пациента. При данной процедуре содержащую ооциты фолликулярную жидкость отсасывают из яичников пациента с применением, например, трансвагинального ультразвука. В фолликулярной жидкости идентифицируют и удаляют ооциты с окружающими скоплениями клеток, а жидкость затем, как правило, сбрасывают. Следовательно, для уже подверженных извлечению ооцитов пациенток, настоящее описание изобретения не требует дополнительных хирургических вмешательств для обеспечения возможности детекции гонадного мозаицизма.
В предпочтительном варианте осуществления, фолликулярную жидкость собирают при заборе ооцитов для оплодотворения in vitro. Способы фолликулярной аспирации хорошо известны специалисту в области гинекологии и акушерства. Как правило, ооциты извлекают посредством фолликулярной аспирации через 36 часов после индукции овуляции, после чего ооциты с окружающими их клетками удаляют из оставшейся фолликулярной жидкости. Предпочтительным способом получения клеток из оставшейся фолликулярной жидкости является центрифугирование, но можно применять любой известный способ клеточного выделения. Предпочтительно, фолликулярную жидкость центрифугируют в течение любого интервала времени приблизительно от 1 минуты приблизительно до 30 минут, приблизительно от 1000 об/мин до 3000 об/мин и при любой температуре приблизительно от 20°C приблизительно до 40°C. В альтернативном варианте осуществления, фолликулярную жидкость не собирают при извлечении ооцитов для оплодотворения in vitro, например, посредством фолликулярной аспирации или лапароскопии.
После того, как клетки выделены из фолликулярной жидкости, их можно подвергнуть генетическому анализу для детекции хромосомных аномалий. По предпочтительному варианту осуществления, клетки подвергают анализу FISH. Например, клетки подвергают обработке гипотоническим раствором в течение приблизительно от 5 до 45 минут при температуре приблизительно от 20°C приблизительно до 40°C, а затем фиксируют на приемлемой поверхности приемлемым фиксатором, как, например, фиксатор Карнуа, приблизительно от 1°C приблизительно до 25°C. Можно проводить гибридизацию соответствующих зондов с однократно фиксированными клетками образца с применением известных специалисту в данной области способов. Предпочтительно, меченые зонды ДНК для анализируемых хромосом предварительно смешивают с блокирующей ДНК и гибридизационным буфером, а затем вносят к фиксированным клеткам из образца фолликулярной жидкости. Затем зонд и образец подвергают денатурации в течение 5 минут приблизительно при 73°C и инкубируют в темной гибридизационной камере приблизительно при 37°C в течение приблизительно от 16 до 18 часов для обеспечения гибридизации. После гибридизации стекла промывают приблизительно в течение 2 минут приблизительно при 73°C в растворе из 1 мл 20×SSC, 49 мл RO H2O и 150 мкл Igepal или другого аналогичного сурфактанта, а затем в течение приблизительно 1 минуты приблизительно при комнатной температуре в растворе из 5 мл 20×SSC, 45 мл RO H2O и 50 мкл Igepal или другого аналогичного сурфактанта. После отмывки стеклам позволяют высохнуть и докрашивают с применением, предпочтительно, DAPI. После этого клетки можно анализировать с применением флуоресцентного микроскопа. Приблизительно от 20 до 1000 клеток из данного образца фолликулярной жидкости можно анализировать с применением данных предпочтительных способов. Можно выявлять поражающий лишь небольшую часть клеток в яичниках слабо выраженный гонадный мозаицизм, так как подход FISH позволяет анализировать большое количество клеток из отдельного образца фолликулярной жидкости.
В предпочтительных вариантах осуществления клетки, выделенные из фолликулярной жидкости, анализируют на хромосомные аномалии, например, анеуплоидию, как, например, моносомию или трисомию, любой хромосомы можно определять с применением хорошо известных специалисту в данной области способов генетического анализа. В предпочтительных вариантах осуществления клетки, выделенные из фолликулярной жидкости, анализируют для определения анеуплоидии для хромосом 13, 15, 16, 18, 21, 22, X или Y. Хромосомные аномалии можно определять с применением анализа FISH со специфичными для данных хромосом зондами. Сходным образом, обнаружение клеток с моносомией для хромосом 13, 15, 16, 18, 21, 22, X или Y можно выполнять с применением специфичных для данных хромосом зондов. Известно, что моносомия хромосом 15, 16, 21 и 22 вовлечена в прерывание беременности (Munne, S. et al., 2004, Reprod. Biomed. Online, 8: 91-90).
По другим предпочтительным вариантам осуществления, кариотипирование можно применять для анализа хромосомных аномалий в клетках. В предпочтительном способе кариотипирования клетки, полученные из фолликулярной жидкости, сначала культивируют с применением приемлемой культуральной среды. Примеры коммерчески доступных культуральных сред включают в себя Amniomax, среду F10 или Rose Park Memorial Institute medium. Клетки предпочтительно культивируют с применением известных специалисту в данной области стандартных способов при подходящей температуре (например, 37°C) до получения сплошного роста. Затем культивированные клетки предпочтительно собирают с применением обычных способов и фиксируют на соответствующей поверхности приемлемым фиксатором, как, например, фиксатор Карнуа при температуре приблизительно от 1°C приблизительно до 25°C. Бэндинг микропрепаратов выполняют с применением известных обычному специалисту в данной области способов и микропрепараты анализируют на метафазные хромосомы под контролем соответствующего микроскопа. Можно проанализировать приблизительно от 1 до 40 клеток из данного образца фолликулярной жидкости, применяя данные предпочтительные способы.
В других предпочтительных вариантах осуществления применяют сравнительную геномную гибридизацию (CGH) для идентификации хромосомных аномалий, включающих в себя едва различимые хромосомные аномалии. CGH основан на количественной двухцветной FISH, с применением синтезированных из контрольного образца зондов, например, выделенных из фолликулярной жидкости клеток и клеток нормального контрольного референсного образца. Предпочтительно, одновременно проводят гибридизацию зондов с метафазными хромосомами из нормального референсного образца. Сравнение интенсивности сигнала от гибридизованных зондов может показать области патологии в клетках фолликулярной жидкости.
В других вариантах осуществления, сконструированные выше зонды можно наносить на матрицу ДНК в называемом CGH-матрица способе. Показали, что CGH-матрица подтверждает аномалии, как, например, мозаицизм трисомии 20 (Schaeffer et al., Am. J. Hum. Genet., 2004; 74: 1168-1174), несбалансированную транслокацию (Klein et al., Clin. Genet., 2004; 65: 477-82), несбалансированные субтеломерные реаранжировки (Ness et al., Am. J. Med. Genet, 2002, 113: 125-136) и несбалансированные инверсии или хромосомные реаранжировки (Daniely et al., Cytogenet. Cell. Genet., 1999, 86: 51-5). Способы CGH-матриц и получения специфичных для хромосом библиотек ДНК описаны и известны в данной области (Hu, et al., Mol. Hum. Reprod., 2004, 10: 283-289; Bolzer et al., Cytogenet. Cell. Genet., 1999, 84: 233-240). Применение основанного на матрицах CGH для определения генетического мозаицизма в клеточной популяции также показано Mansoor Mohammed в опубликованной заявке на патент США № 20030124584, которая включена сюда в качестве ссылки в полном объеме.
Специалисту в данной области хорошо известны другие способы для анализа хромосомных и генетических аномалий, в качестве не ограничивающих примеров включающие в себя многоцветный бэндинг (MCB), количественную FISH (Q-FISH), полимеразную цепную реакцию (PCR), технологию GBA (минитипирование), мультиплексное секвенирование, SNaPshot, MassEXTEND, MassArray, лигирование на мини-матрицах, мини-секвенирование на микроматрицах, маркерные миниматрицы, удлинение праймеров на матрицах (APEX), удлинение праймеров на микроматрицах, GOOD-анализ, кодированные микросферы, анализ полиморфизма длины рестрикционных фрагментов (RFLP), аллель-специфический анализ олигонуклеотидов (ASO), специфичную к метилированию ПЦР (MSPCR), способ пиросеквенирования, анализ acycloprime, обратный дот-блот, микроматрицы GeneChip, динамическую аллель-специфическую гибридизацию (DASH), пептидные зонды нуклеиновых кислот (PNA) и запирающие зонды нуклеиновых кислот (LNA), TaqMan, Molecular Beacons, интеркалирующее окрашивание, праймеры FRET, AlphaScreen, SNPstream, Invader assay, управляемое матрицей включение (TDI), флуоресцентную поляризацию, анализ олигонуклеотидного лигирования и выделение кодированных последовательностей, лигазную цепную реакцию, запирающие зонды, амплификацию по типу катящегося кольца и колориметрический анализ олигонуклеотидного лигирования (OLA).
В программах оплодотворения in vitro предимплантационная генетическая диагностика ооцитов и эмбрионов является способом выбора для отделения аномального эмбриона перед пересадкой эмбриона. Таким образом, в альтернативных вариантах осуществления, у субъектов с идентифицированным гонадным мозаицизмом предимплантационную генетическую диагностику и диагностику хромосомных аномалий в ооцитах и эмбрионах можно выполнять для повышения вероятности отбора и имплантации выживающего в продолжение беременности эмбриона.
Наконец, определение хромосомной аномалии, включающей в себя гонадный мозаицизм, применимо у других животных, предпочтительно млекопитающих, и конкретно трансгенных животных. Генетический мозаицизм часто возникает у полученных посредством микроинъекции в пронуклеустрансгенных животных. Успешный способ скрининга родительских животных на гонадный мозаицизм до спаривания может сократить стоимость размножения трансгенных линий и посредством скрининга родительских животных на гонадный мозаицизм до спаривания повысить эффективность получения трансгенных животных для получения трансгенных млекопитающих.
В свете настоящего описания изобретения, описанные и заявленные здесь способы можно разрабатывать и осуществлять без проведения лишней экспериментальной работы. Хотя способы настоящего описания изобретения описаны в границах предпочтительных вариантов осуществления, специалисту в данной области очевидно, что в способы и в стадии или в последовательность стадий описанных здесь способов можно вносить вариации без отклонения от концепции, объема и сущности изобретения. Более конкретно, очевидно, что вместо описанных здесь средств можно использовать определенные химически или физиологически близкие средства, если достигают аналогичных или сходных результатов. Считают, что все очевидные специалисту в данной области подобные аналогичные замены и модификации находятся в пределах сущности, объема и концепции изобретения, как обозначено в прилагаемой формуле изобретения.
Следующие далее примеры включены сюда для иллюстрации предпочтительных вариантов осуществления изобретения. Специалисту в данной области следует понимать, что в примерах описаны способы, сопровождающие представленные способы, открытые авторами изобретения для правильной работы при применении изобретения, и, таким образом, могут рассматриваться для составления предпочтительных способов его применения. Однако в свете настоящего изобретения специалист в данной области должен понимать, что в определенных вариантах осуществления можно сделать много описанных изменений, и, тем не менее, получить подобный или аналогичный результат без отклонения от объема и сущности изобретения.
Пример 1
1) Забор и обработка клеток из образцов фолликулярной жидкости
Образцы оставшейся фолликулярной жидкости подверженных оплодотворению in vitro пациенток собирают в центрифужные пробирки в аликвотах приблизительно от 5 до 10 мл. Затем образцы центрифугируют приблизительно при 1000 об/мин в течение 10 минут. После этого большую часть супернатанта удаляют, оставляя над осадком приблизительно 0,5 мл жидкости. К осадку добавляют приблизительно 8 мл предварительно нагретого до 37°C 75 мМ KCl, перемешивают, а затем инкубируют при 37°C в течение 20 минут. После инкубации пробирки центрифугируют приблизительно при 1000 об/мин в течение 10 минут. После этого супернатант сбрасывают, оставляя над осадком приблизительно 0,5 мл жидкости. При постоянном перемешивании добавляют приблизительно 8 мл холодного фиксатора Карнуа. Пробирки инкубируют при 2-8°C в течение по меньшей мере 30 минут, а затем центрифугируют при 1000 об/мин в течение 10 минут. После центрифугирования супернатант сбрасывают, оставляя над осадком приблизительно 0,5 мл жидкости. Стадию отмывки с фиксатором повторяют 2 раза.
2) Подготовка микропрепарата и анализ FISH
На задней стороне чистых стекол алмазным маркером отмечают один или два небольших квадрата. В каждый квадрат добавляют 10 мкл фиксированных клеток и оставляют стекла сохнуть на воздухе. Стекла последовательно обезвоживают в спирте: 70% одну минуту; 85% одну минуту; 100% две минуты. После этого покровные стекла обрезают до размера области образца и наносят на покровное стекло 1-2 мкл зонда. Стекло переворачивают на покровное стекло и заклеивают каучуковым клеем. Затем стекло подвергают денатурации, помещая его на подогревательный столик при 73°C в течение пяти минут. После этого стекла немедленно помещают в гибридизационную камеру и инкубируют при 37°C в течение времени от 16 до 18 часов. После инкубации покровные стекла снимают в 5 мл 20×SSC и 45 мл RO H2O. Затем стекло отмывают в 1 мл 20×SSC и 49 мл RO H2O и 150 мкл Igepal (Sigma) в течение двух минут, с последующей еще одной отмывкой в растворе 5 мл 20×SSC, 45 мл H2O и 50 мкл Igepal в течение одной минуты. Стекло сушат на воздухе и заключают в 10 мкл заключающей среды (200 нг/мл DAPI в Vectashield, Vector Lab) и накладывают покровное стекло. Стекло заклеивают каучуковым клеем и изучают под контролем флуоресцентного микроскопа.
3) Зонды для анализа FISH
Для определения гонадного мозаицизма для хромосом 18, X и Y применяют смесь зондов, содержащую CEP 18 Spectrum Aqua/X Spectrum Green/Y Spectrum Orange (AneuVysion EC DNA probe kit, Vysis). Также можно раздельно применять отдельные зонды для 18, X и Y хромосом, несмотря на то, что авторы применяли в виде смеси.
| Таблица 1 | ||||||
| Серийн.№ | № образца | Один яичник | Состояние оплодотворе-ния | |||
| № проанализиро-ванных клеток | Норма для X&18 (%) | Х хр. аном. % | хр. 18 аном. % | |||
| 1 | FF-001 | 100 | 100 | 0 | 0 | - |
| 2 | FF-002 | 100 | 96 | 2 | 2 | - |
| 3 | FF-003 | 200 | 90 | 10 | 0 | - |
| 4 | FF-004 | 100 | 100 | 0 | 0 | - |
| 5 | FF-005 | 100 | 100 | 0 | 0 | - |
| 6 | FF-006 | 100 | 100 | 0 | 0 | + |
| 7 | FF-007 | 100 | 100 | 0 | 0 | + |
| 8 | FF-008 | 100 | 100 | 0 | 0 | - |
| 9 | FF-009 | 100 | 95 | 2 | 3 | - |
| 10 | FF-010 | 100 | 95 | 5 | 0 | - |
| 11 | FF-011 | 100 | 92 | 3 | 5 | - |
| 12 | FF-012 | 100 | 100 | 0 | 0 | - |
| 13 | FF-013 | 100 | 100 | 0 | 0 | +/потеря (прерывание беременности) |
| 14 |