Вакцина на основе пептидов сурвивина
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана вакцинная композиция, пригодная для лечения рака, содержащая: один или несколько вариантов пептидных фрагментов, полученных из белка сурвивина, где указанный пептидный фрагмент выбран из группы, состоящей из: FTELTLGEF (SEQ ID NO: 16), LMLGEFLKL (SEQ ID NO: 5), EPDLAQCFY (SEQ ID NO: 9), APPAWQPFL (SEQ ID NO: 13) и RPPAWQPFL (SEQ ID NO: 14), и адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества. Предложен способ стимулирования сильного специфического Т-клеточного ответа к сурвивину у субъекта, включающий введение описанной вакцины. А также способ лечения или профилактики рака у субъекта, включающий введение описанной вакцины. Вакцина может применяться для профилактического, облегчающего и/или лекарственного лечения, например, онкологических заболеваний. 4 н. и 10 з.п. ф-лы, 3 ил., 3 табл.
Реферат
Все ссылки на патенты и другие источники, цитированные в этой патентной заявке, приведены настоящим в качестве ссылки в их полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к терапевтической вакцине, содержащей один или несколько фрагментов полипептида сурвивина. Вакцина может применяться для профилактического, облегчающего и/или лекарственного лечения, например, онкологических заболеваний. Изобретение также относится к способам комбинированного лечения.
УРОВЕНЬ ТЕХНИКИ
Иммунная система млекопитающих распознает и реагирует на чужеродные или посторонние вещества. Важной гранью системы является Т-клеточный ответ. Этот ответ состоит в том, что Т-клетки узнают и взаимодействуют с комплексами молекул клеточной поверхности, называемыми лейкоцитарными антигенами человека (HLA), составляющими главный комплекс гистосовместимости человека (MHC), и пептидами. Пептиды образуются из более крупных молекул, процессируемых клетками, которые также представляют молекулы HLA/MHC. Взаимодействие Т-клеток и комплексов HLA/пептид ограничено, для этого необходимы T-клетки, которые являются специфическими для определенной комбинации молекулы HLA и пептида. Если специфическая T-клетка не присутствует, то даже в присутствии ее комплекса партнеров Т-клеточного ответа не происходит. Аналогично, ответа не происходит, когда при наличии Т-клеток отсутствует специфический комплекс.
Хорошо известно, что пептидные эпитопы, полученные из ассоциированных с опухолью антигенов (TAA) человека, могут узнаваться цитотоксическими T-лимфоцитами (CTL) в контексте молекул MHC и что большинство, если не все, опухоли экспрессируют такие антигены. Соответственно, предпринимаются многообещающие клинические попытки нацеливания на такие TAA с использованием подходов, таких как вакцинация и адоптивная T-клеточная терапия, для того чтобы вызвать эффективные противоопухолевые CTL ответы у пациентов.
Однако иммуноселекция утративших антиген вариантов может быть серьезным препятствием для лечебного потенциала большинства известных CTL эпитопов в клинической онкологии, и отбор лишенных антигена мутантных опухолей представляет собой хорошо осознаваемое ограничение в терапевтических подходах, когда мишенями становятся антигены, которые не играют никакой роли в злокачественном росте. Дело в том, что большинство охарактеризованных пептидов являются производными полипептидов, которые не являются существенными для выживания опухолевой клетки. Следовательно, если сильные CTL ответы индуцируются по отношению к таким пептидным антигенам при помощи терапевтических мер, таких как вакцинации, то опухолевые клетки, утратившие экспрессию антигенов-мишеней, весьма вероятно, избегнут усиленных иммунных ответов.
Существует необходимость в более эффективных терапевтических вакцинах и в усовершенствованных способах лечения онкологических заболеваний.
Механизм, при помощи которого Т-клетки узнают клеточные аномалии, также органически связан с раком. В W092/20356 было обнаружено семейство генов, которые процессируются в пептиды, а те, в свою очередь, экспрессируются на поверхности клетки, и могут приводить к лизису опухолевых клеток специфическими CTL. Эти гены названы MAGE семейством и, как полагают, кодируют «предшественников антигенов отторжения опухоли» или молекулы «TRAP», а образуемые из них пептиды названы «антигенами отторжения опухоли» или «TRA».
Тем не менее, хотя является общепринятым, что большинство, если не все опухоли являются антигенными, только некоторые действительно являются иммуногенными в смысле, что развитие опухоли полностью контролируется иммунной системой.
Для преодоления этого было предпринято несколько иммунотерапевтических исследований с использованием вакцинаций пептидами, полученными из TAA. Для меланомы, опухоли, для которой было охарактеризовано наибольшее число CTL-распознаваемых TAA, при помощи вакцинации были индуцированы мощные CTL ответы против антигенов и некоторые больные получили полную ремиссию своих заболеваний. Однако, большинство пептидных эпитопов, использованных в этих испытаниях по вакцинации, являются меланоцит-специфическими, и эти пептиды не могут применяться в случае опухолей немеланоцидной природы. Более того, экспрессия этих TAA гетерогенна среди опухолей различных пациентов и даже может варьировать среди метастазов, полученных от одного пациента. Тем не менее, в течение последних нескольких лет был идентифицирован ряд специфических для опухолей пептидных антигенов, которые экспрессируются в ряде различных раков, а именно HER-2, Muc-1 и теломераза.
Было также показано, что при правильном обращении присутствующие в опухоли опухолевые антигены могут быть экспонированы для иммунной системы. Исследования показали, что CD8+ CTL ветвь иммунного ответа, сама по себе или в сочетании с CD4+ Th-клетками, составляет первичную противоопухолевую эффекторную ветвь адаптивного иммунного ответа. До последнего времени основное внимание было обращено на CTL ветвь иммунного ответа. Становится понятным, тем не менее, что CD4 T-клеточный ответ играет существенную роль в отторжении опухоли, особенно в фазе индукции или при развитии CTL ответа in vivo. Следовательно, включение расщепленных классом 1 опухолевых антигенов в схемы эффективной противоопухолевой вакцинации может усилить эффективность вакцин.
Апоптоз представляет собой генетическую программу самоубийства клетки, и ингибирование апоптоза, как предполагают, является важным механизмом, вовлеченным в формирование злокачественной опухоли путем удлинения продолжительности жизни клеток, способствующего накоплению трансформирующих мутаций. Сурвивин является недавно идентифицированным членом семейства белков-ингибиторов апоптоза (IAP). В глобальном анализе генной экспрессии 4 миллионов транскриптов сурвивин был идентифицирован как один из основных генов, неизменно активированных во многих типах раковых, но не нормальных тканей. Солидные злокачественные опухоли, сверхэкспрессирующие сурвивин, включают рак легких, толстой кишки, молочной железы, поджелудочной и предстательной желез, а также рак крови. Кроме того, сообщалось, что ряд меланомных и немеланомных раков кожи неизменно являются сурвивин-позитивными. Сверхэкспрессия сурвивина в большинстве злокачественных опухолей человека позволяет сделать предположение о главной роли ингибирования апоптоза в развитии опухоли, точка зрения, основанная на наблюдении, что в случае колоректального рака и рака мочевого пузыря, а также нейробластомы, экспрессия сурвивина ассоциировалась с неблагоприятным прогнозом. Сурвивин, как и другие ингибиторы апоптоза, экспрессируется в эндотелиальных клетках во время ангиогенеза опухоли, и подавление экспрессии сурвивина при помощи антисмысловых РНК во время ангиогенеза вызывает апоптоз эндотелиальных клеток, который вызывает быстрый коллапс капилляроподобных кровеносных сосудов in vitro. В отличие от эндотелиальных сурвивин не детектируется в нормальных зрелых тканях. Поскольку сурвивин сверхэкспрессируется в большинстве злокачественных опухолей человека и подавление его функции приводит к усилению апоптоза, этот белок может быть мишенью для терапевтических CTL ответов. О белке сурвивине и его потенциальном диагностическом и терапевтическом применении сообщается в US 6245523, который приведен в настоящем описании в качестве ссылки. Сурвивин представляет собой цитоплазматический белок массой 16,5 кДа, содержащий один BIR и сильно заряженный С-концевой скрученный участок вместо RING пальца, который ингибирует апоптоз, индуцированный удалением фактора роста (IL-3) при передаче в предшественники B-клеток. Кодирующий сурвивин ген почти идентичен последовательности рецептора-1 протеазы клеток-эффекторов (EPR-1), но имеет противоположную направленность, что предполагает существование двух отдельных генов, дуплицированных в конфигурации голова-к-голове. Соответственно, сурвивин может быть охарактеризован как антисмысловой EPR-1-продукт. Благодаря противоположной ориентации двух генов аминокислотные последовательности кодируемых белков различны.
Функционально, ингибирование экспрессии сурвивина при активации его природного антисмыслового EPR-1-транскрипта приводит к массовому апоптозу и ослаблению клеточного роста.
US 6245523 сообщает о выделении очищенного сурвивина и предоставляет молекулы нуклеиновых кислот, кодирующих белок сурвивин, и антитела и другие молекулы, которые связываются с сурвивином. US 6245523 также сообщает о противоапоптотически активных фрагментах белка сурвивина и его вариантах, где аминокислотный остаток был вставлен с N- или C-конца, или внутрь предоставленной последовательности сурвивина. В частности, показано, что такие пептиды должны содержать ключевые функциональные остатки, необходимые для апоптоза, а именно Trp в положении 67, Pro в положении 73 и Cys в положении 84.
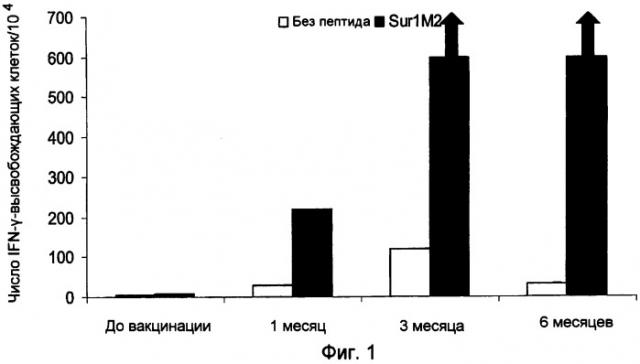
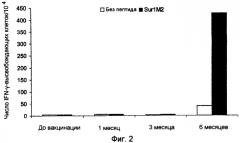
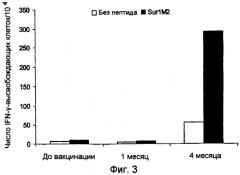
Ранее сообщалось, что слабый Т-клеточный ответ может быть усилен при использовании вакцинации с дендритными клетками, наполненными пептидами сурвивина, что было определено при помощи тестов ELISPOT (WO2004/067023 и Otto, K. et al., J. Vaccine (2004)). Ответ составил менее 30 на 104 клеток, и последующая оценка клинических результатов показала прогрессирование заболевания. Следовательно, эта вакцина имеет только весьма ограниченное применение. Таким образом, представляет большой интерес разработка вакцин, способных индуцировать очень сильный специфический Т-клеточный ответ и, в частности, способных индуцировать клинический ответ, при котором ингибируется прогрессирование заболевания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основывается на открытии того, что MHC Класса I-расщепленные пептиды, полученные из белка сурвивина, способны связываться с молекулами HLA MHC Класса I и, таким образом, вызывать CTL иммунные ответы как ex vivo, так и in situ у больных, страдающих от широкого круга онкологических заболеваний. Перед применением для лечения важно проанализировать иммунные ответы в сочетании с клиническими результатами для оценки пригодности вакцинной композиции для лечения рака. Специфический Т-клеточный ответ после иммунизации может быть полезным тестом на потенциальные антигены, используемые в вакцинах, предпочтительно, чтобы вакцинная композиция была способна вызывать очень сильный Т-клеточный ответ, такой как более 50 IFN-γ-высвобождающих клеток на 104 PBMC, так как это может усилить успех вакцинной композиции для применения при лечении рака. Настоящее изобретение раскрывает особенно эффективные вакцинные композиции, способные индуцировать частичную или полную регрессию опухоли. Очевидно, эти данные открывают путь для новых терапевтических подходов, которые, вследствие того что сурвивин, по-видимому, экспрессируется во всех опухолевых клетках, имеют общее применение при контроле онкологических заболеваний.
Вакцинная композиция или иммуногенная композиция, как описывается в настоящем описании, квалифицируется как фармацевтическая композиция, поскольку пептиды вызывают CTL ответ, способный противодействовать неоплазии. Следовательно, вакцинная композиция квалифицируется как терапевтическая вакцина или как терапевтическая или фармацевтическая композиция.
В аспекте изобретение относится к вакцинной композиции, включающей один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества, для применения в качестве лекарственного средства.
Аспект изобретения относится к варианту пептида сурвивина, состоящему из максимально 50 аминокислотных остатков, способному связываться с HLA-B7, содержащему пептид, выбранный из группы: APPAWQPFL (SEQ ID NO: 13) и RPPAWQPFL (SEQ ID NO: 14).
Дополнительные аспекты относятся к вакцинным композициям, содержащим один или несколько пептидов сурвивина или вариантов пептидов, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23 и где композиция содержит:
i) HLA-B7-связывающий пептид, и/или
HLA-A1- и HLA-A2-расщепленный, пептид, и/или
HLA-A1- и HLA-B35-расщепленный пептид,
ii) и адъювант.
Аспект относится к вакцинной композиции, содержащей три или более пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23 и где
i) по меньшей мере, один пептид или вариант пептида выбран из группы HLA-A1-связывающих пептидов, и где
ii) по меньшей мере, один пептид или вариант пептида выбран из группы HLA-A2-связывающих пептидов, и где
iii) по меньшей мере, один пептид или вариант пептида выбран из группы of HLA-B35-связывающих пептидов,
и адъювант.
Другой аспект настоящего изобретения относится к вакцинной композиции, содержащей семь или более пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
i) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A1-связывающих пептидов,
ii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A2-связывающих пептидов,
iii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A3-связывающих пептидов,
iv) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A24-связывающих пептидов,
v) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A11-связывающих пептидов,
vi) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B35-связывающих пептидов,
vii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B7-связывающих пептидов,
и адъювант.
Развитие солидных опухолей зависит от образования кровеносных сосудов. Подавление ангиогенеза в связи с этим может предотвращать развитие солидных опухолей. Экспрессия сурвивина, bcl-2 и McI-1 в эндотелиальных клетках во время ангиогенеза опухоли позволяет предположить, что вакцинации с использованием описанных в настоящем описании пептидов могут иметь противоангиогенный эффект.
Аспект изобретения относится к вакцине, содержащей один или несколько пептидов или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и адъювант, способной индуцировать проникновение антиген-специфических t-клеток в строму опухоли у субъекта для применения в качестве лекарственного средства.
В одном дополнительном аспекте изобретение относится к вакцинной композиции, содержащей:
i) нуклеиновую кислоту, кодирующую:
a) полипептид сурвивина (SEQ ID NO: 23),
b) пептид сурвивина или
c) вариант пептида сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и
ii) адъювант.
Аспект изобретения относится к применению вакцинной композиции, содержащей один или несколько пептидов сурвивина или вариантов пептидов сурвивина и адъювант, способной вызывать очень сильный специфический ответ цитотоксических T-клеток у субъекта, для производства лекарственного средства. Это рассматривается как очень сильный специфический T-клеточный ответ, который может коррелировать с более высокими показателями хороших клинических ответов. В этом отношении очень сильный специфический Т-клеточный ответ приравнивается к ответу более чем 50 пептид-специфических пятен на 104 PBMC клеток, определенному при помощи ELISPOT теста, до и после введения вакцинной композиции.
Аспект изобретения относится к набору, включающему:
i) вакцинную композицию, содержащую:
a) один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
b) и адъювант, и
ii) вспомогательное лекарственное средство.
Аспект изобретения описывает способ стимуляции сильного специфического Т-клеточного ответа к сурвивину у субъекта, включающий:
a) получение вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция может быть введена более одного раза; и
c) стимулирование посредством этого сильного специфического Т-клеточного ответа у субъекта, где сильный специфический Т-клеточный ответ, определенный при помощи теста ELISPOT, до и после введения вакцинной композиции, составляет более чем 50 пептид-специфических пятен на 104 PBMC клеток,
d) получение сильного специфического Т-клеточного ответа у субъекта.
Дополнительный аспект изобретения относится к способу лечения или профилактики заболевания, включающему:
a) получение вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция вводится более одного раза.
В дополнительном аспекте изобретение относится к способу лечения или профилактики заболевания, включающему:
a) получение вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция вводится более одного раза,
c) стимулирование посредством этого сильного специфического Т-клеточного ответа у субъекта, где сильный специфический Т-клеточный ответ, определенный при помощи теста ELISPOT, до и после введения вакцинной композиции, составляет более чем 50 пептид-специфических пятен на 104 PBMC клеток,
d) получение клнического ответа у субъекта.
В определенных аспектах изобретение относится к способам индуцирования проникновения антиген-специфических T-клеток в строму опухоли у субъекта или ингибирования ангиогенеза у субъекта, включающим:
a) получение вакцины согласно изобретению,
b) введение указанной вакцинной композиции субъекту,
c) получение проникновения антиген-специфических T-клеток в строму опухоли или ингибирования ангиогенеза.
Способ комбинированного лечения, включающий одновременное, последовательное или раздельное введение в любом порядке:
a) вакцинной композиции согласно изобретению и
b) вспомогательного лекарственного средства.
Определения:
AA: Смотрите «Аминокислота».
Адъювант: Вакцинный адъювант представляет собой компонент, который усиливает специфический иммунный ответ на антиген.
Аминокислота: Вещество, содержащее аминоконцевую часть (NH2) и карбоксиконцевую часть (COOH), разделенные центральной частью, включающей атом углерода или цепочку атомов углерода, содержащих по меньшей мере одну боковую цепь или функциональную группу. NH2 относится к аминогруппе, расположенной на аминотерминальном конце аминокислоты или пептида, и COOH относится к карбоксильной группе, расположенной на карбокситерминальном конце аминокислоты или пептида. Генетический термин аминокислота включает как природные, так и неприродные аминокислоты. Природные аминокислоты стандартной номенклатуры, перечисленные в J. Biol. Chem., 243: 3552-59 (1969) и утвержденные в 37 C.F.R., раздел 1,822(b)(2), относятся к группе аминокислот, перечисленных в настоящем описании в нижеприведенной таблице 1. Неприродными являются те аминокислоты, которые не представлены в таблице 1. Примерами неприродных аминокислот являются те, которые перечислены, например, в 37 C.F.R. раздел 1,822(b) (4), каждый из которых приведен в настоящем описании в качестве ссылки. Описанные в настоящем описании аминокислотные остатки могут быть в «D» или «L» изомерной форме.
| Таблица 1 | ||
| Природные аминокислоты и соответствующие им коды | ||
| Символы | Аминокислота | |
| 1-буквенный | 3-буквенный | |
| Y | Tyr | тирозин |
| G | Gly | глицин |
| F | Phe | фенилаланин |
| M | Met | метионин |
| A | Ala | аланин |
| S | Ser | Серин |
| I | Ile | изолейцин |
| L | Leu | лейцин |
| T | Thr | треонин |
| V | Val | Валин |
| P | Pro | пролин |
| K | Lys | Лизин |
| H | His | гистидин |
| Q | Gln | глутамин |
| E | Glu | глутаминовая кислота |
| W | Trp | триптофан |
| R | Arg | аргинин |
| D | Asp | аспарагиновая кислота |
| N | Asn | аспарагин |
| C | Cys | цистеин |
Аминокислотный остаток: термин «аминокислотный остаток» охватывает аминокислоты, или стандартные аминокислоты, нестандартные аминокислоты, или псевдоаминокислоты, вступающие в реакцию с не менее чем одним другим видом, например с 2, например с 3, более чем 3 другими видами. В частности, аминокислотные остатки могут содержать ацильную связь вместо свободной карбоксильной группы и/или аминную связь и/или амидную связь вместо свободной аминогруппы. Более того, вступающие во взаимодействие аминокислотные остатки могут содержать сложную эфирную или сложную тиоэфирную связь вместо амидной связи.
Антитела: представляют собой молекулы иммуноглобулинов или активных участков молекул иммуноглобулинов. Например, антителами являются неповрежденные молекулы иммуноглобулинов или их фрагменты, сохранившие иммунологическую активность.
Антиген: Молекула, которая узнается антителами. Как правило, пептид, полипептид или мультимерный полипептид. Антигены преимущественно способны вызывать иммунный ответ.
A.P.I. плотность: Термин, используемый в нефтяной промышленности для выражения относительной плотности нефтепродуктов на основании значений, установленных API (American Petroleum Institute). API плотность измеряется при помощи гидрометрического прибора по шкале, градуированной в единицах API.
CTL: Цитотоксические T лимфоциты. Подгруппа T-клеток, экспрессирующих CD8 вместе с рецептором T-клеток и поэтому способных отвечать на антигены, представленные молекулами Класса I.
Эмульсия: Суспензия маленьких капель одной жидкости во второй жидкости, с которой первая не смешивается.
Эмульгатор: поверхностно-активное вещество, которое способствует образованию эмульсии.
HLA: Лейкоцитарный антиген человека, также называемый MHC. У человека синтезируется три различных типа молекул MHC Класса I, HLA-A, HLA-B и HLA-C. Молекулы MHC Класса II человека обозначены как HLA-D.
Иммуноглобулин: Антитела сыворотки, включающие IgG, IgM, IgA, IgE и IgD.
Выделенный: используется для описания любого из различных стимуляторов секреции, полипептидов и нуклеотидов, описанных в настоящем описании, которые были идентифицированы и отделены и/или извлечены из компонента их природного окружения. Загрязняющие компоненты их природного окружения представляют собой вещества, которые, как правило, являются помехой диагностическому или терапевтическому использованию полипептида, и могут включать ферменты, гормоны и другие белковые и небелковые растворы. В предпочтительных вариантах осуществления полипептид следует очистить.
Лиганд: Молекула, например, пептид, способная специфически связываться с одним или несколькими узнающими рецепторами. Например, антиген является лигандом для своих узнающих антител.
MHC: Главный комплекс гистосовместимости, также называемый HLA. Существует два основных подкласса MHC, Класс I и Класс II.
Минеральное масло: Масло, получаемое из минерального источника, такого как нефть, в противоположность маслам, получаемым из растений и животных. Смеси углеводородов разнообразных композиций.
Montanide ISA (Montanide Incomplete Seppic Adjuvant): Масляный адъювант, составленный как эмульсия «вода в масле». Адъюванты Montanide ISA представляют собой группу адъювантов на основе масла/поверхностно-активного вещества, у которых неметаболизируемое и/или метаболизируемое масло комбинируется с поверхностно-активными веществами (поставляемыми Seppic, Belgium).
PBMC: Мононуклеарные клетки периферической крови.
PBL: Лейкоциты периферической крови.
Пептид: Множество ковалентно связанных аминокислотных остатков, составляющих последовательность и соединенных амидными связями. Термин используется аналогично терминам олигопептид и полипептид. Природные и/или неприродные аминокислоты могут быть соединены пептидными связями или непептидными связями. Термин пептид также включает посттрансляционные модификации, образуемые в результате химических или катализируемых ферментами реакций, известных в данной области.
Поверхностное натяжение: Поверхностное натяжение представляет собой энергию, необходимую для увеличения размера поверхности. Силы связывания между молекулами жидкости ответственны за поверхностное натяжение, и молекулы на поверхности жидкости сильно сцеплены друг с другом.
Поверхностно-активное вещество: Поверхностно-активное вещество, обладающее способностью ослаблять поверхностное натяжение жидкости, в которой растворено. Поверхностно-активное вещество представляет собой соединение, содержащее полярную группу, которая гидрофильна, и неполярную группу, которая гидрофобна и часто составляет алифатическую цепь.
TAA: Антиген, ассоциированный с опухолью.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вакцинной композиции, содержащей пептиды сурвивина и варианты пептидов сурвивина, как описано в настоящем описании ниже.
Вакцинные композиции
Согласно изобретению вакцинная композиция может быть составлена на основании известных способов, например при смешивании одного или нескольких фармацевтически приемлемых наполнителей или носителей с активным веществом, предпочтительно подходящих для введения человеку. Примеры таких наполнителей, носителей и способов составления можно найти, например, в Remington's Pharmaceutical Sciences (Maack Publishing Co, Easton, PA). Для составления фармацевтически приемлемой композиции, пригодной для эффективного введения, такие композиции согласно изобретению должны содержать эффективное количество полипептида сурвивина, пептида сурвивина или варианта пептида сурвивина, как описано в настоящем описании.
Согласно изобретению вакцинная композиция может вводиться индивидууму в терапевтически эффективных количествах. Эффективное количество может меняться в зависимости от ряда факторов, таких как состояние индивидуума, вес, пол и возраст. Другие факторы включают способ введения.
В дальнейшем вакцинные композиции подразумевают включение композиций, пригодных для терапевтического использования, включая стимулирование иммунного ответа у больного, такого как сильный специфический ответ цитотоксических T-клеток на введение указанной композиции, в особенности вакцинной композиции, способной индуцировать клинический ответ в повреждении-мишени. Кроме того, предполагается, что вакцинная композиция по изобретению не индуцирует никаких системных или локальных токсических реакций или любые другие побочные эффекты.
Для получения вакцин или иммуногенных композиций может потребоваться комбинирование сравнительно небольших молекул пептида сурвивина и вариантов пептида сурвивина, описанных в настоящем описании, с различными веществами, такими как адъюванты, иммуностимулирующие компоненты и/или носители. Адъюванты включаются в вакцинную композицию для усиления специфического иммунного ответа. Поэтому особенно важно идентифицировать адъювант, который при комбинировании с антигеном(ами) образует вакцинную композицию, способную индуцировать сильный специфический ответ цитотоксических T-клеток и, что наиболее важно, клинический ответ в повреждении-мишени.
Адъювант
Было описано большое количество адъювантов и их использование для выработки антител у лабораторных животных, таких как мышь, крыса и кролик. В такой постановке допустимость побочных эффектов весьма велика, поскольку основной целью является получение сильного ответа антител.
Для применения и для утверждения применения в фармацевтике, и особенно для применения у людей, необходимо, чтобы компоненты вакцинной композиции, включая адъювант, были хорошо охарактеризованы. Необходимо также, чтобы при применении композиции был бы минимален риск возникновения неблагоприятных реакций, таких как гранулема, абсцесс или лихорадка.
В предпочтительном варианте осуществления вакцинная композиция является пригодной для введения человеку, поэтому предпочтительные адъюванты пригодны для введения человеческому субъекту.
Выбор адъюванта может также быть отобран по способности к стимуляции иммунного ответа желаемого типа, активации B-клеток или/и T-клеток, и вакцинная композиция может быть составлена таким образом, чтобы оптимизировать распределение и представление соответствующих лимфатических тканей.
Недавно в качестве очень эффективного направления для усиления иммунного ответа, направленного в отношении онкологических заболеваний, был предложен способ, включающий наполнение соответствующих антиген-представляющих клеток антигенными пептидами. Этот способ включает выделение из больного APC (PBL) или клеток-предшественников АРС и наполнение их антигенными пептидами, альтернативно могут быть использованы дендритные клетки, которые дифференцируются in vitro в APC и наполняются антигенными пептидами перед инъекцией больному. Этот способ очень сложный и требующий времени. Использование клеточных культур делает его очень негибкой вакцинной композицией, требующей специальной подготовки и приспособлений для хранения. Настоящее изобретение имеет целью выявление вакцинной композиции, которая легко изготовляется и/или хранится.
Адъюванты, используемые в терапевтической вакцине, могут быть минеральными солями, такими как гели гидроксида алюминия и фосфата алюминия или кальция, масляные эмульсии и составы на основе поверхностно-активных веществ, такие как MF59 (микрофлюидизированная детергентная стабилизирующая эмульсия типа масло в воде), QS21 (очищенный сапонин), AS02 (SBAS2, эмульсия типа масло в воде + монофосфориллипид A (MPL) + QS21), Montanide ISA 51 и ISA-720 (стабилизированная эмульсия «вода в масле»), Адъювант 65 (содержащий арахисовое масло, маннид моноолеат и моностеарат алюминия), RIBI ImmunoChem Research Inc., (Hamilton, Utah), адъюванты в виде микрочастиц, таких как виросомы (однослойные липосомальные пузырьки, включающие гемагглютинин гриппа), AS04 (соль алюминия с MPL), ISCOMS (структурированный комплекс сапонинов и липидов (такой как холестерин), полиактидсогликолид (PLG), микробные производные (натуральные и синтетические), такие как монофосфориллипид A (MPL), Detox (MPL + скелет клеточной стенки M. Phlei), AGP (RC-529 (синтетические ацилированный моносахарид)), DC_chol (липоидные иммуностимуляторы, способные самоорганизовываться в липосомы), OM-174 (производное липида А), CpG мотивы (синтетический олигонуклеотиды, содержащие иммуностимулирующие CpG мотивы), модифицированные бактериальные токсины, LT и CT, с нетоксическими адъювантными эффектами, эндогенные иммуномодуляторы человека, например hGM-CSF или hIL-12 или иммудаптин (тандемное расположение C3d), инертные носители, такие как частицы золота.
Адъюванты QS-21 и Montanide ISA-51 могут поставляться в стерильных одноразовых пробирках.
В одном из вариантов осуществления вакцинная композиция содержит адъювант и пептиды сурвивина или вариант пептидов сурвивина, как описано в настоящем описании ниже. В предпочтительном варианте осуществления адъювантом может быть Montanide Incomplete Seppic Адъювант (ISA) (Seppic, Belgium), который включает Montanide ISA-51, Montanide ISA 50, Montanide ISA 70, Montanide ISA 206, Montanide ISA 708, Montanide ISA-720, Montanide ISA 763A, Montanide ISA 207, Montanide ISA 264, Montanide ISA 27, Montanide ISA 35, Montanide ISA 740, Montanide ISA 773, Montanide ISA 266, Montanide ISA 267, Montanide ISA 28, Montanide ISA 51F, Montanide ISA 016D и Montanide IMS. Три последних из приведенных пока еще не утверждены для применения у людей, но потенциально пригодны для вакцинной композиции согласно изобретению.
Montanide ISA-51 и Montanide ISA-720 применяются, главным образом, у людей и, следовательно, предпочтительны и представляют собой адъюванты на основе масла, которые должны вводиться как эмульсиии (смотрите ниже).
В некоторых вариантах осуществления вакцинная композиция может также содержать один или несколько дополнительных иммуностимулирующих компонентов. Они включают, без ограничения, мурамилдипептид (MDP); например N-ацетил-мурамил-L-аланил-D-изоглутамин (ala-MDP), N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, nor-MDP) и N-ацетил-мурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)- этиламин (CGP 19835A, MTP-PE), диметилглицин, тафтсин, и димиколат трегалозы, монофосфорил-липид A (MPL) и формилметионин-содержащие трипептиды, такие как N-формил-Met-Leu-Phe. Такие соединения коммерчески доступны, например, от Sigma Chemical Co. (St. Louis, MO) и RIBI ImmunoChem Research, Inc. (Hamilton, MT).
Носитель может быть представлен независимо от адъюванта. Функцией носителя может, например, быть увеличение молекулярной массы, в частности фрагментов сурвивина для усиления их активности или иммуногенности, придания стабильности, увеличения биологической активности или увеличения времени полужизни в плазме. Носителем может быть любой подходящий носитель, известный специалисту в данной области. Белком-носителем могут быть, без ограничения, гемоцианин лимфы улитки, белки плазмы, такие как трансферрин, бычий сывороточный альбумин, сывороточный альбумин человека, тироглобулин или овальбумин, иммуноглобулины или гормоны, такие как инсулин или пальмитиновая кислота. Для иммунизации людей носитель должен быть физиологически приемлемым носителем, пригодным для людей и безопасным. Впрочем, столбнячный токсоид и/или дифтерийный токсоид являются подходящими носителями в одном варианте осуществления изобретения. Альтернативно, носитель может представлять собой декстраны, например, сефарозу.
Вакцины на основе масляных эмульсий и поверхностно-активных веществ могут быть сгруппированы по составу на типы: вода в масле, масло в воде и вода в масле в воде.
Адъювант, составленный по типу масло в воде, может являться минеральным или/и неминеральным маслом и поверхностно-активным веществом/эмульгатором. Адъювант смешивается с водной антигенной композицией, предоставляя технологию приготовления вакцины.
Согласно изобретению масло может быть метаболизируемым или неметаболизируемым или смесью метаболизируемого и неметаболизируемого масел. Неминеральные масла быстро метаболизируются и выводятся из области инъекции, поэтому они вызывают очень слабый побочный эффект, однако развивающийся иммунный ответ является столь же слабым, тогда как минеральные масла только частично метаболизируются и обладают повышенным риском индуцировать нежелательные эффекты наряду с хорошим иммунным ответом.
Предпочтительно, чтобы масло было предварительно смешано с эмульгирующим веществом, таким как маннид моноолеат, перед добавлением водной фазы вакцины, и эмульгировано с использованием коллоидной мельницы или безостановочного механического или проточного ультразвукового эмульгаторов.
Более сложная двойная эмульсия (вода/масло/вода) может быть получена при повторном эмульгировании в водной фазе, содержащей небольшое количество Tween 80.
За последние несколько лет был достигнут значительный прогресс в результате применения «готовых к использованию» масляных адъювантов. Масла, содержащие, к примеру, эфиры октадециленовой кислоты и ангидроманнит, быстро образуют двойные или смешанные эмульсии (Вода/Масло/Вода), которые стабильны и при этом обладают низкой плотностью, и не требуют усложненного оборудования для эмульгирования.
В варианте осуществления предпочтительным адъювантом является адьювант для вакцины с составом типа вод