Способ получения пурпурогаллина
Иллюстрации
Показать всеИзобретение относится к фармакологическому производству и может быть использовано для получения пурпурогаллина. Способ предусматривает ферментативное окисление пирогаллола в присутствии перекиси водорода и последующую хроматографическую очистку целевого продукта. В качестве источника фермента и перекиси водорода используют морских ежей Scaphechinus mirabilis, находящихся в биореакторе с морской водой. В биореактор добавляют водный раствор пирагаллола до его концентрации в морской воде 0,4-0,6 мг/мл. Хроматографическую очистку осуществляют на полихроме-1 с последующим элюированием целевого продукта с сорбента 40-60% водным раствором этилового спирта, упариванием в вакууме и кристаллизацией из водного раствора спирта. Изобретение позволяет увеличить выход пурпурогаллина. 3 ил.
Реферат
Изобретение относится к фармакологическому производству и может быть использовано для получения биологически активных веществ из гидробионтов.
Плоский морской еж Scaphechinus mirabilis является источником получения эхинохрома А - субстанции кардиологического и офтальмологического препаратов «Гистохром», биологически активных добавок «Тимарин», «Золотой Рог» и других. В то же время это ценное природное сырье может служить источником и продуцентом других биологически активных веществ, в частности пурпурогаллина.
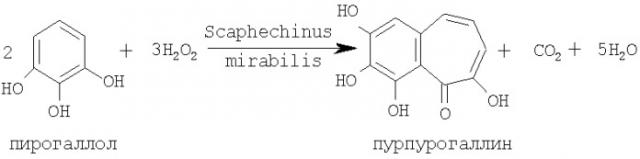
Природный антиоксидант - пурпурогаллин представляет собой индивидуальное соединение 2,7,8,9-тетрагидроксибензо[f]трополон.
Химическая формула пурпурогаллина:
Молекулярный вес 220,18.
Исследования показали, что пурпурогаллин является эффективным стабилизатором масел от окисления [US 4181545, 01.01.1980], может являться эффективным цитопротектором для клеток печени [Wu T.W. et al. Biochem. Cell. Biol. 1991. V.69. No 10-11. P.747-759], почек [Zeng L.H. et. al. // Biochem. Cell Biol. 1992. V.70. No. 8. P.684-690], кардиоклеток [Wu T.W. et al. // Biochem. Cell Biol. 1992. V.70. No. 9. P.803-809]. Он также предохраняет эритроциты человека от лизиса пероксил-радикалом [Wu T.W. et al. // Life Sci. 1994. V.54(2). P.PL23-PL28]. Пурпурогаллин способен ингибировать синтез ДНК некоторых опухолевых клеток [Sugiyama Н., Fung K.P., Wu T.W. // Life Sci. 1993. V.53. No 4. P.39-43], показал антибактериальную активность против граммположительных бактерий, включая Staphylococcus aureus [Sheu S.Y. et al. // Anticancer Res. 1998. V.8(1 A). P.263-267]. Пурпурогаллин защищает желудочковые миоциты и эндотелиальные клетки аорты и гепатоциты от гидроксильных радикалов [Wu T.W. et al. // Biochem. Cell Biol. 1992. V.70. No. 9. P.803-809]. Он также является перспективным профилактическим противораковым средством [Fung K.Р. et al. // Chemother. 1996. V.42. P.199-205].
Селективность пурпурогаллина как антиоксиданта обусловлена тем, что он является ловушкой для супероксид анионов пероксида водорода или гидроксил радикалов. Эффективность пурпурогаллина и его гликозидов намного выше, чем эффективность антиоксидантов Тролокс и аскорбиновой кислоты. Он нормализует состав крови больных с ишемической болезнью сердца. Пурпурогаллин не токсичен и устойчив в кровотоке в нативном состоянии в течение нескольких недель. На его основе могут быть созданы лекарственные препараты для лечения заболеваний, вызванных оксидативным стрессом.
Известен способ получения пурпурогаллина из галлов (чернильных орешков) дуба - разрастаний на молодых ветках дубов, инвазированных личинками перепончатокрылых насекомых [Nierenstein М., Swanton А. // Biochem. J., 1944, V.38. P.373-375]. Сущность способа состоит в экстракции высушенного при 100°С и измельченного материала последовательно хлороформом, четыреххлористым углеродом и этанолом, упаривании экстракта, последующем экстрагировании остатка, смешанного с серебряным порошком в соотношении 1:10 по весу в Сокслете с кипящей водой, выпаривании полученного экстракта до трети объема, кристаллизации из воды и гидролиза серной кислотой или энзимного гидролиза с пурпурогаллазой.
Недостатками данного способа являются:
- использование в качестве катализатора драгоценного металла (порошкового серебра), что значительно удорожает процесс;
- ограниченность сырьевой базы и, как следствие, непригодность способа для промышленного использования.
Известен способ получения пурпурогаллина путем окисления пирогаллола нитритом натрия и уксусной кислотой, либо иодатом натрия и последующей кристаллизацией целевого продукта из ледяной уксусной кислоты [Barltrop J.A., Nicholson J.S. // J. Chem. Soc. 1948. P.116-120]. Выход целевого продукта - 72%. Способ непригоден для промышленного использования, т.к. предусматривает использование взрывоопасных ингредиентов в процессе синтеза.
Известен способ получения производных пурпурогаллина в биохимическом реакторе с использованием биологически чистой культуры микроорганизмов рода Absidia capable [US 5650439, 22.07.1997]. Сущность способа состоит в инакуляции исходной культуры в питательную среду при pH 7 в течение 9 дней. Полученный бульон экстрагируют бутанолом при pH 2. Бутанольный экстракт концентрируют и последовательно хроматографируют на Dianon НР-21 в системе вода-ацетон, сефадексе LH-20 в метаноле, Bond elute C18 в системе вода-метанол. Концентрат экстрагируют этилацетатом при pH 2 и очищают на Capcellpae C18 в системе метанол-вода-NaH2PO4 при pH 2,2. Из 10 л бульона получается 14 мг коричневого аморфного порошка 8-O-пурпурогаллинкарбоксикислоты.
Недостатками данного способа являются:
- получение в качестве конечного продукта производного пирогаллола в виде кислоты;
- длительность процесса очистки (4-х стадийная препаративная колоночная хроматография);
- длительность процесса получения исходного экстракта (9 суток);
- использование токсичных реактивов (метанол, н-бутанол);
необходимость соблюдения стерильности процесса (микробиологическое производство).
Наиболее близким к заявляемому способу является способ получения пурпурогаллина путем ферментативного окислительного синтеза из пирогаллола и катехола. Способ включает растворение 1,0 г пирогаллола и 1,0 г катехола в смеси ацетон - фосфатно-цитратный буфер рН 5,0 (1:10 по объему, 50 мл) с добавлением 2 мг пероксидазы хрена и последовательным добавлением четырехкратно в течение часа при перемешивании 2 мл 3,13% перекиси водорода. Пирогаллол экстрагируют из реакционной смеси этилацетатом (3 раза по 50 мл), концентрируют и хроматографируют на Сефадексе LH-20 с последующим элюированием водно-ацетоновой смесью (40%). После упаривания элюата получают 300 мг пурпурогаллина. Выход целевого продукта - 12% [US 2005/0049284 А1, 2005.02.03].
Недостатками известного способа являются:
- низкий выход целевого продукта (12%);
- использование пожароопасных реактивов (этилацетат, ацетон).
Задачей изобретения является разработка способа получения пурпурогаллина из гидробионтов.
Поставленная задача решена способом получения пурпурогаллина путем ферментативного окисления пирогаллола в присутствии перекиси водорода с последующей хроматографической очисткой целевого продукта, в котором согласно изобретению в качестве источника фермента и перекиси водорода используют морских ежей Scaphechinus mirabilis, находящихся в биореакторе с морской водой при температуре 18-22°С, в который добавляют водный раствор пирагаллола до конечной его концентрации в морской воде 0,4-0,5 мг/мл, хроматографическую очистку осуществляют на полихроме-1 с последующим элюированием целевого продукта с сорбента 40-60% водным раствором этилового спирта, упариванием в вакууме и кристаллизацией из водного раствора этилового спирта. Выход пурпурогаллина составляет 75% от веса исходного сырья.
Технический результат, обеспечиваемый изобретением, заключается в увеличении выхода пурпурогаллина в 6 раз по сравнению с его выходом по способу-прототипу. Способ позволяет рационально использовать ценное биологическое сырье - морских ежей, которые являются сырьем для производства эхинохрома А - субстанции лекарственных препаратов серии «Гистохром».
Предлагаемый способ получения пурпурогаллина существенно отличается от аналогов и прототипа, т.к. основан на применении варианта биореактора с живыми макроорганизмами (морские ежи), в котором происходит биосинтез пурпурогаллина из пирогаллола с использованием ферментных систем морских ежей S. Mirabilis и пероксида водорода.
Биореактор представляет собой проточный аквариум, в который помещают морских ежей. В морскую воду вводят искусственно пирогаллол, и морские ежи начинают превращать его в пурпурогаллин.
Образование пурпурогаллина происходит по схеме
Источником пероксида водорода служат симбиотные с морскими ежами микроорганизмы и диатомовые водоросли, являющиеся основным объектом питания ежей S. mirabilis. Эти микроводоросли синтезируют Н2О2 за счет собственного фотосинтезирующего аппарата. Помимо этого, в состав оболочных панцирей и игл морских ежей входят полигидроксинафтохиноны, в частности эхинохром А. Полигидроксинафтохиноны находятся внутри клеток морских ежей, покрывающих или входящих в состав биоминерального матрикса ежей. В комплексе с клеточными ферментами (флавиновыми белками) они участвуют в процессе образования пероксида водорода, который при наличии в организме ежей фермента каталазы и других пероксидаз, превращается в кислород и воду, обеспечивая кислородное питание всех внутренних органов и тканей морских ежей.
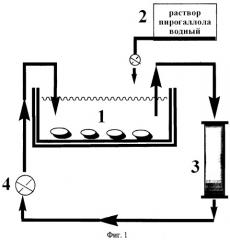
На фиг.1 представлена принципиальная схема биореактора.
Морских ежей помещают на дно аквариума (1) и заливают морской водой (слой воды должен быть выше поверхности ежей на 2 см). Из емкости (2) дозировано прибавляют раствор пирогаллола до конечной концентрации его в морской воде 0,4-0,6 мг/мл. Включают насос, циркулирующий воду через фильтр-ловушку (3) с полихромом-1. Биореактор функционирует в течение 24 часов. При заполнении фильтра-ловушки пурпурогаллином на две трети фильтр-ловушку выводят из системы и заменяют новым. Степень заполнения определяют визуально: пурпурогаллин имеет темно-коричневый цвет. Фильтр-ловушку промывают дистиллированной или деминерализованной водой, затем 10% водным раствором этилового спирта. Целевой продукт элюируют с сорбента 40-60% водным раствором этилового спирта. Раствор пурпурогаллина упаривают в вакууме, а затем кристаллизуют целевой продукт из водного раствора этилового спирта.
После окончания цикла работы морских ежей промывают морской водой, дистиллированной или деминерализованной водой и далее используют для получения эхинохрома А по фармакопейной технологии.
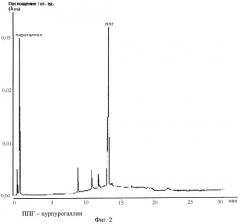
На фиг.2 представлен состав полифенолов в биореакторе через 6 часов инкубации морских ежей в присутствии пирогаллола (анализ методом ВЖХ).
На фиг.3 представлен состав полифенолов в элюате с фильтра-ловушки (анализ методом ВЖХ).
Изобретение иллюстрируется следующим примером конкретного выполнения: ПРИМЕР.
Морских ежей вида S. mirabilis в количестве 0,5 кг помещают в биореактор (1) и заливают морской водой (0,5 л) при 20°С. Слой воды должен быть выше поверхности ежей на 2-3 см («зеркало»). Из емкости (2) по каплям прибавляют 50 мл раствора пирогаллола в морской воде в концентрации 5 мг/мл до конечной его концентрации в морской воде 0,5 мг/мл. Включают насос, циркулирующий воду через фильтр-ловушку (3), заполненный 0,1 кг полихрома-1. Процесс прекращают после заполнения двух третей фильтра-ловушки. Фильтр промывают дистиллированной водой (0,5 л), затем 10% водным раствором этилового спирта (0,1 л). Пурпурогаллин элюируют с сорбента 0,5 л 40% водного раствора этилового спирта и 0,5 л 60% водного раствора этилового спирта. Раствор упаривают в вакууме и кристаллизуют из 40% водного раствора этилового спирта. Ежей промывают морской, затем дистиллированной водой и выгружают из реактора.
Выход пурпурогаллина составляет 750 мг за 1 цикл работы биореактора (24 часа), т.е. 75% от веса исходного сырья.
Способ получения пурпурогаллина путем ферментативного окисления пирогаллола в присутствии перекиси водорода с последующей хроматографической очисткой целевого продукта, отличающийся тем, что в качестве источника фермента и перекиси водорода используют морских ежей Scaphechinus mirabilis, находящихся в биореакторе с морской водой, в который при температуре 18-22°С добавляют водный раствор пирогаллола до конечной его концентрации в морской воде 0,4-0,6 мг/мл, хроматографическую очистку осуществляют на полихроме-1 с последующим элюированием целевого продукта с сорбента 40-60%-ным водным раствором этилового спирта, упариванием в вакууме и кристаллизацией из водного раствора этилового спирта.