Производные альфа-аминоамидов, применимые в качестве противовоспалительных агентов
Иллюстрации
Показать всеИзобретение относится к применению (S)-(+)-2-[4-(2-фторбензилокси)-бензиламино]пропанамида в качестве противовоспалительного агента. Также изобретение относится к фармацевтической композиции, обладающей противовоспалительной активностью, включающей фармацевтически приемлемое вспомогательное вещество и в качестве активного агента (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамид в количестве, эффективном для уменьшения или предотвращения воспаления. Технический результат - производное α-аминоамида в качестве противовоспалительного агента. 2 н. и 2 з.п. ф-лы, 1 табл.
Реферат
Область техники
Изобретение относится к производным α-аминоамидов, химическому классу блокаторов натриевых каналов, которые являются применимыми в качестве противовоспалительных агентов. В особенности, изобретение относится к их применению в качестве терапевтических противовоспалительных агентов и к содержащим их фармацевтическим композициям.
Уровень техники
Воспаление вызывает сильные изменения возбудимости первичных чувствительных нейронов, иннервирующих воспаленную ткань. Такие изменения лежат в основе развития и поддержания хронического воспалительного состояния. Исследования показали, что появляется пост-трансляционная модификация или нарушение экспрессии натриевых каналов в нейронах ганглиев задних корешков (DRG) после воспаления ткани.
Считают, что существует множество разнообразных путей воспаления и индуцированного воспалением повреждения ткани. Например, натриевые каналы существенно стимулируются в воспаленных тканях. Инъекция каррагенана в подошвенную поверхность задней лапы крыс, используемая как модель воспаления на животных, вызывает развитие отека, гипертермии и гипералгезии. Хотя блокаторы натриевых каналов могут быть эффективными в облегчении невропатической боли, не все проявляют очевидное противовоспалительное действие. Действительно, два блокатора натриевых каналов, кробенетин и мекселетин, были способны уменьшить механическую гипералгезию без какого-либо влияния на отек и ограниченную подвижность воспаленного сустава, индуцированные каррагенаном. Следовательно, такие открытия показывают, что обезболивающая активность блокаторов натриевых каналов не является обязательно связанной с противовоспалительными свойствами.
В то же время содержание воспалительных медиаторов, таких как вещество P и пептид, связанный с геном кальцитонина (CGRP), которые вовлечены в передачу боли, повышается в нейронах DRG после воспаления. Вещество P играет важную роль в индукции нейрогенного воспаления, и было показано, что оно проявляет сильное провоспалительное действие, такое как расширение сосудов, повышенная проницаемость капилляров и секреция простагландина E2.
Патентные публикации PCT WO90/14334, WO94/22808, WO97/05102, WO 97/0511 и WO 99/35215, текст которых включен в виде ссылок в настоящее описание, описывают замещенные соединения бензиламинопропионамида, активные в отношении центральной нервной системы и применимые в качестве анти-эпилептических, анти-паркинсонических, нейропротекторных, антидепрессантных и потивоспазматических снотворных агентов (см. также Pevarello P. et al. (1998), "Synthesis and anticonvulsant activity of a new class of 2-[(arylalkyl)amino]alkanamide derivatives", J. Med. Chemistry, 41: 579-590). WO99/35125 и WO99/35123 описывают замещенные соединения бензиламинопропанамида, активные в отношении центральной нервной системы и применимые в качестве обезболивающих агентов (см. также Veneroni O. et al. (2003) "Anti-allodynic effect of NW-1029, a novel Na+ channel blocker, in experimental animal models of inflammatory and neuropathic pain", Pain 102 (1-2): 17-25).
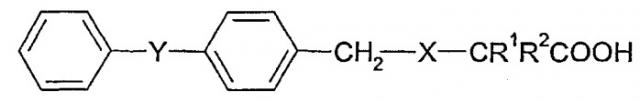
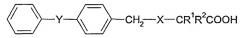
Патент США № 3549690, выданный Leigh et al., кроме того, описывает производные карбоновой кислоты следующей общей формулы:
которые снижают концентрацию холестерина и/или триглицеридов в сыворотке крови и которые обладают противовоспалительной активностью. Патент США № 6548507, выданный Bountra et al., относится к применению антагонистов натриевых каналов для лечения заболеваний, опосредованных или усугубляемых апоптозом нейронов, в частности апоптозом чувствительных нейронов.
Сущность изобретения
Несмотря на большое количество доступных противовоспалительных агентов, применение таких противовоспалительных агентов ограничено тяжелыми побочными эффектами и/или ограниченной активностью при некоторых воспалительных состояниях. Например, неблагоприятные побочные эффекты в желудочно-кишечном тракте обычно индуцируют определенные уровни классических противовоспалительных лекарственных средств, таких как индометацин, нестероидное противовоспалительное лекарственное средство (НПВС). Подобным образом, ингибиторы COX-2 только частично снижают воспалительные расстройства. Следовательно, все еще существует явная необходимость в разработке новых соединений с улучшенным терапевтическим индексом для лечения воспалительных расстройств. Настоящее изобретение обеспечивает быстрые и высокоэффективные способы для лечения множества воспалительных расстройств органов и систем организма с использованием, in vivo, определенных α-аминоамидных соединений по изобретению в терапии, которая является лучшей альтернативой существующим методам лечения.
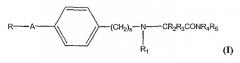
В одном варианте воплощения изобретение включает лечение одного или более воспалительных расстройств у пациента, нуждающегося в этом, введением эффективного количества, по меньшей мере, одного α-аминоамидного соединения формулы (I):
где:
A представляет собой -(СН2)n-Х-группу, где n является целым числом от 0 до 5, X представляет собой CH2, -O-, -S- или -NH-;
s равно 1 или 2;
R представляет собой фурильное, тиенильное или пиридильное кольцо или фенильное кольцо, необязательно замещенное одним или двумя заместителями, независимо выбираемыми из галогена, гидрокси, циано, C1-С6 алкила, C1-С6 алкокси или трифторметила;
R1 представляет собой водород или C1-С6 алкил или C3-C7 циклоалкил;
R2 и R3 независимо выбирают из водорода; C1-C4 алкила, необязательно замещенного гидрокси или фенилом; фенила, необязательно замещенного одним или двумя заместителями, независимо выбираемыми из C1-C6 алкила, галогена, гидрокси, C1-C6 алкокси или трифторметила; или R2 и R3, вместе с атомом углерода, с которым они связаны, образуют С3-С6 циклоалкильное кольцо; и
R4, R5 представляют собой, независимо, водород, C1-C6 алкил или С3-С7 циклоалкил; или R4 и R5, вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное гетероциклическое кольцо;
или их изомеров, смесей и фармацевтически приемлемых солей.
Алкильные и алкоксигруппы могут быть разветвленными или могут быть группами с линейной цепью.
В одном варианте воплощения изобретения, когда n равно 1, s равно 1, X представляет собой O, R1, R2, R4 и R5 представляют собой H и R3 является CH3, R не является м-фтор-замещенным фенильным кольцом.
Фармацевтически приемлемые соли соединений по изобретению включают, например, кислотно-аддитивные соли с неорганическими кислотами, например азотной, соляной, бромисто-водородной, серной и фосфорной кислотами и подобными, или органическими кислотами, например уксусной, пропионовой, гликолевой, молочной, щавелевой, малоновой, яблочной, винной, лимонной, янтарной, бензойной, коричной, миндальной, метансульфоновой, п-толуолсульфоновой и салициловой кислотами и подобными.
Некоторые из соединений формулы (I) могут иметь асимметричные атомы углерода и, следовательно, могут существовать и в виде рацемических смесей и в виде отдельных оптических изомеров (энантиомеров). Соответственно, термин "фармацевтически приемлемые соли" α-аминоамида формулы (I) также обозначают включение в его рамки всех возможных изомеров и их смесей и любых фармацевтически приемлемых метаболитов, биопредшественников и/или пролекарств, т.е. соединений, которые имеют структурную формулу, отличающуюся от таковой α-аминоамида формулы (I), и, кроме того, непосредственно или косвенно преобразуются in vivo в соединение, имеющее формулу (I), при введении млекопитающему, особенно человеку.
Предпочтительные соединения формулы (I) включают таковые, где A представляет собой группу, выбираемую из CH2-, -CH2-CH2-,
-CH2-S-, -CH2-CH2-S-, и -(СН2)n-О-, где n является целым числом от 1 до 5;
- s равно 1 или 2;
- R представляет собой фенильное кольцо, необязательно замещенное одним или двумя заместителями, независимо выбираемыми из галогена, трифторметила, метокси, или тиенильного кольца;
- R1 представляет собой водород или C1-C4 алкил;
- один из R2 и R3 представляет собой водород и другой представляет собой C1-C4 алкил, необязательно замещенный гидрокси или фенилом, необязательно замещенным одним или двумя атомами галогена, или R2 и R3 оба являются метилом, или вместе они могут образовывать с атомом, с которым они связаны, циклопропильное или циклопентильное кольцо; и
- R4, R5 представляют собой водород или С1-C4 алкил, или, вместе с атомом азота, с которым они связаны, образуют пирролидиновое или пиперидиновое кольцо, и его фармацевтически приемлемые соли.
Примеры специфических соединений формулы (I), которые могут быть использованы отдельно или в комбинации с другими соединениями формулы (I), в эффективном количестве для лечения одного или более воспалительных заболеваний у пациента включают, но не ограничиваются ими:
2-(4-Бензилоксибензиламино)пропанамид;
2-[4-(2-Метоксибензилокси)бензиламино]пропанамид;
2-[4-(2-Фторбензилокси)бензиламино]пропанамид;
(S)-(+)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид;
2-[4-(2-Фторбензилокси)бензиламино]-2-метилпропанамид;
Метансульфонат (S)-(+)-2-[4-(3-фторбензилокси)бензиламино]пропанамида;
2-[4-(2-Фторбензилокси)бензиламино]-N-метилпропанамид;
N-{2-[4-(2-Фторбензилокси)бензиламино]}пропионилпирролидин;
2-[4-(3-Метоксибензилокси)бензиламино]пропанамид;
2-[4-(3-Цианобензилокси)бензиламино]пропанамид;
2-[4-(3-Фторбензилокси)бензиламино]пропанамид;
(S)-(+)-2-[4-(3-Фторбензилокси)бензиламино]пропанамид;
2-[4-(3-Фторбензилокси)бензиламино]-2-метилпропанамид;
2-[4-(3-Фторбензилокси)бензиламино]-N-метилпропанамид;
N-{2-[4-(3-Фторбензилокси)бензиламино]}пропионилпирролидин;
2-[4-(4-Фторбензилокси)бензиламино]пропанамид;
2-[4-(3-Фторбензилокси)бензиламино]-2-метилпропанамид;
2-[4-(2-Хлорбензилокси)бензиламино]пропанамид;
2-[4-(3-Хлорбензилокси)бензиламино]пропанамид;
2-(4-Бензилоксибензиламино)-3-гидроксипропанамид;
2-[4-(2-Фторбензилокси)бензиламино]-3-гидроксипропанамид;
2-[4-(3-Фторбензилокси)бензиламино]-3-гидроксипропанамид;
2-(4-Бензилоксибензиламино)-3-гидрокси-N-метилпропанамид;
2-[4-(2-Фторбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(3-Фторбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(2-Хлорбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(3-Цианобензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(3-Цианобензилокси)бензиламино]-2-метил-3-гидрокси-N-метилпропанамид;
2-[4-(3-Хлорбензилокси)фенилэтиламино]пропанамид;
2-{4-[2-(3-Фторфенил)этилокси]бензиламино}пропанамид;
2-{4-[2-(3-Фторфенил)этил]бензиламино}пропанамид;
2-[N-(4-Бензилоксибензил)-N-метиламино]пропанамид;
2-{4-[(3-Хлорбензилокси)фенилэтил]амино}пропанамид;
2-[4-Бензилтиобензиламино]пропанамид;
2-[4-(2-Фторбензилтио)бензиламино]пропанамид;
2-[4-(3-Фторбензилтио)бензиламино]пропанамид;
2-[4-(3-Фенилпропилокси)бензиламино]пропанамид;
2-[4-(4-Фенилбутилокси)бензиламино]пропанамид;
2-[4-(5-Фенилпентилокси)бензиламино]пропанамид;
2-(4-Бензилоксибензиламино)-3-фенил-N-метилпропанамид;
2-(4-Бензилоксибензиламино)-3-метил-N-метилбутанамид;
2-(4-бензилоксибензиламино)-2-фенилацетамид;
2-[4-(2-Фторбензилокси)бензиламино]-2-фенилацетамид;
2-[4-(3-Фторбензилокси)бензиламино]-2-фенилацетамид;
2-[4-(2-Фторбензилокси)бензил-N-метиламино]-2-фенилацетамид;
2-[4-(3-Фторбензилокси)бензил-N-метиламино]-2-фенилацетамид;
2-[4-(3-Хлорбензилокси)бензиламино]-2-фенилацетамид;
2-[4-(2-Фторбензилокси)бензиламино]-2-(2-фторфенил)ацетамид;
2-[4-(2-Фторбензилокси)бензиламино]-2-(3-фторфенил)ацетамид;
2-[4-(3-Фторбензилокси)бензиламино]-2-(2-фторфенил)ацетамид;
2-[4-(3-Фторбензилокси)бензиламино]-2-(3-фторфенил)ацетамид;
2-[4-(3-Хлорбензилокси)бензиламино]-2-(3-фторфенил)ацетамид;
2-(4-(2-Тиенилокси)бензиламино)пропанамид;
или их изомеры, смеси и фармацевтически приемлемые соли.
Предпочтительным соединением формулы (I), которое может быть использовано отдельно или в комбинации с другими соединениями формулы (I), в эффективном количестве для лечения одного или более воспалительных расстройств у пациента, является (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамид или его фармацевтически приемлемая соль.
В одном варианте воплощения изобретения пациентом, получающим лечение, является млекопитающее, включая человека, нуждающееся в облегчении, предотвращении или подавлении симптомов одного или более воспалительных расстройств.
В особенности, млекопитающему, нуждающемуся в вышеуказанном лечении, вводят дозу α-аминоамида формулы (I), как определено выше, в интервале от около 0,3 до около 100 мг/кг массы тела в сутки. "Лечение", как используется в настоящем описании, включает любой уход посредством манипуляций или применений к млекопитающему и, в особенности, человеку, которые предназначены для a) предотвращения заболевания или расстройства от появления у субъекта, который может быть предрасположен к заболеванию/расстройству, но у которого оно до сих пор не было диагностировано; b) ингибирования заболевания/расстройства, или состояния, т.е., купирования его развития; или c) облегчения заболевания/расстройства или состояния, т.е., обеспечения регрессии заболевания/расстройства или состояния.
Воспалительные состояния у млекопитающих, включая людей, могут, следовательно, быть ингибированы, облегчены и предотвращены. Примеры воспалительных состояний у млекопитающих, которые могут быть вылечены введением одного или более α-аминоамидных соединений формулы (I) включают, но не ограничиваются: артритные состояния, такие как анкилозирующий спондилит, шейный артрит, фибромиалгия, заболевания кишечника, ювенильный ревматоидный артрит, пояснично-крестцовый артрит, остеоартрит, остеопороз, псориатический артрит, ревматическое заболевание, ревматоидный артрит, экзема, псориаз, дерматит и воспалительные состояния, такие как солнечные ожоги; воспалительные заболевания глаз, такие как увеит и конъюнктивит; заболевания легких, в которые вовлечено воспаление, такие как астма и бронхит; состояния желудочно-кишечного тракта, включая язвы, гингивит, болезнь Крона, атрофический гастрит, gastritis varialoforme, язвенный колит, глютеновая болезнь, местный илеит, пептические язвы, изжога и другие повреждения ЖК тракта, например, Helicobacter pylori; воспаление внутренних органов, такое как раздражение мочевого пузыря и цистит; воспалительные неврологические расстройства центральной или периферической нервной системы; рассеянный склероз; воспалительные невропатии и неврологические осложнения СПИД, воспаление, ассоциированное с аутоиммунными заболеваниями, травмой, включая травму, вызванную хирургическим вмешательством, инфекциями, метаболическими расстройствами и опухолями.
В другом аспекте изобретение включает α-аминоамид формулы (I), вводимый в качестве активного агента фармацевтически приемлемой композиции, обладающей противовоспалительной активностью, которая может быть получена обычными методами, известными в области техники, например смешиванием активного агента с фармацевтически приемлемыми терапевтически инертными органическими и/или неорганическими носителями или вспомогательными веществами.
Подробное описание изобретения
Предпочтительным соединением формулы (I), используемым в эффективном количестве для лечения одного или более воспалительных расстройств у пациента, является (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамид. Соединение формулы (I) и его фармацевтически приемлемые соли могут быть получены посредством хорошо известных способов, как описано в международных заявках, цитированных выше.
“Комбинированная терапия" (или "ко-терапия") включает введение альфа-аминоамидного соединения формулы (I) по изобретению и, по меньшей мере, второго агента, в качестве части специфической схемы лечения, предназначенной для обеспечения полезного эффекта из совместного действия таких терапевтических агентов. Преимущества таких комбинаций включают уменьшение дозы обычных воспалительных агентов (т.е., иных, чем агенты по настоящему изобретению) с последовательным уменьшением побочных эффектов таких обычных агентов. Полезный эффект комбинации включает, но не ограничивается ими, фармакокинетическое или фармакодинамическое совместное действие, возникающее в результате комбинации терапевтических агентов. Введение таких терапевтических агентов в комбинации обычно проводят в течение определенного периода времени (обычно минуты, часы, дни или недели, в зависимости от выбранной комбинации). "Комбинированная терапия" может быть, но обычно не является, предназначенной для введения двух или более таких терапевтических агентов, как части отдельных схем монотерапии, которые таким образом в любом случае приводят к комбинациям, предусматриваемым настоящим изобретением. "Комбинированная терапия" предназначена для введения таких терапевтических агентов последовательным образом, то есть, где каждый терапевтический агент вводят в различное время, а также введения таких терапевтических агентов, или по меньшей мере двух из терапевтических агентов, по существу, одновременным образом. По существу, одновременное введение может быть достигнуто, например, введением субъекту одной капсулы, имеющей фиксированное соотношение каждого терапевтического агента или во множестве отдельных капсул для каждого из терапевтических агентов. Последовательное или, по существу, одновременное введение каждого терапевтического агента может быть достигнуто любым соответствующим путем, включая, но не ограничиваясь, пероральные пути, внутривенные пути, внутримышечные пути и непосредственное всасывание через ткани слизистых мембран. Терапевтические агенты можно вводить одним и тем же путем или различными путями. Например, первый терапевтический агент выбранной комбинации может быть введен внутривенной инъекцией, тогда как другие терапевтические агенты комбинации могут быть введены перорально.
Альтернативно, например, все терапевтические агенты могут быть введены перорально или все терапевтические агенты могут быть введены внутривенной инъекцией. Последовательность, в которой вводят терапевтические агенты, не является строго ограниченной. "Комбинированная терапия" также может включать введение терапевтических агентов, как описано выше, в дополнительной комбинации с другими биологически активными ингредиентами и нелекарственным лечением (например, хирургическим или лучевым лечением). Когда комбинированная терапия кроме того включает нелекарственное лечение, нелекарственное лечение может быть проведено в любое подходящее время, при условии, что достигается полезный эффект из взаимодействия комбинации терапевтических агентов и нелекарственного лечения. Например, в соответствующих случаях полезный эффект все еще достигается, когда нелекарственное лечение отдалено по времени от введения терапевтических агентов возможно на дни или даже недели.
Композиции α-аминоамида по изобретению могут быть введены во множестве лекарственных форм, например перорально в форме таблеток, пастилок, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов, эмульсий или суспензий; ректально в форме суппозиториев, парентерально, например посредством внутримышечной или внутривенной инъекции или инфузии; и трансдермально в форме пластыря, мази, эмульсии, лосьона, геля, крема и назального спрея.
Подходящие фармацевтически приемлемые терапевтически инертные органические и/или неорганические носители или вспомогательные вещества, применимые в получении таких композиций, включают, например, воду, желатин, гуммиарабик, лактозу, крахмал, целлюлозу, стеарат магния, тальк, растительные масла, полиалкиленгликоли и подобные. Композиции α-аминоамида формулы (I) могут быть стерилизованы и могут содержать дополнительные компоненты, хорошо известные специалистам в области техники, такие как, например, консерванты, стабилизаторы, увлажняющие или эмульгирующие агенты, например парафиновое масло, моноолеат маннида, соли для установления осмотического давления, буферы и подобное.
Кроме того, твердые пероральные формы могут содержать, вместе с активным агентом, разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие вещества, например диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция, и/или полиэтиленгликоли; вяжущие вещества, например крахмалы, гуммиарабик, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезагрегантные агенты, например крахмал, альгиновую кислоту, альгинаты или гликолат крахмала натрия; пенящиеся смеси; красители; подсластители; увлажняющие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и, в общем, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических композициях. Фармацевтические препараты могут быть получены любым известным способом, например посредством процессов смешивания, гранулирования, таблетирования, покрытия оболочкой из сахара или покрытия оболочкой из пленки.
Пероральные композиции включают композиции с замедленным высвобождением, которые могут быть получены обычным образом, например посредством нанесения кишечно-растворимой оболочки на таблетки и гранулы.
Жидкими дисперсиями для перорального введения могут быть, например, сиропы, эмульсии и суспензии. Сиропы могут, кроме того, содержать в качестве носителя, например, сахарозу или сахарозу с глицерином, и/или маннитом, и/или сорбитом.
Суспензии и эмульсии могут содержать в качестве носителя, например, природную камедь, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, при желании, подходящее количество гидрохлорида лидокаина. Растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя, например, стерильную воду, или предпочтительно они могут быть в форме стерильных, водных или изотонических физиологических растворов.
Суппозитории могут содержать, вместе с активным агентом, фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, поверхностно-активное вещество полиоксиэтиленового эфира сорбита и жирных кислот или лецитин.
Композиции, включающие α-аминоамиды формулы (I), обычно находятся в форме лекарственной дозы, содержащей, например, от 21 до 7000 мг активного ингредиента на стандартную лекарственную форму. Подходящее лечение дают 1, или 2, или 3 раза в сутки, в зависимости от скорости выведения. Соответственно, желаемая доза может быть представлена в однократной дозе или в виде разделенных доз, вводимых с соответствующими интервалами, например, от двух до четырех или более суб-доз в сутки.
Фармацевтические композиции, включающие α-аминоамид формулы (I), могут содержать на лекарственную форму, например капсулу, таблетку, порошок для инъекций, чайную ложку, суппозиторий и подобные, от около 21 до 7000 мг активного агента.
Оптимальные терапевтически эффективные дозы для введения могут быть легко определены специалистом в области техники и будут варьироваться, в основном, от эффективности препарата, типа введения и распространенности подвергаемого лечению воспалительного состояния или расстройства. Кроме того, факторы, ассоциированные с определенным субъектом, получающим лечение, включая возраст субъекта, массу тела, диету и время введения, приведут к необходимости коррекции дозы до соответствующего терапевтически эффективного уровня.
Преимущества, полученные из применения и способов изобретения, как указано выше, многочисленны и включают возможность предотвращения и лечения практически всех типов воспалительных расстройств.
Неожиданно обнаружено, что применение α-аминоамидов формулы (I), как указано в настоящем описании, не вызывает значительных нежелательных побочных эффектов на желудочно-кишечном уровне, которые обычно вызывают классические противовоспалительные лекарственные средства, например НПВС, такие как индометацин, и ингибиторы COX-2, которые только частично их уменьшают.
Следующие примеры представлены с целью более полно проиллюстрировать предпочтительные варианты воплощения изобретения. Такие примеры не должны никаким образом расцениваться как ограничивающие рамки изобретения, как определено приложенной формулой изобретения.
ПРИМЕРЫ
ПРИМЕР 1. Отек лапы при воспалении, индуцированном каррагенаном
Противовоспалительную активность α-аминоамидных соединений формулы (I) подтверждали на модели воспаления, индуцированного инъекцией каррагенаном у крыс. Было обнаружено, что α-аминоамидные соединения, раскрытые в настоящем описании, являются активными в ингибировании образования отека лапы после инъекции каррагенана и высвобождения вещества Р (SP) in vitro, и поэтому считается, что они являются, в целом, применимыми в качестве противовоспалительных агентов.
Потенциальный противовоспалительный эффект (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамида ("соединение A") исследовали на модели острой воспалительной боли у крыс, индуцированной подподошвенной инъекцией каррагенана. Внутриподошвенная инъекция каррагенана выявляет зависимое от времени увеличение объема лапы.
Методика
Использовали самцов крыс Wistar 175-200 граммов. В левую заднюю лапу вводили 100 мкл каррагенана (2% мас./об. в физиологическом растворе). Соединение A (30 мг/кг), индометацин (5 мг/кг), или контрольный носитель (такой как дистиллированная вода) вводили перорально за 1 час до инъекции каррагенана. Объем лапы измеряли с помощью плетизмометра (Ugo Basile) непосредственно перед (исходный) и через 1, 2, 3, 4 и 5 ч после инъекции каррагенана.
Результаты
В контрольной группе инъекция каррагенана приводила к связанному со временем увеличению объема ипсилатеральной задней конечности на 1,02 мл через 5 ч после инъекции каррагенана. Соединение A (30 мг/кг) предотвращало образование отека лапы во всех рассматриваемых временных точках. Следует отметить, что ингибирование было максимальным через 4 ч после инъекции каррагенана с уменьшением на 40% отека по сравнению с контрольным растворителем. Подобным образом, индометацин (5 мг/кг) был способен предотвращать образование отека лапы, обеспечивая ингибирование на около 50% в той же самой временной точке. Данные представлены в таблице 1.
| Таблица 1Воздействие соединения A (30 мг/кг п/o) и индометацина (5 мг/кг п/o) на объем отека лапы (мл), индуцированного каррагенаном | |||||
| 60' | 120' | 180' | 240' | 300' | |
| Контрольный растворитель | 0,35±0,03 | 0,54±0,04 | 0,72±0,03 | 0,92±0,03 | 1,02±0,04 |
| Соединение A30 мг/кг | 0,19±0,03 | 0,32*±0,03 | 0,44***±0,03 | 0,56***±0,04 | 0,70***±0,05 |
| Индометацин 5 мг/кг | 0,29±0,04 | 0,31*±0,04 | 0,38***±0,05 | 0,45***±0,05 | 0,57***±0,07 |
| Данные выражены как среднее Δмл ± с.о. 13/15 крыс и представляют собой разницу объема отека лапы в различные временные точки после инъекции каррагенана по отношению к исходному объему лапы, измеренному перед лечением. Данные оценивали двухфакторным дисперсионным анализом с последующим тестом Бонферрони. * p<0,05; ***p<0,001 по сравнению с носителем. |
ПРИМЕР 2. Определение высвобождения вещества P (SP) из синаптосом спинного мозга крыс
Методика
Использовали взрослых самцов крыс Sprague-Dawley. После декапитации спинной мозг удаляли и гомогенизировали в сахарозном буфере 0,32 M, pH 7,4. Образцы центрифугировали при 12000 g в течение 20 минут и фракцию синаптосом ресуспендировали в физиологическом буфере. Высвобождение SP из переохлажденных синаптосом спинного мозга индуцировали KCl (35 мМ) и измеряли методом РИА (см. Lee CM. et al. (1980) "The development и application of a novel N-terminal directed substance P antiserum", Life Science 27 (7):535-543).
Результаты
In vitro, соединение A обладало высокой активностью в уменьшении индуцированного высвобождения SP из переохлажденных синаптосом спинного мозга в зависимости от концентрации, в интервале от 0,1 до 30 мкМ с ИК50 2,12 мкМ. SP является одним из веществ, называемых цитокинами, которые являются медиаторами воспаления. SP является главной связью в цепи событий, которая после воздействия вредного фактора на ткани или клетки организма-хозяина приводит к воспалительному повреждению и симптомам воспаления. Способность ингибировать высвобождение SP является важной стадией в уменьшении повреждения и симптомов, связанных с воспалением.
Эквиваленты
Специалист в области техники узнает или будет способным определить с использованием не более чем обычного эксперимента многочисленные эквиваленты специфических методов, описанных в настоящем описании. Такие эквиваленты рассматриваются как находящиеся в рамках настоящего изобретения и охватываются следующей формулой изобретения. Различные замещения, изменения и модификации могут быть сделаны без отклонения от рамок изобретения, как определено формулой изобретения. Например, выбор определенного замещения альфа-аминоамидного соединения формулы (I), или специфических лекарственных форм, считается обычным делом для среднего специалиста в области техники со знанием вариантов воплощения, описанных в настоящем описании. Другие аспекты, преимущества и модификации находятся в рамках изобретения. Содержания всех ссылок, выданных патентов и опубликованных патентных заявок, цитированных на всем протяжении настоящей заявки, являются таким образом включенными в виде ссылки. Соответствующие компоненты и способы таких патентов, заявок и других документов могут быть выбраны для настоящего изобретения и его вариантов воплощения.
1. Применение (S)-(+)-2-[4-(2-фторбензилокси)-бензиламино]пропанамида в качестве противовоспалительного агента.
2. Применение по п.1, где доза противовоспалительного агента составляет в интервале от около 0,3 до около 100 мг/кг массы тела в сутки.
3. Применение по п.1 для уменьшения или предотвращения воспаления, ассоциированного с заболеванием или расстройством, выбранным из группы, состоящей из анкилозирующего спондилита; шейного артрита; фибромиалгии; ювенильного ревматоидного артрита; пояснично-крестцового артрита; остеоартрита; остеопороза; псориатического артрита; ревматического заболевания; ревматоидного артрита; экземы; псориаза; дерматита; солнечных ожогов; воспалительных заболеваний глаз; увеита; конъюнктивита; воспалительных заболеваний легких; астмы; бронхита; язв; гингивита; болезни Крона; атрофического гастрита; gastritis varialoforme; язвенного колита; глютеновой болезни; местного илеита; пептической язвы; воспаления ЖК тракта из-за Helicobacter pylori; воспаления внутренних органов; раздражения мочевого пузыря; цистита; воспалительных неврологических расстройств центральной или периферической нервной системы; рассеянного склероза; и воспалительных невропатий.
4. Фармацевтическая композиция, обладающая противовоспалительной активностью, включающая фармацевтически приемлемое вспомогательное вещество и, в качестве активного агента, (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамид, в количестве, эффективном для уменьшения или предотвращения воспаления.