Способ получения этидия бромистого
Иллюстрации
Показать всеИзобретение относится к способу получения этидия бромистого (3,8-диамино-5-этил-6-фенилфенантридиния бромистого) путем кватернизации 3,8-динитро-6-фенилфенантридина избытком диэтилсульфата с последующим восстановлением полученного 3,8-динитро-5-этил-6-фенилфенантридиния этилсульфата железом при нагревании в смеси 1 н. серной кислоты и 95%-ного этанола, обработкой раствором гидроксида натрия, экстракцией н-бутанолом и обработкой бромистоводородной кислотой. Технический результат - упрощение способа и повышение выхода продукта, который применяется в качестве флуоресцентного красителя, широко используемого в молекулярной биологии, генной инженерии и диагностической медицине.
Реферат
Изобретение относится к органической химии, конкретно к способам получения этидия бромистого (3,8-диамино-5-этил-6-фенилфенантридиния бромистого) -флуоресцентного красителя, широко используемого в молекулярной биологии, генной инженерии и диагностической медицине [1) Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. Пер. с англ. М.: Мир, 1984. 480 с.; 2) Pat. 4683202 US, Int. C1. C12Q 1/68, C12N 15/10, B01L 7/00, C07K 14/795, C07K 14/805. US C1. 435/91.2, 435/317.1, 435/320.1, 536/23.1, 536/24.33. Process for amplifying nucleic acid sequences; 3) Using molecular marker technology in studies on plant genetic diversity, DNA-based technologies. PCR-based technologies Sequence-tagged sites (Microsatellites, SCARs, CAPS, ISSRs), IPGRI and Cornell University, 2003, 38 pp.]. При экспозиции в УФ свете он флуоресцирует оранжевым цветом (590 нм), интенсивность которого многократно усиливается (в 20-25 раз) при его связывании с ДНК и РНК [Karsten U., Wollenberger А. // Anal. Biochem. 1977. V.77. P.464-470], что позволяет обнаруживать нуклеиновые кислоты в клетках и тканях. Современными методами флуоресцентной микроскопии с помощью этидия бромистого можно обнаружить количества ДНК до 2 нанограммов в пробе [Giache V., Pirami L., Becciolini А. // J. Biolumin. Chemilumin. 1994. V.9. N 3. P.329-332].
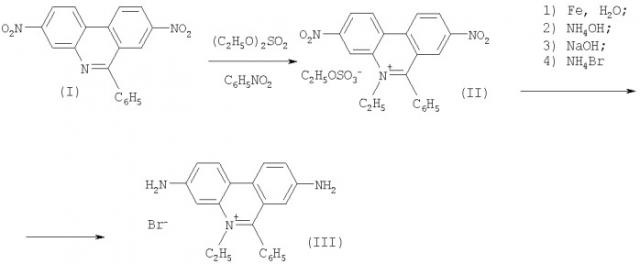
Известен способ синтеза этидия бромистого, первая стадия которого - кватернизация 3,8-динитро-6-фенилфенантридина (I) (2,7-динитро-9-фенилфенантридин по устаревшей номенклатуре) с диэтилсульфатом [Pat. 735438 Brit., CI. 2(3), С2А (3:6:13), С2 В27, C2R (18:19). Improvements in or relating to phenanthridinium salts.] (прототип). Ha этой стадии в качестве растворителя применяли нитробензол, который удаляли далее гидродистилляцией. Для синтезированного с выходом 24% кристаллического продукта кватернизации, названного 2,7-динитро-9-фенил-10-этил-фенантридиний этосульфатом [3,8-динитро-5-этил-6-фенилфенантридиний этилсульфат (II)], в патенте не приведено данных элементного анализа и каких-либо характеристик. На второй стадии синтеза полученный кристаллический продукт кватернизации растворяли в кипящей воде и проводили его восстановление железом при кипячении. Далее осаждали избытком аммиака гидроксид железа (+2), нагревали смесь для коагуляции этого гидроксида и удаляли избыток железа и гидроксид фильтрованием. Затем к реакционной смеси добавляли концентрированный раствор гидроксида натрия. Экстрагировали смесь н-бутанолом, экстракт промывали водой и обрабатывали раствором аммоний бромида. После гидродистилляции бутанола и обработки остатка смесью метанол-вода (1:1, по объему), получали с выходом 84% продукт, названный гемигидратом 2,7-диамино-9-фенил-10-этилфенантридиний бромида [3,8-диамино-5-этил-6-фенил-фенантридиний бромид (III)]. Для этого продукта также не приведено данных элементного состава и каких-либо характеристик. Таким образом, выход этидия бромистого, согласно данным патента, составил 20% в расчете на 3,8-динитро-6-фенилфенантридин (I). Путь синтеза этидия бромистого способом-прототипом приведен на схеме 1.
Схема 1
Недостатком способа-прототипа синтеза этидия бромистого является применение нитробензола в качестве растворителя на первой стадии кватернизации. Применение нитробензола и необходимость его удаления для выделения 3,8-динитро-5-этил-6-фенилфенантридиний этилсульфата (II) - полупродукта для последующей стадии получения этидия бромистого - удорожает процесс и увеличивает время синтеза.
Следующим недостатком способа-прототипа является применение воды для растворения этилсульфата (II) при восстановлении его железом. Гидролиз этилсульфата (II) с образованием трудно растворимых побочных продуктов в этих условиях приводит к снижению выхода и чистоты целевого этидия бромистого на последующих стадиях обработки.
Еще одним недостатком способа-прототипа является применение бромистого аммония на заключительной стадии синтеза, требующее удаления его избытка на стадии выделения целевого продукта.
Задачей изобретения является создание простого, дешевого способа получения этидия бромистого (3,8-диамино-5-этил-6-фенилфенантридиния бромистого), позволяющего получать целевой продукт с высоким выходом.
Задача решается способом, в котором этидий бромистый получают кватернизацией 3,8-динитро-6-фенилфенантридина избытком диэтилсульфата, выступающим в качестве реагента и растворителя, последующим восстановлением полученного 3,8-динитро-5-этил-6-фенилфенантридиний этилсульфата (II) железом при нагревании в смеси 1 н. серной кислоты и 95%-ного этанола, обработкой раствором гидроксида натрия, экстракцией н-бутанолом и обработкой экстракта бромистоводородной кислотой. Выход этидия бромистого составляет 42% [в расчете на 3,8-динитро-6-фенилфенантридин (I)].
Путь синтеза этидия бромистого, представляемый настоящим изобретением, приведен на схеме 2.
Схема 2
Диэтилсульфат выступает в качестве реагента и растворителя на стадии кватернизации, после выделения продукта избыток диэтилсульфата регенерируется вакуумной перегонкой.
Использование смеси 1 н. серной кислоты и 95%-ного этанола на стадии восстановления этилсульфата (II) железным порошком позволяет исключить образование трудно растворимых продуктов его гидролиза.
Использование на заключительной стадии синтеза бромистоводородной кислоты позволяет исключить применение бромистого аммония, требующего удаления его избытка при выделении целевого продукта.
Таким образом, предлагаемый способ более прост и дешев по сравнению с прототипом и позволяет увеличить выход этидия бромистого до 42% [в расчете на 3,8-динитро-6-фенилфенантридин (I)] (в прототипе выход составляет 20%).
Данное изобретение иллюстрируется примерами.
Пример 1. 3,8-Динитро-5-этил-6-фенилфенантридиний этилсульфат (II).
Смесь 121 г (0.351 моля) 3,8-динитро-6-фенилфенантридина (I) и 221 мл (260 г, 1.69 моля) диэтилсульфата нагрели при перемешивании до температуры 165°С и выдержали при 165±2°С в течение 1.5 ч. Наблюдали образование темноокрашенного раствора и выделение газа (этилена). Смесь оставили на 16 ч при 20°С, затем при перемешивании добавили 150 мл абсолютного эфира. Декантировали эфирный слой с образовавшегося вязкого тестообразного продукта, продукт обработали 2×75 мл эфира. К оставшемуся в колбе тестообразному продукту добавили 330 мл 95%-ного этанола и смесь тщательно растерли. Образовавшийся мелкокристаллический продукт отфильтровали, промыли на фильтре 100 мл 95%-ного этанола. Не высушивая, продукт загрузили в бумажный патрон аппарата Сокслета и экстрагировали 4×250 мл 95%-ного этанола кипячением каждый раз по 8 ч. Из объединенных спиртовых экстрактов, оставляемых при 0÷+5°С на 16 ч, отфильтровали игольчатые кристаллы. Их высушили при 120-130°С до постоянного веса. Получили 130 г (74%) этилсульфата (II) в виде мутных выветрившихся игл с т.пл. 203-205°С (с разл., запаянный капилляр), содержание основного вещества по данным ВЭЖХ составляет 98%.
Найдено, %: С 55.49, 55.23; Н 4.18,3.99; N 8.38, 8.27; S 6.75,6.50. C23H21N3O8S. Вычислено, %: С 55.30; Н 4.25; N 8.41; S 6.42.
Спектр ЯМР 1Н (5%-ный раствор в ацетоне-D6, δ /м.д., J/Гц): 0.93 и 1.76 (оба т, по 3 Н, J=7, группы СН3 фрагментов С2Н5О и C2H5N соответственно); 3.55 и 5.27 (оба к, по 2 Н, J - 7, группы СН2 вышеупомянутых фрагментов соответственно); 7.8-8.0 м (3 Н) и 8.1-8.2 м (2 Н) (С6Н5); 8.43 д (1 Н, J=2,5, Н-7 или Н-4); 8.68 д. д (1 Н, J=9 и J=2, Н-2 или Н-9); 8.86 д. д (1 Н, J=9 и J=2.5, Н-9 или Н-2); 9.38 и 9.42 (оба д, по 1 Н, J=9, Н-1, Н-10); 9.44 д (1 Н, J=2, Н-4 или Н-7).
ИК спектр, KBr: 580, 720, 750, 780, 800, 1020, 1225, 1250, 1350, 1390, 1525, 1550, 1620 см1. УФ спектр (EtOH), λмакс/нм (lg ε): 210 (4.47), 260 (4.20) и 325 (4.22).
Из эфирных и спиртовых декантатов и маточных растворов регенерировали эфир, спирт и 147 г диэтилсульфата с т.кип.95-97°С (0.4 КПа). Из бумажного патрона аппарата Сокслета после высушивания при 120-130°С регенерировали 27 г (22%) исходного 3,8-динитро-6-фенилфенантридина (I). С учетом этого регенерированного исходного соединения выход этилсульфата (II) составил 96%.
Пример 2. 3,8-Диамино-5-этил-6-фенилфенантридиний бромид (этидий бромид) (III). К перемешиваемой смеси 49.0 г (0.0981 моля) этилсульфата (II) в 400 мл 1 н. раствора серной кислоты (содержит 0.2 моля H2SO4) прилили 150 мл 95%-ного этанола и затем добавили порциями по 5 г 91.1 г (1.63 грамм-атома) порошка железа. Происходит экзотермическая реакция, окрашивание смеси в темно-красный цвет. После перемешивания в течение 30 мин смесь кипятили 1 ч с обратным холодильником, затем охладили до 25°С и добавили 100 мл 25%-ного аммиака (содержит 1.33 моля NH3). Образуется объемистый осадок. Довели смесь до кипения для коагуляции осадка гидроокиси железа. Горячую смесь фильтровали, промыли осадок шлама 2×50 мл горячей воды (70-90°С). К охлажденному до 25°С фильтрату, объединенному с промывными водами, добавили по каплям при перемешивании свежеприготовленный охлажденный до 25°С раствор 115 г NaOH в 115 мл воды (содержит 2.875 моля NaOH). Смесь экстрагировали 6×100 мл н. бутанола. Экстракт отфильтровали от следов шлама, к фильтрату добавили при перемешивании 12.5 мл 46.5%-ной бромистоводородной кислоты (содержит 0.105 моля НВ2) и затем из смеси отогнали н. бутанол и воду при 60-70°С (4 КПа). Остатки н. бутанола удалили, добавляя 3×50 мл воды и снова удаляя отгонкой. Темный смолообразный остаток растворили в 160 мл метанола при кипячении с обратным холодильником, раствор оставили на 16 ч при 0÷±5°С. Осадок отфильтровали и экстрагировали в аппарате Сокслета 2×250 мл метанола (кипячение каждый раз в течение 8 ч). Из объединенных экстрактов, хранимых при 0÷+5°С, отфильтровали темно-красные кристаллы. После высушивания при 105-110°С (0.4 КПа) получили 22.0 г (57%) этидий бромида (III) в виде темно-красного порошка с т.пл. 261-264°С (с разл.), лит.: т.пл. 260-262°С (с разл.) [Алдрич. Каталог-справочник химических реактивов. 2007-2008. Россия. 2864 с], т.пл. 248-249°С (с разл.) [Watkins T.I. // J. Chem. Soc. 1952. P. 3059-3064]. Содержание основного вещества по данным ВЭЖХ составило 97%. Методом ТСХ (пластинки «Kieselgel 60 F254» фирмы «Merck», система ацетон-метанол-вода-0.1 н. HCl 3:3.5:2.5:1, по объему) для этидия бромида найдено значение Rf=0.78.
Найдено, %: С 63.51, 63.16; Н 5.07, 5.11; N 10.57, 10.46; Br 19.53, 19.75. C21H20BrN3.
Вычислено, %: С 63.96; Н 5.12; N 10.66; Br 20.26.
Спектр ЯМР 1Н (1%-ный раствор в ДМСО-D6, J /м.д., J/Гц): 1.40 т (3 Н, J=7, СН3); 4.47 к (2 Н, J=7, СН2); 5.93 и 6.36 (оба уш. с по 2 Н, 2 группы NH2); 6.27 д (1 Н, 7=2, Н-7); 7.3-7.4 м (2 Н. Н-2, Н-4); 7.53 д. д (1 Н, J=9 и J=2, Н-9); 7.6-7.8 (м, 5 Н, С6Н5); 8.58 и 8.68 (оба д, по 1 Н, J=9, Н-10 и Н-1 соответственно). Отнесения сигналов в спектре ЯМР 1Н сделаны по аналогии с лит.[Firth W.J., Watkins C.L., Graves D.E., Yielding L. W. // J. Heterocycl. Chem. 1983. V.20. N 3. P.759-765].
ИК спектр, KBr: 845, 1260, 1320, 1410, 1470, 1500, 1630 см-1 соответствует спектрам, приведенным в лит.[Firth W.J., Watkins C.L., Graves D.E, Yielding L.W. // J. Heterocycl. Chem. 1983. V. 20. N 3. P.759-765], [The Sadtler Standard Spectra: Infrared Grating Spectra. Philadelphia. 1966-1989. Spectrum N 22,948].
ЭСП (MeOH), λмакс/нм (lg ε): 215 (4.62), 295 (4.80) и 528 (3.85) соответствует спектру, приведенному в лит.[The Sadtler Standard Spectra: Ultraviolet Spectra. Philadelphia. 1966-1968. Spectrum N 28,880].
Способ получения этидия бромистого (3,8-диамино-5-этил-6-фенилфенантридиния бромистого) путем кватернизации 3,8-динитро-6-фенилфенантридина диэтилсульфатом в среде растворителя с последующим восстановлением полученного 3,8-динитро-5-этил-6-фенилфенантридиний этилсульфата железом при нагревании, обработкой раствором гидроксида натрия, экстракцией н-бутанолом и обработкой Br-содержащим неорганическим реагентом, отличающийся тем, что в качестве растворителя при кватернизации используют избыток диэтилсульфата, восстановление железом полученного 3,8-динитро-5-этил-6-фенилфенантридиний этилсульфата проводят в смеси 1 н. серной кислоты и 95%-ного этанола, а в качестве Br-содержащего неорганического реагента используют бромистоводородную кислоту.