Диагностические соединения
Иллюстрации
Показать всеИзобретение относится к конъюгатам формулы (III) или (IIIa), и к их применению в качестве радиофармацевтических средств, к способам их получения и синтетическим промежуточным соединениям, используемым в таких способах. 8 н. и 7 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к новым пептидным соединениям и к их применению для диагностической визуализации с использованием позитронно-эмиссионной томографии (PET). Более конкретно, это изобретение относится к применению таких пептидных соединений в качестве нацеленных векторов, которые связываются с рецепторами, ассоциированными с ангиогенезом, в частности с интегриновыми рецепторами, например αvβ3 интегриновым рецептором. Таким образом, такие соединения могут быть использованы для диагностики или терапии, например, злокачественных заболеваний, сердечных заболеваний, эндометриоза, заболеваний, связанных с воспалением, ревматоидного артрита и саркомы Капоши. Кроме того, оно относится к способам и реагентам для получения таких пептидных соединений.
Применение радиоактивно меченых биоактивных пептидов для диагностической визуализации приобретает большое значение в медицинской радиологии. Биологически активные молекулы, которые селективно взаимодействуют с клетками определенных типов, являются полезными для доставки радиоактивности в ткани-мишени. Например, радиоактивно меченые пептиды обладают важной способностью доставлять радионуклиды в опухоли, инфарктные и инфицированные ткани с целью диагностической визуализации и радиотерапии. 18F, имеющий период полураспада приблизительно 110 минут, является предпочтительным позитронно-эмиссионным нуклидом для визуализационных исследований многих рецепторов. Поэтому меченые 18F биоактивные пептиды имеют значительный клинический потенциал благодаря их применимости в PET для количественного обнаружения и характеристики широкого ряда заболеваний.
Новые кровеносные сосуды могут образовываться посредством двух разных механизмов: васкулогенеза или ангиогенеза. Ангиогенез представляет собой образование новых кровеносных сосудов посредством ветвления существующих сосудов. Первичным стимулом этого процесса может являться недостаточный приток питательных веществ и кислорода (гипоксия) к клеткам ткани. Клетки могут реагировать путем секреции ангиогенных факторов, которых существует множество; одним из часто упоминаемых примеров является васкулярный эндотелиальный фактор роста (VEGF). Эти факторы инициируют секрецию протеолитических ферментов, которые разрушают белки базальной мембраны, а также ингибиторов, которые ограничивают действие этих потенциально вредных ферментов. Другое известное действие ангиогенных факторов заключается в том, чтобы вызывать миграцию и деление эндотелиальных клеток. Эндотелиальные клетки, которые прикреплены к базальной мембране и образуют непрерывный слой вокруг кровеносных сосудов на стороне, противоположной просвету сосудов, не претерпевают митоз. Объединенный эффект от утраты прикрепления и сигналов с рецепторов на ангиогенные факторы заставляет эндотелиальные клетки перемещаться, делиться и перегруппировываться, и наконец синтезировать базальную мембрану вокруг новых сосудов.
Ангиогенез играет важную роль в росте и трансформации тканей, включая заживление ран и воспалительные процессы. Опухоли должны инициировать ангиогенез, когда они достигают миллиметрового размера с тем, чтобы поддерживать свою скорость роста. Ангиогенез сопровождается характерными изменениями в эндотелиальных клетках и их окружении. Поверхность этих клеток трансформируется при подготовке к миграции, и скрытые структуры обнажаются, когда базальная мембрана деградирует, в дополнение к целому ряду белков, которые вовлечены в осуществление и контроль протеолиза. В случае опухолей, полученная в результате сеть кровеносных сосудов является обычно дезорганизованной, сопровождается образованием острых изгибов, а также артериовенозных шунтов. Ингибирование ангиогенеза считается перспективной стратегией противоопухолевого лечения. Трансформации, сопутствующие ангиогенезу, также являются очень многообещающими для диагностики, примером чего является злокачественное заболевание, но данная концепция также является многообещающей при воспалении и ряде заболеваний, связанных с воспалением, включая атеросклероз, причем макрофаги при ранних атеросклеротических поражениях представляют собой потенциальные источники ангиогенных факторов.
Многие лиганды, вовлеченные в адгезию клеток, содержат трипептидную последовательность аргинин-глицин-аспарагиновая кислота (RGD). Последовательность RGD, по-видимому, действует в качестве первичного сайта распознавания для лигандов, презентирующих эту последовательность, и рецепторов на поверхности клеток. Обычно полагают, что вторичные взаимодействия между лигандом и рецептором усиливают специфичность взаимодействия. Эти вторичные взаимодействия могут происходить между группировками лиганда и рецептора, которые находятся непосредственно по соседству с последовательностью RGD, или в сайтах, которые находятся на расстоянии от последовательности RGD.
Для эффективного нацеливания и визуализации in vivo интегриновых рецепторов, связанных с ангиогенезом, следовательно, необходим селективный, высокоаффинный вектор на основе RGD, который является химически устойчивым и стабильным. Кроме того, при конструировании агентов визуализации очень важным фактором является путь выделения с тем, чтобы уменьшить проблемы фона.
В WO 03/006491 описаны пептидные соединения, которые нацелены на интегриновые рецепторы, ассоциированные с ангиогенезом. Однако существует необходимость в дополнительных пептидных соединениях, пригодных для методов диагностической визуализации, таких как PET. В одновременно находящейся на рассмотрении международный заявке на патент PCT/GB 2004/001052 описаны способы, пригодные для введения радиоактивной метки 18F в биологически активные векторы. Но все еще существует необходимость в пептидных соединениях, которые могут быть получены быстро, эффективно и в то же время обладать нужной биологической активностью.
В первом аспекте настоящего изобретения предложен способ радиофторирования, включающий взаимодействие соединения формулы (I):
где вектор содержит фрагмент:
с соединением формулы (II):
где
n представляет собой целое число от 0 до 20;
m представляет собой целое число от 0 до 10;
Y представляет собой водород, С1-6алкил (такой как метил) или фенил, с получением соединения формулы (III):
где m, n и Y являются такими, как определено для соединения формулы (II), и вектор является таким, как определено для соединения формулы (I).
Эту реакцию можно осуществить в подходящем растворителе, например в водном буфере в интервале pH от 1 до 11, удобно от 2 до 11, более удобно от 2 до 6, и при неэкстремальном значении температуры от 5 до 100°С, удобно от 20 до 70°С, предпочтительно при температуре окружающей среды.
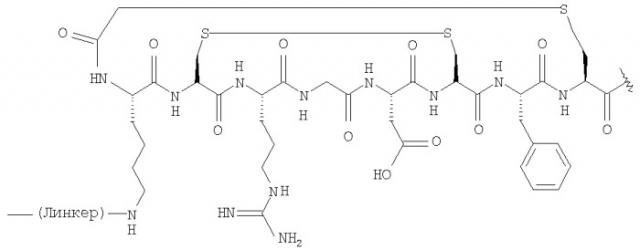
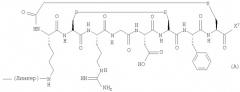
В одном конкретном аспекте, вектор в формуле (I) или (III) имеет формулу(А):
где X7 представляет собой либо -NH2, либо
где а представляет собой целое число от 1 до 10, предпочтительно а равно 1.
Линкер-образующая часть вектора в соединении формулы (I) выбрана так, чтобы обеспечить хорошую фармакокинетику in vivo, например подходящие характеристики выделения полученного в результате конъюгата формулы (III). Использование линкерных групп с разными липофильностями и/или зарядом может значительно изменить in vivo фармакокинетику пептида до подходящей для диагностических целей. Например, когда необходимо, чтобы конъюгат формулы (III) выводился из организма посредством почечной экскреции, используют гидрофильный линкер, а когда необходим гепатобилиарный путь экскреции, используют гидрофобный линкер. Было обнаружено, что линкеры, содержащие полиэтиленгликолевую группировку, замедляют клиренс крови, что в некоторых случаях бывает желательным.
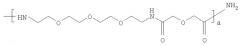
Линкер-образующая часть вектора в соединении формулы (I) представляет собой С1-60гидрокарбильную группу, удобно C1-30гидрокарбильную группу, возможно включающую от 1 до 30 гетероатомов, удобно от 1 до 10 гетероатомов, таких как кислород или азот. Подходящие линкерный группы включают алкильные, алкенильные, алкинильные цепи, ароматические, полиароматические и гетероароматические кольца и полимеры, содержащие полиэтиленгликолевые, аминокислотные или углеводные субъединицы. Предпочтительно, линкер-образующая часть вектора в соединении формулы (I) содержит полиэтиленгликолевую субъединицу, наиболее предпочтительно линкер представляет собой линкер формулы В:
где b представляет собой целое число от 2 до 20, и предпочтительно равно от 3 до 10, наиболее предпочтительно 5.
Термин «гидрокарбильная группа» означает органический заместитель, состоящий из углерода и водорода, такие группы могут содержать насыщенные, ненасыщенные или ароматические части.
Соответственно, предпочтительными соединениями формулы (I) являются соединения формулы (Ia):
где X7 представляет собой либо -NH2, либо
где а представляет собой целое число от 1 до 10, предпочтительно а равно 1, и b представляет собой целое число от 2 до 20 и предпочтительно равно от 3 до 10, наиболее предпочтительно 5.
Предпочтительными соединениями формулы (II) являются те, в которых m равно 0, n равно 0, и Y представляет собой водород.
Соединения формулы (I) и (III) могут быть получены обычными способами пептидного синтеза, например посредством твердофазного пептидного синтеза, например, как описано в Atherton, E. and Sheppard, R.C.; «Solid Phase Synthesis»; IRL Press: Oxford, 1989. Включение аминоксигруппы в соединение формулы (I) может быть достигнуто путем образования стабильной амидной связи, образованной при взаимодействии аминной функциональной группы пептида с активированной кислотой и введенной либо во время, либо после пептидного синтеза.
В другом аспекте настоящего изобретения предложены соединения формулы (I) и (Ia), как они определены выше, применяемые в качестве реагентов, полезных для получения радиоактивно меченых пептидных соединений.
В дополнительном аспекте настоящего изобретения предложены радиоактивно меченые конъюгаты формулы (III) или их соль, как определено выше. Предпочтительными соединениями формулы (III) являются соединения формулы (IIIa):
или их соль, где X7 представляет собой либо -NH2, либо
где а представляет собой целое число от 1 до 10, предпочтительно а равно 1, и b представляет собой целое число от 2 до 20 и предпочтительно равно от 3 до 10, наиболее предпочтительно 5.
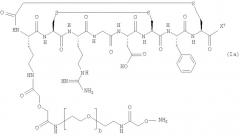
Одно особенно предпочтительное соединение формулы (III) представляет собой:
Подходящие соли соединений формулы (III) и (IIIa) включают фармацевтически приемлемые соли присоединения кислоты, такие как соли, образованные соляной, бромистоводородной, серной, лимонной, винной, фосфорной, молочной, пировиноградной, уксусной, трифторуксусной, янтарной, щавелевой, фумаровой, малеиновой, щавелевоуксусной, метансульфоновой, этансульфоновой, пара-толуолсульфоновой, бензолсульфоновой и изоэтионовой кислотой.
Соединения формулы (II) могут быть получены из соответствующих предшественников формулы (IV):
или их защищенных производных, где L представляет собой уходящую группу, предпочтительно, когда m≥1, L представляет собой пара-толуолсульфонат, трифторметансульфонат или метансульфонат, или галогенид, а когда m равно 0, L представляет собой пара-триалкиламмониевую соль или пара-нитро, и Y, m и n являются такими, как определено для соединения формулы (II); путем взаимодействия с водным [18F]-фторидом, полученном в циклотроне, подходящим образом предварительно активированным выпариванием из основания (например, из тетрабутиламмония или K2CO3/Kryptofix-222), в подходящем растворителе, таком как ацетонитрил, N,N-диметилформамид или диметилсульфоксид, обычно при температуре окружающей среды или при повышенной, например до 140°С, температуре. Альдегидные или кетонные функциональные группы соединений формулы (II) также могут быть быстро получены из их защищенных предшественников, таких как ацетали или кетали, путем простой обработки кислотой с последующим фторированием.
Как показано ниже в анализе конкурентного связывания in vitro, соединения формулы (I) и (Ia) связываются с рецепторами, ассоциированными с ангиогенезом. Эти соединения могут, таким образом, быть полезными для лечения, in vivo диагностики и визуализации заболеваний и состояний, ассоциированных с ангиогенезом.
Термин «заболевания и состояния, ассоциированные с ангиогенезом» включает заболевания и состояния, упоминаемые ниже. В этом отношении также сделана ссылка на WO 98/47541.
Заболевания и состояния, ассоциированные с ангиогенезом, включают различные формы рака и метастаз, например рак молочной железы, кожи, колоректальный рак, рак поджелудочной железы, предстательной железы, легких или яичников.
Другие заболевания и состояния, ассоциированные с ангиогенезом, представляют собой воспаление (например, хроническое воспаление), атеросклероз, ревматоидный артрит и гингивит.
Дополнительные заболевания и состояния, ассоциированные с ангиогенезом, представляют собой артериовенозные мальформации, астроцитомы, хориокарциномы, глиобластомы, глиомы, гемангиомы (детскую, капиллярную), гепатомы, гиперпластические процессы эндометрия, ишемию миокарда, эндометриоз, саркому Калоши, дегенерацию желтого пятна, меланому, нейробластомы, окклюзионное заболевание периферических артерий, остеоартрит, псориаз, ретинопатию (диабетическую, пролиферативную), склеродермию, семиномы и неспецифический язвенный колит.
В настоящем изобретении также предлагается радиофармацевтическая композиция, содержащая эффективное количество (например, количество, эффективное для применения в визуализации in vivo посредством PET) соединения общей формулы (III) или (IIIa), или его соли, как определено выше, вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями.
Предпочтительно воплощение изобретения относится к соединению общей формулы (III) или (IIIa), или его соли, как определено выше, для применения в медицине, в частности, в диагностике или визуализации in vivo, например с помощью PET, заболевания или состояния, ассоциированного с ангиогенезом.
Радиоактивно меченые конъюгаты формулы (III) или (IIIa) могут быть введены пациентам для РЕТ-визуализации в количествах, достаточных для получения нужного сигнала, типичная дозировка радионуклида от 0,01 до 100 мКи, предпочтительно от 0,1 до 50 мКи, наиболее предпочтительно от 1 до 20 мКи, обычно будет достаточной для массы тела 70 кг.
Радиоактивно меченые конъюгаты формулы (III) или (IIIa) следовательно могут быть изготовлены в виде препаратов для введения с использованием физиологически приемлемых носителей или эксципиентов известным специалисту в данной области техники образом. Например, соединения, возможно с добавлением фармацевтически приемлемых эксципиентов, могут быть суспендированы или растворены в водной среде с получением раствора или суспензии, которую затем стерилизуют.
В другом аспекте изобретения предлагается применение радиоактивно меченого конъюгата формулы (III) или (IIIa), или его соли, как определено выше, для изготовления радиофармацевтического средства для использования в способе визуализации in vivo, удобно посредством PET, и предпочтительно для визуализации заболевания или состояния, ассоциированного с ангиогенезом; включающее введение указанного радиофармацевтического средства в организм человека или животного и генерацию изображения по меньшей мере части указанного организма.
В еще одном аспекте изобретения предложен способ in vivo диагностики или визуализации заболевания или состояния, ассоциированного с ангиогенезом, включающий введение радиофармацевтического средства в указанный организм, например в сосудистую систему, и генерацию изображения по меньшей мере части указанного организма, в котором было распределено указанное радиофармацевтическое средство с помощью PET, где указанное радиофармацевтическое средство содержит радиоактивно меченый конъюгат формулы (III) или (IIIa), или его соль.
В еще одном аспекте изобретения предложен способ мониторинга эффекта лечения тела человека или животного лекарственным средством для борьбы с состоянием, ассоциированным с раком, предпочтительно ангиогенезом, например цитотоксическим агентом, причем указанный способ включает введение в указанный организм радиоактивно меченого конъюгата формулы (III) или (IIIa), или его соли, и детекцию захвата указанного конъюгата клеточными рецепторами, предпочтительно рецепторами эндотелиальных клеток и в частности avβ3 рецепторами, причем указанное введение и детекцию возможно, но предпочтительно осуществляют многократно, например до, во время и после лечения указанным лекарственным средством.
В еще одном аспекте настоящего изобретения предложен набор для получения радиоактивного фторированного индикатора, содержащего простетическую группу формулы (II) и соединение формулы (I).
При использовании наборов, соединение формулы (II) будут добавлять к соединению формулы (I) соответственно, которое может быть для удобства растворено в водном буфере (pH 1-11). После взаимодействия при неэкстремальной температуре в течение от 1 до 70 минут меченый пептид можно очистить, например, посредством твердофазной экстракции (SPE) или высокоэффективной жидкостной хроматографии (ВЭЖХ) и собрать.
ПРИМЕРЫ
Изобретение проиллюстрировано примерами, в которых использованы следующие сокращения:
ВЭЖХ: высокоэффективная жидкостная хроматография
NMR: ядерный магнитный резонанс
TFA: трифторуксусная кислота
час(ы): часы
мин: минута(ы)
DMAP: 4-(диметиламино)пиридин
THF: тетрагидрофуран
DCM:дихлорметан
DMF: N,N-диметилформамид
TBAF: тетрабутиламмония фторид
МеОН: метанол
TLC: тонкослойная хроматография
TIS:триизопропилсилан
DMSO: диметилсульфоксид
PBS: фосфатный буферный солевой раствор
РуАОР: [7-азабензотриазол-1-илокситрис(пирролидино)фосфоний-гексафторфосфат]
Вос: трет-бутоксикарбонил
КТ: комнатная температура
Пример 1. Получение трифлата 4-триметиламмония бензальдегида (соединение 1)
Данное соединение синтезировали согласно методике, описанной в Haka et al. (J. Labelled Cpds.&Radiopharms 1989 27(7) 823).
Пример 2. Получение Пептидного предшественника (Соединение 3)
Пептид, Соединение 2, синтезировали, используя стандартный пептидный синтез.
(а) 1,17-Диазидо-3,6,9,12,15-пентаоксагептадекан
Раствор обезвоженного гексаэтиленгликоля (25 г, 88 ммоль) и метансульфонилхлорида (22,3 г, 195 ммоль) в обезвоженном THF (125 мл) хранили в атмосфере аргона и охлаждали до 0°С в бане лед/вода. По каплям в течение 45 мин добавляли раствор триэтиламина (19,7 г, 195 ммоль) в обезвоженном THF (25 мл). Через 1 час охлаждающую баню удаляли, и реакционную смесь перемешивали в течение еще 4 часов. Затем к смеси добавляли воду (55 мл), затем гидрокарбонат натрия (5,3 г, до pH 8) и азид натрия (12,7 г, 195 ммоль). THF удаляли дистилляцией, и водный раствор кипятили с обратным холодильником в течение 24 час (образовались два слоя). Смесь охлаждали, добавляли эфир (100 мл), и водную фазу насыщали хлоридом натрия. Фазы разделяли, и водную фазу экстрагировали эфиром (4×50 мл). Объединенные органические фазы промывали рассолом (2×50 мл) и сушили (MgSO4). После фильтрации и выпаривания растворителя получали 26 г (89%) желтого масла. Продукт использовали на следующей стадии без дополнительной очистки.
(б) 17-Азидо-3,6,9,12,15-пентаоксагептадеканамин
К энергично перемешиваемой суспензии 1,17-диазидо-3,6,9,12,15-пентаоксагептадекана (25 г, 75 ммоль) в 5%-ной HCl (200 мл) добавляли раствор трифенилфосфина (19,2 г, 73 ммоль) в эфире (150 мл) в течение 3 часов при комнатной температуре. Реакционную смесь перемешивали в течение еще 24 часов. Фазы разделяли, и водную фазу экстрагировали дихлорметаном (3×40 мл). Водную фазу охлаждали в бане лед/вода и значение pH доводили до 12 путем добавления твердого гидроксида калия. Водную фазу концентрировали, и продукт извлекали дихлорметаном (150 мл). Органическую фазу сушили (Na2SO4) и концентрировали с получением 22 г (95%) желтого масла. Продукт идентифицировали с помощью масс-спектрометрии с электрораспылением (ESI-MS) (МН+ рассчитано: 307,19; обнаружено 307,4). Неочищенное масло использовали на следующей стадии без дополнительной очистки.
(в) 23-Азидо-5-оксо-6-аза-3,9,12,15,18,21-гексаоксатрикозановая кислота
К раствору 17-азидо-3,6,9,12,15-пентаоксагептадеканамина (15 г, 50 ммоль) в дихлорметане (100 мл) добавляли дигликолевый ангидрид (Acros, 6,4 г, 55 ммоль). Реакционную смесь перемешивали в течение ночи. За реакцией наблюдали с помощью анализа ESI-MS, и добавляли дополнительное количество реагентов для доведения реакции до завершения. Раствор концентрировали с получением желтого осадка, который растворяли в воде (250 мл). Продукт выделяли из водной фазы посредством непрерывной экстракции дихлорметаном в течение ночи. После высушивания и выпаривания растворителя получали выход продукта 18 г (85%). Продукт характеризовали с помощью анализа ESI-MS (МН+ рассчитано: 423,20; обнаружено 423,4). Продукт использовали на следующей стадии без дополнительной очистки.
(г) 23-Амино-5-оксо-6-аза-3,9,12,15,18,21-гескаоксатрикозановая кислота
23-Азидо-5-оксо-6-аза-3,9,12,15,18,21-гексаоксотрикозановую кислоту (9,0 г, 21 ммоль) растворяли в воде (50 мл) и восстанавливали, используя H2(r)-Pd/C (10%). Реакцию продолжали, пока анализ ESI-MS не показал полное превращение в целевой продукт (MH+ рассчитано: 397,2; обнаружено 397,6). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
(д) (Вос-аминоокси)ацетил-PEG(6)-дигликолевая кислота
К раствору дициклогексикарбодиимида (515 мг, 2,50 ммоль) в диоксане (2,5 мл) добавляли по каплям раствор (Вос-аминоокси)уксусной кислоты (477 мг, 2,50 ммоль) и N-гидроксисукцинимида (287 мг, 2,50 ммоль) в диоксане (2,5 мл). Реакционную смесь перемешивали при КТ в течение 1 часа и фильтровали. Фильтрат переносили в реакционный сосуд, содержащий раствор 23-амино-5-оксо-6-аза-3,9,12,15,18,21-гексатрикозановой кислоты (1,0 г, 2,5 ммоль) и N-метиморфолина (278 мкл, 2,50 ммоль) в воде (5 мл). Смесь перемешивали при КГ в течение 30 мин. Анализ ESI-MS показал полное превращение в целевой продукт (МН+ рассчитано: 570,28; обнаружено 570,6).
Неочищенный продукт очищали препаративной ВЭЖХ (колонка: Phenomenex Luna 5µ C18 (2) 250×21,20 мм, детектирование: 214 нм, градиент: 0-50% В в течение 60 мин, где А=H2O/0,1% TFA и В = ацетонитрил/0,1% TFA, скорость потока: 10 мл/мин, с получением 500 мг (38%) чистого продукта.
Продукт анализировали посредством ВЭЖХ (колонка: Phenomenex Luna 3µ C18 (2), 50×2,00 мм, детектирование: 214 нм, градиент: 0-50% В в течение 10 мин, где А=Н20/0,1% TFA и В = ацетонитрил/0,1% TFA, скорость потока: 0,75 мл/мин, Rt=5,52 мин). Дальнейшее подтверждение проведено посредством ЯМР-анализа.
(е) Конъюгация (Вос-аминоокси)ацетил-PEG(6)-дигликолевой кислоты и Соединения 2
(Вос-аминоокси)ацетил-PEG(6)-дигликолевую кислоту (0,15 ммоль, 85 мг) и РуАОР (0,13 ммоль, 68 мг) растворяли в DMF (2 мл). Добавляли N-метилморфолин (0,20 ммоль, 20 мкл), и смесь перемешивали в течение 10 мин. Добавляли раствор Соединения 2 (0,100 ммоль, 126 мг) и N-метилморфолина (0,20 ммоль, 20 мкл) в DMF (4 мл), и реакционную смесь перемешивали в течение 25 мин. Добавляли дополнительное количество N-метилморфолина (0,20 ммоль, 20 мкл), и смесь перемешивали в течение еще 15 мин. DMF выпаривали в вакууме, и продукт переносили в 10%-ную смесь ацетонитрил-вода и очищали с помощью препаративной ВЭЖХ (колонка: Phenomenex Luna 5µ C18 (2) 250×21,20 мм, детектирование: УФ 214 нм, градиент: 5-50% В в течение 40 мин, где А=H2O/0,1% TFA, и В = ацетонитрил/0,1% TFA, скорость потока: 10 мл/мин) с получением 100 мг полуочищенного продукта. После второй стадии очистки, где TFA заменили НСООН (градиент: 0-30% В, в остальном такие же условия, что и выше) получали 89 мг (50%). Продукт анализировали посредством ВЭЖХ (колонка: Phenomenex Luna 3µ C18 (2) 50×2 мм, детектирование: УФ 214 нм, градиент: 0-30% В в течение 10 мин, где А=H2O/0,1% НСООН, и В = ацетонитрил/0,1% НСООН, скорость потока: 0,3 мл/мин, Rt: 10,21 мин). Дополнительное определение параметров продукта проводили с помощью ESI-MS (МН2 2+ рассчитано: 905,4, обнаружено: 906,0).
Пример 3. Хемоселективное лигирование 18F-фторбензальдегида и Соединения 3 с получением Соединения 4
Снятие защиты с пептида 3 проводили путем добавления TFA, содержащей 5% воды, к 10 мг пептида. Пептид со снятой Вос-защитой (5,9 мг, 0,0044 ммоль) в 1 мл воды добавляли к 4-фторбензальдегиду (Соединение 1) (1,1 мг, 0,94 мкл, 0,0089 ммоль) в 1 мл ацетонитрила. pH смеси составляло 3,5. Через 45 минут при 70 градусах смесь очищали дважды с помощью препаративной хроматографии с обращенной фазой (Phenomenex Luna C18 колонка, 00G-4253-N0; растворители: А=вода + 0,1% TFA / В=CH3CN+0,1% TFA, градиент: 10-40% В в течение 30 мин; поток 5,0 мл /мин; детектирование при 214 нм) с получением 2,0 мг (32%) чистого соединения (аналитическая ВЭЖХ: Phenomenex Luna C18 колонка, 00G-4252-E0; растворители: А=вода + 0,1% TFA/В=CH3CN+0,1% TFA, градиент: 10-50% В в течение 20 мин; поток 1,0 мл/мин; время удерживания 16,3 минуты, детектирование при 214 и 254 нм). Дополнительное определение параметров продукта проводили с помощью масс-спектроскопии, получили значение m/z 1437,2 [М-Н+].
Пример 4. Радиосинтез 18F-соединения 4
Способ 1
18F-Фторид (вплоть до 370 МБк) азеотропно сушили в присутствии Kryptofix 222 (5 мг в 0,5 мл ацетонитрила) и карбоната калия (50 мкл 0,1 М раствора в воде) путем нагревания в атмосфере N2 до 110°С в течение 20 минут. В течение этого времени добавляли и выпаривали 3×0,5 мл ацетонитрила. После охлаждения до <40°С добавляли раствор трифлата триметиламмония бензальдегида (1 мг в 0,4 мл DMSO). Реакционный сосуд герметично укупоривали и нагревали до 90°С в течение 15 минут, чтобы осуществить мечение. Между тем, Соединение 3 (6 мг) обрабатывали 5%-ной водой в TFA (200 мкл) в течение 5 минут при КТ. Затем растворители удаляли под вакуумом. Пептид со снятой защитой повторно растворяли в 0,1 М NH4OAc буфере, pH 4 (0,4 мл) и объединяли с 4-18F-фторбензальдегидом в реакционном сосуде. Реакционный сосуд герметично укупоривали и нагревали до 70°С в течение 15 минут для осуществления конъюгации. После охлаждения до комнатной температуры продукт получали посредством препаративной радио-ВЭЖХ (колонка Phenomenex Luna C18(2) 5 мкм 10×100 мм, растворители: А=вода/0,1% TFA и В = ацетонитрил/0,1% TFA; градиент 15-25% В в течение 5 мин; 25% В в течение 12 минут; 25-50% В в течение 10 минут; поток 4,0 мл/мин, УФ-детектирование при 210 и 254 нм). Фракцию продукта разбавляли водой (10 мл) и наносили на картридж SepPak C18-plus (обработанный 10 мл EtOH и 20 мл Н2О). Соединение 4 элюировали этанолом (1 мл). Этанол удаляли под вакуумом, и соединение 4 готовили в виде препарата в PBS.
Способ 2
а) Радиосинтез 18F-фторбензальдегида
18F-фторид (вплоть до 370 МБк) азеотропно сушат в присутствии Kryptofix 222 (5 мг в 0,5 мл ацетонитрила) и карбоната калия (50 мкл 0,1 М раствора в воде) путем нагревания в атмосфере N2 до 110°С в течение 20 минут. В течение этого времени добавляют и выпаривают 3×0,5 мл ацетонитрила. После охлаждения до <40°С добавляют раствор трифлата триметиламмония бензальдегида (1 мг в 0,4 мл DMSO). Реакционный сосуд герметично укупоривают и нагревают до 90°С в течение 15 минут, чтобы осуществить мечение. Неочищенную реакционную смесь охлаждают до комнатной температуры и разбавляют добавлением воды. Смесь пропускают последовательно через ионообменные картриджи (предварительно обработанные этанолом (или ацетонитрилом) и водой) и элюируют смесью ацетонитрил/вода. Элюат концентрируют с использованием С18 Seppak, и трифторбензальдегид элюируют ацетонитрилом.
b) Конъюгация Соединения 3 и 4-18F-фторбензальдегида
Соединение 3 обрабатывают 5%-ной водой в TFA в течение 5 минут при комнатной температуре. Затем растворители удаляют выпариванием под вакуумом. Пептид повторно растворяют в 0,1 М NH4ОAc буфере, pH 4 (0,5 мл) и соединяют с 4-18F-фторбензальдегидом в реакционном сосуде. Реакционный сосуд герметично укупоривают и нагревают до 70°С в течение 15 минут для осуществления конъюгации. После охлаждения до комнатной температуры продукт получают посредством препаративной радио-ВЭЖХ (как описано для способа 1) или с помощью SPE.
Биологические данные
Изучение связывания
Используя препараты клеточных мембран, которые, как известно, экспрессируют αvβ3-интегриновый рецептор, было проведено изучение конкурентного связывания с использованием 125I-эхистатина и меченых F-19 пептидов в качестве конкурирующих лигандов. Были получены кривые связывания, и Ki рассчитывали, используя программное обеспечение PrismTM.
Соединение 4 имело значение Ki 10 нМ.
Биораспределение в опухолях легких Льюис
Мышам (самцы C57BL/6, приблизительно 25 г) подкожно инъецировали во внутреннюю часть правого бедра клетки карциномы легких Льюис (LLC) (0,1 мл, 1×107 клеток/мл в среде). За животными наблюдали в отношении роста опухоли в течение 15 суток, это время было выбрано в процессе разработки модели, так как оно показывает наивысший уровень ангиогенеза.
Для определения биораспределения 18F-соединений, животным-опухоленосителям инъецировали тестируемый продукт (0,1 мл, 5-10 МБк/мл) в виде внутривенного болюса через хвостовую вену. Животных безболезненно умерщвляли через различные промежутки времени после инъекции. Препарировали мышцы, почки, мочу, легкое, печень, желудок, тонкий кишечник, толстый кишечник, щитовидную железу, опухоль и брали образец крови. Препарированные ткани и образцы крови взвешивали и осуществляли подсчеты (система с автоматизированным гамма-счетчиком Wallac). В каждый момент времени исследовали по меньшей мере трех животных. Результаты выражены в виде % и.д. (инъецированная доза) и % и.д. на грамм ткани.
В таблице 1 показано биораспределение Соединения 4 в модели опухоли легких Льюис у мышей. Обобщенные данные за промежуток времени. Усредненные данные (n>3) 5 независимых экспериментов представлены в виде среднего (SD).
| Таблица 1 | |||||
| Время (мин после инъекции) | Кровь % и.д./г | Мышцы % и.д./г | Легкое % и.д./г | Печень % и.д./г | Опухоль % и.д./г |
| 5 | 6,35 | 1,78 | 6,54 | 6,01 | 2,69 |
| (2,34) | (0,57) | (1,71) | (1,03) | (0,53) | |
| 60 | 0,84 | 0,56 | 2,12 | 1,48 | 1,84 |
| (0,39) | (0,23) | (0,90) | (0,65) | (0,45) | |
| 120 | 0,45 | 0,27 | 1,17 | 0,89 | 1,49 |
| (0,13) | (0,07) | (0,28) | (0,29) | (0,32) | |
| Время (мин. После инъекции) | Опухоль: кровь | Опухоль: мышцы | Опухоль: легкое | Опухоль: печень | |
| 5 | 0,48 | 1,62 | 0,45 | 0,46 | |
| 60 | 2,27 | 3,60 | 0,95 | 1,35 | |
| 120 | 3,31 | 5,80 | 1,27 | 1,75 |
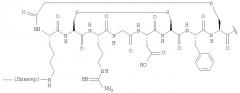
Для сравнения, биораспределение Соединения 5 в модели опухоли легких Льюис у мышей показано в таблице 2. Обобщенные данные за промежуток времени. Усредненные данные (n>3) 5 независимых экспериментов представлены в виде среднего (SD).
| Таблица 2 | |||||
| Время (мин после инъекции) | Кровь % и.д./г | Мышцы % и.д./г | Легкое % и.д./г | Печень % и.д./г | Опухоль % и.д./г |
| 5 | 7,30 | 2,27 | 8,67 | 7,6 | 4,10 |
| (1,3) | (0,6) | (1,4) | (0,9) | (0,9) | |
| 60 | 0,90 | 0,87 | 3,37 | 3,70 | 2,07 |
| (0,2) | (0,3) | (0,5) | (0,9) | (0,3) | |
| 120 | 0,71 | 0,44 | 2,03 | 3,28 | 1,12 |
| (0,2) | (0,1) | (0,4) | (0,9) | (0,3) | |
| Время (мин. после инъекции.) | Опухоль: кровь | Опухоль: мышцы | Опухоль: легкое | Опухоль: печень | |
| 5 | 0,6 | 1,8 | 0,5 | 0,5 | |
| 60 | 2,3 | 2,6 | 0,6 | 0,6 | |
| 120 | 1,6 | 2,6 | 0,6 | 0,3 |
Дополнительная PEG-группировка в соединении 4 придает значительно более благоприятные in vivo характеристики. В особенности, остаточная активность, присутствующая в фоновых тканях, таких как кровь, мышцы, легкое и печень, для соединения 4 через 120 минут значительно меньше, чем для соединения 5. Соответственно соотношения опухоль: фон значительно лучше, что, таким образом, делает визуализацию возможной.
1. Способ радиофторирования, включающий взаимодействие соединения формулы (Ia) где Х7 представляет собой либо -NH2, либо ,где а представляет собой целое число от 1 до 10, предпочтительно а равно 1, и b представляет собой целое число от 2 до 20 и предпочтительно равно от 3 до 10, наиболее предпочтительно 5, ,с соединением формулыс получением соединения формулы (IIIa): где Х7 представляет собой либо -NH2, либо где а представляет собой целое число от 1 до 10, предпочтительно а равно 1, и b представляет собой целое число от 2 до 20 и предпочтительно равно от 3 до 10, наиболее предпочтительно 5.
2. Соединение формулы (Ia): где X7 представляет собой либо -NH2, либо ,где а представляет собой целое число от 1 до 10, и b представляет собой целое число от 2 до 20.
3. Соединение по п.2, где а равно 1.
4. Соединение по п.2, где b представляет собой целое число от 3 до 10.
5. Соединение по п.2, где b равно 5.
6. Соединение формулы (IIIa): ,или его соль, где Х7 представляет собой либо -NH2, либо ,где а представляет собой целое число от 1 до 10, и b представляет собой целое число от 2 до 20.
7. Соединение по п.6, где а равно 1.
8. Соединение по п.6, где b представляет собой целое число от 3 до 10.
9. Соединение по п.6, где b равно 5.
10. Соединение формулы (III), которое представляет собой:
11. Радиофармацевтическая композиция для in vivo диагностики или визуализации заболевания или состояния, ассоциированного с ангиогенезом, содержащая эффективное количество соединения формулы (III) или (IIIa), или его соли, как они определены в любом из пп.6-10, вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями.
12. Соединение формулы (III) или (IIIa), или его соль, как они определены в любом из пп.6-10, для применения в медицине, в частности в диагностике или визуализации in vivo, например, с помощью PET (позитронно-эмиссионной томографии), заболевания или состояния, ассоциированного с ангиогенезом.
13. Применение радиоактивно меченого конъюгата формулы (III) или (IIIa), или его соли, как они определены в любом из пп.6-10, для изготовления радиофармацевтического средства для использования в способе визуализации in vivo, особенно PET, и предпочтительно для визуализации заболевания или состояния, ассоциированного с ангиогенезом; включающее введение указанного радиофармацевтического средства в организм человека или животного и генерацию изображения по меньшей мере части указанного организма.
14. Способ in vivo диагностики или визуализации заболевания или состояния, ассоциированного с ангиогенезом, включающий введение радиофармацевтического средства в указанный организм, например в сосудистую систему, и с помощью PET генерацию изображения по меньшей мере части указанного организма, в котором было распределено указанное радиофармацевтическое средство, где указанное радиофармацевтическое сред