Штамм бактерий pseudomonas aureofaciens вкм в-2500 д для биодеградации полициклических ароматических углеводородов в условиях загрязнения почв арсенитом натрия
Иллюстрации
Показать всеИзобретение относится к биотехнологии и микробиологической промышленности. Штамм бактерий Pseudomonas aureofaciens ВКМ В-2500 Д получен в результате трансформации плазмидой pKSl штамма Pseudomonas aureofaciens BS1393(pBS216) и имеет лабораторный номер Pseudomonas aureofaciens BS1504. Изобретение позволяет осуществить быструю деградацию ПАУ в почвах, при их загрязнении солями никеля, а также защиту растений от токсического воздействия ПАУ и улучшение их роста при культивировании вследствие уменьшения содержания ПАУ в этих почвах за счет биодеградации. 2 ил., 7 табл.
Реферат
Изобретение относится к биотехнологии и микробиологической промышленности и касается получения плазмидосодержащего штамма бактерий, используемого для очистки окружающей среды от полициклических ароматических углеводородов в условиях загрязнения почв арсенитом натрия.
В настоящее время в России очень остро стоит проблема загрязнения почв особо устойчивыми к разложению токсичными соединениями техногенного происхождения. К загрязнителям этого класса относятся органические соединения (нефть, нефтепродукты, полициклические ароматические углеводороды, пестициды), тяжелые металлы и металлоиды, в частности мышьяк.
Полициклические ароматические углеводороды (ПАУ) являются приоритетными загрязнителями вследствие своего повсеместного распространения и отрицательного влияния на живые организмы. ПАУ входят в состав тяжелых фракций нефти (около 5-10%) и попадают в окружающую среду в результате аварийных разливов нефтепродуктов, транспортировки и переработки нефти. Большое количество ПАУ образуется при неполном сгорании органических соединений и постоянно присутствует в выбросах ТЭЦ, коксо-, газо- и нефтехимических производств. В загрязненных почвах содержание индивидуальных ПАУ могут превышать ПДК в десятки, сотни и даже тысячи раз (Juhasz A.L. and R. Naidu. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: a review of the microbialdegradation of benzo[a]pyrene. International biodeterioration and biodegradation. 2000. 45: 57-88). Действие ПАУ на живые организмы связано с их токсичными, мутагенными и канцерогенными свойствами.
В сельском хозяйстве используются эффективные, но очень токсичные и крайне устойчивые к разложению пестициды, в состав которых входят соединения мышьяка. Загрязнение почв соединениями мышьяка представляет серьезную опасность, поскольку, накапливаясь в сельскохозяйственных растениях, данные соединения могут поступать в организм человека и вызывать ряд тяжелых заболеваний.
Все чаще загрязнение окружающей среды носит комплексный характер, обусловленный как присутствием органических токсикантов, так и соединений тяжелых металлов и мышьяка. Наличие высоких концентраций тяжелых металлов и мышьяка в почвах значительно снижает скорость деградации органических загрязнителей (Sandrin T.R. and Maier M. Impact of metals on biodegradation of organic pollutants. Environmental Health Perspectives. 2003. V.111. №8. P.1093-1101).
Известен мультиплазмидный штамм Pseudomonas aeruginosa 123, несущий плазмиды ОСТ, САМ, NAH, способный утилизировать октан, камфору, нафталин и салицилат и используемый при биологической очистке воды от нефти и нефтепродуктов (Авт. св. SU №612958, C02F 3/34, 30.06.1978).
Однако отсутствуют сведения о способности этого штамма деградировать нефть и нефтепродукты в присутствии мышьяка. Кроме того, Pseudomonas aeruginosa относится к микроорганизмам, являющимся патогенными для человека.
Известен патент (патент США №6923914, C02F 3/00, 02.08.2005), в котором описана очистка воды и почвы от тяжелых металлов и мышьяка с помощью углеводород-утилизирующих бактерий различных систематических групп, в том числе бактерий рода Pseudomonas (Pseudomonas putida, Pseudomonas aeruginosa), в присутствии различных углеводородов (алканов, алкенов, алкинов, ароматических углеводородов, полимеров ароматических углеводородов, алифатических углеводородов).
Однако в данном патенте отсутствуют какие-либо сведения об эффективности деградации углеводородов и уменьшении их концентрации в воде и почве.
Наиболее близкими к предлагаемому изобретению являются штаммы бактерий Pseudomonas stutzeri MEV-S1 (Патент RU 2228952, кл. C12N 1/20, 20.05.2004) и Pseudomonas alcaligenes MEV (Патент RU 2228953, кл. C12N 1/20, 20.05.2004), используемые для очистки почв, грунтовых и поверхностных вод от нефти и продуктов ее переработки.
Данные штаммы утилизируют нефть, мазут, дизельное топливо; полициклические ароматические углеводороды (ПАУ), содержащие от 2 до 4 бензольных колец: нафталин, фенантрен, пирен, флуорен; фенол. Они устойчивы к ионам тяжелых металлов: Pb, Zn, Mo, Fe, Cr. Штаммы продуцируют поверхностно-активные вещества (биосурфактанты).
Авторами указанных патентов показано, что данные штаммы могут быть использованы для получения препарата для очистки почвы, грунтовых и поверхностных вод при попадании в окружающую среду нефти и продуктов ее переработки, а также при комбинированном загрязнении углеводородами нефти и металлами: Pb, Zn, Mo, Fe и Cr.
Однако отсутствуют сведения о способности этих штаммов деградировать нефть, нефтепродукты и ПАУ в присутствии мышьяка.
Кроме того, во всех перечисленных аналогах нет сведений о влиянии штаммов на рост и развитие растений.
Фитостимулирующие свойства штаммов являются очень важными при проведении фиторемедиационных технологий, основанных на использовании растений и ассоциированных с растением микроорганизмов для очистки окружающей среды (Назаров А.В., Иларионов С.А. Потенциал использования микробно-растительного взаимодействия для биоремедиации. Биотехнология. 2005, №5, с.54-62).
Задачей изобретения является конструирование плазмидосодержащего штамма бактерий для биодеградации (утилизации) ПАУ в условиях загрязнения почв арсенитом натрия.
Техническим эффектом, который может быть получен при использовании предлагаемого штамма, является быстрая деградация ПАУ в почвах, при их загрязнении арсенитом натрия, а также защита растений от токсичного воздействия ПАУ и улучшение их роста при культивировании вследствие уменьшения содержания ПАУ в этих почвах за счет биодеградации.
Поставленная задача достигается конструированием штамма бактерий Pseudomonas aureofaciens BKM В-2500 Д для биодеградации (утилизации) ПАУ в условиях загрязнения почв арсенитом натрия.
Исходным бактериальным штаммом для получения предлагаемого плазмидосодержащего штамма является штамм бактерий Pseudomonas aureofaciens BS1393, подавляющий рост многих фитопатогенных грибов и бактерий за счет продуцирования антибиотически активных соединений и используемый для получения на его основе препарата для защиты растений (Боронин A.M., Кочетков В.В. Эффективный биофунгицид для защиты растений. Агро XXI. 2003. №1-6, с.64-66).
Штамм Pseudomonas aureofaciens BS1393 был ранее депонирован во Всероссийской коллекции микроорганизмов под номером BKM B-2188 Д.
Этот штамм использован в качестве реципиента для внесения в него плазмид биодеградации и устойчивости к мышьяку по методикам, описанным ранее (Сиунова Т.В., Анохина Т.О., Машукова А.В., Кочетков В.В., Боронин A.M. Ризосферный штамм Pseudomonas chlororaphis, способный к деградации нафталина в присутствии кобальта/никеля. Микробиология. 2007. Т.76. №2, с.212-218).
Предлагаемый сконструированный штамм бактерий Pseudomonas aureofaciens BS1393(pBS216, pKS1) имеет лабораторный номер Pseudomonas aureofaciens BS1503 и депонирован во Всероссийской коллекции микроорганизмов (ИБФМ РАН) под номером Pseudomonas aureofaciens BKM В-2500 Д.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д характеризуется следующими признаками.
Среды культивирования.
Штамм хорошо растет на следующих средах: мясопептонном агаре, LB (бакто-триптон - 10 г/л, дрожжевой экстракт - 5 г/л, хлористый натрий - 10 г/л, рН 7,2), Кинг Б (пептон - 20 г/л, K2HPO4 - 1,5 г/л, MgSO4×7Н2О - 1,5 г/л, глицерин - 10 мл/л), триптозо-соевом агаре (триптозо-соевый экстракт - 30 г/л), минеральной синтетической среде М9 (Na2HPO4 - 6 г/л, KH2PO4 - 3 г/л, NH4Cl - 1 г/л, NaCl - 0,5 г/л, 1М MgSO4 - 2 мл, 1М CaCl2 - 1 мл, глюкоза - 2 г/л), минеральной синтетической среде М9 с нафталином 1-2 г/л в качестве единственного источника углерода и энергии.
Морфология колоний.
Морфологию колоний на питательных средах определяют после 4-5 суток роста при 28°С.
На мясопептонном агаре колонии круглые, гладкие, выпуклые, блестящие, слизистые, желто-оранжевого цвета, однородной структуры. Пигмент зеленый флуоресцирующий, со временем переходящий в желто-оранжевый, диффундирующий в среду.
На LB - круглые с ровными краями, гладкие, выпуклые, непрозрачные, желто-оранжевого цвета, диаметр 4-5 мм, пигмент желто-оранжевый, диффундирующий в среду.
На триптозо-соевом агаре колонии крупнее, интенсивнее окрашены, более интенсивная диффузия в среду пигмента.
На Кинг Б - колонии желто-зеленые, флюоресцирующие, пигмент интенсивный, зеленый, флюоресцирующий, со временем приобретает желто-оранжевую окраску. Со временем в среде образуются игольчатые, оранжевые кристаллы. В жидкой среде Кинг Б в течение суток образуется сильная муть, осадок, зеленый флуоресцирующий пигмент, переходящий на 4-е сутки в желто-оранжевый.
На М9 с нафталином - колонии округлые, слабовыпуклые, непрозрачные, светло-коричневые.
Культурально-морфологические признаки.
Клетки палочковидные, размером (0,6-0,9)×(1,5-2,0) мкм, подвижные, с полярными жгутиками (лофотрих), грамотрицательные, спор не образуют. Очертания концов клеток закругленные. Размеры клеток даны для односуточной культуры, выращенной на мясопептонном агаре при 28°С.
Физиолого-биохимические признаки.
Прототроф. В факторах роста не нуждается. Не накапливает в клетках поли-бета-оксибутират. Синтезирует феназиновые антибиотики, специфичные для вида Pseudomonas aureofaciens. Аргининдигидролаза имеется. Желатину разжижает, молоко пептонизирует, образуя зеленоватый пигмент. Молекулярный азот не фиксирует. Крахмал не гидролизует. Пектиназная активность отсутствует. Нитраты не редуцирует. Оптимальная температура роста 28-30°С. Не растет при 37°С. Значение рН среды: растет в пределах рН среды от 5,5 до 8,0. Оптимальное для роста значение рН 6,8-7,4.
Источники углерода.
Использует в качестве источника углерода глюкозу, фруктозу, трегалозу, маннит, глицерин. Не усваивает арабинозу, ксилозу, рамнозу, галактозу, сорбозу, мальтозу, лактозу, адонит, сорбит, дульцит, инулин.
Из органических кислот усваивает уксусную, муравьиную, молочную, янтарную, фумаровую, пировиноградную, яблочную, бензойную, салициловую. Не усваивает винную, лимонную, щавелевую, глюконовую кислоты.
Использует в качестве источника углерода нафталин, фенантрен.
Энергетические субстраты.
В качестве источников азота хорошо усваивает (NH4)2SO4, NH4NO3, пептон, аланин, аргинин. Слабо усваивает KNO3, аспарагин, тирозин, мочевину.
Отношение к кислороду.
Облигатный аэроб. Нитраты не редуцирует.
Устойчивость к антибиотикам.
Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), триметоприму (100 мкг/мл), хлорамфениколу (100 мкг/мл), карбеницилину (1000 мкг/мл), гентамицину (20 мкг/мл). Чувствителен к канамицину (50 мкг/мл), тетрациклину (20 мкг/мл).
Хромосомная устойчивость к тяжелым металлам.
Штамм обладает исходным уровнем хромосомной устойчивости к цинку, кадмию, хромату. Максимальная толерантная концентрация (МТК) цинка - 1,5 мМ, кадмия - 0,2 мМ, хромата - 0,2 мМ.
Принципиальные физиологические свойства.
Штамм обладает фунгицидными и бактерицидными свойствами. Антагонистическая активность предлагаемого штамма по отношению к фитопатогенным грибам и бактериям не отличается от активности исходного бесплазмидного штамма Pseudomonas aureofaciens BS1393.
Принципиальные специфические продукты.
Штамм синтезирует гетероциклические феназиновые антибиотики (феназин-1-карбоновую кислоту, 2-оксифеназин-1-карбоновую кислоту и 2-оксифеназин), сидерофоры, индолил-3-уксусную кислоту (ИУК).
Устойчивость к мышьяку.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д устойчив к арсениту натрия (NaAsO2) и арсенату натрия (Na2AsO3). Минимальная ингибирующая концентрация (МИК) арсенита натрия - 16 мМ, арсената натрия - 40 мМ.
Генетические признаки.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д содержит природную плазмиду биодеградации нафталина pBS216 (Кочетков В.В., Балакшина В.В., Мордухова Е.А., Боронин A.M. Плазмиды, кодирующие биодеградацию нафталина в ризосферных бактериях рода Pseudomonas. Микробиология. 1997. Т.66. №2, с.211-216) и генетически сконструированную плазмиду устойчивости к мышьяку pKS1, ранее обозначенную как pUCP22::arsRBC (Сизова О.И., Любунь Е.В., Кочетков В.В., Валидов Ш.З., Воронин A.M. Влияние природных и генетически модифицированных ризосферных бактерий Pseudomonas aureofaciens на накопление мышьяка растениями. Прикладная биохимия и микробиология. 2004. Т.40. №1, c.78-82).
Деградацию нафталина (двухкольцевой представитель ПАУ) до метаболитов цикла Кребса обеспечивает предлагаемому штамму nah-оперон плазмиды pBS216. Плазмида pKS1 придает штамму устойчивость к соединениям мышьяка за счет вывода аниона мышьяка из клетки. Таким образом, предлагаемый штамм Pseudomonas aureofaciens BKM В-2500 Д имеет фенотип NAH+ Asr.
Плазмида pKS1, ранее обозначенная как pUCP22::arsRBC, описана в работе Сизовой с соавт. (Сизова О.И., Любунь Е.В., Кочетков В.В., Валидов Ш.З., Воронин A.M. Влияние природных и генетически модифицированных ризосферных бактерий Pseudomonas aureofaciens на накопление мышьяка растениями. Прикладная биохимия и микробиология. 2004. Т.40. №1, c.78-82).
Плазмида устойчивости к мышьяку pKS1 (размер 6920 п.н.) была трансформирована в бактериальный штамм Pseudomonas aureofaciens BS1393(pBS216), содержащий плазмиду биодеградации нафталина pBS216. В результате трансформации был получен штамм Pseudomonas aureofaciens BKM В-2500 Д, устойчивый к мышьяку и способный деградировать нафталин.
Стабильность плазмид биодеградации нафталина pBS216 и устойчивости к мышьяку pKS1 при культивировании данного штамма в неселективных условиях после 7 пассажей составляет около 40% и 5% соответственно.
Генетически сконструированная плазмида устойчивости к мышьяку pKS1 не является стабильной в предлагаемом штамме. Тем не менее в условиях загрязнения ростового субстрата мышьяком наличие данной плазмиды способствует лучшей жизнеспособности предлагаемого штамма и, как следствие, сохранению его деградативных и фитостимулирующих свойств.
Заранее нельзя было ожидать, что при трансформации плазмиды pKS1 в бактериальный штамм Pseudomonas aureofaciens BS1393 (pBS216) обе плазмиды будут одновременно поддерживаться в клетке, поскольку стабильность поддержания плазмид и экспрессия плазмидных генов зависит от видовой принадлежности бактериального штамма-хозяина (Anokhina Т.О., Volkova O.V., Puntus I.F., Filonov A.E., Kochetkov V.V., Boronin A.M. Plant growth-promoting Pseudomonas bearing catabolic plasmids: naphthalene degradation and effect on plants. Process Biochemistry. 2006. V.41. P.2417-2423).
Селективные условия выращивания штамма.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д в присутствии мышьяка выращивают в минеральной среде МП следующего состава, г/л: (NH4)2SO4 - 1, KH2PO4 - 2, K2HPO4 - 1, NaCl - 0,1, NaHCO3 - 0,5. В качестве источника углерода и энергии в среду добавляют глюкозу (2 г/л) или нафталин (1 г/л). Мышьяк в виде соли арсенита натрия (NaAsO2) добавляют в концентрации 5 мМ.
Условия хранения.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д хранят на чашках с минеральной средой М11 с добавлением мышьяка (5 мМ) и нафталина (пары). Пересевы на свежие среды - один раз в месяц. Указанный штамм может храниться не менее 1 года в 15% глицерине при -20°С, не более 5 лет в полужидкой агаризованной среде с мышьяком (5 мМ) под вазелиновым маслом следующего состава: питательный бульон (Difco, США) - 4 г/л, NaCl - 5 г/л, агар - 6 г/л, рН 6,8.
Сведения по биологической безопасности.
Штамм не патогенен для теплокровных животных и человека. Не обладает фитопатогенной активностью, о чем свидетельствует отсутствие мацерации на ломтиках картофеля при нанесении на них уколом живых клеток штамма.
Поскольку большинство ПАУ плохо растворимы в воде, при изучении микробиологической деградации этих соединений в качестве модельного соединения часто используют нафталин, как наиболее биодоступный (водорастворимый) представитель полиароматических углеводородов.
Предлагаемый штамм бактерий Pseudomonas aureofaciens ВКМ В-2500 Д обладает лучшей жизнеспособностью и более высокой скоростью роста в присутствии арсенита натрия и нафталина по сравнению с чувствительным вариантом Pseudomonas aureofaciens BS1393(pBS216).
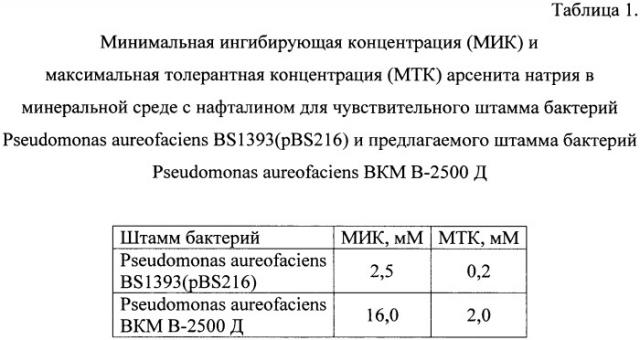
Уровень устойчивости к арсениту натрия в присутствии нафталина у штамма Pseudomonas aureofaciens ВКМ В-2500 Д составляет 16 мМ, что в 6,4 раза выше, чем у чувствительного штамма Pseudomonas aureofaciens BS1393(pBS216) (Таблица 1).
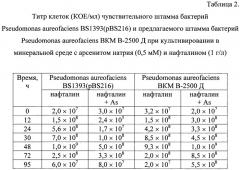
Максимально достижимый титр клеток предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д при периодическом культивировании составляет около 1×109 КОЕ/мл, а чувствительного Pseudomonas aureofaciens BS1393(pBS216) - 5,0×108 КОЕ/мл (Таблица 2). При этом лаг-фаза (время адаптации культуры к новой среде культивирования) составляет 4 ч для предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д, и 24 ч - для чувствительного.
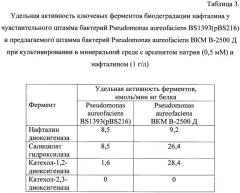
Сохранение активности ферментов биодеградации нафталина у предлагаемого штамма при различных условиях культивирования (наличие или отсутствие солей мышьяка в среде) свидетельствует о способности предлагаемого штамма эффективно деградировать ПАУ в присутствии мышьяка.
Данные, представленные в Таблице 3, показывают, что арсенит натрия не оказывает ингибирующего влияния на активность ключевых ферментов биодеградации нафталина у предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д, за исключением катехол-2,3-диоксигеназы. В присутствии арсенита натрия уровни активности нафталин диоксигеназы у чувствительного Pseudomonas aureofaciens BS1393(pBS216) и предлагаемого Pseudomonas aureofaciens ВКМ В-2500 Д штаммов не отличаются. Активность салицилат гидроксилазы и катехол-1,2-диоксигеназы у предлагаемого штамма в 3 и 18 раз соответственно выше, чем у чувствительного. Активность катехол-2,3-диоксигеназы в обоих штаммах в присутствии мышьяка не регистрируется.
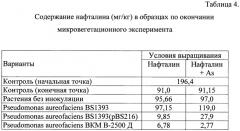
Данные, представленные в Таблице 4, показывают, что инокуляция проростков растений рапса предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2500 Д способствует практически полной деградации нафталина в стерильных условиях при комплексном загрязнении субстрата нафталином и арсенитом натрия. Остаточное содержание нафталина в этом варианте составляет 2,77 мг/кг по сравнению с контролем (91,15 мг/кг нафталина в конце эксперимента).
Таким образом, эффективность деградации в варианте с предлагаемым штаммом бактерий Pseudomonas aureofaciens ВКМ В-2500 Д составляет около 97%, а с чувствительным штаммом бактерий Pseudomonas aureofaciens BS1393(pBS216)-69%.
Рост растений значительно ингибируется в присутствии ПАУ и мышьяка. Инокуляция семян/проростков растений предлагаемым штаммом бактерий Pseudomonas aureofaciens ВКМ В-2500 Д способствует повышению всхожести растений и увеличению их биомассы как в условиях стерильного микровегетационного эксперимента (Таблица 5), так и при выращивании растений в комплексно загрязненной почве (Таблица 6, 7).
Т.е. показано, что наличие в среде культивирования арсенита натрия не препятствует способности предлагаемого штамма деградировать нафталин (один из ПАУ) и положительно влиять на рост растений в почве, загрязненной нафталином, фенантреном и мышьяком.
Ранее Ветровой с соавт. (Ветрова А.А., Нечаева И.А., Игнатова А.А., Пунтус И.Ф., Аринбасаров М.У., Филонов А.Е., Боронин A.M. Влияние катаболических плазмид на физиологические параметры бактерий рода Pseudomonas и эффективность биодеструкции нефти. Микробиология. 2007. Т.76. №3, с.354-360) было показано, что присутствие плазмиды pBS216 в бактериальном штамме Pseudomonas aureofaciens BS1393 (pBS216) способствует его росту на нефти, дизельном топливе и гексадекане. При культивировании штамма Pseudomonas aureofaciens BS1393 (pBS216) на нефти наблюдается значительный прирост биомассы штамма и увеличение степени деструкции нефти.
Поскольку плазмида устойчивости к мышьяку pKS1 обеспечивает рост предлагаемого штамма Pseudomonas aureofaciens BKM В-2500 Д в присутствии мышьяка на различных субстратах, мы предполагаем, что наличие в среде культивирования солей мышьяка не будет препятствовать способности штамма Pseudomonas aureofaciens BKM В-2500 Д деградировать нефть.
Возможность осуществления предлагаемых объектов изобретений подтверждается следующими примерами, но не ограничивается ими.
Пример 1. Получение штамма бактерий Pseudomonas aureofaciens BKM В-2500 Д, устойчивого к мышьяку.
1-й этап. Электротрансформация штамма бактерий Pseudomonas aureofaciens BS1393 плазмидной ДНК pBS216 (85 т.п.н.), придающей штамму Nah+ фенотип.
Штамм бактерий Pseudomonas aureofaciens BS1393 выращивают в 10 мл жидкой среды LB в течение 14-16 ч при 30°С. Дальнейшие манипуляции проводят во льду. Биомассу собирают центрифугированием (5 тыс об/мин, 2-4 мин) и ресуспендируют в охлажденной деионизованной воде. Отмывку повторяют 4 раза и доводят объем суспензии до 100-150 мкл. В кювету для электропорации ("BioRad") вносят 40 мкл клеточной суспензии и 1 мкл раствора ДНК плазмиды pBS216 (концентрация ДНК составляет 0,02-0,1 мкг/мкл).
Условия электротрансформации: напряжение - 1,2 кВ, емкость - 25 пФ, при этом время импульса составляет 4,6 - 5,2 мсек. Трансформированные клетки подращивают 2 ч в жидкой среде LB при 30°С. Биомассу осаждают в режиме 5 тыс об/мин, 2 мин, отмывают 1 раз 0,85% раствором NaCl и всю полученную суспензию клеток высевают на минеральную среду М9 с нафталином в качестве единственного источника углерода и энергии.
Выросшие колонии расчищают на агаризованной минеральной среде М9 с нафталином до отдельных колоний, которые затем анализируют на наличие плазмидной ДНК.
2-ой этап. Электротрансформация штамма бактерий Pseudomonas aureofaciens BS1393(pBS216) плазмидной ДНК pKS1 (размер 6920 п.н.), придающей штамму Arr фенотип.
Подготовку клеток штамма бактерий Pseudomonas aureofaciens BS1393 (pBS216) для электротрансформации проводят, как описано выше для штамма бактерий Pseudomonas aureofaciens BS1393.
Клетки штамма бактерий Pseudomonas aureofaciens BS1393(pBS216) трансформируют плазмидой pKS1, как описано выше. После подращивания клетки высевают на селективную среду Mile добавлением арсенита натрия (5 мМ) и нафталина.
Выросшие колонии анализируют на наличие плазмид pBS216 (85 т.п.н.) и pKS1 (размер 6920 п.н.) общепринятыми электрофоретическими методами. Данные анализа подтверждают, что получен штамм бактерий Pseudomonas aureofaciens ВКМ В-2500 Д.
Пример 2. Физиологические характеристики предлагаемого штамма бактерий Pseudomonas aureofaciens ВКМ В-2500 Д.
Штаммы бактерий Pseudomonas aureofaciens BS1393 (pBS216) и Pseudomonas aureofaciens ВКМ В-2500 Д выращивают на синтетической среде M11 следующего состава, г/л: (NH4)2SO4 - 1, KH2PO4 - 2, K2HPO4 - 1, NaCl - 0,1, NaHCO3 - 0,5. В качестве источника углерода и энергии в среду добавляют нафталин (1 г/л).
Минимальные ингибирующие концентрации (уровень бактериальной устойчивости) и максимальные толерантные концентрации арсенита и арсената натрия для штаммов, использованных в работе, определяют согласно методу, описанному ранее (Подольская В.И., Грузина Т.Г., Ульберг З.Р., Сокловская А.С., Грищенко Н.И. Особенности влияния мышьяка на рост бактерий и АТФ-азную активность плазматических мембран. 2002. Прикладная биохимия и микробиология. Т.38. №1, с.57-62). Используемые концентрации мышьяка лежат в пределах от 0,2 до 20 мМ.
Кинетику роста штаммов определяют общепринятыми микробиологическими методами (Перт С. Основы культивирования микроорганизмов и клеток. М.: Мир, 1978, 336 с.). Культивирование бактерий проводят при 24°С в жидкой среде на качалке (150 об/мин) в колбах Эрленмеера. В колбы вносят по 200 мл минеральной среды Ml 1 и засевают клетками штамма до концентрации 1×107 КОЕ/мл. Мышьяк в виде солей арсенита натрия (NaAsO2) добавляют в концентрации 0,5 мМ. Количество колониеобразующих единиц в мл (КОЕ/мл) определяют, высевая соответствующее разведение культуры на агаризованную среду LB.
Представленные в Таблице 1 результаты показывают, что МИК и МТК мышьяка в минеральной среде для чувствительного штамма Pseudomonas aureofaciens BS1393(pBS216) составляют 2,5 и 0,2 мМ, а для предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д - 16,0 и 2,0 мМ соответственно.
Т.е. устойчивость к мышьяку у предлагаемого штамма бактерий Pseudomonas aureofaciens ВКМ В-2500 Д значительно повышается за счет наличия в нем плазмиды pKS1.
Подсчет количества жизнеспособных клеток в культуральной среде показывает, что мышьяк (0,5 мМ) ингибирует рост чувствительного штамма Pseudomonas aureofaciens BS1393(pBS216). Через 12 ч культивирования в присутствии мышьяка КОЕ уменьшается на два порядка по сравнению с титром клеток при заражении и достигает около 2х105 КОЕ/мл (Таблица 2).
Подсчет количества жизнеспособных клеток предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д в культуральной среде показывает, что через 48 ч культивирования КОЕ возрастает на 2 порядка по сравнению с титром клеток при заражении независимо от условий культивирования (наличие или отсутствие мышьяка в среде) и достигает около 1,0×109 КОЕ/мл.
Таким образом, из данных Таблицы 2 видно, что предлагаемый штамм Pseudomonas aureofaciens ВКМ В-2500 Д обладает лучшими ростовыми характеристиками по сравнению с чувствительным штаммом Pseudomonas aureofaciens BS1393(pBS216) при их культивировании в минеральной среде с нафталином в качестве единственного источника углерода и энергии в присутствии мышьяка.
Пример 3. Удельная активность ключевых ферментов биодеградации нафталина у чувствительного штамма бактерий Pseudomonas aureofaciens BS1393(pBS216) и предлагаемого штамма бактерий Pseudomonas aureofaciens ВКМ В-2500 Д в присутствии арсенита натрия.
Определение активностей ключевых ферментов биодеградации проводят в бесклеточных экстрактах. Для этого штаммы выращивают на синтетической среде МП в присутствии арсенита натрия (0,5 мМ) до оптической плотности 0,3, что соответствует экспоненциальной фазе роста клеток. В качестве единственного источника углерода и энергии используют нафталин (2 г/л). Клетки осаждают центрифугированием (5000 g, 0°C, 10 мин), дважды отмывают 0,05 М калий-фосфатным буфером рН 7,0. Отмытые клетки ресуспендируют в 4 мл 0,05 М калий-фосфатного буфера рН 7,0, замораживают и разрушают на ИБФМ-прессе (Россия) (7 атм). После дезинтеграции клеточный дебрис и неразрушенные клетки удаляют центрифугированием (32000 g, 0°С, 60 мин).
Супернатант немедленно используют в качестве клеточного экстракта для определения активностей ферментов. В реакционную смесь с конечным объемом 3 мл вносят 100-200 мкл экстракта. Определение активностей проводят при 30°С, начиная реакцию внесением клеточного экстракта, на UV-160A спектрофотометре (Shimadzu, Япония).
Активность нафталин диоксигеназы определяют спектрофотометрически по уменьшению экстинкции NADH реакционной смеси, содержащей 100 мкМ NADH и 100 мкМ нафталина (спиртовой раствор), бесклеточный экстракт и 0,05 М фосфатный буфер рН 7,5, учитывая эндогенное потребление NADH бесклеточным экстрактом (λ=340 нм, ε=6,220 мМ-1 см-1) (Dua D. and Meera S. 1981. Purification and characterization of naphthalene oxygenase from Corynebacterium renale. Eur. J. Biochem. 120 (3), 461-465).
Активность салицилат-гидроксилазы определяют спектрофотометрически по уменьшению экстинкции NADH реакционной смеси, содержащий 100 мкМ NADH и 100 мкМ салицилат, бесклеточный экстракт и 0,05 М фосфатный буфер рН 7,5, учитывая эндогенное потребление NADH бесклеточным экстрактом (λ=340 нм, ε=6,220 мМ-1 см-1) (Shamsuzzaman K.M. and Barnsley E.A. 1974. The regulation of naphthalene catabolism in pseudomonads. Biochem. Biophys. Res. Communs. 60, 582-587).
Активность катехол-2,3-оксигеназы определяют по скорости образования 2-гидроксимуконового полуальдегида в реакционной смеси, содержащей 0,5 мМ катехола, бесклеточный экстракт и 0,05 М Трис-HCl буфер рН 7,5 (λ=375 нм, ε=33,4 мМ-1 см-1) (Feist C.F. and Hegeman G.D. 1969. Phenol and benzoate metabolism by Pseudomonas putida of tangential pathways. J. Bacteriol. 100 (2), 869-877).
Активность катехол-1,2-оксигеназы определяют по скорости образования цис-цис-муконата в реакционной смеси, содержащей 5 мМ Na ЭДТА, 1 мМ катехола, бесклеточный экстракт, 0,05 М фосфатный буфер рН 7,0 (λ=260 нм, ε=16,9 мМ-1 см-1) (Hegeman G.D. 1966. Synthesis of the enzymes of the mandelate pathway by Pseudomonas putida. Synthesis of enzymes by the wild type. J. Bacteriol. 91, 1140-1154).
Удельную активность ферментов выражают в микромолях потребленного кофактора или образующегося продукта в минуту на 1 мг общего бактериального белка. Определение концентрации белка проводят спектрофотометрически (Kalb V.F., Bernlohr R.W. 1977. A new spectrophotometric assay for protein in cell extract. Anal. Biochem. 82, 362).
Результаты представлены в Таблице 3.
Арсенит натрия не оказывает ингибирующего влияния на активность ключевых ферментов биодеградации нафталина у предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д. В присутствии арсенита натрия уровни активности нафталин диоксигеназы у чувствительного Pseudomonas aureofaciens BS1393(pBS216) и предлагаемого Pseudomonas aureofaciens ВКМ В-2500 Д штаммов не отличаются. Активность салицилат гидроксилазы и катехол-1,2-диоксигеназы у предлагаемого штамма в 3 и 18 раз соответственно выше чем у чувствительного. Активность катехол-2,3-диоксигеназы в обоих штаммах в присутствии мышьяка не регистрируется.
Пример 4. Оценка деградации нафталина предлагаемым штаммом бактерий Pseudomonas aureofaciens ВКМ В-2500 Д в стерильном микровегетационном эксперименте в присутствии арсенита натрия.
Семена рапса (Brassica napus ssp. oleifera, L.) стерилизуют 10% раствором гипохлорита натрия в течение 60 мин, затем промывают 4 раза стерильной водопроводной водой в течение 2 часов. Семена раскладывают на агаризованную среду Кинг Б и инкубируют 48 ч при 24°С для контроля стерильности семян. Стерильные проростки инокулируют суспензией штаммов, взятых с экспоненциальной фазы роста, плотностью около 108 КОЕ/мл в течение 15 мин.
Выращивание проростков проводят в закрытых пластиковых сосудах размером 77 мм × 77 мм × 97 мм фирмы "Sigma" (Sigma Chemical Co, США) в 150 г песка при влажности 10%. Нафталин вносят в виде пудры до конечной концентрации 200 мг/кг песка и тщательно перемешивают. Арсенит натрия вносят в виде раствора арсенита натрия до конечной концентрации 15 мг/кг песка. Для обеспечения минерального питания растений используют среду Мурашиге-Скуга (Murashige Т. and F. Skoog. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 1962. V.15. P.473-497) без добавления в нее аминокислот и углеводов (Sigma Chemical Co, США). Контролем служат растения, выращенные с добавлением нафталина и без инокуляции.
В один горшок высевают 20 проростков. Растения выращивают со следующим режимом: 12-часовой световой период и 12-часовой темновой период при температуре 20 и 10°С соответственно.
Остаточное содержание нафталина в стерильных модельных системах с растениями определяют на 7 сутки. Для этого все содержимое пластикового сосуда экстрагируют 100 мл метанола в течение суток при периодическом перемешивании. Отбирают 1 мл экстракта и определяют содержание нафталина с помощью ВЭЖХ в следующих условиях: колонка С 18, Nova Pak Waters, система 50% метанол - 50% вода, УФ детектор, 254 нм, скорость протока 1 мл/мин. Расчет концентрации нафталина производят по площади пика по сравнению с площадью пика контрольного образца.
Полученные значения, представленные в Таблице 4, показывают, что инокуляция растений предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2500 Д способствует практически полной деградации нафталина в присутствии арсенита натрия. Остаточное содержание нафталина в этом варианте составляет 2,77 мг/кг по сравнению с контролем (91,15 мг/кг нафталина в конце эксперимента).
Таким образом, эффективность деградации нафталина предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2500 Д составляет около 97%, а чувствительным Pseudomonas aureofaciens BS1393(pBS216) - 69% (т.е. в 1,4 раза выше).
Пример 5. Демонстрация способности штамма бактерий Pseudomonas aureofaciens ВКМ В-2500 Д улучшать рост растений рапса в стерильном микровегетационном эксперименте при комплексном загрязнении модельного субстрата нафталином и арсенитом натрия.
Стерилизацию семян рапса и выращивание проростков проводят, как описано в примере 3. Через 2 суток оценивают всхожесть семян, через 7 измеряют длину стебля.
Полученные данные представлены на Фиг.1 и в Таблице 5.
Нафталин (200 мг/кг) значительно ингибирует рост растений в стерильном микровегетационном эксперименте. Чувствительный штамм бактерий Pseudomonas aureofaciens BS1393(pBS216) и предлагаемый штамм бактерий Pseudomonas aureofaciens ВКМ В-2500 Д, несущие плазмиду биодеградации нафталина pBS216, защищают растения от его негативного воздействия. В присутствии арсенита натрия этот эффект в большей степени сохраняется у предлагаемого штамма Pseudomonas aureofaciens ВКМ В-2500 Д, содержащего плазмиду биодеградации нафталина pBS216 и плазмиду устойчивости к мышьяку pKS1 (Фиг.1).
Т.е. инокуляция проростков рапса предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2500 Д способствует повышению всхожести растений и увеличению их биомассы в стерильном микровегетационном эксперименте при комплексном загрязнении субстрата нафталином и арсенитом натрия (Таблица 5).
Пример 6. Демонстрация способности штамма бактерий Pseudomonas aureofaciens BKM В-2500 Д улучшать рост растений сорго при комплексном загрязнении почвы нафталином, фенантреном и арсенитом натрия.
Для изучения влияния штамма Pseudomonas aureofaciens BKM В-2500 Д на рост растений сорго в комплексно загрязненной почве используют серую лесную почву следующего состава: 91,00% зола, 2,89% С, 1,05% Н, 0,25% N, 0,06% Р, 0,48% Са, 0,14% Mg, 1,20% Fe, 2,47% K, 72,5% SiO2. pH водной вытяжки 7,05. Перед использованием воздушно-сухую почву просеивают через сито с диаметром отверстий 2,0 мм. Почву перемешивают с нафталином (1 г/кг) и фенантреном (0,2 г/кг), вносимыми в виде пудры. Раскладывают по пластиковым горшкам по 400 г. Затем почву поливают водопроводной водой (200 мл) или раствором арсенита натрия до конечной концентрации 50 мг/кг почвы.
В каждый горшок сажают по 6 проклюнувшихся семян сорго сорта «Пищевое». В вариантах с использованием бактерий семена предварительно инокулируют, выдерживая их в суспензии штаммов плотностью 108 КОЕ/мл в течение 1 ч. Для каждого варианта обработки используют 3 горшка.
Растения поливают через 2 суток 100 мл водопроводной воды. Растения выращивают при 12-часовом световом/ темновом периоде при температуре 20°С.
Через 7 суток выращивания оценивают всхожесть семян. Через 30 суток растения извлекают из почвы и измеряют общий сухой вес.
Данные, представленные в Таблице 6 и на Фиг.2, показывают, что инокуляция семян сорго предлагаемым штаммом Pseudomonas aureofaciens BKM В-2500 Д способствует повышению всхожести растений и увеличению их биомассы при комплексном загрязнении почвы нафталином, фенантреном и арсенитом натрия. В комплексно загрязненной почве общий сухой вес неинокулированных растений сорго составляет в среднем 71 мг, а растений, обработанных предлагаемым штаммом Pseudomonas aureofaciens BKM B-2501 Д - 356 мг, таким образом, биомасса увеличивается в 5 раз (Таблица 6).
В результате инокуляции семян сорго предлагаемым штаммом также улучшается всхожесть растений.
Пример 7. Демонстрация способности штамма бактерий Pseudomonas aureofaciens BKM В-2500 Д улучшать рост растений ячменя ярового при комплексном загрязнении почвы нафталином, фенантреном и арсенитом натрия.
Подготовку почвы, внесение загрязнителей, инокуляцию семян ячменя ярового сорта «Зазерский 85» и выращивание растений проводят, как описано в Примере 6.
Данные, представленные в Таблице 7, показывают, что инокуляция семян ячменя ярового предлагаемым штаммом Pseudomonas aureofaciens BKM В-2500 Д способствует повышению всхожести растений и увеличению их биомассы при комплексном загрязнении почвы нафталином (1 г/кг), фенантреном (0,2 г/кг) и арсенитом натрия (50 мг/кг).
Таким образом, показано, что предлагаемый штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д способен деградировать ПАУ в присутствии арсенита натрия. Он разлагает ПАУ в почвах при их загрязнении арсенитом натрия, а также защищает растения от токсичного воздействия ПАУ и улучшает их рост при культивировании на этих почвах.
Штамм не токсичен для растений и может быть использован для создания на его основе специального биопрепарата, предназначенного для защиты и улучшения роста растений, растущих на почвах, загрязненных ПАУ и арсенитом натрия.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д для биодеградации полициклических ароматических углеводородов в условиях загрязнения почв арсенитом натрия.