Способ замедления начальных стадий дифференцировки эмбриональных стволовых клеток млекопитающих, исключая приматов, in vitro
Иллюстрации
Показать всеИзобретение относится к биотехнологии и клеточной биологии. Установлено, что чувствительность ЭСК мыши к клиностатированию возрастает в зависимости от стадий развития клеток: от колоний ЭСК до сформированных ЭТ. Показано, что клиностатирорование ЭТ приводит как к запаздыванию начала кардиомиоцитарной дифференцировки, так и к существенному уменьшению количества сокращающихся кардиомиоцитов. Показана задержка нейрональной дифференцировки на поздних стадиях дифференцировки. Изобретение может найти применение в космической медицине. 2 н.п. ф-лы, 8 ил., 1 табл.
Реферат
Изобретение относится к биотехнологии, клеточной биологии, и может быть использовано для замедления начальных стадий развития культуры эмбриональных стволовых клеток млекопитающих, исключая приматов.
Уровень техники
Эволюционные процессы на Земле осуществляются при постоянном участии гравитационного поля. Известно, что гравитационное поле способствует нормальному развитию и функционированию любой живой системы на Земле. Моделирование влияний гравитационного фактора в лабораторных условиях осуществляется при помощи медленного 2Д-клиностатирования - вращения культуры клеток относительно вектора гравитации в горизонтальном положении с постоянной скоростью, при этом ось вращения находится перпендикулярно вектору гравитации, или ЗД-клиностатирования, когда положение культуры клеток постоянно рандомизируется относительно вектора гравитации [Moore D., 1996; Jack J.W.A. van Loon, 2007].
Большое число экспериментальных данных, выполненных на различных типах клеток, свидетельствуют об их чувствительности к сдвигам гравитационной стимуляции, которые вызывают как структурные изменения, так и изменения функциональной активности клеток [Cogoli А., 1993; Таирбеков М.Г., 2002; Crawford-Young ST., 2006; Буравкова Л.Б., 2008].
Немаловажным являются исследования влияния клиностатирования на развитие, дифференцировку и регенерацию живых организмов [Мелехова О.П. и др., 1976; Оганесян С.С. и др., 1980].
Однако изменения на клеточном уровне, происходящие в условиях как реальной, так и моделированной микрогравитации, не позволяют в настоящее время сформулировать общие закономерности этого воздействия. Поэтому вопрос о влиянии гравитации на клетку и механизмах развивающихся эффектов весьма актуален.
Анализ большого литературного материала показал, что остается открытым вопрос об использовании метода клиностатирования для культивирования эмбриональных стволовых клеток (ЭСК) млекопитающих, клеток, которые находятся на самых ранних этапах развития и дифференцировки. ЭСК характеризуются несколькими весьма важными свойствами: неограниченной способностью к пролиферации при сохранении нормального кариотипа и возможностью дифференцироваться во все известные виды клеток организма [Evans M.J., 1981; Guan К. et al., 1999; Keller G., 2005]. Поэтому ЭСК и сформированные ими эмбриоидные тела (ЭТ) являются адекватной моделью для изучения механизмов, регулирующих начальные стадии как спонтанной, так и индуцированной различными воздействиями дифференцировки клеток.
Культивирование ЭСК без подложки, без добавления фактора, ингибирующего лейкемию, приводит к образованию ЭТ [Doetschman Т.С. et al., 1985; Guan К. et al., 1999], клетки спонтанно дифференцируются в производные трех зародышевых листков. При добавлении мощных специфических индукторов (например, ретиноевая кислота или нейрогенный фактор роста, эпидермальный фактор роста) можно получить направленную дифференцировку по кардиомиоцитарному или нейрональному пути [Strubing С. et al., 1995; Guan К. et al., 1999]. В литературе представлены данные о влиянии на начальные стадии развития ЭСК химических и биологических факторов и практически нет экспериментальных результатов по действию механических факторов на ЭСК.
В уровне техники авторами не обнаружены документы по клиностатированию культур клеток млекопитающих на ранних стадиях развития, приводящему к выраженному изменению в их развитии.
Сущность заявленного изобретения
Клиностатирование культуры клеток не убирает гравитацию, но тестовый образец, помещенный на клиностат, испытывает влияние сниженной силы тяжести. В экспериментах использовали горизонтальный клиностат с частотой вращения 6 об/мин, что соответствует ускорению свободного падения 10-4 g.
Образование ЭТ отражает вступление клеток на начальные стадии дифференцировки, которые могут изменяться под действием различных физических, химических и биологических факторов [Wobus A.M. et al. 1991; Strubing С. et al., 1995; Guan K. et al., 1999; Гордеева О.Ф. и др, 2003]. Оценку способности образовывать клетками ЭТ проводили в период после воздействия клиностатирования (72 ч) в последующих пассажах ЭСК.
Примеры, иллюстрирующие изобретение
В работе использовали ЭСК мыши линии R1. Клетки, культивируемые на подложке из инактивированных митомицином C (5 мкл/мл) эмбриональных фибробластов, подвергали действию клиностатирования (6 об/мин, 72 ч). Для постоянного перемешивания среды культивирования использовали горизонтальный шейкер (60 об/мин) - динамический контроль. Культивирование ЭСК (15-33 пассажи, 150-200 тыс.клеток) осуществляли в CO2-инкубаторе («Sanyo», Япония) при температуре 37°C и 5% CO2 на флаконах 25 см в среде α-МЕМ («ICN», США), содержащей 15% охарактеризованной фетальной сыворотки коровы (FBS) («Нус1оп», США), в количестве, принятом для таких сред, 0,1 мМ 2-меркаптоэтанол, 2 мМ L-глутамин («ICN», США), а также заменимые аминокислоты («ICN», США), нуклеозиды («Sigma» США), витамины («ICN», США), в количестве, принятом для таких сред, антибиотик гентамицин (20 мкг/мл), глюкозу («ICN», США) и 1 мМ пирувата натрия («ICN», США).
Количественный анализ сфотографированных колоний и ЭТ, а также их морфометрия (площадь, периметр, максимальный и минимальный диаметр) были проведены с помощью компьютерной программы SigmaScan Pro5 («Sigma», США).
Для оценки способности образовывать ЭТ, клетки после клиностатирования высевали на чашки Петри (диаметр 35 мм, 200 тысяч клеток) в среде α-МЕМ. Спустя 3-4 суток после посева клеток производили подсчет образовавшихся ЭТ (суспензия 5 мкл, 5 полей).
ЭТ культивировали в условиях клиностатирования (72 ч), пассируя 600 тел в культуральных флаконах 25 см2, в среде α-МЕМ («ICN», США), содержащей все вышеперечисленные добавки. Условия клиностатирования ЭТ не отличались от условий, которые были описаны для культивирования ЭСК на стадии колоний.
Последующую дифференцировку клеток in vitro в кардиомиоциты проводили после 72 ч клиностатирования ЭТ методом регистрации появления сокращающихся кластеров. Подсчет образованных сокращающихся кластеров осуществляли каждые 24 ч при помощи микроскопа и цифровой видеокамеры; делая видеозапись сокращений.
Метод клиностатирования с последующей нейрональной дифференцировкой клеток in vitro проводили иным способом. ЭСК линии R1 (21-25 пассажи) в количестве 100-200 тыс.клеток пассировали на флакон (9,1 см2) в той же среде α-МЕМ. Образованные ЭТ подвергались клиностатированию (48 ч) и впоследствии с каждого флакона (опыт, статический и динамический контроли) высевали на 4-луночные планшеты (8 ЭТ на каждую лунку). Спустя 18 дней проводили иммуноцитохимическое окрашивание антителами против соответствующих нейрональных антигенов.
Обработку результатов образования сокращающихся кластеров кардиомиоцитов и нейронов, а также подсчет апоптотических клеток и полостей внутри ЭТ проводили на основе стандартного пакета статистических программ «Statistica 7.0» для WinXP с использованием непараметрических методов сравнения двух независимых между собой групп (критерий Манна-Уитни) и метода оценки достоверности сдвига в значениях исследуемого признака (критерий Фридмана).
Анализ полученных результатов
В результате подсчета образованных ЭТ (начальной стадии дифференцировки ЭСК) в период после действия метода клиностатирования было обнаружено, что количество сформированных ЭТ в опыте имело тенденцию к уменьшению по сравнению с серией сК.
На основании отсутствия изменений в образовании колоний ЭСК доказано, что метод клиностатирования не оказывает влияния на образование колоний недифференцированными клетками.
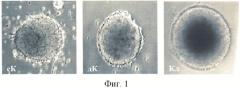
Клиностатирование ЭТ в течение 72 ч in vitro показал наличие разной морфологии ЭТ в трех образцах (сК-статический контроль, дК-динамический контроль и клиностат) (фиг.1). В частности, показано, что клиностатируемые ЭТ за счет постоянного вращения поддерживаются в суспензионном состоянии, и что особенно важно, так это то, как на момент окончания воздействия визуально было обнаружено, что клиностатируемые ЭТ отличались более ровной и округлой формой (фиг.1).
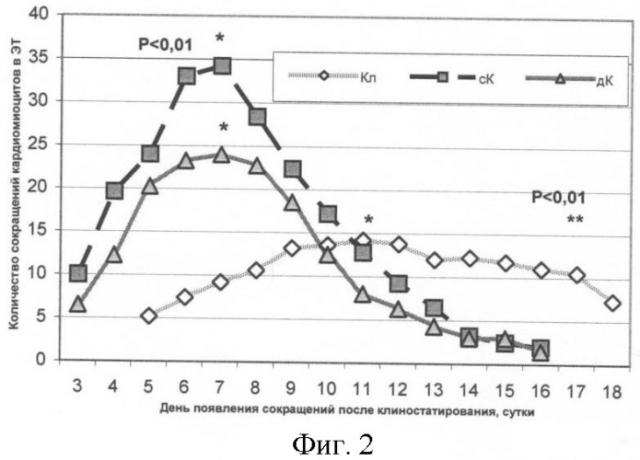
В периоде последействия проводили наблюдение за появлением сокращающихся кластеров кардиомиоцитов. Время сокращений во всех трех группах продолжалось в течение 14 суток (фиг.2). Было отмечено, что в обеих контрольных сериях появление сокращающихся кластеров происходило на 3-й день после завершения эксперимента, в отличие от опыта, где была выявлена задержка на 2 дня. Результаты статистической обработки показали достоверные различия по времени, в течение которого сокращались кластеры кардиомиоцитов в исследуемых группах (фиг.2). Таким образом, после воздействия длительного клиностатирования ЭТ (72 ч) in vitro происходило существенное запаздывание по времени начала дифференцировки ЭСК в ЭТ (p<0,01, по критерию Фридмана).
Максимальное число сокращений в ЭТ для статического и динамического контролей наблюдали на 7-е сутки после клиностатирования (5-й день сокращения), а для клиностатируемых ЭТ на 11-е (7-й день сокращения). Данные других исследователей, описывающие спонтанную дифференцировку ЭСК мыши в кардиомышечном направлении, говорят о появлении первых сокращающихся кластеров на сроках 2-3 суток после прикрепления ЭТ к подложке [Guan et al., 1999; Wei H. et al., 2005], что согласуется с результатами, полученными в контроле.
В результате оценки суммарного количества сокращающихся кластеров в период их максимума было выявлено достоверное отличие всех трех образцов между собой (p<0,01 по критерию Манна-Уитни). Полученные результаты дают основание полагать, что количество сокращений в ЭТ, культивированных в условиях клиностатирования (72 ч), снижено.
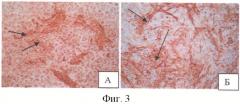
Для подтверждения присутствия в ЭТ кардиомиоцитов было проведено иммуноцитохимическое окрашивание дифференцированных ЭСК антителами к тропонину I - клеточному маркеру, который, как известно, экспрессируется в дифференцированных кардиомиоцитах [Wei Н., et al., 2005]. Из фиг.3 (стрелками указаны окрашенные клетки) видно, что количество предшественников кардиомиоцитов на 18 сутки после клиностатирования больше в контроле, что подтверждает ослабление спонтанной дифференцировки в опыте.
Известно, что одним из направлений дифференцировки ЭСК мыши in vitro является дифференцировка в клетки нервной системы [Guan et al, 1998]. Оценка степени спонтанной нейрональной дифференцировки ЭСК после влияния метода клиностатирования проводилась с помощью антител к специфическим белкам нервных клеток: МАР2 (MAP-microtubule associated proteins) и β-III тубулину. Ранее было показано, что спонтанная дифференцировка в нейрональные клетки происходит через 15-20 суток после прикрепления ЭТ [Striibing С. et al., 1995]. Максимальное количество МАР2-положительных нейронов, дифференцированных из ЭСК мыши in vitro, выявлялось примерно на 18-20 день культивирования [Fraichard A., et al, 1995]. В связи с вышеизложенным, в исследовании иммуноцитохимическое окрашивание ЭСК на специфические белки ((3-Ш тубулин, МАР2) осуществляли через 20 суток после начала культивирования ЭТ.
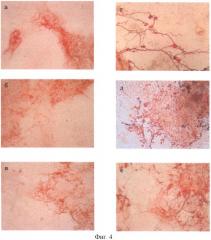
МАР2-положительные и β-III тубулин-положительные нейроны были обнаружены во всех вариантах исследования (опыт, статический контроль - сК и динамический контроль - дК) (фиг.4). Морфологически они представляли клетки с короткими и длинными отростками. Количественный анализ полученных результатов показал, что число β-III тубулин-положительных нейронов в опыте достоверно выше по сравнению с серией сК и сравнимо с серией дК (p<0,05 по критерию Манна-Уитни) (табл.1).
| Таблица 1. | |||
| Количество нейрональных клеток, выявленных на 20-е сутки специфическими антителами к β-III тубулину и МАР2 (в % от сК). | |||
| опыт | сК | дК | |
| β-III тубулин-положительные нейроны | 364±195* n=19 | 100±0 n=12 | 411±58 n=10 |
| МАР2 - положительные нейроны | 65±9* | 100±0 | 122±95 |
| n=16 | n=16 | n=16 | |
| * отличия между опытом и сК; p<0,05. | |||
| n - количество лунок. |
Обнаружение в клиностатируемых культурах большого числа клеток, окрашенных на β-III тубулин, связано с тем, что дифференцировка существенной части ЭСК остановилась на стадии нейробластов, а терминальной стадии дифференцировки достигало значительно меньшее количество клеток. Об этом свидетельствует количество МАР2-положительных клеток в клиностатируемых ЭТ, которое было достоверно снижено по сравнению с серией сК. Была выявлена тенденция к снижению МАР2-положительных клеток в клиностатируемых ЭТ по сравнению с дК (табл.1).
Анализ экспрессии маркера нейрональной дифференцировки - МАР2 позволяет предположить, что постоянное перемешивание среды культивирования незначительно активировало, а условия клиностатирования (48 ч) снижали спонтанную дифференцировку клеток. Очевидным фактом служит то, что ЭТ дольше находились в неприкрепленном состоянии, и как следствие, происходила задержка их последующего развития.
Таким образом, данные, показывающие снижение экспрессии маркеров поздних стадий нейрональной дифференцировки, согласуются с результатами, полученными при изучении спонтанной дифференцировки ЭСК в кардиомиоциты, где было показано уменьшение числа сокращающихся кластеров в ЭТ после культивирования в условиях измененной гравитации. Обнаружение в клиностатируемых культурах большого числа клеток, окрашенных на β-III тубулин может быть связано с тем, что дифференцировка существенной части ЭСК останавливалась на стадии нейробластов, а терминальной стадии дифференцировки достигало значительно меньшее количество клеток. Метод клиностатирования создает условия для определенной задержки дифференцировки ЭСК в нейрональном направлении применительно к поздним стадиям этого процесса.
Анализ полутонких срезов ЭТ (100 срезов) показал, что в опыте клетки внутреннего слоя расположены менее плотно, чем в контроле, и в них можно обнаружить фрагментированные ядра (фиг.5).
При эмбриональном развитии млекопитающих ранним сигналом процессов апоптоза является кавитация, т.е. когда часть клеток эмбриональной эктодермы, уходя в апоптоз, формирует впадину за счет активации процессов аутофагии [Coucouvanis and Martin, 1995; Qu X. et al, 2007]. В экспериментах по изобретению, как можно видеть из фиг.6, в ЭТ контроле в центральной части располагались достаточно большие по размеру пустоты (показано стрелками) по сравнению с ЭТ опытом. Причем вокруг них можно было обнаружить клетки, по морфологическим признакам напоминающие эпителий.
Обнаружено (фиг.7) существенно меньшее количество апоптотических клеток, приходящихся на 1 мм площади среза ЭТ в опыте по сравнению с контролем (p<0,01; критерий Манна-Уитни; ni=24 (опыт), п2=67 (контроль)). При этом относительная площадь полостей в опыте достоверно ниже таковой в контроле (p<0,05; критерий Манна-Уитни; п1=24, п2=70) (фиг.8).
Таким образом, можно сделать вывод, что отсутствие больших полостей при клиностатировании связано с замедлением процесса аутофагии и морфогенеза в ЭТ. Эти изменения могли быть причиной задержки дифференцировки, обнаруженной авторами после клиностатирования.
Используя метод клиностатирования, впервые было установлено, что чувствительность ЭСК к клиностатированию возрастает в зависимости от стадий развития клеток: от колоний ЭСК до сформированных ЭТ. Впервые показано, что клиностатирование ЭТ приводит как к запаздыванию начала кардиомиоцитарной дифференцировки, так и к существенному уменьшению количества сокращающихся кардиомиоцитов. Продемонстрировано, что вращение культуры клеток относительно вектора гравитации приводит к значительному снижению клеток поздних стадий нейрональной дифференцировки.
Новизна
Заявленное изобретение обладает новизной, так как впервые установлено, что чувствительность ЭСК мыши к клиностатированию возрастает в зависимости от стадий развития клеток: от колоний ЭСК до сформированных ЭТ. Впервые показано, что клиностатирорование ЭТ приводит как к запаздыванию начала кардиомиоцитарной дифференцировки, так и к существенному уменьшению количества сокращающихся кардиомиоцитов. Впервые показана задержка нейрональной дифференцировки на поздних стадиях дифференцировки.
Изобретательский уровень
Заявленное изобретение обладает изобретательским уровнем, так как в уровне техники ранее не было показано достоверного влияния клиностатирования на развитие ЭСК мыши на ранних стадиях развития. Кроме того, такое предположение ни коим образом не могло вытекать из существующего уровня техники. Напротив, методики, используемые в предшествующих работах, не показывали никакого достоверного влияния на развитие ЭСК мыши на ранних стадиях развития. Таким образом, заявленное изобретение вносит существенный вклад в существующий уровень техники.
Краткое описание чертежей
На фиг.1 показан внешний вид ЭТ при клиностатировании (увелич.×200): сК - статический контроль, дК - динамический контроль, Кл - опыт.
На фиг.2 показана динамика появления сокращающихся кластеров кардиомиоцитов в ЭТ после остановки клиностатирования: Кл - опыт, сК - статический контроль, дК - динамический контроль.
На фиг.3 показано иммуноцитохимическое окрашивание дифференцированных ЭСК антителами к тропонину I через 18 суток после клиностатирования: А - опыт (×200); Б - контроль (×200). Стрелкой указаны окрашенные клетки.
На фиг.4 показана окраска дифференцированных клеток из ЭТ на специфические маркеры (×200): МАР2: а - сК; б - опыт; в - дК; β-III тубулин: г - сК; д - опыт; е - дК.
На рисунке 5 показаны полутонкие срезы ЭТ (толщина 1-2 мкм). Окраска метиленовым синим-азуром-фуксином: а - контроль; б - опыт (увелич.×400). Толстые стрелки - пустоты и ядра апоптотических клеток. Тонкие стрелки - клетки внешнего слоя.
На фиг.6 показаны полутонкие срезы ЭТ (толщина 1-2 мкм). Окраска метиленовым синим-азуром-фуксином (увелич. × 400): а - контроль; б - опыт. Стрелки - полости кавитации.
На фиг.7 показано число ЭСК мыши, вступивших в апоптоз, в расчете на 1 мм2 площади полутонкого среза ЭТ.
На фиг.8 показана относительная площадь полостей на полутонком срезе ЭТ.
Источники информации
1. Буравкова Л.Б. Проблемы гравитационной биологии клетки // Авиакосмическая и экологическая медицина. 2008. Т.42(6). С.10-18.
2. Гордеева О.Ф., Мануйлова Е.С., Гривенников И.А., Смирнова Ю.А., Красникова Н.Ю., Зиновьева Р.Д., Хрущов Н.Г. Экспрессия регуляторных генов Oct-4, Pax-6, Prox-1, Ptx-2 на начальных стадиях дифференцировки эмбриональных стволовых клеток in vitro. Онкогенез. 2003. Т.34. №3. С.174-182.
3. Гурьева Т.С., Дадашева О.А., Мелешко Г.И., Шепелев Е.Я., Боря К., Сабо В. Эмбриональное развитие перепела в невесомости // Космическая биология и авиакосмическая медицина. 1993. Т. №. С.73-76.
4. Мелехова О.П., Шилейко Л.В., Бурлакова О.В. Клиностатирование зародышей амфибий различного возраста // В сб. Гравитация и организм. 1976.
5. Мелешко Г.И., Шепелев Е.Я., Гурьева Т.С., Бодя К., Сабо В. Эмбриональное развитие птиц в условиях невесомости // Космическая биология и авиакосмическая медицина. 1991. Т 25. №1. С.37-39.
6. Оганесян С.С, Геворкян Р.А., Заминян Т.С., Элоян М.А. Влияние на миокард куриного эмбриона моделированной гравитационной перегрузки // Космическая биология и авиакосмическая медицина. 1980. Т.14. №6. С.54-57.
7. Серова Л. В. Невесомость и приспособительные возможности млекопитающих / М. ИПГМ. 1996. С.128.
8. Таирбеков М.Г. Молекулярные и клеточные основы гравитационной чувствительности // Москва. 2002. 104 С.
9. Cogoli A. The effect of hypogravity and hypergravity on cells of the immune system // J. Leukocyte Biol. 1993. V.54. P.259-268.
10. Coucouvanis E. and Martin G.R. Signals for death and survival: a two-step mechanism for cavitations in the vertebrate embryo // Cell. 1995. V.83. P.297-287.
11. Crawford-Young S. J. Effects of microgravity on cell cytoskeleton and embryogenesis // Int. J. Dev. Biol. 2006. V.50. P.183-191.
12. Doetschman T.C., Eistetter H., Katz M., Schmidt W., Kemler R. The in vitro sevelopment of blastocyst-derived embryonic stem cell lines: formation of visceral yolk sac, blood islands and myocardium // J. Embryol. Exp. Morphol. 1985. V.87. P.27-45.
13. Evans M.J., Kaufman M.H. Establishment in culture of pluripotential cells from mouse embryos // Nature. 1981. V.292. P.154-158. Fraichard A., et al, 1995. Guan K., Rohwedel J., Wobus A. M. Embryonic stem cell differentiation models: cardiogenesis, myogenesis, neurogenesis, epithelial and vascular smooth muscle cell differentiation in vitro II Cytotechnology. 1999. V.30. P.211-226.
14. Jack J.W.A. van Loon. Some history and use of the random positioning machine, RPM, in gravity related research // Advances in Space Research.
15. 2007. №39. P.1161-1165. 15. Keller G. Embryonic stem cell differentiation: emergence of a new era in biology and medicine // Genes & Dev. 2005. V.19. P.1129-1155.
16. Moore D., Cogoli A. Gravitational and spase biology at the cellular level. In Biological and medical reserch in space // An overview of life sciences research in microgravity. Ed. by Moore D., Bie P., Oser H. Springer. 1996. P.1-107. 17. Qu X., Zou Z., Sun Q., Luby-Phelps K., Cheng P., Hogan R.N., Gilpin C.
17. Levine B. Autophagy gene-dependent clearance of apoptotic cells during embryonic development // Cell. 2007. V.128. P.931-946.
18. Striibing C, Ahnert-Hilger G., Jin S., Wiedenmann В., Hesheler J., Wobus A.M. Differentiation of pluripotent embryonic stem cells into the neuronal lineage in vitro gives rise to the mature inhibitory and exciatory neurons // Mech. Dev. 1995. V.53. P.275-287.
19. Wei H., Juhasz O., Li J., Tarasova E.S., Boheler K.R. Embrionic ste, cells and cardiomyocyte differentiation: phenotypic and molecular analyses // J. Cell. Mol. Med. 2005. V.9. №4. P.804-817.
20. Wobus A.M., Wallukat G., Hesheler J. Pluripotent mouse embryonic stem cells are able to differentiate into cardiomyocytes expressing chronotropic responses to adrenergic and cholinergic agents and Ca2+channel blockers // Differentiation. 1991. V.48. P.173-182.
1. Способ замедления начальных стадий дифференцировки культуры эмбриональных стволовых клеток (ЭСК) млекопитающих, исключая приматов, in vitro с последующим их развитием по кардиомиоцитарному пути, включающий следующие этапы:15-33 пассажи, 150-200 тыс.клеток ЭСК, культивируемых на подложке из инактивированных эмбриональных фибробластов, подвергают действию клиностатирования при 6 об./мин в течение 72 ч, культивирование ЭСК осуществляют в СО2-инкубаторе при 37°С и 5% СО2 на флаконах 25 см2 в среде α-МЕМ, содержащей 15% охарактеризованной фетальной сыворотки коровы (FBS), 0,1 мМ 2-меркаптоэтанола, 2 мМ L-глутамина, заменимые аминокислоты, нуклеозиды, витамины, антибиотик гентамицин (20 мкг/мл), глюкозу и 1 мМ пирувата натрия;затем клетки на 3-4 сут. высеивают на чашки Петри в среду α-МЕМ для образования эмбриоидных тел (ЭТ);образовавшиеся ЭТ пассируют по 600 тел на флакон 25 см2 и культивируют в условиях, идентичных условиям культивирования ЭСК на стадии колоний, подвергая клиностатированию в течение 72 ч при 6 об./мин.
2. Способ замедления начальных стадий дифференцировки культуры эмбриональных стволовых клеток (ЭСК) млекопитающих, исключая приматов, in vitro с последующим их развитием по нейрональному пути, включающий следующие этапы:21-25 пассажи, 100-200 тыс.клеток ЭСК, культивируемых на подложке из инактивированных эмбриональных фибробластов, пассируют на флаконы 9,1 см2, культивирование ЭСК осуществляют в СО2-инкубаторе при 37°С и 5% СО2 в среде α-МЕМ, содержащей 15% охарактеризованной фетальной сыворотки коровы (FBS), 0,1 мМ 2-меркаптоэтанола, 2 мМ L-глутамина, заменимые аминокислоты, нуклеозиды, витамины, антибиотик гентамицин (20 мкг/мл), глюкозу и 1 мМ пирувата натрия, до стадии образования эмбриоидных тел (ЭТ);образовавшиеся ЭТ клиностатируют при 6 об./мин в течение 48 ч;затем на 4-х луночный планшет высевают по 8 ЭТ на каждую лунку на 18 дней в среду α-МЕМ, содержащую все необходимые добавки, в условиях, идентичных условиям культивирования ЭСК на стадии колоний.