Способ получения трехмерных матриц для тканеподобных структур из клеток животного происхождения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к способу получения трехмерных матриц для тканеподобных структур из клеток животного происхождения. Данный способ предусматривает ковалентное связывание гистонов с поверхностью предварительно активированных биосовместимых полимерных микросфер из кристаллизованного декстрана. Затем проводят осаждение центрифугированием микросфер с ковалентно связанными гистонами. После чего микросферы, содержащие от 160 до 200 мкг белка на 1,0 г, наносят на поверхность субстрата в количестве от 0,5 до 1,0 мг на 1,0 см2 и высушивают при комнатной температуре. Далее промывают буферным раствором рН 7,5 для удаления несвязанного с субстратом материала. Полученный слой микросфер на поверхности субстрата с нанесенными на него клетками используют в качестве основы для получения тканеподобных клеточных структур. Представленное изобретение позволяет повысить надежность структуры и стабильность белкового слоя трехмерной матрицы, а также упростить и удешевить способ получения трехмерных матриц для тканеподобных структур из клеток животного происхождения. 5 з.п. ф-лы, 11 ил.
Реферат
Изобретение относится к области медицины, в частности к биомедицине, которая включает принципы и методы клеточной биологии и клеточной инженерии, т.е. культивирование клеток на субстратах, модифицированных микроструктурами, содержащими полимерные микросферы и природные катионные белки, а именно гистоны из ткани тимуса телят, и такие субстраты могут быть использованы для культивирования зависимых от прикрепления клеток для получения трехмерных тканеподобных структур.
Создание тканеподобных клеточных структур необходимо для восстановления целостности тканей и органов человека путем их имплантации в зону повреждения. При использовании разных модифицирующих субстратов биологически активных молекул создают матрицы, на которых получают сложные клеточные композиции, специфичные для каждой конкретной ткани. Наряду с этим пространственная структура матрицы имеет большое значение для правильной укладки нанесенных на нее клеток, входящих в формируемую ткань. Покрытие субстрата микросферами с иммобилизованными на их поверхности гистонами может способствовать этому процессу.
Для пояснения свойства белков, в частности гистонов, используемых в изобретении, заявитель считает целесообразным дать их характеристику в приложении к данному описанию (Приложение).
В настоящее время разработаны специальные технологии для конструирования поверхности субстрата с определенной микроконфигурацией (1). Такие поверхности используются, например, при сокультивировании клеток для целей тканевой инженерии (2).
Для конструирования культуральной поверхности с определенной микроконфигурацией используют технику фотолитографии с целью создания желаемой топографии поверхности, содержащей адгезивные и неадгезивные области для клеток (3, 4). Показано, что на такой поверхности субстрата скорость пролиферации и выживание клеток коррелируют с доступностью, количеством и распределением адгезивных островков, а не с фактической адгезивной областью. Для применения данного способа необходима специальная подготовка субстрата.
Наряду с топографической модификацией поверхности широко используют различные полимерные материалы и составы для покрытия поверхности субстрата с целью иммобилизации белков и пептидов, которые способствуют высокоспецифическому взаимодействию клеток с лигандом на носителе.
Известен состав (5) для покрытия, включающий водорастворимый полимер, химически связанный с адгезивным для клеток пептидом, который предназначен для покрытия поверхности культурального сосуда или носителей для культивирования животных клеток в суспензии в бессывороточной среде. Однако он не обеспечивает получения надежной структуры.
Известен состав (6), содержащий адгезивные для клеток белки, ковалентно связанные с поверхностью субстрата для клеточного культивирования с целью улучшения клеточного прикрепления и стабилизации клеточного роста. Однако такой состав дорогостоящий.
Известен состав (7) для покрытия субстратов ростовыми факторами для стимуляции роста эукариотических клеток. Однако данный состав не позволяет получить стабильный белковый слой.
Известен состав (8) для покрытия, содержащий поли-L-лизин в солевом растворе для покрытия поверхности таких субстратов, как пластик, стекло или микропористые волокна. Данный способ, как и способ (7), не позволяет получить стабильный белковый слой, что является необходимым условием для создания тканеподобных структур.
Известен способ покрытия культуральной поверхности положительно заряженными белками (9), который является наиболее близким по технической сущности к предлагаемому изобретению и выбран в качестве прототипа. В известном способе на поверхность культурального сосуда наносят суммарный гистон из ткани тимуса телят (Sigma IIA). На такой культуральной поверхности субстрата, содержащей адсорбированные белки, клетки клонируют в среде с минимальным количеством сыворотки.
Недостатками известного способа являются ненадежность структуры и нестабильность белкового слоя, что не позволяет эффективно и надежно создавать тканеподобную структуру. Указанные недостатки обусловлены тем, что использование субстрата с адсорбированным белковым слоем не обеспечивает стерического соответствия адгезивных белков и адгезионных рецепторов на поверхности клетки и имеется вероятность открепления от субстрата адсорбированных пистонов и их переход в культуральную среду и интернализации гистона клетками, прикрепленными к субстрату.
Предлагаемое изобретение лишено указанных недостатков благодаря осуществлению топографической модификации поверхности при нанесении на нее биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм с иммобилизованными на их поверхности адгезивными для клеток положительно заряженными гистонами.
Техническим результатом предлагаемого изобретения являются повышение надежности структуры и стабильности белкового слоя трехмерной матрицы, упрощение и удешевление способа ее получения на поверхности субстрата, используемого в дальнейшем в качестве основы для получения тканеподобных клеточных структур, за счет адсорбции биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм, с иммобилизованными на их поверхности гистонами, на поверхности субстрата, что обеспечивает эффективное прикрепление клеток к микросферам и имеет ряд преимуществ, которые обусловлены, в основном, тем, что:
- физическая адсорбция микросфер - менее сложный процесс, чем химическая модификация поверхности;
- получение микросфер с модифицированной поверхностью дешевле и может иметь промышленный масштаб по сравнению с химическим присоединением белков к поверхности;
- требуется небольшое количество микросфер для покрытия достаточно большой поверхности субстрата по сравнению с традиционными сферическими микроносителями, диаметр которых от 100 до 250 мкм.
- предотвращается переход чужеродного белка из субстрата в культуральную среду, что исключает возможность ингибирования роста клеток.
- микросферы могут быть использованы для топографической модификации поверхности субстрата с целью создания трехмерных матриц, которые с нанесенными на них клетками являются основой для формирования тканеподобных клеточных структур, а также могут быть использованы для сокультивировании клеток для целей тканевой инженерии и в качестве моделей in vitro для масштабного скрининга лекарственных средств и биологически активных веществ.
Технический результат достигается тем, что известном способе клонирования клеток, который включает известные и общие с заявленным новым способом признаки, используют иммобилизацию гистонов из ткани тимуса телят на поверхности субстрата, адсорбцию гистонов на поверхности субстрата, удаление неадсорбированного белка, оценку способности прикрепления, распластывания, морфологического состояния и скорости роста клеток при культивировании на модифицированной гистонами поверхности субстрата, в предлагаемом способе поверхность субстрата топографически модифицируют микросферами, покрытыми гистонами, причем используемые гистоны предварительно ковалентно связывают с поверхностью биосовместимых полимерных микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм, причем перед ковалентным связыванием гистонов проводят активацию микросфер, которую осуществляют добавлением к водной суспензии микросфер сшивающего агента, в качестве которого используют бромциан при концентрации не более 0,42 моль/л, при температуре не более 4°С и времени инкубации не более 2 мин, затем активированные микросферы осаждают при центрифугировании и осадок промывают дистиллированной водой и повторно центрифугируют, после чего проводят повторное суспензирование микросфер в растворе гистона при весовом соотношении белка и микросфер, равном 1:100, а реакцию ковалентного связывания осуществляют при рН 7,5-8,0, температуре не более 4°С, времени инкубации не более 2 ч, затем микросферы с ковалентно связанными гистонами осаждают центрифугированием, после чего микросферы, содержащие от 160 до 200 мкг белка на 1,0 г, наносят на поверхность субстрата в количестве от 0,5 до 1,0 мг на 1,0 см2 и высушивают при комнатной температуре, затем промывают буферным раствором рН 7,5 для удаления не связанного с субстратом материала, а полученный слой микросфер на поверхности субстрата с нанесенными на него клетками используют в качестве основы для получения тканеподобных клеточных структур. Помимо этого требуемое количество иммобилизованного белка определяют аминокислотным анализом. При этом за оптимальное количество иммобилизованного гистона принимают 180 мкг белка на 1,0 г микросфер. Для иммобилизации выбирают комбинации различных типов гистонов и их ковалентные конъюгаты. В частности, выбирают суммарный гистон, коровые гистоны и их ковалентные конъюгаты. При этом клетки культивируют в бессывороточной среде с ростовыми добавками.
В предлагаемом изобретении для топографической модификации поверхности культуральных сосудов используют биосовместимые полимерные микросферы, приготовленные из кристаллизованного декстрана диаметром не более 1,0 мкм, и положительно заряженные белки, выбранные из группы, содержащей гистоны H1, Н2А, Н2В, Н3, Н4, комбинации различных типов гистонов, перекрестно сшитые конъюгаты различных типов гистонов.
Заявленный способ был апробирован в лабораторных условиях на базе Санкт-Петербургского государственного университета и Института цитологии РАН СПб. Результаты проведенных исследований поясняются следующими примерами (более подробные пояснения лабораторных испытаний с описанием прилагаемых фигур приведены в приложении к данному описанию):
Пример 1.
Получение гистонов и микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм и химическое связывание гистонов с микросферами осуществляют следующим образом. Препараты суммарного гистона сернокислого из ткани тимуса телят получают известным способом (10). Препараты коровых гистонов, содержащие в своем составе гистоны Н2А, Н2В, Н3, Н4, получают из суммарного гистона (11). Препараты отдельных фракций гистонов получают при хроматографическом разделении препарата коровых гистонов (11).
Электрофоретический анализ препаратов гистонов проводят в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) по методу Томаса и Коррнберга (12). Электрофорез в полиакриламидном геле в присутствии ДСН при высоком значении рН системы позволяет фракционировать белки в зависимости от их молекулярной массы. В присутствии ДСН фракции гистонов могут быть разделены в порядке их возрастающей подвижности: H1, Н3, Н2В, Н2А, Н4. Растворимые ковалентные конъюгаты суммарного и коровых гистонов получают при использовании метода перекрестного связывания (13). Получение растворимых ковалентных конъюгатов суммарного гистона осуществляют следующим образом.
Суммарный гистон конъюгируют при использовании метода перекрестного связывания. Образец суммарного гистона в количестве 20 мг растворяют в фосфатно-солевом буферном растворе рН 7,5 до конечной концентрации 2 мг/мл и диализуют против 0,2 М натрия тетраборнокислого, подкисленного до рН 9,0 концентрированной соляной кислотой. Диализ проводят в течение 18 ч при температуре 4°С. Реакцию конъюгирования проводят при использовании в качестве сшивающего агента диметилсуберимидат гидрохлорида до конечной концентрации 5 мг/мл и реакцию проводят в течение 30 мин при температуре 23°С при перемешивании раствора на магнитной мешалке. Реакцию останавливают добавлением равного объема 1,0 М моноэтаноламина, рН 8,0. Раствор инкубируют в течение 2 ч при температуре 23°С, подвергают диализу против дистиллированной воды, как описано выше, замораживают и высушивают сублимацией.
Перекрестно сшитые конъюгаты суммарного гистона анализируют электрофорезом в ДСН - 15% ПААГ, рН 8,8.
Электрофоретический анализ перекрестно сшитых конъюгатов суммарного гистона показывает, что ковалентные конъюгаты суммарного гистона содержат в своем составе димеры и олигомеры гистонов.
Традиционные сферические микроносители, полученные на основе полистирола, сефадекса, полиакриламида, коллагена и желатина, используются для размножения адгезивных клеток в суспензии и в качестве компонента структурной матрицы для прикрепления клеток в монослойной культуре. К таким сферическим микроносителям, в частности, относятся перекрестно сшитые декстрановые гранулы, покрытые коллагеном (Cytodex 3; Pharmacia, Uppsala, Sweden) диаметром от 100 до 250 мкм (14). Рост клеток на их поверхности происходит так же, как в монослое, который модифицирован только радиусом кривизны сферических поверхностей различного диаметра. Микроносители на основе перекрестно сшитого декстрана имеют крупные поры и подвержены сжатию, что затрудняет сбор продуктов, которые секретируются в культуральную среду (15).
Кроме того, ковалентная сшивка цепей декстрана в значительной мере изменяет структуру и химическую стабильность микроносителей. Поэтому перекрестно сшитые биодеградируемые микроносители при их распаде образуют продукты, токсичные для жизнедеятельности клеток. Сферические микроносители, площадь поверхности которых значительно превышает размер распластанной клетки, не обеспечивают стерического соответствия для взаимодействия адгезивных для клеток белков с адгезионными клеточными рецепторами. Получение микросфер на основе кристаллического декстрана осуществляют по способу Шредера (16). Этот способ основан на кристаллизации полисахаридов в эмульсионной среде под действием осадителя - ацетона. Для получения микросфер 500 мг декстрана с молекулярной массой 500000 и 500 мг декстрана с молекулярной массой 10000 растворяют в 0.5 мл воды и добавляют 5 мл эмульсионной среды (хлопковое масло). Эмульсию обрабатывают ультразвуком при мощности 50 Вт в течение 30 сек. Затем гомогенную суспензию по порциям вносят в ацетон (300 мл), содержащий 0.1% Твин-80, при перемешивании на магнитной мешалке. Полученные микросферы промывают ацетоном (3×50 мл) и дистиллированной водой (4×50 мл) при центрифугировании и высушивают при комнатной температуре.
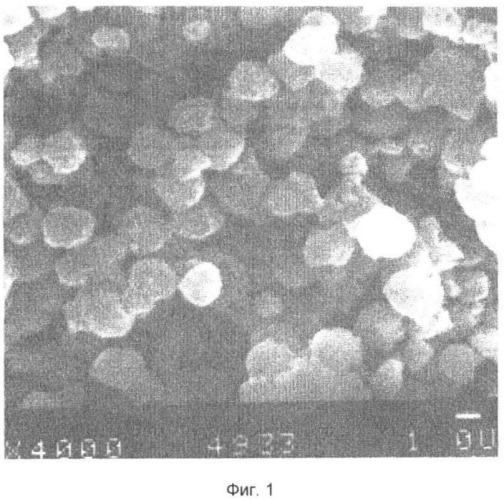
Образцы микросфер из кристаллизованного декстрана анализируют с использованием электронной микроскопии при их нанесении на поверхность стекла.
Для этого стандартные образцы стекла обрабатывают смесью этанол-эфир (в равных объемах) в течение 1 ч и выдерживают при 500°С в течение 1 ч.
Поверхность стекла покрывают водной суспензией микросфер и высушивают при комнатной температуре.
Результаты электронной микроскопии представлены на фиг.1-3. Показано, что микросферы имеют средний диаметр 1,0 мкм и формируют однородный слой на поверхности стекла. Слой микросфер на поверхности стекла устойчив к действию культуральной среды при длительном хранении.
В предпочтительном варианте осуществления предлагаемого изобретения топографическую модификацию поверхности культуральных сосудов проводят полимерными микросферами из кристаллизованного декстрана диаметром 1,0 мкм, ковалентно связанными с суммарным гистоном.
Ковалетное связывание суммарного гистона с микросферами осуществляют следующим образом.
Образец микросфер из кристаллизованного декстрана в количестве 100 мг промывают ацетоном и осаждают центрифугированием. После центрифугирования микросферы суспензируют в 1.0 мл дистиллированной воды и помещают в ледяную баню. Перед иммобилизацией гистона на поверхности микросфер проводят предварительную активацию микросфер сшивающим агентом, в качестве которого выбирают бромциан. Активацию проводят в присутствии триэтиламина для связывания выделяющейся в ходе активации бромисто-водородной кислоты. Для этого к суспензии микросфер добавляют 50 мг бромциана до конечной концентрации 0,42 моль/л и 0.1 мл триэтиламина до конечной концентрации 0,64 моль/л при интенсивном перемешивании и выдерживают в течение двух минут. Активированные микросферы промывают ацетоном шесть раз (6×12 мл) и два раза дистиллированной водой (2×12 мл) при центрифугировании. После последнего центрифугирования к активированным микросферам добавляют 1.0 мл 0,1% раствора суммарного гистона в фосфатно-солевом буфере рН 7,5. Полученную вторичную суспензию микросфер при весовом соотношении белка и микросфер, равном 1:100, инкубируют при 4°С в течение 2 ч для связывания гистоновых белков с активированными микросферами. Микросферы со связанным белком осаждают из суспензии при повторном центрифугировании и промывают дистиллированной водой шесть раз (6×12 мл), замораживают и высушивают сублимацией.
Ковалентное связывание обусловлено реакцией между ε-аминогруппой лизиновых остатков гистонов и активными группами в цепях полисахаридов.
Определение количества белка, связанного с микросферами, осуществляют с помощью аминокислотного анализа (17). Декстрановые микросферы (50 мг), ковалентно связанные с суммарным гистоном, высушивают до постоянного веса при 50°С. В качестве стандарта используют препарат суммарного гистона (10 мг). Оба образца гидролизуют 6 н. хлористо-водородной кислотой в герметических пробирках в течение 24 ч при 110°С. После высушивания образцов до постоянного веса проводят аминокислотный анализ и рассчитывают количество белка.
Количество белка оценивают на основании данных по содержанию в гидролизатах устойчивых к гидролизу аминокислот, таких как аспарагиновая кислота, глицин, глутаминовая кислота.
Например, в анализируемых образцах по данным аминокислотного анализа содержание аспарагиновой кислоты составляет 200 мкг в 10 мг образца суммарного гистона и 0,18 мкг в 50 мг образца декстрановых микросфер. Следовательно, в образце микросфер массой 50 мг содержится 9 мкг суммарного гистона. Отсюда количество ковалентно связанного суммарного гистона с поверхностью микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм составляет 180 мкг белка на 1,0 г микросфер или 5,73 пикомоля на 1,0 см2 поверхности микросфер (расчетная величина).
Расчет количества суммарного гистона, ковалентно связанного с 1,0 см2 поверхности микросфер, проводят следующим образом. Плотность микросфер из кристаллизованного декстрана близка к 1,0 г на 1,0 см3, а их диаметр равен 1,0 мкм (0,0001 см), отсюда количество микросфер в 1,0 см3 составляет 1012 единиц. Площадь сферы выражается формулой: Sсф.=4πR2, отсюда площадь поверхности каждой микросферы равна 314·10-10 см2, а площадь всех микросфер в 1,0 см3 составляет 314·102 см2. Содержание суммарного гистона в 1,0 см3 составляет 180 мкг (180000 нг), а в пересчете на 1,0 см2 эта величина составляет 573 мг (180000: 314·102=573 нг) или 5,73 пикомоля суммарного гистона с молекулярной массой 100 кДа.
Культивирование клеток проводят на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов. Используют 6-луночные культуральные сосуды фирмы Corning Costar. Каталоговый №3506. Для этого на поверхность культурального сосуда диаметром 35 мм наносят 10-20-кратный избыток микросфер, что составляет от 1,5 до 2,0 мг на 1,0 см2 водной суспензии микросфер, содержащих микросферы из кристаллизованного декстрана диаметром около 1,0 мкм, ковалентно связанные с суммарным гистоном.
По расчету объемное количество микросфер, необходимое для формирования слоя толщиной 1,0 мкм на поверхности субстрата площадью 10 см2, составляет 10-3 см3. Учитывая, что объем шара (идеальной микросферы) составляет 52% от объема описываемого куба, а плотность микросфер близка к 1,0 г на 1,0 см3, тогда объем величиной 10-3 см3 будет вмещать 520 мкг микросфер или 52 мкг на 1,0 см2.
Культуральные сосуды выдерживают в ламинарном боксе в течение ночи для полного высушивания субстрата и затем промывают фосфатно-солевым буфером рН 7,5 для удаления не связанного с субстратом материала и повторно высушивают, как описано выше. На поверхности субстрата формируется однородный слой микросфер, который имеет повышенную устойчивость к действию культуральной среды.
Пример 2.
В этом варианте осуществления предлагаемого изобретения для топографической модификации поверхности культуральных сосудов используют перекрестно сшитые конъюгаты суммарного гистона, ковалентно связанные с полимерными микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм. Получение микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм осуществляют, как в примере 1. Получение перекрестно сшитых конъюгатов суммарного гистона проводят на поверхности микросфер и осуществляют следующим образом. К образцу микросфер в количестве 10 мг с первично ковалентно связанным суммарным гистоном добавляют 2,5 мг диметилсуберимидат гидрохлорида в качестве сшивающего агента. Реакцию ковалентного связывания проводят в течение 30 мин при 23°С при перемешивании суспензии на магнитной мешалке. Реакцию ковалентного связывания инициируют доведением рН суспензии до 9,1 при добавлении 0,2 мл насыщенного раствора натрия тетраборнокислого. Реакцию ковалентного связывания останавливают добавлением равного объема 1,0 М моноэтаноламина, рН 8,0. Суспензию инкубируют в течение 2 ч при температуре 23°С и затем подвергают диализу против дистиллированной воды в течение 18 ч, замораживают и высушивают сублимацией.
Ковалентное связывание обусловлено реакцией между ε-аминогруппами лизиновых остатков в молекулах первично связанных с микросферами гистонов и вторично добавленных гистонов к суспензии микросфер.
Количество белка, ковалентно связанного с микросферами, определяют, как описано в примере 1. Количество ковалентно связанных перекрестно сшитых конъюгатов суммарного гистона с поверхностью микросфер из кристаллизованного декстрана диаметром не более 1,0 мкм составляет 200 мкг белка на 1,0 г микросфер.
Топографическую модификацию поверхности культуральных сосудов полимерными микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона, осуществляют, как описано в примере 1.
Пример 3.
В этой серии экспериментов оценивают способность клеток распластываться на субстратах, покрытых разными типами гистонов. Для этого проводят анализ изменения структуры актинового цитоскелета и формы клеток, распластанных на субстратах, покрытых гистонами разных типов. Используют постоянную линию клеток почки эмбриона человека (НЕК 293) и постоянную линию клеток эмбриональных фибробластов мыши (3T3/BALB clone A31), полученные из Российской коллекции клеточных культур (Институт цитологии. Российская академия наук, Санкт-Петербург). Клетки культивируют на среде Дальбекко (ДМЕМ, Биолот) с добавлением 10%-ной эмбриональной бычьей сыворотки крови (Биолот).
Анализируют следующие типы гистоновых белков: H1, H2B, Н3, Н2А+Н4, суммарный гистон, коровые гистоны, перекрестно сшитые конъюгаты суммарного гистона, перекрестно сшитые конъюгаты коровых гистонов.
Окрашивание актинового цитоскелета проводят следующим образом. На силиконизированное стекло (Reppel-Silane, Pharmacia) наносят раствор белка (гистоновые белки растворяют в дистиллированной воде до концентрации 20 мкг/мл) и инкубируют в течение 18 ч при 4°С. После чего инкубируют в течение 1 ч при 37°С в 2% растворе бычьего сывороточного альбумина (БСА) в фосфатно-солевом буфере рН 7,5 (ФСБ) для того, чтобы исключить неспецифическое связывание клеток с субстратом. На субстрат наносят клетки (100 мкл, 105 клеток в 1,0 мл) и инкубируют в течение 1 ч в СO2-инкубаторе. Прикрепившиеся клетки фиксируют в течение 10 мин 4%-ным раствором формальдегида в ФСБ, инкубируют в течение 10 мин при комнатной температуре с 0,1%-ным раствором Тритона Х-100 в ФСБ и затем окрашивают родамином-фаллоидином в течение 10 мин при 37°С. Препараты в пропилгалате анализируют с помощью микроскопа Opton ICM (Zeiss).
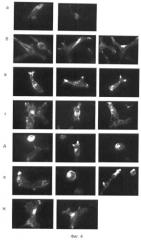
Клетки демонстрируют различную структуру цитоскелета после распластывания на субстратах, покрытых разными типами гистонов, которые изображены на фиг.4а-ж; фиг.5а-д; фиг.6а-г.
Через 4 ч инкубации клетки линии НЕК 293 прикрепляются к субстрату, но не распластываются. Под флуоресцентным микроскопом видно диффузное окрашивание актина. Через 20 ч инкубации степень распластывания клеток зависит от типа гистонового белка, покрывающего подложку (фиг.4а-ж). Все изучаемые гистоновые белки можно разделить на три группы по способности клеток распластываться на субстратах, покрытых гистонами разных типов.
Первая группа. Эту группу представляет гистон H1. Показано, что распластывание клеток на субстрате, покрытом гистоном H1, очень слабое, клетки практически не вытянутые, актиновые олигомеры без какой-либо регулярной структуры. Эти результаты демонстрируют, что гистон H1 не является подходящим субстратом для культивирования клеток НЕК 293 и 3T3/BALB.
Вторая группа. Эта группу составляют суммарный гистон, коровые гистоны и гистон Н2А. Показано, что распластывание клеток лучше, чем в первой группе. Клетки поляризованы, актин концентрируется на концах вытянутых клеток, однако формирования структур, содержащих актин, не наблюдается. Суммарный гистон, коровые гистоны и гистон Н2А, составляющие эту группу, могут быть лучшими субстратами для культивирования клеток линии НЕК 293 и 3T3/BALB. Отсутствие организованной структуры цитоскелета может подавлять пролиферацию клеток. Из данных литературы известно, что формирование стресс-фибрилл является важным фактором для стимуляции пролиферации.
Третья группа. Эту группу составляют перекрестно сшитые конъюгаты суммарного гистона и гистон Н2В. Клетки НЕК 293 и 3T3/BALB хорошо распластаны на этих субстратах, сильно поляризованы, имеют широкую ламеллу на ведущем крае и много микроворсинок и филлоподий, ориентированных в разных направлениях. Длинные выросты отдельных клеток имеют тенденцию контактировать с другими клетками, распластанными на субстрате. Наблюдается формирование фибриллярных актиновых структур. Эти результаты позволяют предполагать, что перекрестно сшитые конъюгаты суммарного гистона и гистон Н2В, которые составляют эту группу, являются наилучшими субстратами для культивирования клеток НЕК 293 и 3T3/BALB. Хорошо известно, что гистоны отличаются по общему содержанию гидрофобных и гидрофильных групп. Наибольшее количество гидрофильных групп имеет гистон Н2В (18). Вполне вероятно, что именно гистон Н2В, содержащийся в суммарном гистоне, отвечает за взаимодействие клеток с суммарным гистоном и стимулирует пролиферацию.
Известно, что клетки уже через 30 мин инкубации на субстрате начинают вырабатывать собственный внеклеточный матрикс и использовать эти белки для прикрепления и распластывания. Поэтому в отдельной серии экспериментов исследуют прикрепление и распластывание клеток на субстратах, покрытых гистонами в присутствии ингибитора синтеза белка циклогексимида. Клетки НЕК 293, распластанные на субстратах, покрытых гистонами различных типов, в присутствии циклогексимида, представлены на фиг.5а-д. Как и в уже описанных экспериментах, клетки, распластанные на перекрестно сшитых конъюгатах суммарного гистона и на гистоне Н2В, демонстрируют наибольшее распластывание и наилучшую структуру актинового цитоскелета. Клетки на этих субстратах демонстрируют мобильный фенотип и формируют ламеллоподии. В присутствии циклогексемида клетки используют для прикрепления и распластывания только гистоновую подложку, а не собственный внеклеточный матрикс. Таким образом, результаты вышеописанных экспериментов показывают, что клетки могут использовать для прикрепления, распластывания и роста субстраты, покрытые гистонами.
Пример 4.
В этой серии экспериментов оценивают прикрепление и распластывание адгезивных клеток на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов. Используют 6-луночные культуральные сосуды фирмы Corning Costar.
Для этого поверхность 6-луночных культуральных сосудов топографически модифицируют полимерными микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанными с положительно заряженными гистонами.
В этих экспериментах исследуют следующие типы субстратов.
Субстрат 1. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с суммарным гистоном.
Субстрат 2. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами суммарного гистона.
Субстрат 3. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с коровыми гистонами.
Субстрат 4. Поверхность культуральных сосудов покрывают микросферами, ковалентно связанными с перекрестно сшитыми конъюгатами коровых гистонов.
В качестве контроля используют не покрытую микросферами поверхность культуральных сосудов.
Используют следующие культуры клеток.
(а) Постоянная линия клеток почки эмбриона человека (НЕК 293).
Клеточная линия НЕК 293 обычно поддерживается в среде ДМЕМ (среда ИГЛА в модификации Дальбекко), которая содержит 10% эмбриональную бычью сыворотку.
В каждую лунку 6-луночных культуральных сосудов, содержащую ДМЕМ и эмбриональную бычью сыворотку, вносят клетки НЕК 293. Клетки культивируют в СО2-инкубаторе при 37°С в течение 10-14 сут. Клетки снимают с помощью трипсина и оценивают количество клеток.
В каждую лунку 6-луночных культуральных сосудов вносят 5×105 клеток НЕК 293 и выдерживают 4.5 ч в бессывороточной среде и 24 ч при добавлении 10% эмбриональной бычьей сыворотки крови при 37°С в СО2-инкубаторе. После инкубации клетки фиксируют с помощью метанола и окрашивают кристаллическим фиолетовым.
Прикрепление и распластывание клеток анализируют под инвертированным микроскопом (ув. 10×10). Число клеток НЕК 293, прикрепившихся к субстрату, покрытому микросферами, ковалентно связанными с комбинациями различных типов гистонов, одинаково во всех вариантах опытов и в контроле. Клетки прикрепляются к микросферам через 4.5 ч. Не обнаруживается заметных различий в степени прикрепления клеток к исследуемым различным субстратам (субстраты 1-4). Распластывание клеток на субстрате начинается после 4 ч инкубации. После 24 ч инкубации в присутствии сыворотки клетки хорошо распластываются.
Морфологический анализ окрашенных распластанных клеток с помощью инвертированного микроскопа показывает, что характер распластывания клеток на поверхности субстрата, покрытой микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанных с гистонами, отличается от распластывания клеток на контрольной поверхности субстрата и имеет свои особенности.
На однородном слое микросфер, где микросферы расположены на оптимальном расстоянии друг от друга, клетки в процессе прикрепления к нескольким микросферам подвергаются функциональному растяжению с формированием длинных отростков, которые соединяют клетки друг с другом, формируя трехмерные сетеобразные клеточные структуры (фиг.7а-г).
Распределение микросфер на поверхности субстрата принимают за оптимальное в том случае, если максимальное расстояние между микросферами не превышает размер распластанной клетки.
На монослое микросфер клетки в процессе прикрепления взаимодействуют с большим количеством микросфер и хорошо распластываются, но без формирования длинных отростков. Клетки контактируют между собой и объединяются в плотные слои, образуя сетеобразные клеточные структуры.
На контрольной поверхности субстрата клетки в процессе распластывания также образуют большие кластеры и сеть, однако единичных распластанных клеток наблюдается гораздо больше.
(б) Постоянная линия клеток эмбриональных фибробластов мыши (BALB/3T3 clone A31).
В этой серии экспериментов используются те же субстраты, что и в разделе (а).
Наблюдается одинаковое число прикрепившихся клеток 3Т3 BALB к субстрату во всех вариантах экспериментов. Наибольшее количество клеток прикрепляется к микросферам через 4.5 ч (фиг.8а-в). Распластывание 3Т3 BALB клеток на субстратах начинается после 4.5 ч и происходит лучше, чем в случае НЕК 293 клеток. После 24 ч инкубации в присутствии сыворотки крови клетки хорошо распластываются. Клетки в процессе прикрепления к нескольким микросферам, расположенным на оптимальных расстояниях друг от друга, формируют длинные отростки, которые соединяют клетки друг с другом, образуя трехмерные сетеобразные клеточные структуры. Распластывание на микросферах лучше, чем в контроле.
Пример 5.
В этой серии экспериментов оценивают морфологическое состояние клеток после длительного культивирования на топографически модифицированной микросферами, ковалентно связанными с суммарным гистоном, поверхности культуральных сосудов.
В этой серии экспериментов используют 6-луночные культуральные сосуды, топографически модифицированные микросферами из кристаллизованного декстрана диаметром не более 1,0 мкм, ковалентно связанными с суммарным гистоном. В опытах используют клеточную линию НЕК 293 почки эмбриона человека.
Культивирование клеток осуществляют, как описано в примере 4. Клетки культивируют как в среде с сывороткой, так и в бессывороточной среде.
Для оценки состояния клеток НЕК 293 в течение 6 сут культивирования клетки фиксируют метанолом и окрашивают кристаллическим фиолетовым. Проводят анализ препаратов, полученных через 1 и 6 сут культивирования в среде с 10% эмбриональной бычьей сывороткой (вариант 1) и в бессывороточной среде с ростовыми добавками (вариант 2). После 1 сут культивирования наблюдают хорошее распластывание клеток на исследуемых субстратах и образование контактов между соседними клетками (фиг.9а-д). Между распластанными клетками наблюдают много свободных микросфер без клеток. Через 6 сут культивирования число распластанных клеток значительно увеличивается в обоих вариантах. Они растут в виде колоний, образуют большие кластеры и объединяются в плотный слой клеток, образуя сетеобразные клеточные структуры. На этой стадии культивирования наблюдается очень мало свободных микросфер. Рост культуры сопровождается образованием монослойности клеток в кластерах. Существенных различий между клетками, культивируемыми в среде с сывороткой и в бессывороточной среде, не наблюдают. На контрольных поверхностях клетки также образуют большие кластеры и сеть, однако единичных распластанных клеток наблюдается гораздо больше, чем в опытных вариантах.
Пример 6.
В этой серии экспериментов оценивают скорости роста адгезивных клеток на топографически модифицированной микросферами, ковалентно связанными с гистонами, поверхности культуральных сосудов.
Для этого 6-луночные культуральные сосуды покрывают микросферами, ковалентно связанными с суммарным гистоном.
Как показано в примере 4, на такой поверхности субстрата клетки хорошо прикрепляются и распластываются.
В этом исследовании используют две клеточные линии: постоянная линия клеток почки эмбриона человека (НЕК 293) и постоянная линия эмбриональных фибробластов мыши (3T3/BALB clone A31). В этой серии экспериментов культивирование клеток проводят как в среде, содержащей сыворотку, так и в среде, не содержащей сыворотку.
Культивирование клеток обычно осуществляют в среде, содержащей сыворотку. Сыворотка содержит в своем составе различные компоненты, которые позволяют клеткам адгезировать и расти на поверхности субстрата. Однако необходимо отметить, что сыворотка содержит в своем составе смесь многочисленных субстанций с физиологической активностью, которые высвобождаются из клеток крови и эндотелиальных клеток сосудов. Поэтому анализ и использование продуктов культивируемых клеток в среде, содержащей сыворотку, требуют использования определенных методов их очистки. Поэтому создание бессывороточного способа культивирования адгезивных клеток человека и животных является необходимым.
А. Постоянная линия клеток почки эмбриона человека (НЕК 293).
(а) Культивирование клеток в среде с сывороткой или в бессывороточной среде.
Клетки высевают на