Генетически модифицированная линия фибробластов мыши nih/3т3-174
Иллюстрации
Показать всеИзобретение относится к генной инженерии и может быть использовано для продуцирования белка ядрышка SURF-6 млекопитающих. Линию клеток NIH/3T3-174 получают с помощью генетической модификации фибробластов мыши линии NIH/3T3. Модификацию проводят с помощью двух последовательных трансфекций при достижении клетками 70% конфлуентности. Первую трансфекцию осуществляют 5 мкг плазмиды pUHrT62-1, кодирующей гены устойчивости клеток к неомицину (G-418) и тетрациклинзависимого трансактиватора, и 15 мкл реагента для липосомальной трансфекции в 500 мкл среды ДМЕМ. Вторую трансфекцию проводят смесью 2.5 мкг плазмиды pBI-SURF6, несущей гены EGFP (зеленого флуоресцирующего белка) и белка SURF-6, и 2.5 мкг линейного фрагмента ДНК, кодирующей ген устойчивости к пуромицину, и 15 мкл реагента для липосомальной трансфекции в 500 мкл среды ДМЕМ. Экспрессия генов EGFP и SURF-6 находится под контролем промотора, активируемого добавлением в среду культивирования индуктора - антибиотика доксициклина. Полученная линия клеток NIH/3T3-174 способна при добавлении индуктора продуцировать белок SURF-6 на уровне, в 10-20 раз превышающем содержание белка в исходных немодифицированных фибробластах. 5 ил.
Реферат
Изобретение относится к биотехнологии и создано для продуцирования и выделения белка ядрышка SURF-6 млекопитающих для скрининга антител, включая аутоиммунные сыворотки, на иммуноблотах и биологических микрочипах.
Известно, что дрожжи S. cerevisiae и S. pombe продуцируют белок Rrp14p, который является гомологом белка SURF-6 млекопитающих (Oeffinger et al. Yeast Rrp14p is required for ribosomal subunit synthesis and for correct positioning of the mitotic spindle during mitosis. Nucleic Acids Res. 2007, 35: 1354-1366). Однако низкий уровень экспрессии Rrp14p и лишь частичная - около 20% - гомология Rrp14p с SURF-6 не позволяют использовать дрожжи для выделения белка SURF-6, характерного для соматических клеток млекопитающих.
Известно, что клетки человека линии HeLa также содержат ген белка SURF-6 (Polzikov et al. Identification of an evolutionary conserved SURF-6 domain in a family of nucleolar proteins extending from human to yeast. Biochem. Biophys. Res. Commun. 2005, 327: 143-149). Однако опухолевая природа клеток HeLa не позволяет использовать их для изучения белка SURF-6 в нормальных (нетрансформированных) клетках млекопитающих.
Известно также, что белок SURF-6 транслируется в нормальных фибробластах мыши линии NIH/3T3 (Magoulas and Fried. The Surf-6 gene of the mouse surfeit locus encodes a novel nucleolar protein. DNA Cell Biol. 1996, 15: 305-316; Magoulas et al. The SURF-6 protein is a component of the nucleolar matrix and has a high binding capacity for nucleic acids in vitro. Eur. J. Cell Biol. 1998, 75:174-183). Однако в этих клетках экспрессия гена SURF-6 находится под контролем стандартных внутриклеточных транскрипционных факторов и не может быть повышена какими-либо внешними воздействиями (Гурченков и др. Свойства и функции нового белка ядрышка SURF-6 в клетках мыши 3Т3. Биоорганическая химия. 2005, 31: 578-585).
Задачей изобретения является создание на основе фибробластов мыши линии NIH/3T3 новой - генетически модифицированной - линии клеток, способной продуцировать белок ядрышка SURF-6 на уровне, в 10-20 раз превышающем его содержание в немодифицированных клетках.
Поставленная задача решается за счет линии фибробластов мыши NIH/3T3-174 для продуцирования белка ядрышка SURF-6 млекопитающих, полученная из исходных клеток NIH/3T3 при достижении ими 70% конфлуентности и трансфекции с использованием 5 мкг ДНК, включающей плазмиды pUHrT62-1, pBI-SURF6 и линейного фрагмента ДНК, несущего ген устойчивости к пуромицину, и 15 мкл реагента для липосомальной трансфекции в 500 мкл среды ДМЕМ.
Полученная линия клеток NIH/3T3-174 способна продуцировать белок SURF-6 на уровне, который в 10-20 раз превышает уровень содержания SURF-6 в исходной линии клеток NIH/3T3.
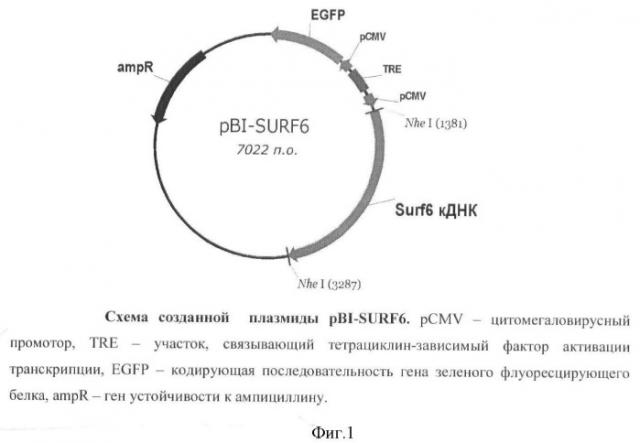
Для получения генетически модифицированных клеток используют фибробласты мыши линии NIH/3T3 из Российской коллекции клеточных культур (Институт цитологии РАН, Санкт-Петербург). Генетическую модификацию клеток производят с помощью двух плазмид. Первая, или вспомогательная, плазмида pUHrT62-1 предоставлена ее разработчиками (Urlinger et al. Exploring the sequence space for tetracycline-dependent transcriptional activators: novel mutations yield expanded range and sensitivity, Proc. Natl. Acad. Sci. U.S.A. 2000, 97: 7963-7968). Она кодирует тетрациклинзависимый фактор активации транскрипции и ген устойчивости клеток к неомицину (G418). Вторая, или действующая, плазмида pBI-SURF6 создана на основе коммерческого вектора pBI-EGFP ("Clontech", США). Она содержит тетрациклинзависимый промотор, активируемый тетрациклинзависимым фактором в присутствии антибиотика тетрациклинового ряда - доксициклина, ген зеленого флуоресцирующего белка EGFP и ген SURF-6 мыши (Фиг.1).
Первую трансфекцию проводят плазмидой pUHrT62-1. Трансфецированные клетки выращивают на селективной среде, содержащей 450 мкг/мл неомицина (G418), в течение одного месяца. Клетки, устойчивые к неомицину, отбирают и наращивают до состояния 70% конфлуентности. Затем клетки трансфецируют плазмидой pBI-SURF6 и линейным фрагментом ДНК, несущим ген устойчивости к пуромицину и выделенным из pLoxPuro по сайтам рестрикции BamHI и ScaI (Arakawa et al. Mutant loxP vectors for selectable marker recycle and conditional knock-outs. BMC Biotechnology. 2001, 1:7). Трансфецированные клетки выращивают на селективной среде, содержащей 450 мкг/мл неомицина и 1 мкг/мл пуромицина, в течение одного месяца. Клетки, не чувствительные к антибиотикам, отбирают, наращивают и для длительного хранения замораживают в жидком азоте. Линия клеток, полученная в результате двух последовательных трансфекции, названа NIH/3T3-174.
Доказательствами генетической модификации клеток линии NIH/3T3-174 являются следующие признаки.
С помощью полимеразной цепной реакции (ПЦР), использующей в качестве матрицы геномную ДНК, выделенную из клеток NIH/3T3-174, доказано наличие плазмиды рВ1-SURF6, встроенной в их геном (Фиг.2).
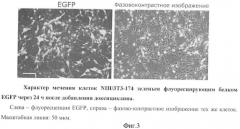
После добавления в культуральную среду 5 мкг/мл доксициклина на 24 ч и облучении светом с длиной волны 484 нм клетки NIH/3T3-174 проявляют зеленую флуоресценцию, что обусловливается экспрессией гена EGFP, присутствующего во второй - действующей - плазмиде pBI-SURF6 (Фиг.3).
С помощью обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) в линии клеток NIH/3T3-174 проводят анализ уровня мРНК SURF-6 после индукции доксициклином. После 48 ч индукции выявлено значительное повышение содержания мРНК SURF-6 при постоянном уровне мРНК маркерного гена глицеральдегид-2'-фосфатдегидрогеназы (GAPDH) (Фиг.4).
После электрофоретического разделения равного количества суммарных белков, выделенных из клеток NIH/3T3 и NIH/3T3-174, и их иммуноблотирования, значительное увеличение содержания SURF-6, по сравнению с контрольными клетками NIH/3T3 и клетками NIH/3T3-174, выявляется уже через 24 часа после индукции экспрессии дополнительных копий генов SURF-6. Через 48 ч индукции уровень SURF-6 оказывается приблизительно в 20 раз выше, чем в контрольных клетках, о чем свидетельствует анализ фотограмм с помощью программы TotalLab, версия 2.00 ("Phoretix", США) (Фиг.5). Наличие продуктов деградации SURF-6, обнаруженных в линии NIH/3T3-174 через 48 ч после индукции и обозначенных на фиг.4 звездочками, свидетельствует о запуске в клетке механизмов усиленного протеолиза и деградации дополнительных копий молекул белка.
Таким образом, результаты проведенных экспериментов говорят о генетической модификации родительских клеток линии NIH/3T3 и способности полученной линии клеток NIH/3T3-174 продуцировать белок ядрышка SURF-6 в присутствии индуктора-антибиотика доксициклина на более высоком уровне.
Генетически модифицированные клетки NIH/3T3-174 имеют следующие характеристики:
Морфологические признаки. Линия клеток NIH/3T3-174 проявляет основные фенотипические признаки, присущие родительской линии - фибробластам клеток мыши линии NIH/3T3. Эти признаки сохраняются, как минимум, в течение 40 пассажей, что соответствует приблизительно 5 месяцем культивирования (фиг.3).
Культуральные свойства. Среда культивирования - ДМЕМ, содержащая 10% эмбриональной сыворотки крупного рогатого скота («HyClone", США), 2 мМ L-глутамина, антибиотики пенициллин и стрептомицин (по 250 ЕД каждого), а также селективные антибиотики - неомицин (G418) в концентрации 150 мкг/мл и пуромицин в концентрации 0.5 мкг/мл, при 37°С и 5% CO2/95% О2. Пересев культуры осуществляют дважды в неделю с помощью трипсина-ЭДТА («ПанЭко», Россия). При пересеве культуры в новый культуральный сосуд площадью 25 см2 вносят 106 клеток (2×105 клеток/мл).
Способ криоконсервирования линии клеток NIH/3T3-174. Криозащитная среда: 90% бычьей эмбриональной сыворотки и 10% диметилсульфоксида (DMSO). Криоампулы с суспензией клеток помещают на 3 часа в холодильник при -70° и затем - в жидкий азот. Жизнеспособность клеток после размораживания - 90-95%. Бактерии, грибы, дрожжи или микоплазма в культуре NIH/3T3-174 не обнаружены.
Изобретение иллюстрируют графические материалы:
Фиг.1. Схема созданной плазмиды pBI-SURF6.
Фиг.2. ПЦР-анализ встраивания в геном клеток NIH/3T3-174 плазмиды pBI-SURF6.
Фиг.3. Характер мечения клеток NIH/3T3-174 зеленым флуоресцирующим белком EGFP через 24 ч после добавления доксициклина.
Фиг.4. Уровень мРНК SURF-6 в исходных (контрольных) клетках NIH/3T3 и в клетках NIH/3T3-174 через 48 ч после индукции, выявляемый методом ОТ-ПЦР.
Фиг.5. Содержание белка SURF-6 в исходных (контрольных) клетках NIH/3T3 и в клетках NIH/3T3-174 через 24 ч и 48 ч после добавления доксициклина, выявляемое методом иммуноблотирования.
Изобретение иллюстрируют примеры.
Пример 1
Получение действующей плазмиды pBI-SURF6.
Для получения плазмиды pBI-SURF6, фрагмент ДНК (1900 п.о.), соответствующий кДНК Surf-6, амплифицируют с помощью ПЦР, использующей в качестве матрицы плазмиду pBS-SURF6, содержащую кДНК SURF-6 мыши (Magoulas and Fried. The Surf-6 gene of the mouse surfeit locus encodes a novel nucleolar protein. DNA Cell Biol. 1996, 15: 305-316).
Проведенная ПЦР реакция включает в себя ген-специфические праймеры (5'-праймер-gctagcatggcttctctcctggccaaggat, 3'-праймер - gctegcggagaggcctgcacgctccag, встроенные сайты эндонуклеазы рестрикции NheI подчеркнуты), а также Taq-полимеразу (5 ед/мкл), смесь ddNTP (по 10 мМ каждого), а также буфер для ДНК-полимеразы. Продукты полимеразной цепной реакции разделяют электрофоретически в 2%-агарозном геле в присутствии бромида этидия при напряженности поля 5 В/см. Выделенный из геля фрагмент двухцепочечной кДНК SURF-6 очищают с помощью набора "QIAEX II Gel Extraction Kit" ("Qiagen", Германия) и клонируют в вектор pBI-EGFP ("Clontech", США). Реакцию лидирования проводят в 10 мкл, используя 4 мкл очищенного ПЦР-продукта, 0.5 мкл Т4 ДНК-лигазы (3 ед/мкл), 1 мкл 10-кратного буфера для лигирования и 0.5 мкл вектора pBI-EGFP, линеаризованного по сайту рестрикции NheI. Полученная плазмида названа pBI-SURF6 и протестирована на наличие нуклеотидных замен в клонированном фрагменте ДНК методом автоматического секвенирования ДНК.
Пример 2
Получение линейного фрагмента ДНК, несущего ген устойчивости к пуромицину. Для получения фрагмента ДНК, несущего ген устойчивости к пуромицину, используют плазмиду pLoxPuro (Arakawa et al. Mutant loxP vectors for selectable marker recycle and conditional knock-outs. BMC Biotechnology. 2001, 1:7). Для проведения реакции рестрикции выбирают рестриктазы ВатHI и Scal, сайты рестрикции которых фланкируют нужный фрагмент ДНК в pLoxPuro. Для этого к 2 мкг плазмиды pLoxPuro добавляют по 20 ЕД рестриктаз BamHI и SeaI в буфере для рестрикции и инкубируют реакционную смесь при 37°С в течение 2-х ч. После поведения реакции рестрикции нужный фрагмент ДНК отделяют с помощью электрофореза от линеаризованной плазмиды pLoxPuro, выделяют из геля и очищают с помощью набора "QIAEX II Gel Extraction Kit" ("Qiagen", Германия).
Пример 3
Проведение трансфекции клеток.
Трансфекцию клеток проводят липосомальным методом с использованием реагента Lipofectamine2000 ("Invitrogen", Великобритания) в чашках Петри диаметром 35 мм при достижении клетками 70% конфлуентности. Для первой трансфекции используют 5 мкг плазмиды pUHrT62-1, 15 мкл реагента Lipofectamine2000 в 500 мкл среды ДМЕМ. Через 6 часов клетки промывают средой ДМЕМ, содержащей 10% эмбриональной сыворотки крупного рогатого скота, 2 мМ L-глутамина, антибиотики пенициллин и стрептомицин (по 250 ЕД каждого) и 450 мкг/мл неомицина (G418), и культивируют в течение 1 месяца, дважды в неделю заменяя старую культуральную среду на свежую среду того же состава. Для второй трансфекции используют 2.5 мкг плазмиды pBI-SURF6, 2.5 мкг линейного фрагмента ДНК, несущего ген устойчивости к пуромицину, 15 мкл реагента Lipofectamine 2000 в 500 мкл среды ДМЕМ. Через 6 часов после добавления компонентов клетки промывают ростовой средой ДМЕМ, содержащей 10% эмбриональной сыворотки крупного рогатого скота, 2 мМ L-глутамина, антибиотики пенициллин и стрептомицин (по 250 ЕД каждого), 450 мкг/мл неомицина (G418) и пуромицин в концентрации 1 мкг/мл, и культивируют в течение 1 месяца, дважды в неделю заменяя старую культуральную среду на свежую среду того же состава. Описанные в примере условия трансфекции клеток линии NIH/3T3 плазмидами pUHrT62-1, pBI-SURF6 и линейным фрагментом ДНК позволяют получить клон клеток NIH/3T3-174, способный суперпродуцировать белок SURF-6 в присутствии индуктора доксициклина (Фиг.5). Таким образом, наряду с конфлуентностью клеток другим условием успешного получения клона с нужными свойствами является соотношение массы ДНК (в мкг) и объема липосомного реагента (в мкл), используемых для каждой из трансфекции, равное 1:3.
Пример 4
Отбор клонов клеток, устойчивых к селективным антибиотикам.
Из чашки Петри диаметром 60 мм ("Costar", Германия), содержащей клетки, удаляют культуральную среду. Клетки дважды промывают средой ДМЕМ (без сыворотки) и добавляют 100 мкл трипсина-ЭДТА («ПанЭко», Россия) на 3-5 мин при 37°С, а затем - 5 мл полной культуральной среды, содержащей селективные антибиотики. Под контролем бинокуляра («Ломо», Россия) пастеровской пипеткой отбирают клетки, образующие клоны, и переносят их в культуральный флакон площадью 25 см2. Клетки культивируют при 37°С и 5% CO2/95% О2 до достижения 60-70% конфлуентности.
Пример 5
Доказательства генетической модификации клеток NIH/3T3-174: ПЦР с использованием геномной ДНК.
С помощью полимеразной цепной реакции (ПЦР), использующей в качестве матрицы геномную ДНК, выделенную из клеток NIH/3T3-174, праймер к TRE-элементу встроенной в геном плазмиды pBI-SURF6 (Фиг.1) (5' gtcgagctcggtacccgggtcgagtaggcgtgtacg) и ген-специфический праймер к кодирующей последовательности SURF-6 мыши (5' tcagttaaagatcagccctgattcctg), выявляют фрагмент ДНК с электрофоретической подвижностью в районе 850 п.о., что соответствует расчетной подвижности ожидаемого продукта ПЦР (Фиг.2).
Пример 6
Доказательства генетической модификации клеток NIH/3T3-174: ОТ-ПЦР.
Суммарную РНК выделяют в 100 мкл раствора с помощью набора для выделения РНК "SV Total RNA Isolation System" ("Promega", США); кДНК синтезируют на матричной РНК (мРНК) посредством обратной транскрипции с использованием 10 ед/мкл обратной транскриптазы M-MLV вируса лейкоза мышей Мелони. Для образования затравочных участков на цепи мРНК используют набор случайных праймеров по 1 мкМ каждого. Реакцию синтеза кДНК проводят в объеме 20 мкл.
Для проведения ПЦР используют праймеры для гена SURF-6 и гена «домашнего хозяйства» - GAPDH (глицеральдегид-2'-фосфатдегидрогеназы) мыши.
Праймеры для амплификации участка гена SURF-6: 5' attttctgcgacagcggctgcgcagatgagtatcttgtccc, 5' tgcatcctgatcacgaagctcgttgagtccatggggagcttt AGC TTT; для амплификации участка гена GAPDH 5'-tgcaccaccaactgcttagctgttatacagggagatgaaa, 5'-cattgtcataccaggaaatgagcatttgattctggaccatggc.
Пример 7
Определение содержания SURF-6 в суммарных клеточных лизатах методом иммуноблотирования.
Электрофоретическое разделение белков проводят по стандартной методике, предложенной Лэммли. Для этого клетки лизируют на льду в буфере А, содержащем 50 mM Трис-(гидроксиметил)-аминометана (рН 7.5), 150 mM NaCl, 10% глицерина, 0.5% Тритона X-100 и смесь протеазных ингибиторов ("Sigma", США) с помощью пестикового гомогенизатора. Перед лизисом число клеток в каждом образце подсчитывают с помощью камеры Горяева («МиниМед», Россия). Суммарную концентрацию белков в лизатах определяют по методу Лоури (модификация Петерсона) с помощью набора Protein Assay Kit ("Sigma"). Перед электрофоретическим разделением к приготовленным лизатам добавляют 5-кратный буфер Лэммли, содержащий 250 мМ Трис-(гидроксиметил)-аминометана (рН 6,8), 50% глицерина, 10% ДСН, 500 мМ β-меркаптоэтанола, 0,5% бромфенолового синего. Образцы подвергают термической обработке при 100°С в течение 5 мин. В каждый карман 12% ПААГ наносят лизаты, полученные из одинакового количества клеток и содержащие не менее 50 мкг суммарного белка. Электрофоретическое разделение белков проводят при 60 В для концентрирования белков в «верхнем» (концентрирующем) геле и при 160 В для дальнейшего разделения в электрофорезной камере. После разделения белков гель инкубируют в буфере для проведения полусухого электроблоттинга, содержащем 50 мМ Трис-(гидроксиметил)-аминометана, 38 мМ глицина, 0.1% додецилсульфата натрия и 20% метанола. Перенос белков на нитроцеллюлозную мембрану (0.22 мкм, "Millipore", США) проводят при постоянном напряжении 20 В в течение 30 мин. Затем мембрану инкубируют с антителами к белку SURF-6 (Magoulas et al. The SURF-6 protein is a component of the nucleolar matrix and has a high binding capacity for nucleic acids in vitro. Eur. J. Cell. Biol. 1998, 75: 174-183) (разведение 1:2500), а затем - с антителами к иммуноглобулинам кролика, конъюгированными с пероксидазой хрена ("Sigma"; разведение 1:2000) в буфере TBST, содержащим 20 мМ Трис-(гидроксиметил)-аминометана (рН 7.6), 150 мМ NaCl, 0.05% Твина-20. Мембрану проявляют методом хемилюминесценции, используя набор ECL + Plus ("AmershamPharmaciaBiotech", Великобритания).
Линия фибробластов мыши NIH/3T3-174 для продуцирования белка ядрышка SURF-6 млекопитающих, полученная из исходных клеток NIH/3T3 при достижении ими 70% конфлуентности и трансфекции с использованием 5 мкг ДНК, включающей плазмиды pUHrT62-1, pBI-SURF6 и линейный фрагмент ДНК, несущий ген устойчивости к пуромицину, и 15 мкл реагента для липосомальной трансфекции в 500 мкл среды ДМЕМ.