Модифицированные витамин к-зависимые полипептиды
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ получения модифицированного витамин К-зависимого полипептида, включающий модификацию активационного пептида, которая включает, по меньшей мере, часть последовательности аминокислот другого витамин К-зависимого полипептида и где указанная часть представляет собой, по меньшей мере, 3 смежных аминокислоты активационного пептида FVII, или 5 смежных аминокислот активационного пептида FX, или 5 смежных аминокислот активационного пептида FIX с условием, что пептид QSFNDFTR исключен, или 8 смежных аминокислот активационного пептида протромбина, или удлинение на смежные аминокислоты активационного пептида второго витамин К-зависимого полипептида, которое имеет длину, по меньшей мере, равную 15% полной длины последовательности аминокислот активационного пептида второго витамин К-зависимого полипептида, в котором второй витамин К-зависимый полипептид выбран из группы, состоящей из протеина Z, GAS 6 и протеина S, и где второй витамин К-зависимый полипептида имеет увеличенное время полужизни в плазме. Раскрыт модифицированный витамин К-зависимый полипептид, полученный описанным способом, обладающий коагуляционной активностью. Изобретение позволяет создавать модифицированные витамин К-зависимые полипептиды с увеличенным временем полужизни в плазме. 8 н. и 32 з.п ф-лы, 2 ил., 5 табл.
Реферат
Область изобретения
Настоящее изобретение относится к кодированию последовательностей модифицированной комплиментарной ДНК (кДНК) для витамин К-зависимых полипептидов в конкретном человеческом факторе VII, человеческом факторе VIIa, человеческом факторе IX и человеческом протеине С и их производных с улучшенной устойчивостью и увеличенным временем полужизни плазмы, рекомбинантным вектором экспрессии, содержащим такие последовательности кДНК, клетки хозяина, преобразованные такими рекомбинантными векторами экспрессии, рекомбинантные полипептиды и производные, которые имеют биологическую активность немодифицированного белка дикого типа, но с повышенной устойчивостью, и к процессам для изготовления таких рекомбинантных белков и их производных. Изобретение также охватывает вектор передачи для использования в человеческой генной терапии, включающей такие последовательности модифицированной ДНК.
Предпосылки создания изобретения
Витамин К-зависимые белки используются для лечения некоторых видов гемофилии. Классическая гемофилия или гемофилия А является наследственным геморрагическим диатез-нарушением. Оно вызвано связанным с хромосомой Х недостатком фактора VIII (антигемофильного глобулина А) и является почти исключительно мужским заболеванием с частотой между одним и двумя индивидуумами на 10,000 человек. Нарушение Х-хромосомы передается женскими носителями, которые сами по себе не страдают гемофилией. Клиническое проявление гемофилии состоит в тенденции к повышенному кровотечению. До внедрения лечения фактором VIII и концентратами фактора VIII средняя продолжительность жизни для человека с серьезной гемофилией была менее 20 лет. Использование концентратов фактора VIII из плазмы и позже их рекомбинантных форм FVIII значительно улучшило ситуацию для пациентов, страдающих гемофилией, экстенсивно увеличивая среднюю продолжительность жизни и давая большинству пациентов возможность жить более или менее нормальной жизнью. Гемофилия В встречается в 5 раза реже, чем гемофилия А, вызвана нефункционирующими или отсутствующими факторами FDC и лечится концентратами из плазмы или рекомбинантными формами FIX. Как в случае гемофилии А, так и в случае гемофилии В, наиболее серьезная медицинская проблема при лечении этой болезни заключается в создании аллогенных антител против факторов реплантации. До 30% всех пациентов, страдающих гемофилией, показывают антитела до FVIII. Антитела до FIX развиваются в меньшей степени, но с более тяжелыми последствиями, поскольку они менее восприимчивы к иммунной толерантности индукционной терапии.
Принятая в настоящее время модель свертывания крови предполагает, что физиологическая схема начала свертывания крови состоит в формировании комплекса между фактором ткани (TF) и фактором VIIa (FVIIa) на поверхности ткани с определением клеток, которые обычно находятся вне сети сосудов. Это приводит к активации факторов FIX и FX и, в конечном счете, к образованию тромбина. В цепи положительной обратной связи тромбин активизирует факторы FVIII и FIX, так называемое «внутреннее» плечо каскада свертывания крови, таким образом усиливая выработку фактора FXa, который является необходимым для появления полного выхода тромбина для достижения полного гемостаза. Доказано, что путем ввода надфизиологических концентраций гемостаза FVIIa достигается путем обхода потребности в факторах FVIIIa и FIXa. Клонирование кДНК для фактора FVII (US 4.784.950) позволяет развить рекомбинантную замену фактора свертывания крови, полученного из этой плазмы. Этот фактор FVIIa был впервые успешно введен в 1988 году пациенту с высоким титром подавляющих антител для фактора FVIII. С тех пор число признаков FVIIa постоянно росло, выявляя потенциал фактора FVIIa как универсального гемостатического агента (Erhardtsen, 2002).
Фактор FVII - одноцепочный гликопротеид с молекулярным весом 50 kDa, который выделяется ячейками печени в кровоток, как неактивный профермент аминокислот 406. Он содержит 10 γ-карбокси-глютаминовые кислотные остатки (положения 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35), локализованные в Gla-области белка. Остатки Gla требуют витамина К для их биосинтеза. Локализованный С-терминал домена Gla состоит из двух областей эпидермального фактора роста и области серин-протеазы трипсин-типа. Дальнейшие посттрансляционные модификации фактора FVII включают гидроксилирование (Asp 63), N-(Asn145 и Asn322) и гликозилирование (Ser52 и Ser60) O-типа.
Фактор FVII преобразуется в свою активную форму FVIIa путем расщепления белка одиночной пептидной связи в Arg152-Ile153, приводя к формированию двух полипептидных цепей: легкую цепь N-терминала (17 kDa) и тяжелую цепь С-терминала (28 kDa), которые соединяются одной дисульфидной связью. В отличие от других витамин К-зависимых полипептидов, активационный пептид, который расщепляется при активации, не был описан для фактора FVII. Сайт расщепления Arg152-Ile153 по сравнению с гомологией соответствует сайту разрыва активации С-терминала других витамин К-зависимых полипептидов. Однако, поскольку Arg144 также мог бы создавать сайт расщепления протеазы, нельзя исключать того, что FVII, в отличие от общепринятого мнения, обладает активационным пептидом восьми аминокислот между Arg144 и Arg152.
Существенным для достижения активной конформации фактора FVIIa является формирование солевого мостика после раздела активации между Ile153 и Asp343. Активация FVII может быть достигнута в лабораторных условиях использованием FXA, FXIIa, FIXa, FVIIa, FSAP и тромбина. Моллерап и др. (Biotechnol. Bioeng. (1995 г.) 48: 501-505) сообщают, что определенный распад также происходит в тяжелой цепи в Arg290 и/или Arg315.
Фактор FVII присутствует в плазме в концентрации 500 нг/мл. Например, 1%, 5 нг/мл FVII присутствует как фактор FVIIa. Период полураспада плазмы FVII был найден равным приблизительно 4 часам и таковой для FVIIa приблизительно 2 часам. Хотя период полураспада фактора FVIIa в 2 часа является сравнительно долгим для активизированного фактора свертывания крови, который в другом случае составляет несколько минут из-за необратимого ингибирования серпина подобно антитромбину III, это является серьезным препятствием для терапевтического использования фактора FVIIa, поскольку он требует многократной внутривенной инъекции или непрерывного вливания для достижения гемостазы, что связано с очень высокой стоимостью лечения и неудобствами для пациента. С другой стороны, фактор FVIIa имеет потенциал, который нужно использовать как универсальное гемостатическое средство, и имеется медицинская потребность в развитии такой формы FVIIa, которая имеет более длительное функциональное время полужизни.
Было сделано несколько попыток модификации фактора FVII:
Николайсен и другие (WO 88/10295, 25 июня 1987 года) предложили, что удаляя или модифицируя следующие аминокислоты, фактор FVII будет стабилизирован против протеолитической деградации: Lys32, Lys38, Lys143, Arg290, Arg315, Lys316, Lys341, Arg392, Arg 396, Arg402, Ile42 и Tyr44.
Николайсен (US 5.580,560, 13 ноября 1989 года) в WO 88/10295 также включил мутации или удаление в Arg304, Phe278 и Tyr332, чтобы сделать фактор FVII/FVIIa менее восприимчивым к расщеплению белка.
Бхарадвей и другие (JBC (1996), 48, стр.30685-30691) описал мутант фактора FVII Phe328Ser, который не смог активизировать FX и не показал никакой обнаруживаемой амидолизной активности.
Дикинсон и другие (PNAS (1996) 93, 14379-14384) предложил варианты фактора FVIIa, в которых Lys157, Val158, Glu296, Met298, Asp334, Ser336 или Lys337 были заменены на Ala.
Неленсестуен (WO 99/29767, 23 октября 1997 года) модифицировал область Gla, используя способ точечных мутаций, чтобы приблизить ее свойства к фосфолипидным мембранам, получив, таким образом, модифицированный фактор FVIIa с повышенной специфической активностью. Предложенные точечные мутации представляют собой Pro10, Gly11, Arg28 и Lys32.
Неленсестуен (WO 00/66753, 29 апреля 1999 года) модифицировал область Gla, используя способ точковых мутаций, чтобы увеличить ее сродство с фосфолипидными мембранами, получив. таким образом, модифицированный фактор FVIIa с повышенной специфической активностью. Предложенные точковые мутации выполнены в точках 5, 9, 11, 12, 29, 33, 34, 35 и/или 36.
Корнфельд и другие (Archiv. Biochem. И Biophys., 363, рр 43-54) показали, что окисление Met298 и Met306 приводит к повышенной на 30% скорости диссоциации FVIIa-ox TF и на 20% сниженную активацию FX по сравнению с фактором FVIIa дикого типа.
Кембелл-Кук и другие (JBC (1998), 14, рр.8516-8521) описал мутант FVII Gin100Arg и показал, что он не имеет никакой обнаруживаемой коагулирующей активности, хотя и имеет амидолизную активность, сопоставимую с фактором FVIIa дикого типа, и предположил, что это может быть благодаря связи с фактором ткани (TF).
Иино и другие (Arch. Biochem. Biophys. (1998 г.) 352:182-192) показал, что мутации O-гликозилированных участков Ser-52 и Ser-60 снижают коагулирующую активность FVIIa, возможно, путем изменения взаимодействия с TF.
Руф и другие (Biochemistry (1999 г.) 16, pp.1957-66) показал, что мутация Arg36Ala снижает скорость активации FX.
Иванага и другие (Thromb. Haemost. (Приложение от августа 1999), 466 реферат 1474) ссылается на вариант FVII, в котором остатки 316-320 удалены или остатки 311-322 заменены соответствующими остатками трипсина.
Соэнджима Кенджи и другие (JP 2001061479, 24 августа 1999 года) создал модифицированный фактор FVIIa с увеличенной специфической активностью, расщепляя дисульфидную группу между Cys159 и Cys164 или заменяя, добавляя или удаляя, по меньшей мере, часть структуры петли от Thr233 до Asp244, или заменяя, добавления или удаляя, по меньшей мере, часть мешающей последовательности между Arg304 и Cys329.
Педкрсен и другие (US 2003/0096338 от 11 февраля 2000 года) заявляет связь между FVII и FVIIa с неполипептидными агентами, включая сахар, с целью продлить период полужизни FVIIa. Формула изобретения также охватывает ввод новых гликозилированных сайтов N- и/или O-типа или ввод новых гликозилированных сайтов, в сочетании с удалением существовавших ранее гликозилированных сайтов N- и/или O-типа, чтобы получить гликоконъюгаты в лабораторных условиях.
Петерсон и Олсен (US 2003/0170863, 3 мая 2000 года) описывают модифицированный фактор FVIIa, в котором Leu305 или Phe374 была заменена другой аминокислотой. Не менее 20 аминокислот в области протеазы (153-406) были заменены в сочетании с вышеупомянутыми мутациями. Раскрыты и другие модифицировавшие молекулы FVII, которые произвольно имеют другие аминокислоты, замененные в положениях 274, 300-304 и 306-312 в сочетании с Leu305 и Phe374. Эти модификации приводят к тому, что FVIIa спонтанно достигнет более активного уровня, чем тот, который обычно стимулирует TF.
Петерсон и Олсен (US 2003/0104978 и 2003/0100740, 29 сентября 2000 года) далее описывают другие модифицировавшие молекулы FVIIa с точковыми мутациями, отличающихся от замещений Ala в положениях Lys157, Lys337, Asp334, Ser336, Val158, Glu296 и Met298.
Рингель и Клаусен (US 2002/0151471 и US 2002/0137673, 2 октября 2000) заявляют препарат, содержащий множество факторов FVII или родственных полипептидов, которые содержат некоторые пропорции гликозилатов различного N-типа
Руф и другие (WO 02/38162, 9 ноября 2000 года) патентуют варианты FVII/FVIIa с модификациями Met298Gln, Glu296Ile и Val158Asn или их сочетания, обеспечивающие повышенную амидолизную активность в отсутствии TF и более высокое родовое сходство с TF. Этот фактор был далее модифицирован, чтобы увеличить его устойчивость в модифицированных трипсин-подобных сайтах расщепления в Lys32, Lys38, Arg290, Arg304, Arg315 и Lys341 и химотрипсин-подобных сайтах расщепления в Ile42, Tyr44, Phe278 и Tyr332.
Перссон (WO 02/077218, 22 марта 2001 года) заявляет мутанты FVII/FVIIa, в которых мутированы аминокислоты 247-260, 393-405 и Pro406, более конкретно R396, Q250 и Pro406, предпочтительно аминокислота, к которой может быть прикреплена химическая группа с целью увеличения полужизни FVII/FVIIa. Это может быть объединено с мутациями, которые увеличивают активность FVII/FVIIa в К157, V158, Е296, М298, L305, D334, S336, К337 и F374.
Перссон и Олсен (US 2003/0100075, 27 сентября 2001 года) заявляют, что Leu305 расположен в конце α-спирали в комплексной форме TF в FVIIa, который, как полагают, является важным для активности. В свободном факторе FVIIa эта спираль искажена и, таким образом, возможно, неустойчива. Замена Leu305 другими аминокислотами приводит согласно этому изобретению к вариантам, которые достигают активной конформации, которая в ином случае обеспечивается TF. Аминокислоты Lys157, Lys337, Asp334, Ser336, Val158, Glu296 и Met298 расположены в областях, которые влияют на формирование солевого мостика между Ile153 и Asp343. Замена этих аминокислот приводит согласно этому изобретению к облегчению вставки М-конца протеазы, в частности создание солевого мостика необходимо для повышения активности.
Перссон и Олсен (US 2003/0130191, 2 ноября 2001 года) далее предлагают модифицированные мутанты фактора FVII/VIIa с повышенной специфической активностью, которые замещаются другими аминокислотами в положениях: 313-329, 364, 366, 373 и 376, также как в положениях 330-339.
Haaning и другие (WO 03/093465, 30 апреля 2002 года) патентуют Nelseastuen (модификация домена Gla для повышения связывания фосфолипида, а именно замена в Pro10 предпочтительно Gln, Lys32, предпочтительно Glu, Asp33, предпочтительно гидрофобной аминокислотой, предпочтительно Phe, Ala34, предпочтительно отрицательно заряженной аминокислотой, предпочтительно Glu, и вставку аминокислоты после Ala3, предпочтительно Tyr, с введением дополнительных сайтов N-гликозилирования.
Foncuberta и другие (WO 2004/011675, 25 июля 2002 года) описывают встречающиеся в природе аллельные варианты фактора FVII, которые теоретически могут привести к более высоким уровням экспрессии и улучшению функции фактора FVIIa. Не приведены никакие данные по таким улучшенным свойствам. Два варианта из 49 были найдены в экзоне и привели к замещению аминокислот: A294V и R353Q.
Перссон и Олсен (WO 2004/029090, 25 сентября 2002 года) показали, что мутирующий Phe374 в сочетании с некоторыми другими аминокислотами приводит к увеличению активности TF независимо от фактора FVIIa TF, а именно, L305V, S314E, К337А и F374Y привели к увеличению амидолизной активности TF.
Хаанин и другие (WO 2004/029091, 30 сентября 2002 года) модифицировал фактор FVII при L39, I42, S43, К62, L65, F71, Е82 и F275 на сайте связи TF FVII/FVIIa, увеличивая сродство с TF.
Андерсен и другие (WO 2004/083361, 20 марта 2003 года) модифицировал фактор FVII/FVIIa в положениях 196 (D196N/K), 237 (G237L или вставках GAA GAAA или GAAAA) и 341 (K341N/Q), чтобы увеличить сродство с TF.
Блайчман и другие (WO 2004/108763, 5 июня 2003 года) модифицировал фактор FVII/FVIIa в области EGF на основании анализа различий между областями EGF человека и кролика, поскольку фактор VIIa кролика имеет более высокую степень сродства с человеческим фатором TF, как человеческий фактор VIIa. Было заявлено и показано, что мутанты в положениях 53, 62, 74, 75 и 83 имеют более высокую степень сродства с человеческим фактором TF и увеличивают гемостатический потенциал.
Хаанинг и другие (WO 2004/111242, 19 июня 2003 года) модифицировал фактор FVII/FVIIa в положениях: 4, 10, 28, 32, 33, 34, 36, 74, 77, 116, предпочтительно A3Y, P10Q, R28F, К32Е, D33F, A34L, R36E, К38Е, P74S, Е77А, E116D. Мутация R36E вызывает уменьшение связи с TF и снижает генерацию тромбинов в биопробах, зависимых от TF при поддержании той же активности в биопробах, зависимых от PL.
Джохансен и другие (WO 2005/032581, 7 октября 2003 года) описывает гибридные молекулы, состоящие из домена связи липидной мембраны с доменом активности фактора VII, опционно сопряженного с наполнителем, предпочтительно с PEG.
Маун и другие (Protein Sci. (2005) 14:1171-80) ввел новые дисульфидные связи, чтобы удержать конформацию фактора FVII в активном состоянии, подобном состоянию фактора TF*FVIIa. Кинетический анализ амидолизной активности показал, что все варианты фактора VIIa увеличили специфическую активность по сравнению с диким типом, причем наибольшая активность имела место в вариантах 136:160 и 138:160 с субстратом S-2765, имеющими 670-кратное и 330-кратное увеличение соответственно. Фактор VIIa в дисульфидно-блокированных вариантах больше не требовал TF в виде софактора для максимальной активности в амидолизной биопробе. В присутствии растворимого TF активность повышалась в 20 и 12 раз для вариантов 136:160 и 138:160, соответственно, по сравнению с диким типом.
Подробное описание изобретения
Целью настоящего изобретения является создание модифицированных витамин К-зависимых полипептидов, например модифицированных факторов FVII и FVIIa c увеличенным функциональным временем полужизни.
Фактор FVII относится к другим белкам домена Gla, подобно фактору FIX, FX, протеину С, протеину Z, протромбину, GAS6 и протеину S. В близком сродстве состоят факторы FVII, FIX, FX и Протеин С, в которых N-конец домена Gla сопровождается двумя эпидермальными доменами фактора роста (EGF), сопровождаемыми доменом серин-протеазы трипсин-типа. Протеин Z имеет аналогичную структуру, но с пассивным доменом протеазы. В протромбине домен Gla сопровождается двумя крингель-доменами вместо двух доменов EGF, которые сопровождаются доменом протеазы трипсин-типа. В GAS6 и протеине S домен Gla сопровождается четырьмя доменами EGF и затем двумя доменами ламинина-G вместо области протеазы.
Поразительна большая разница во времени полужизни плазмы близкородственных белков плазмы:
| FVII | 2-4 часа |
| Протеин С | 6-8 часов |
| FIX | 18-30 часов |
| FX | 20-42 часа |
| Протеин S | 24-58 часов |
| Протромбин | 41-72 часа |
Конкретная близкородственная подгруппа этих белков содержит FVII, FIX, FX и Протеин С.
На фиг.1 сравнивается гомология между FVII, белком С, FIX и FX человеческого происхождения и другими биологическими видами. Молекулы консервативны, и наиболее поразительное различие выявлено в домене активации. Для фактора FVII пептид активации не был описан. Однако при активации фактор FVII в дополнение к расщеплению в Arg152 мог также быть расщеплен в Arg144 с освобождением предполагаемого пептида активации восьми аминокислот, содержащих консервативный сайта N-гликозилирования.
Удивительно то, что длина пептидов активации и посттрансляционных модификаций пептидов активации коррелируется с увеличенным временем полужизни (табл.1).
| Таблица 1 | |||
| Время полужизни плазмы | Длина активационного пептида человека | Место N-глюзилирования в активационном пептиде | |
| FVII | 2-4 часа | Активационный пептид (или предполагаемый активационный пептид 8 аминокислот) отсутствует | 1 в предполагаемом активационном пептиде 8 аминокислот |
| Протеин С | 6-8 часов | 16 аминокислот | 0 |
| FIX | 18-30 часов | 34 аминокислоты | 2 |
| FX | 20-42 часа | 51 аминокислоты | 2 |
Таким образом, изобретение относится к способу получения модификационного витамин К-зависимого полипептида, включающего модификацию активационного пептида первого витамин К-зависимого полипептида, в результате чего модифицированный витамин К-зависимый полипептид имеет увеличенный период полужизни по сравнению с первым полипептидом, зависимым от витамина К, в котором активационный пептид не был изменен.
Изобретение далее относится к способу приготовления такого модификационного витамин К-зависимого полипептида, включающего стадию модификации активационного пептида первого витамин К-зависимого полипептида, добавляя, по меньшей мере, часть активационного пептида второго витамин К-зависимого полипептида, или заменяя по меньшей мере, часть активационного пептида первого витамин К-зависимого полипептида, по меньшей мере, частью активационного пептида второго витамин К-зависимого полипептида.
Витамин К-зависимые полипептиды представляют собой группу белков, которые нуждаются в витамине К на своем биосинтетическом пути метаболизма к карбоксилатной группе или боковым цепям глютаминовых кислотных остатков своих белковых предшественников. Витамин К-зависимые полипептиды включает, но не ограничиваются этим, фактор VII, фактор VIIa, фактор IX, фактор IXa, фактор X, фактор Ха, фактор II (протромбин). Протеин С, активированный Протеин С, протеин S, активизированный протеин S, GAS6, активизированный GAS6, протеин Z, активизированный протеин Z и т.д. Кроме того, полезные витамин К-зависимые полипептиды могут быть дикого типа или могут содержать мутации. Степень и местоположение глюкозирования или других посттрансляционных модификаций могут изменяться в зависимости от выбранных клеток хозяина и природы главной окружающей клеточной среды. Что касается определенных аминокислотных последовательностей, то посттрансляционные модификации таких последовательностей описаны в настоящей заявке.
"Фактор VII/VIIa" как он используется в настоящей заявке, означает продукт, состоящий либо из неактивированной формы (фактор VII) или активизированной формы (фактор VIIa) либо их смесей. "Фактор VII/VIIa" в вышеупомянутом определении включает белки, которые имеют аминокислотную последовательность естественного человеческого фактора VII/VIIa. Этот фактор также включает белки со слегка модифицированной аминокислотной последовательностью, например модифицированный N-конец, включая N-конец для извлечения или добавки аминокислоты, в той мере, в какой белки, в основном, сохраняют активность фактора VIIa. «Фактор VII» в рамках вышеупомянутого определения также включает естественные аллельные изменения, которые могут существовать и переходить от одного индивидуума к другому. «Фактор VII» в рамках вышеупомянутого определения дополнительно включает варианты FVII/FVIIa. Такие варианты отличаются по одному или большему количеству аминокислотных остатков от последовательности дикого типа. Примеры таких различий могут включать укорочение N- и/или С-конца одного или нескольких аминокислотных остатков (например, от 1 до 10 аминокислотных остатков), или дополнений в виде одного или нескольких дополнительных остатков на N- и/или С-конце, например добавление остатка метионина в N-конец, также как консервативных замещений аминокислоты, т.е. замещений, выполненных в группах аминокислот с аналогичными характеристиками, например (1) небольшие аминокислоты, (2) кислые аминокислоты, (3) полярные аминокислоты, (4) основные аминокислоты, (5) гидрофобные аминокислоты и (6) ароматические аминокислоты. Примеры таких консервативных замен показаны в табл.2.
| Таблица 2 | ||||
| (1) | Аланин | Глицин | ||
| (2) | Аспартовая кислота | Глутаминовая кислота | ||
| (3) | Аспарагин | Глутамин | Серин | Треонин |
| (4) | Аргинин | Гистидин | Лизин | |
| (5) | Изолейцин | Лейцин | Ветионин | Валин |
| (6) | Фенилаланин | Тирозин | Триптофан |
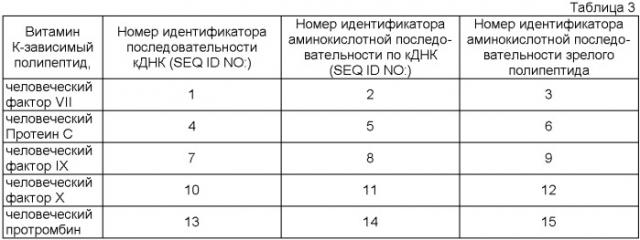
Аминокислотные последовательности различных витамин К-зависимых полипептидов и кодирующие их последовательности кДНК показаны в табл.3.
Первый витамин К-зависимый полипептид предпочтительно выбран из группы, состоящей из фактора VII, фактора VIIa, фактора IX, фактора IXa, протеина С и активированного протеина С. Более предпочтительно, чтобы первый витамин К-зависимый полипептид, был бы выбран из группы, состоящей из человеческого фактора VII, человеческого фактора VIIa, человеческого фактора IX, человеческого фактора IXa, человеческого протеина С и человеческого активизированного протеина С. Наиболее предпочтительно первый витамин К-зависимый полипептид - человеческий фактор VII или человеческий фактор VIIa. В конкретном варианте первый витамин К-зависимый полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из номеров идентификатора последовательностей (SEQ ID Nos): 3, 6 и 9.
Второй витамин К-зависимый полипептид отличается от первого витамин К-зависимого полипептида. Соответственно, модифицированный витамин К-зависимый полипептид, полученный по процессу настоящего изобретения, содержит, по меньшей мере, часть активационного пептида, в естественном виде не встречающегося в первом витамин К-зависимом полипептиде.
Второй витамин К-зависимый полипептид имеет более продолжительное время полужизни в плазме, чем первый витамин К-зависимый полипептид. В другом варианте длина активационного пептида второго витамин К-зависимого полипептида больше длины активационного пептида первого витамин К-зависимого полипептида.
Предпочтительно, чтобы второй витамин К-зависимый полипептид был бы выбран из группы, состоящей из фактора IX, фактора Х и протромбина. Более предпочтительно, если второй витамин К-зависимый полипептид выбран из группы, состоящей из человеческого фактора IX, человеческого фактора Х и человеческого протромбина. В конкретном варианте второй витамин К-зависимый полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей номеров SEQ ID NO: 9, 12 и 15.
Часть добавленного активационного пептида второго витамин К-зависимого полипептида предпочтительно состоит, по меньшей мере, из 8, более предпочтительно, по меньшей мере, из 12 и еще более предпочтительно, по меньшей мере, из 15 смежных аминокислот в аминокислотной последовательности активационного пептида второго витамин К-зависимого полипептида.
В другом варианте часть добавленного активационного пептида второго витамин К-зависимого полипептида может состоять, по меньшей мере, из 0,15·N смежных аминокислот в аминокислотной последовательности активационного пептида второго витамин К-зависимого полипептида, в котором N - общее количество аминокислот активационного пептида второго витамин К-зависимого полипептида. Предпочтительно часть активационного пептида второго витамин К-зависимого полипептида состоит, по меньшей мере, из 0,5·N, более предпочтительно, по меньшей мере, из 0,75·N, еще более предпочтительно, по меньшей мере, из 0,9·N, и, наиболее предпочтительно, по меньшей мере, из 0,95·N смежных аминокислот в аминокислотной последовательности активационного пептида второго витамин К-зависимого полипептида. В еще одном варианте часть добавленного активационного пептида второго витамин К-зависимого полипептида состоит, по меньшей мере, из (N-x) смежных аминокислот в аминокислотной последовательности активационного пептида второго витамин К-зависимого полипептида, в котором N - общее количество аминокислот активационного пептида второго витамин К-зависимого полипептида и в котором х может быть 7, предпочтительно х - 5, более предпочтительно х - 4, более предпочтительно х - 3 и еще наиболее предпочтительно х - 2.
Также возможно, что часть добавленного активационного пептида второго витамин К-зависимого полипептида состоит из центральной части активационного пептида, т.е. она не содержит С-конца аминокислоты или N-конца аминокислоты активационного пептида.
Наиболее предпочтительно, чтобы полный активационный пептид второго витамин К-зависимого полипептида был бы добавлен к аминокислотной последовательности первого витамин К-зависимого полипептида при сохранении специфики активации первого витамин К-зависимого полипептида. Альтернативно вариант полного активационного пептида второго витамин К-зависимого полипептида может быть добавлен к аминокислотной последовательности первого витамин К-зависимого полипептида. Варианты включают активационные пептиды, в которые были добавлены, удалены и/или замещены в пределах от 1 до 10, предпочтительно от 1 до 7, более предпочтительно от 1 до 5 и наиболее предпочтительно от 1 до 3 аминокислот.
Если период полужизни профермента должен быть продлен, сайты расщепления N- и С-концов активации первого витамин К-зависимого полипептида предпочтительно удерживаются в различных активационных пептидах. Также, если период полужизни активизированной формы витамин К-зависимого полипептида должен быть продлен либо сайты расщепления N- или С-конца активации первого витамин К-зависимого полипептида должны быть удалены, предпочтительно должен быть удален сайт расщепления N-конца активации. Если период полужизни FVIIa должен быть продлен, предпочтительно сайты расщепления N-конца активации должны быть удалены, тогда как предпочтительно сайты расщепления С-конца активации должны быть сохранены.
В табл.3 просуммирована последовательность активационных пептидов от нескольких витамин К-зависимых полипептидов.
Термин "активационный пептид", как он используется здесь, включает известные активационные пептиды и предполагаемые активационные пептиды типа указанных в факторе VII.
В качестве не ограничивающего примера любая из следующих аминокислотных последовательностей может быть добавлена к аминокислотной последовательности SEQ ID номера 3 или 6
аа от 1 до 35 последовательности SEQ ID NO: 18;
аа от 1 до 34 последовательности SEQ ID NO: 18;
аа от 1 до 33 последовательности SEQ ID NO: 18;
[… …]
аа от 1 до 8 последовательности SEQ ID NO: 18;
аа от 1 до 7 последовательности SEQ ID NO: 18;
аа от 1 до 6 последовательности SEQ ID NO: 18;
аа от 1 до 5 последовательности SEQ ID NO: 18;
аа от 2 до 35 последовательности SEQ ID NO: 18;
аа от 2 до 34 последовательности SEQ ID NO: 18;
аа от 2 до 33 последовательности SEQ ID NO: 18;
[… …]
аа от 2 до 9 последовательности SEQ ID NO: 18;
аа от 2 до 8 последовательности SEQ ID NO: 18;
аа от 2 до 7 последовательности SEQ ID NO: 18;
аа от 2 до 6 последовательности SEQ ID NO: 18;
аа от 3 до 35 последовательности SEQ ID NO: 18;
аа от 3 до 34 последовательности SEQ ID NO: 18;
аа от 3 до 33 последовательности SEQ ID NO: 18;
[… …]
аа от 3 до 10 последовательности SEQ ID NO: 18;
аа от 3 до 9 последовательности SEQ ID NO: 18;
аа от 3 до 8 последовательности SEQ ID NO: 18;
аа от 3 до 7 последовательности SEQ ID NO: 18;
и т.д.
В качестве не ограничивающего примера любая из следующих аминокислотных последовательностей может быть добавлена к аминокислотной последовательности SEQ ID NO: 3, 6 или 9
аа от 1 до 52 последовательности SEQ ID NO: 19;
аа от 1 до 51 последовательности SEQ ID NO: 19;
аа от 1 до 50 последовательности SEQ ID NO: 19;
[… …]
аа от 1 до 8 последовательности SEQ ID NO: 19;
аа от 1 до 7 последовательности SEQ ID NO: 19;
аа от 1 до 6 последовательности SEQ ID NO: 19;
аа от 1 до 5 последовательности SEQ ID NO: 19;
аа от 2 до 52 последовательности SEQ ID NO: 19;
аа от 2 до 51 последовательности SEQ ID NO: 19;
аа от 2 до 50 последовательности SEQ ID NO: 19;
[… …]
аа от 2 до 9 последовательности SEQ ID NO: 19;
аа от 2 до 8 последовательности SEQ ID NO: 19;
аа от 2 до 7 последовательности SEQ ID NO: 19;
аа от 2 до 6 последовательности SEQ ID NO: 19;
аа от 3 до 52 последовательности SEQ ID NO: 19;
аа от 3 до 51 последовательности SEQ ID NO: 19;
аа от 3 до 50 последовательности SEQ ID NO: 19;
[… …]
аа от 3 до 10 последовательности SEQ ID NO: 19;
аа от 3 до 9 последовательности SEQ ID NO: 19;
аа от 3 до 8 последовательности SEQ ID NO: 19;
аа от 3 до 7 последовательности SEQ ID NO: 19;
и т.д.
Часть полного активационного пептида второго витамин К-зависимого полипептида вставлена вблизи около области активационного пептида первого витамин К-зависимого полипептида. Она может быть вставлена между двумя аминокислотами первого витамин К-зависимого полипептида без удаления аминокислот первого витамин К-зависимого полипептида. Например, в случае FVII, который является первым витамин К-зависимым полипептидом, часть полного активационного пептида второго витамин К-зависимого полипептида может быть вставлена между аминокислотами 144 и 145, между аминокислотами 145 и 146, между аминокислотами 146 и 147, между аминокислотами 147 и 148, между аминокислотами 148 и 149, между аминокислотами 149 и 150, между аминокислотами 150 и 151, между аминокислотами 151 и 152 или между аминокислотами 152 и 153, где нумерация относится к последовательности SEQ ID NO: 3. Предпочтительно часть полного активационного пептида второго витамин К-зависимого полипептида вставлена между аминокислотами 144 и 145, где нумерация относится к SEQ ID NO: 3. Предпочтительно Сайт расщепления С-конца и специфика активации первого витамин К-зависимого полипептида при вставке сохраняются. Сайт расщепления N-конца может быть удален вставкой.
С другой стороны, часть полного активационного пептида второго витамин К-зависимого полипептида заменяет участок аминокислот в первом витамин К-зависимом полипептиде. Например, в случае FVII, который является первым витамин К-зависимым полипептидом, часть полного активационного пептида второго витамин К-зависимого полипептида может заменять аминокислоты от 140 до 152 в последовательности SEQ ID NO: 3. Предпочтительно сайт расщепления С-конца и специфика активации первого витамин К-зависимого полипептида при вставке сохраняются. Сайт расщепления N-конца может быть уделен вставкой.
Сайт расщепления N-конца может быть удален, заменяя некоторые аминокислоты первого витамин К-зависимого полипептида частью или полным активационным пептидом второго витамин К-зависимого полипептида. Соответственно, часть полного активационного пептида второго витамин К-зависимого полипептида может заменять любую из следующих аминокислотных последовательностей SEQ ID NO: 3:
аа от 140 до 145;
аа от 141 до 145;
аа от 142 до 145;
аа от 143 до 145;
аа от 144 до 145;
аа 145;
аа от 140 до 144;
аа от 141 до 144;
аа от 142 до 144;
аа от 143 до 144; или
аа 144.
В другом варианте сайты протеолитического расщепления в первом витамин К-зависимом полипептиде, которые являются N-концом и С-концом области активационного пептида, сохраняются в процессе модификации. Таким образом, сохраняется специфика активации первого витамин К-зависимого полипептида.
В другом варианте, если время полужизни в плазме профермента должно быть продлено, сайты расщепления N-конца и С-конца активации второго витамин К-зависимого полипептида заменяют сайты первого витамин К-зависимого полипептида, или сайт расщепления N-конца активации может быть извлечен из первого витамин К-зависимого полипептида, и сайт расщепления С-конца активации может быть извлечен из второго витамин К-зависимого полипептида, или наоборот. Если время полужизни в плазме активизированного витамин К-зависимого полипептида должно быть стабилизировано, то сайт расщепления С-конца или N-конца активации должен быть удален, В случае устойчивого фактора FVIIa активационный пептид должен быть сохранен с легкой цепью N-конца. Это подразумевает то, что сайт расщепления С-конца активации должен быть сохранен, тогда как сайт расщепления N-конца активации, полученный от витамин К-зависимого полипептида, должен быть удален. Также может оказаться необходимым удалить гипотетический сайт расщепления активационного пептида в Arg144.
Модификация может дополнительно включать вставку активационного пептида второго витамин К-зависимого полипептида или, как вариант, удаление, по меньшей мере, части активационного пептида первого витамин К-зависимого полипептида, в то время как предпочтительно сохранить специфику активации первого витамин К-зависимого полипептида. Часть, которая будет удалена, может состоять, по меньшей мере, из 2, предпочтительно 4, более предпочтительно, по меньшей мере, из 6 и еще более предпочтительно, по меньшей мере, из 8 смежных аминокислот активационного пептида первого витамин К-зависимого полипептида.
В другом варианте часть активационного пептида первого удаленного витамин К-зависимого полипептида может состоять, по меньшей мере, из 0,15·N смежных аминокислот в аминокислотной последовательности активационного пептида первого витамин К-зависимого полипептида, в котором N - общее количество аминокислот активационного пептида первого витамин К-зависимого полипептида. Предпочтительно часть активационного пептида первого витамин К-зависимого полипептида состоит, по меньшей мере, из 0,5·N, более предпочтительно, по меньшей мере, из 0,75·N, еще более предпочтительно, по меньшей мере, из 0,9·N, наиболее предпочтительно, по меньшей мере, из 0,95·N смежных аминокислот в аминокислотной последовательности активационного пептида первого витамин К-зависимого полипептида.
В еще одном варианте часть активационного пептида первого удаленного витамин К-зависимого полипептида состоит, по меньшей мере, из (N-x) смежных аминокислот в аминокислотной последовательности активационного пептида первого витамин К-зависимого полипептида, в котором N - общее количество аминокислот активационного пептида первого витамин К-зависимого полипептида, в котором х может быть 7, предпочтительно х - 5, более предпочтительно х - 4, более предпочтительно х - 3 и наиболее более предпочтительно х - 2.
Также возможно, что часть активационного пептида первого удаленного витамин К-зависимого полипептида состоит из центральной части активационного пептида, т.е. он не содержит собственно аминокислоту С-конца или собственно аминокислоту N-конца активационного пептида.
В конкретном варианте полный активационный пептид первого витамин К-зависимого полипептид