Способ определения скорости гибели живых микробов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способу определения скорости гибели живых микробов. Способ позволяет использовать определение скорости гибели микробов для определения эффективности антимикробных препаратов. Способ заключается в определении скорости гибели микробов, основанном на вычислении по формуле нормированного по интервалу времени логарифма отношений, измеренных в два разных, отстоящих на данный интервал, момента времени процесса гибели микробов. Изобретение позволяет сократить время, повысить точность и упростить определение скорости гибели микробов. 1 з.п. ф-лы, 2 ил.
Реферат
Предлагаемое изобретение относится к области медицины, микробиологии, пищевых и промышленных биотехнологий, а именно к исследованию биологических материалов путем определения их физических и химических свойств с помощью оптических средств, к биологическим системам, в которых материал возбуждается оптическими средствами и флуоресцирует.
В природе факторами гибели микробов чаще всего выступают физические и химические процессы, протекающие в непосредственной среде обитания микроба, а также биологические конфликты разного механизма реализации. При наличии вышеуказанных факторов количество живых особей в популяции уменьшается, и будет наблюдаться гибель микробов. Но если скорость размножения в силу одновременно присутствующих благоприятных условий превышает вероятность гибели, нормированную на единицу времени, будет наблюдаться рост популяции. В случае биологического конфликта это можно констатировать, например, при прогрессирующих стадиях развития болезней человека, вызванных микробным фактором. С целью терапевтического вмешательства в процесс развития болезни применяется воздействие на среду обитания микроба, т.е. организм человека с помощью физиотерапевтических процедур и фармакологических препаратов, направленных на увеличение скорости гибели микроба. Для определения степени бактерицидности и бактериостатичности химического препарата необходимо измерять скорость гибели микробов, находящихся под воздействием препарата, что и является целью предлагаемого изобретения.
При воздействии химического лечебного препарата искусственного и/или естественного происхождения на систему, содержащую микроб, чаще всего происходит избирательная гибель живых микроорганизмов, либо этого не происходит. По измеренному количеству живых микробов на основе определения скорости их гибели в нескольких моментах времени, в течение которого происходит воздействие лечебного препарата, можно объективно оценить эффективность лечения. При этом в указанном контексте в настоящее время методы определения концентраций живых микробов на фоне всех микробов имеют субъективный уровень оценки, при этом измерение скорости их гибели не может быть проведено с нужной точностью вследствие наличия разрушенных микробных тел в микробных ассоциациях. Это связано с тем, что в большинстве случаев непосредственное определение концентрации микробов содержит систематический множитель, который не влияет на показатель определяемой скорости гибели.
Известен способ определения скорости гибели микробов на основе дискодиффузионного метода, в котором приблизительную скорость гибели микробов определяют по визуальной оценке, в течение определенного интервала времени по изменениям зоны поражения микробной суспензии антимикробным препаратом. Затем по найденным интервалам вычисляют скорость (Осипов Г.А., Парфенов А.И., Богомолов П.О. Сравнительное хромато-масс-спектрометрическое исследование состава химических маркеров микроорганизмов в крови и биоптатах слизистой оболочки кишечника. Российский гастроэнтерологический журнал. 2001, 1: 54-69) [4].
Этот способ определения скорости гибели микробов позволяет определять скорость гибели микробов несложным, но длительным образом, он достаточно неточен и имеет субъективный характер оценки.
Известен также способ определения скорости гибели микробов, который позволяет определять скорость их гибели непосредственно, во многих условиях наблюдения и основан на прямом подсчете количества клеток во времени при помощи лабораторного контроля, на основе которого устанавливают кинетику изменения и далее делают вывод о скорости гибели микробов (Garrett ER. Kinetics of antimicrobial action. Scand J Infect Dis Suppl. 1978; 14: 54-85) [1].
Этот способ определения скорости гибели микробов позволяет определять скорость гибели микробов без косвенных показателей.
Недостаток аналога в том, что он достаточно сложен и дорог, а также не позволяет проводить измерение в экспресс-режиме.
Наиболее близким по технической сущности к предлагаемому является способ определения скорости гибели микробов, который основан на оценке скорости гибели с использованием техники хромато-масс-спектрометрии для проведения анализа относительной концентрации микробов в нужный момент времени. Для этого при использовании данной технологии определяют по способу концентрацию специфических молекул, принадлежащих микробам, и на их основании судят о количестве микробных клеток. Осуществляется оценка уменьшения популяции живых организмов при помощи лабораторного трудоемкого анализа, что не позволяет достаточно быстро оценивать эту величину. Такие проблемы связаны с необходимостью предварительной обработки субстрата химическими препаратами с целью спецификации молекул, принадлежащих микробам исследуемого типа, и с применением для дальнейшего детектирования этих химических компонент дорогостоящей аппаратуры, что в конечном итоге позволяет рассчитать скорость гибели микробов по формуле (1) (Осипов Г.А. Демина А.М. Хромато-масс-спектрометрическое обнаружение микроорганизмов в анаэробных инфекционных процессах. Вестник РАМН. - 1996. Т.13, №2, с.52-59) [3].
где K - скорость гибели микробов, t1 и t2 - моменты времени первого и второго наблюдения, C(t1) и C(t2) - измеренные концентрации в моменты времени первого и второго наблюдения.
Этот способ определения скорости гибели микробов позволяет делать это с хорошей чувствительностью, точностью и специфичностью.
Но недостаток способа в том, что он достаточно сложен и дорог, а также не позволяет проводить измерение в экспресс-режиме.
Техническим результатом предлагаемого способа является сокращение времени определения скорости гибели микробов, повышение точности и простота определения скорости гибели микробов.
Указанный технический результат достигается тем, что в способе определения скорости гибели живых микробов, основанном на вычислении по формуле нормированного по интервалу времени логарифма отношений, измеренных в два разных, отстоящих на данный интервал, момента времени процесса гибели микробов, берут отношение мощностей флуоресценции линейных концентраций микробов в анализируемых идентичных биосубстратах в моменты времени t1 и t2, измеренные в данный интервал времени:
K=(1/(t2-t1))ln(F(t1)/F(t2)), при F (t1)=Fdet(t1)-f(t1), F(t2)=Fdet(t2)-f(t2)
где K - скорость гибели микробов, t1 и t2 - моменты времени первого и второго измерения, F(t1) и F(t2) - измеренные мощности флуоресценции биосубстрата в моменты времени первого и второго измерения; добавление экспериментально определенной концентрации бактерицидного детергента, определяемой по максимуму зависимости параметра флуоресценции от концентрации добавленного детергента в отдельном измерении, описывается разностью мощностей флуоресценции биосубстратов в моменты времени t1 и t2:
K=(1/(t2-t1))ln((Fdet(t1)-f(t1))/(Fdet(t2)-f(t2)))=(1/(t2-t1))ln(F(t1)/F(t2))
где K - скорость гибели микробов, t1 и t2 - моменты времени первого и второго измерения, f(t1) и f(t2) - измеренные мощности флуоресценции биосубстрата до добавления детергента в моменты времени первого и второго измерения, Fdet(t1) и Fdet(t2) - мощности флуоресценции, измеренные в моменты времени первого и второго измерения после добавления бактерицидного детергента в биосубстрат, а экспериментально выявленную концентрацию детергента определяют по максимуму зависимости параметра флуоресценции от концентрации добавленного детергента в отдельном измерении, при этом в случае использования флуоресцирующего детергента скорость гибели вычисляют по модифицированной формуле (1), добавляя в числитель и знаменатель подлогарифмической дроби параметр флуоресценции детергента, рассчитанный на основании предварительных измерений параметров флуоресценции зависимых от концентрации детергента в биосубстрате, со знаком минус, в этом случае:
K=(1/(t2-t1))ln((Fdet(t1)-f(t1)-D)/(Fdet(t2)-f(t2)-D)),
где D - параметр флуоресценции раствора антисептического бактерицидного детергента без учета органических примесей в биосубстрате, также используют линейные по отношению концентраций параметры в качестве мощностей флуоресценции.
Описание способа
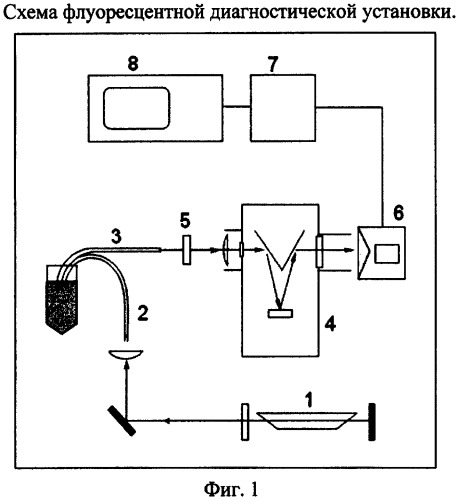
Предлагаемый способ определения скорости гибели микробов основывается на измерениях линейно зависящих от концентраций микробов спектральных интенсивностей их флуоресценции, возбуждаемой лазером, в два различных момента времени процесса гибели микробов. В приборной реализации используются следующие устройства, входящие в состав установки (Фиг.1) для лазерно-флуоресцентной диагностики, представляющей собой лазер (1) с соответствующе подобранной длиной волны генерации, раздвоенный оптический кабель с волокнами для подвода возбуждающего излучения (2) к анализируемому образцу и снятия флуоресцентного отклика и подвода его к спектроанализатору (3), спектроанализатор (4), состоящий из оптического фильтра на длину волны накачки (5), диспергирующий элемент, и многоканальный полупроводниковый детектор (6), усилитель электрического сигнала, АЦП (7) и ЭВМ (8), имеющая программное обеспечение для обработки и хранения спектральной информации. Программное обеспечение написано по алгоритму, позволяющему на основе снятого спектра оценивать скорость гибели микроба.
В настоящей клинической методике, реализуемой на аппарате «Спектролюкс-МБ», используется низко интенсивное лазерное излучение с длинной волны 632.8 нм. Данный диапазон длин волн является диапазоном возбуждения порфириносодержащих соединений и структур. Порфирины в составе ферментных систем, цитохромов и витаминов являются неотъемлемым компонентом метаболизма клетки и работы ферментных систем микробной клетки и организма человека в норме и при патологическом состоянии [8].
Принцип флуоресцентной диагностики, используемой в целях данного технического решения, основан на регистрации как с помощью интегрального детектора, так и с помощью различных многоканальных детекторов с диспергирующими элементами испускаемого оптически возбужденными лазером органическими молекулами порфиринов и порфириносодержащих структур, входящими в состав микробов в качестве биологически активных компонент, света с определением его параметров.
Поэтому показатель, который оценивается в этом анализе, является зависимым от типа молекул и их концентраций. Этот показатель является интегральным, т.е. складываемых из сигналов от отдельных химических и биологических компонент подсвечиваемого лазером субстрата. Различные образцы исследуемого биологического субстрата (кровь, гной, слюна, культура микроорганизмов) являются сложной динамической микробиологической системой, содержащей одномоментно и в разных пропорциях микроорганизмы живые, с деформированной клеточной стенкой, в стадии лизиса, разрушенные и мертвые микробы. Флуоресцентный сигнал от сложных биосубстратов будет определяться всеми ими. Метод, разработанный ООО «НПЦ Спектролюкс», позволяет оценить интегральную интенсивность флуоресценции биосубстрата.
Для определения параметра, пропорционального только концентрации живых микробов, в каждый момент времени измеряют флуоресцентный сигнал непосредственно биосубстрата и сигнал от того же биосубстрата с добавленным в него бактерицидным детергентом, действие которого обусловлено гидрофобным взаимодействием с липидным биослоем мембран бактерий и других микроорганизмов, увеличения проницаемости их клеточных стенок и цитоплазматических мембран и, таким образом, инициации цитолиза живых микроорганизмов в биосубстрате. Оптимальную дозу бактерицидного детергента при этом рассчитывают заранее на живой модели культуры по максимуму параметра интенсивности флуоресценции, зависящей от концентрации добавленного детергента.
Экспериментальный расчет концентрации бактерицидного детергента на модели микробосодержащей суспензии (живая культура Е. Coli штамм (АТСС25922) в концентрации 10-7 в физиологическом растворе) представлен в примере №1.
В результате проведения в двух изначально идентичных по составу и времени получения биосубстратах, но в разные моменты времени гибели бактерий будут получены четыре величины. Они связаны с концентрациями микробов в следующих пропорциях:
Где Fdet - параметр флуоресценции, измеренный после добавления детергента в биосубстрат, f - параметр флуоресценции, измеренный до добавления детергента в биосубстрат, dF - разность этих параметров, h - систематический множитель. В скобках показаны моменты времени измерений параметров.
Видно, что если подставить концентрацию С из этих соотношений в формулу (1), то коэффициент пропорциональности h, являющийся зависящим от условий измерения аппаратным параметром, сократится, и зависимость от него не будет присутствовать в получающемся выражении:
K=(1/(t2-t1))ln((dF(t1)/h)/(dF(t2)/h))=(1/(t2-t1))ln(dF(t1)/dF(t2)) (3)
С помощью комбинированного с применением бактерицидных детергентов флуоресцентного детектирования микробов в биосубстрате удается с хорошей точностью измерить скорость гибели микробов по формуле (3).
В формуле:
Первый множитель (1/(t2-t1) всегда больше «0», следовательно, рассмотрим только второй множитель:
ln((Fdet(t1)-f(t1))/(Fdet(t2)-f(t2)))=(1/(t2-t1))ln(F(t1)/F(t2))
Если F(t1) ≤ F(t2), следовательно, К<0, антибиотики неэффективны. Так как в момент времени t2 наличие живых микробов больше, чем в момент времени t1.
Если F(t1) ≥ F(t2), следовательно, К>0, антибиотики эффективны. Так как в момент времени t2 наличие живых микробов меньше, чем в момент времени t1.
В момент t2 биосубстрат имеет большую флуоресценцию F(t2) не за счет увеличения количества мертвых бактерий, а за счет процесса гибели живых при инициации и интенсификации процесса гибели за счет внесения детергента и, таким образом, увеличения количества порфиринов и порфириносодержащих структур, что находит отражение в резком кратковременном всплеске флуоресценции F(t2)>F(t1) (за счет процесса гибели живых, при N(t1)>N(t2) живых микроорганизмов), зависящем от объема, вида микроорганизма и концентрации микрорганизмов, содержащих порфирины. Всплеск флуоресценции после добавления детергента в момент t2 тем больше, чем больше было живых микроорганизмов, но включающий флуоресценцию порфиринов гибнущих и мертвых микроорганизмов, особенно в сложной суспензии. Затем флуресценция снижается за счет уменьшения количества живых бактерий и соответственно скорости гибели.
При добавлении бактерицидного детергента в качестве индикатора эффективности антибиотиков in vitro регистрируется флуоресценция оставшихся в живых после действия антибиотика микроорганизмов через процесс их гибели, отраженный в F(t2) порфиринов и порфириносодержащих структур, линейных количеству живых микроорганизмов.
Из-за наличия стационарной флуоресценции порфиринов мертвых микроорганизмов Fdet не будет равен 0.
Способ лишен систематических зависимостей от видовой специфичности микроорганизмов и обладает достаточной чувствительностью. При этом время непосредственного измерения флуоресценции определяется 5-10 секундами, а время приготовления биосубстратов к измерениям составляет около 1-5 минут. Время, отведенное на определение скорости гибели микробов, таким образом определяется временем, необходимым для действия антимикробного препарата in vitro.
Для удобства иногда лучше применять вместо интегральной мощности флуоресценции специальные спектральные параметры. Это обусловлено наличием примесей в исследуемых биологических субстратах, которые имеют характерный спектральный диапазон флуоресценции, отличающийся от диапазона флуоресценции молекул живых микробов. Тогда для повышения точности применяют отношение спектральных параметров, учитывающих эти особенности.
В случае использования флуоресцирующего детергента для определения скорости гибели микробов используют модифицированную формулу (1), добавляя в числитель и знаменатель подлогарифмической дроби параметр флуоресценции чистого бактерицидного детергента, рассчитанного на основании предварительных измерений параметров флуоресценции зависимых от концентрации детергента в биосубстрате, со знаком минус:
где D - параметр флуоресценции раствора бактерицидного детергента без учета органических примесей.
Повышение точности происходит при использовании нефлуоресцирующего бактерицидного детергента.
После определения скорости гибели микробов под воздействием антимикробного препарата возможно оценить эффективность и бактерицидность антимикробного препарата in vitro.
Примеры применения способа.
Клинический пример №1 (клинико-микробиологический)
Произведем расчет скорости гибели живых бактерий методом флуоресцентного анализа для оценки эффективности антимикробных препаратов на модели микробосодержащей суспензии с живой культурой 18 часов условно-патогенных микроорганизмов E.Coli (ATCC 25922) в физиологическом растворе в концентрации 10-7.
К микробосодержащей суспензии добавили стандартные растворы трех различных антимикробных препаратов в идентичном объеме: цефазолин (1), ампициллин (2), мирамистин 0,5% раствор (3). Проведены предварительные исследования флуоресценции растворов антибиотиков. Отмечена незначительная их флуоресценция по сравнению с микробной культурой.
В качестве детергента, инициирующего цитолиз живых микробных клеток, был использован хлоргексидин в экспериментально выявленной 0 концентрации 6 мкл на 1,5 мл микробосодержащей суспензии.
Пример экспериментального определения концентрации бактерицидного детергента (хлоргексидин) на модели микробосодержащей суспензии (живая культура Е. Coli штамм (ATCC 25922) в концентрации 107 в физиологическом растворе):
Fd=D - интенсивность флуоресценции детергента. В данном примере не учитывалась из-за значения ниже чувствительности спектрометра.
Fs+d=F - интенсивность флуоресценции суспензии с детергентом
| Объем бактерицидного детергента d на объем спектр. кюветы 1, 5 мл | Интенсивность флуоресценции |
| d1=1 мкл | F=0,001 |
| d2=2 мкл | F=0,0015 |
| d3=3 мкл | F=0,002 |
| d4=4 мкл | F=0,0023 |
| d5=5 мкл | F=0,0028 |
| d6=6 мкл | F=0,0050 |
| d7=7 мкл | F=0,0051 |
| d8=8 мкл | F=0,0055 |
| d9=9 мкл | F=0,0058 |
| d10=10 мкл | F=0,0061 |
где:
d - концентрация бактерицидного детергента на 1,5 мл спектрометрической кюветы,
n - номер измерения,
Fs+dn=F - интенсивность флуоресценции суспензии с детергентом в концентрации dn.
Таким образом, должно выполняться следующее неравенство:
Fc+dn=Fc+dn+1
Следовательно, приоритетной является концентрация бактерицидного детергента d=6 мкл, т.к. Fs+d6=Fs+d7
С использованием лабораторной системы «Спектролюкс-МБ» определили интенсивность флуоресценции микробосодержащих суспензий с детергентом в момент времени t1. Были получены следующие результаты: F1(t1)=F2(t1)=F3(t1)=0,001 отн. ед. с учетом аналогичной микробосодержащей суспензии в эксперименте, где
F1 - интенсивность флуоресценции микробосодержащей суспензии с антибиотиком цефазолин;
F2 - интенсивность флуоресценции микробосодержащей суспензии с антибиотиком ампициллин,
F3 - интенсивность флуоресценции микробосодержащей суспензии с мирамистином.
В момент времени t2, то есть после 6 часов инкубации в термостате при t=37,7°C также добавили детергент хлоргексидин в экспериментально выявленной концентрации и определили интенсивности флуоресценции суспензий, и рассчитали скорость гибели живых бактерий по формуле
K=(1/(t2-t1))ln(F(t1)/F(t2)) - скорость гибели микробов.
F1(t2)=0,01, следовательно K1=-0,3
F2(t2)=0,002, следовательно K2=-0,1
F3(t2)=0,0001, следовательно K3=0,3,
Следовательно, сделан вывод о бактерицидности (т.е. уменьшении количества живых бактерий) и большей эффективности мирамистина для данной микробосодержащей суспензии.
При аналогичных исследованиях, проведенных на убитых культурах (кипячение при 100°C) при различной концентрации микробов отмечено незначительное изменение флуоресценции по сравнению с исходной, не более чем на 10-20%. Это связано с тем, что флуоресценция живых микробных культур интегрально определяется флуоресценцией экзо - и эндогенных порфиринов, которая существенно увеличивается при разрушении оболочек микробов детергентом и снятии «блока тушения» флуоресценции внутриклеточными кислородсодержащими соединениями.
У мертвых микробов оболочки разрушены и поэтому субстрата для «всплеска» флуоресценции под воздействием детергента практически нет.
Клинический пример №2
Применение способа определения скорости гибели живых бактерий для определения эффективности антибиотиков in vitro для оптимизации лечения инфекций, вызванных полирезистентными MRSA.
Описанным выше предлагаемым способом были определены скорости гибели микробов S. Aureus при воздействии 4 различных препаратов. Для этого измеряли флуоресценцию гнойного отделяемого до воздействия антимикробного препарата и через 1 час после такового (пробы находились в течение 1 часа в термостате при 37°С).
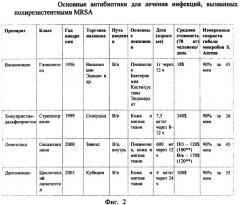
Результаты измерений, а также некоторая дополнительная информация по ним представлены в таблице на фиг.2.
Из представленных экспериментальных данных следует, что наиболее предпочтительным антимикробным препаратом для эффективного бактерицидного воздействия на St. Aureus является Даптомицин при наименьшем времени гибели микроба при прочих равных условиях проявления бактерицидного эффекта исследуемых препаратов.
В качестве антимикробного препарата в комплексной терапии инфекционного процесса, вызванного штаммом MRSA, был выбран препарат, способствующий наибольшей скорости гибели штаммом MRSA в составе смешанной микрофлоры гнойного отделяемого.
Таким образом, обследовано и пролечено 53 больных с флегмонами челюстно-лицевой области (из них 23 группа сравнения). Показано, что применение предлагаемого способа (у больных со средней степенью тяжести заболевания) позволило сократить сроки нормализации t°, пульса и ЧСС на 2-3 дня, сроков гнойного отделяемого на 1-3 дня, купирования отека и инфильтрата на 2-3 дня, сроков реабилитации больных на 3-4 дня. Это свидетельствует, что предлагаемый метод может быть использован для скрининга антимикробных препаратов как в условиях микробиологической лаборатории, так и в условиях клиники (выбор предпочтительного антимикробного препарата и индивидуальное определение сроков их применения).
Способ определения скорости гибели живых бактерий позволяет быстро в экспресс-режиме проводить всю процедуру определения скорости гибели микробов в течение 15-90 минут, при этом затраченное непосредственно на измерение время составляет 1-10 минут. Не требует расходов на дорогостоящее оборудование и дополнительную сложную обработку биосубстратов вследствие отсутствия расходных материалов, так как используются биологические объекты, например культуры микробов и биологических жидкостей (кровь, слюна, моча и др.).
Способ позволяет с достаточной чувствительностью и отсутствием зависимости от видовой специфичности бактерий определять скорость гибели широкого спектра микроорганизмов и соответственно скорости гибели микробов, оценивать эффективность антимикробных препаратов.
Литература
1. Garrett ER. Kinetics of antimicrobial action. Scand J Infect Dis Suppl. 1978; 14: 54-85.
2. Митрука Б.М. Применение газовой хроматографии в микробиологии и медицине. М.: Медицина, 1978.
3. Осипов Г.А., Демина A.M. Хромато-масс-спектрометрическое обнаружение микроорганизмов в анаэробных инфекционных процессах. Вестник РАМН. - 1996. Т.13, №2, с.52-59.
4. Осипов Г.А., Парфенов А.И., Богомолов П.О. Сравнительное хромато-масс-спектрометрическое исследование состава химических маркеров микроорганизмов в крови и биоптатах слизистой оболочки кишечника. Российский гастроэнтерол. журнал. 2001, 1: 54-69.
5. Машковский М.Д. Лекарственные средства. Пособие для врачей. Харьков: «Торсинг», 1998.
6. www.RLSnet.ru
7. www.Humbio.ro
8. Карнаухов В.Н. Люминесцентный спектральный анализ клетки. М.: - Наука, 1978.
1. Способ определения скорости гибели живых микробов, основанный на вычислении по формуле нормированного по интервалу времени логарифма отношений измеренных в два разных, отстоящих на данный интервал, момента времени процесса гибели микробов, отличающийся тем, что берут отношение мощностей флуоресценции линейных концентраций микробов в анализируемых идентичных биологических субстратах в моменты времени t1 и t2 по формулеК=(1/(t2-t1))ln(F(t1)/F(t2)),где К - скорость гибели микробов, t1 и t2 - моменты времени первого и второго измерения, F(t1) и F(t2) - измеренные параметры флуоресценции биосубстрата в моменты времени первого и второго измерения; добавление экспериментально рассчитанной концентрации бактерицидного детергента описывается разностью мощностей флуоресценции биосубстратов в моменты времени t1 и t2К=(1/(t2-t1))ln((Fdet(t1)-f(t1))/(Fdet(t2)-f(t2)))при F(t1)=Fdet(t1)-f(t1), F(t2)=Fdet(t2)-f(t2),где К - скорость гибели микробов, t1 и t2 - моменты времени первого и второго измерения, f(t1) и f(t2) - измеренные параметры флуоресценции биосубстрата без детергента в моменты времени первого и второго измерения, Fdet(t1) и Fdet(t2) - параметры флуоресценции, измеренные в моменты времени первого и второго измерения после добавления бактерицидного детергента в биосубстрат, также используют как нефлуоресцирующий, так и флуоресцирующий детергент, в последнем случае для определения скорости гибели микробов используют следующую математическую формулуК=(1/(t1-t2))ln(Fdet(t1)-f(t1)-D)/(Fdet(t2)-F(t2)-D)),где D - параметр флуоресценции раствора антисептического детергента.
2. Способ по п.1, отличающийся тем, что в качестве параметров флуоресценции используют линейные по отношению к концентрации микробов параметры флуоресценции.