Лечение рака мочевого пузыря с использованием ео9 и пропиленгликоля
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармацевтическому средству для лечения рака мочевого пузыря, включающему в себя ЕO9 в растворе с концентрацией пропиленгликоля (ПГ), выбранному из группы, состоящей из приблизительно 30% объем/объем ПГ, приблизительно 20% объем/объем ПГ и приблизительно 10% объем/объем ПГ. 2 н. и 22 з.п. ф-лы, 1 табл., 13 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
По данной заявке испрашивается приоритет предварительной патентной заявки США №60/771678, поданной 9 февраля 2006 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лечению рака мочевого пузыря посредством способов и композиций EO9. В настоящем изобретении возможно использование концентраций пропиленгликоля и/или NAD(P)H: экспрессии хинон оксидоредутазы-1 (NQO1), оксидоредуктазы цитохрома P450 (P450R) и белка-транспортера глюкозы 1 (Glut-1) в переходно-клеточной карциноме мочевого пузыря человека с целью предложения индивидуального направленного лечения рака мочевого пузыря.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Рак мочевого пузыря является одним из семи наиболее часто встречающихся опухолей в мире. В 2000 году он занимал четвертое место по распространенности у мужчин в Соединенном Королевстве при 9000 новых случаев, которые были диагностированы в том году (1). В 2002 году в Европе было выявлено 280000 случаев рака мочевого пузыря и более чем 60000 новых случаев предполагали в Соединенных Штатах в 2004 году.
Наиболее распространенным морфологическим типом рака мочевого пузыря (приблизительно 90%) является переходно-клеточная карцинома (TCC), которая происходит из уротелия, клеток, выстилающих внутреннюю поверхность мочевыводящей системы (мочеточников, мочевого пузыря и уретры). Переходно-клеточную карциному (TCC) можно классифицировать как поверхностную (pTa и pT1) или инвазивную в мышечный слой (>pT2). Лечением поверхностного TCC в настоящее время является трансуретральная резекция (ТУР; т.е. хирургическое удаление всех видимых изменений), за которым следует адъювантная химиотерапия или иммунотерапия. Достоверное снижение количества рецидивов для поверхностных опухолей, наблюдаемое после адъювантной химиотерапии, при сравнении с одним только ТУР доказывает обоснованность такого лечения (2). В то время как в повседневой практике применяют средства, такие как Митомицин C (MMC), Эпирубицин и BCG, широко известно, что существует необходимость разрабатывать более эффективные и/или менее токсичные средства против TCC или применять современные терапевтические средства более правильно в плане таргетного лечения индивидуумов (или подгрупп пациентов), что является скорее всего более выгодным.
Митомицин C (MMC) является противоопухолевой композицией на основе встречающегося в природе хинона, который принадлежит к классу соединений, известных как биоредуктивные лекарственные средства (3). В основном биоредуктивные лекарственные средства являются предшественниками лекарственных средств, для которых необходима метаболическая активация для получения цитотоксических метаболитов, и все они предназначены для устранения клеток в состоянии гипоксии, которые расположены в недостаточно кровоснабжаемых районах солидных опухолей. Однако данные лекарственные средства также могут быть направлены на аэробные участки опухоли.
Ключевыми параметрами, которые определяют цитотоксичную избирательность биоредуктивных лекарственных средств на основе хинона (т.е. между гипоксическими и аэробными опухолевыми клетками), являются наличие специфичных ферментативных редуктаз, необходимых для восстановления предшественника лекарственного средства, и способность молекулярного кислорода менять процесс активации (4, 5) (хотя относительная роль редуктаз и давления кислорода в прекращении клеточной гибели зависит от рассматриваемого соединения (4, 6)). Факт, что MMC регулярно применяют при лечении TCC, предполагает, что для данного заболевания характерно наличие не только соответствующей биохимической машины, необходимой для биоредуктивной активации, но и, что другие соединения данного класса также могут быть использованы для лечения данного заболевания. Два примера дополнительных соединений, которые могут быть использованы, включают в себя производное индолхинона EO9 и азиридинил бензохинон RH1 (7, 8).
Как указано, способность лекарственных средств на основе хинона устранять аэробные или гипоксические клетки в значительной степени определяют по комплексному взаимоотношению между энзимологией опухолей, включающей наличие редуктаз, и гипоксией. В активацию биоредуктивных лекарственных веществ вовлечено несколько редуктаз (4, 6), хотя существенное внимание отдано ферментам редуктазы цитохрома P450 (P450R) и NAD(P)H:хинон оксидоредуктазе-1 (NQO1). Принимая во внимание измерение гипоксии, показано, что эндогенные маркеры, такие как транспортер глюкозы-1 (Glut-1) или карбоангидраза IX (CAIX), коррелируют с экзогенными гипоксийными маркерами, такими как пимонидазол (9, 10). Таким образом, взаимоотношение между опухолевой гипоксией и экспрессией двух ведущих редуктаз при поверхностной и инвазивной переходно-клеточных карциномах (TCC) мочевого пузыря является ключевым определяющим моментом. Кроме того, для лечения рака мочевого пузыря необходимо использование фармацевтических композиций с различными степенями проникновения для целевого действия на поверхностные опухоли или опухоли, инвазивные в мышечный слой. Настоящее изобретение относится к данным аспектам лечения рака мочевого пузыря.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Достоверные отличия в экспрессии NQO1 были обнаружены между поверхностными и инвазивными опухолями с наблюдаемыми низкими уровнями в опухолях с инвазией в мышечный слой. Напротив, P450R и Glut-1 экспрессировались на всех стадиях и степенях дифференцировки TCC, хотя экспрессия возрастала с опухолевой стадией (в частности, в случае Glut-1). Кроме того, экспрессия Glut-1 была достоверно повышена в опухолях стадии G3, принимая во внимание существующие низкие уровни NQO1. Данные результаты демонстрируют очевидные отличия в экспрессии NQO1 и Glut-1, существующие между поверхностным и TCC мочевого пузыря. Кроме того, обнаружены фармацевтические композиции биоредуктивных лекарственных веществ на основе хинона с различными уровнями проникновения.
Данные результаты, имеющие терапевтическое применение биоредуктивных лекарственных веществ на основе хинона в данной монокомпозиционной терапии, могли бы подойти для поверхностного заболевания, тогда как для заболевания с инвазией в мышечный слой предпочтительным было бы комбинированное лечение с применением хинонов для направленного действия на гипоксическую фракцию и других терапевтических способов лечения для эрадикации аэробной фракции. Кроме того, фармацевтические композиции с низкими уровнями проникновения можно выбирать при лечении поверхностных опухолей мочевого пузыря, в то время как фармацевтические композиции с высокими уровнями проникновения можно выбирать при лечении опухолей мочевого пузыря с инвазией в мышечный слой. Объединяя вышесказанное, данные аспекты настоящего изобретения обеспечивают важный прогресс в лечении рака мочевого пузыря посредством предоставления адаптаций к конкретным характеристикам профиля заболевания индивидуума для лечения опухоли.
В частности, один из вариантов осуществления согласно настоящему изобретению относится к способу лечения рака мочевого пузыря, включающего в себя определение уровней, по меньшей мере, одного белка внутри опухоли и выбора лечения на основании, по меньшей мере, одного уровня белка, где лечение включает в себя введение биоредуктивного лекарственного вещества на основе хинона как одного, так и в сочетании с другим лечением.
В другом варианте осуществления белок выбран из группы, состоящей из NAD(P)H: хинон оксидоредутазы-1 (NQO1) и NADPH редуктазы цитохрома P450 (P450R). В конкретном варианте осуществления белок является NQO1 и лечение включает в себя введение только биоредуктивного лекарственного вещества на основе хинона. В другом конкретном варианте осуществления белок является NQO1 и лечение включает в себя введение биоредуктивного лекарственного вещества на основе хинона в сочетании с другим лечением. В другом варианте белок является P450R и лечение включает в себя введение только биоредуктивного лекарственного вещества на основе хинона. В еще одном варианте белок является P450R и лечение включает в себя введение биоредуктивного лекарственного вещества на основе хинона в сочетании с другим лечением. В дополнительном варианте осуществления настоящего изобретения белок является NQO1 и P450R и лечение включает в себя введение только биоредуктивного лекарственного вещества на основе хинона. В еще одном другом варианте осуществления NQO1 и P450R и лечение включает в себя введение только биоредуктивного лекарственного вещества на основе хинона в сочетании с другим лечением.
Один из вариантов осуществления настоящего изобретения дополнительно содержит определение степени гипоксии внутри опухоли и выбора лечения на основании, по меньшей мере, одного уровня белка и степени гипоксии. В конкретном варианте осуществления степень гипоксии определяют посредством измерения транспортера глюкозы 1 (Glut-1) и/или карбоновой ангидразы IX (CAIX).
Конкретный вариант осуществления соответственно настоящему изобретению относится к способу лечения рака мочевого пузыря, включающего в себя подбор лечения на основании уровней, выбранных из группы, состоящей из показателей NAD(P)H: хинон оксидоредутазы-1 (NQO1), NADPH редуктазы цитохрома P450 (P450R) и уровней транспортера глюкозы-1 (Glut-1), где лечение включает в себя введение биоредуктивного лекарственного вещества на основе хинона как одного, так и в сочетании с другим лечением. В различных аспектах данного конкретного варианта осуществления: показателем может быть NQO1 или P450R и лечение включает в себя введение только биоредуктивного лекарственного вещества на основе хинона; показателем может быть NQO1 или P450R и лечение включает в себя введение биоредуктивного лекарственного вещества на основе хинона в сочетании с другим лечением; показателем может быть NQO1 или P450R и лечение включает в себя введение только биоредуктивного лекарственного вещества на основе хинона; показателем может быть NQO1 или P450R и лечение включает в себя введение биоредуктивного лекарственного вещества на основе хинона в сочетании с другим лечением или показателем может быть NQO1, P450R и Glut-1 и лечение включает в себя введение только одного биоредуктивного лекарственного вещества на основе хинона или в сочетании с другим лечением.
В одном из вариантов осуществления настоящее изобретение включает в себя способ лечения инвазивного рака мочевого пузыря, включающий в себя определение уровней NQO1 и Glut-1 внутри опухоли; подбора комбинированного лечения, включающего биоредуктивное лекарственное вещество на основе хинона в сочетании с другим лечением на основании того, что указанный уровень NQO1 ниже и указанный уровень Glut-1 выше, что может наблюдаться, если указанная опухоль является поверхностной.
В другом варианте осуществления настоящее изобретение включает в себя способ разделения пациентов для адекватной терапии рака мочевого пузыря на основании уровней экспрессии NQ01 и Glut-1 внутри указанной опухоли мочевого пузыря пациента, включающий в себя: определение уровней экспрессии NQ01 и Glut-1 внутри указанной опухоли мочевого пузыря пациента и введение биоредуктивного лекарственного вещества как единственного терапевтического вещества, если указанный пациент имеет поверхностный рак мочевого пузыря с высокими уровнями NQ01, или проведение комбинированного лечения, где биоредуктивное лекарственное вещество применяют в сочетании с лучевой терапией или другим химиотерапевтическим средством, если указанный пациент имеет инвазивный рак мочевого пузыря с низким уровнем NQ01 и высоким уровнем Glut-1.
В конкретных вариантах осуществления настоящего изобретения другим лечением является лучевая терапия и/или введение, по меньшей мере, одного химиотерапевтического средства.
В различных вариантах осуществления индивидуально применяемое биоредуктивное лекарственное вещество на основе хинона может быть выбрано из группы, состоящей из митомицина C, индолхинона EO9 и азиридинил бензохинона (RH1) и их сочетания.
Настоящее изобретение также относится к фармацевтическим композициям. В частности, один из вариантов осуществления, соответствующий настоящему изобретению, относится к фармацевтической композиции, включающей в себя EO9 в растворе с пропиленгликолем (ПГ) в концентрации, выбранной из группы, состоящей из приблизительно 30% объем/объем ПГ, приблизительно 20% объем/объем ПГ и приблизительно 10% объем/объем ПГ. Концентрации EO9 могут находиться в пределах от приблизительно 300 мкМ до приблизительно 400 мкМ. В конкретном варианте осуществления композиция включает в себя раствор с концентрацией EO9 приблизительно 347 мкМ.
Фармацевтические композиции по настоящему изобретению дополнительно могут содержать NaHCO3, ЭДТА, маннит и воду. В одном из вариантов осуществления композиция включает в себя от приблизительно 10 мг/мл до приблизительно 120 мг/мл NaHCO3. В конкретном варианте осуществления композиция включает в себя приблизительно 100 мг/мл или приблизительно 100,25 мг/мл NaHCO3. В другом конкретном варианте осуществления композиция включает в себя приблизительно 50 мг/мл NaHCO3 или приблизительно 50,125 мг/мл NaHCO3. В другом варианте осуществления композиция включает в себя от приблизительно 0,5 мг/мл до приблизительно 3,0 мг/мл маннита. В конкретном варианте осуществления композиция включает в себя приблизительно 0,625 мг/мл маннита. В другом конкретном варианте осуществления композиция включает в себя 1,25 мг/мл маннита. В другом конкретном варианте осуществления композиция включает в себя приблизительно 100 мг/мл NaHCO3, приблизительно 0,625 мг/мл маннита и приблизительно 0,1 мг/мл EO9 в растворе, включающем в себя ЭДТА, ПГ и воду.
Один из вариантов осуществления в соответствии с настоящим изобретением относится к фармацевтической композиции, включающей в себя EO9, NaHCO3 и маннит в растворе, включающем в себя ЭДТА, ПГ и воду, где ПГ находится в растворе в процентном соотношении, выбранном из группы, состоящей из от приблизительно 6% до приблизительно 14% объем/объем; от приблизительно 16% до приблизительно 24% объем/объем и от приблизительно 26% до приблизительно 34% объем/объем. В другом варианте осуществления ПГ находится в растворе в процентном соотношении, выбранном из группы, состоящей из приблизительно 10% объем/объем, приблизительно 20% объем/объем и приблизительно 30% объем/объем. В другом варианте осуществления композиция включает в себя раствор с концентрацией EO9 приблизительно 347 мкМ и с концентрацией ПГ приблизительно 10% объем/объем. В еще одном другом варианте осуществления композиция включает в себя раствор с концентрацией EO9 приблизительно 347 мкМ и с концентрацией ПГ приблизительно 20% объем/объем. В дополнительном варианте осуществления композиция включает в себя раствор с концентрацией EO9 приблизительно 347 мкМ и с концентрацией ПГ приблизительно 30% объем/объем. Данные описанные варианты осуществления настоящего изобретения могут включать в себя от приблизительно 10 мг/мл до приблизительно 120 мг/мл NaHCO3 и в одном конкретном варианте осуществления будут включать в себя приблизительно 100, приблизительно 100,25 или приблизительно 50,125 мг/мл NaHCO3. Данные описанные варианты осуществления настоящего изобретения также могут включать в себя от приблизительно 0,5 мг/мл до приблизительно 3,0 мг/мл маннита, и в одном конкретном варианте осуществления будут включать в себя приблизительно 0,625 или приблизительно 1,25 мг/мл маннита.
Один из вариантов осуществления настоящего изобретения может включать в себя фармацевтическую композицию, где композиция включает в себя раствор с концентрацией EO9 приблизительно 347 мкМ, с концентрацией ПГ приблизительно 10% объем/объем, NaHCO3 приблизительно 100,25 мг/мл и маннита приблизительно 0,625 мг/мл. Другой вариант осуществления может включать в себя фармацевтическую композицию, где композиция включает в себя раствор с концентрацией EO9 приблизительно 347 мкМ, с концентрацией ПГ приблизительно 30% объем/объем, NaHCO3 приблизительно 100,25 мг/мл и маннита приблизительно 0,625 мг/мл.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
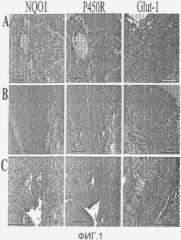
На фиг.1 представлен иммуногистохимический анализ NQO1, P450R и Glut-1 у трех пациентов с переходно-клеточной карциномой мочевого пузыря.
На фиг.2 представлен прибор, используемый для изучения проникновения лекарственного вещества через многоклеточный слой.
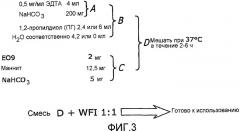
На фиг.3 представлено схематическое изображение получения раствора лекарственного вещества.
На фиг.4 представлена хроматограмма отрицательного образца, меченного WV14, в качестве внутреннего стандарта.
На фиг.5 представлены хроматограммы стандарта EO9 в культуре RPM1 1640.
На фиг.6 представлены хроматограммы стандарта EO9 в 0,1% DMSO (6A); 30% пропиленгликоле (ПГ; 6B); 20% ПГ (6C) и 10% ПГ (6D).
На фиг.7 представлены калибровочные кривые для EO9 в 0,1% DMSO и в различных концентрациях ПГ (30%; 20%; 10%).
На фиг.8 показано проникновение EO9 с различными концентрациями ПГ через многоклеточный слой DLD-1.
На фиг.9 представлены образцы поперечных сечений через окрашенные DLD-1 многоклеточные слои.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Биоредуктивные лекарственные вещества на основе хинона являются предшественниками лекарственных веществ, которые формируют цитотоксические производные после ферментной активации. Белок NAD(P)H:хинон оксиредуктаза-1 (NQO1; также называемый DT-диафораза (DTD)), двухэлектронный фермент редуктаза, играет заметную роль в активации биоредуктивных лекарственных веществ на основе хинона при аэробных состояниях. Биоредуктивные лекарственные вещества на основе хинона также являются цитотоксическими при гипоксических состояниях, включая клетки с низкой активностью NQO1. Белки, отщепляющие один электрон, такие как редуктаза цитохрома P450, могут играть более заметную роль в активации биоредуктивных лекарственных веществ на основе хинона при гипоксических состояниях. Исходя из вышеизложенного уровни данных редуктаз и состояния гипоксии могут показывать целесообразность различных схем лечения опухолей, включая целесообразность использования различных биоредуктивных лекарственных веществ на основе хинона. Настоящее изобретение таким образом оценивает уровни описанных редуктаз и степень гипоксического состояния при различных стадиях и степенях TCC.
Прогресс в лечении рака мочевого пузыря также может наступить в результате обеспечения фармацевтическими препаратами, включающими в себя биоредуктивные лекарственные вещества на основе хинона с различными степенями проникновения. Например, фармацевтические препараты с низкими проникающими способностями могут быть полезны в применении при лечении поверхностных опухолей мочевого пузыря, т.к. лекарственное вещество может оставаться рядом с внутренней поверхностью мочевого пузыря, там где лечение наиболее необходимо. Напротив, фармацевтические композиции с высокими проникающими способностями могут быть полезны в применении при лечении опухолей мочевого пузыря с более выраженной инвазией в мышечный слой, т.к. лекарственное вещество может проникать в более глубокие слои мочевого пузыря, где в таких случаях наиболее необходимо лечение. Объединяя вышесказанное, данные аспекты настоящего изобретения обеспечивают важный прогресс в лечении рака мочевого пузыря посредством адаптации к конкретным характеристикам профиля заболевания индивидуума для лечения опухоли.
Апазиквон (prop.INN, USAN), также известный как EO9 или NSC-382459 (3-гидроксиметил-5-азиридинил-1-метил-2-(1H-индол-4,7-дион)пропенол со структурной формулой:
является полностью синтетическим биоредуктивным алкилирующим индолохиноном. Считают, что основной механизм активации EO9 сходен с другими индолохинонами, включая восстановление посредством клеточных ферментов, которые отщепляют один или два электрона, с получением семихинона и гидрохинона соответственно. Окисление семихинона при аэробных условиях приводит к окислительно-восстановительному циклу, который может привести к клеточной гибели посредством образования активных форм кислорода (ROS), приводящих к разрывам цепей ДНК. В частности, при гипоксических условиях семихинон/гидрохинон может алкилировать и образовывать сшивки между ДНК и другими макромолекулами, вызывая клеточную гибель. EO9 является одним неограничивающим примером биоредуктивного лекарственного вещества на основе хинона, который пригоден для использования в настоящем изобретении.
Пример 1
I. Материалы и способы
A. Ткани человека
Фиксированные в формалине, залитые в парафин образцы переходно-клеточных карцином мочевого пузыря человека (n=52) применяли в исследовании после получения одобрения местного исследовательского и этнического комитета (LREC) в соответствии с правилами Медицинского исследовательского совета. Для обеспечения конфиденциальности все сведения о пациенте были анонимны и все эксперименты выполняли в соответствии с руководством, изложенным в LREC. Опухоли, используемые в исследовании, представляли собой все степени дифференцировки (11 степень дифференцировки 1; 26 степень дифференцировки 2; 15 степень дифференцировки 3) как поверхностных (19 pTa; 19 pT1), так и инвазивных в мышечный слой (14≥pT2) стадий TCC мочевого пузыря человека. Все опухолевые блоки применяли для изготовления тканевых микрочипов (TMA) и последующего иммуногистохимического анализа.
B. Изготовление тканевых микрочипов
Композиции тканевых микрочипов (TMA) изготовляли из залитых в парафин блоков для получения TCC мочевого пузыря человека с различными степенями дифференцировки (G1-G3) и различными стадиями (pTa, pT1, ≥pT2). Композицию тканевого микрочипа (TMA) получали посредством прибора для микрочипов Beecher Instruments (Silver Spring, MD, США) с применением модифицированного способа Bubendorf et al. (11), включенного в настоящий документ в качестве ссылки. В кратком изложении, секции каждого залитого в парафин донорского блока окрашивали с использованием гематоксилина и эозина (H&E), проверяли под микроскопом и маркировали область, содержащую интересующую ткань, на парафиновом блоке. Из данных выбранных областей посредством биопсии получали внутреннюю часть цилиндрической формы (600 мкМ) и переносили в принимающий блок. Тканевой сбор образцов включал четыре внутренних части из каждого опухолевого блока для обеспечения данных от каждого исходного блока. Суммарно 108 внутренних образцов, полученных от 26 пациентов, включили в блок TMA и изготовили два TMA блока. Срезы толщиной 5 мкМ нарезали из исходных TMA блоков и разместили на предметных стеклах с применением ленточной системы переноса (Instrumedics, США). H&E окрашивание для гистологического подтверждения и цельности образцов выполняли на первом и каждом десятом секционном срезе от каждого микрочипового блока. TMA композиции затем подвергали иммуногистохимическому анализу.
C. Антитела
Используемые антитела включали в себя мышиные моноклональные антитела против NQO1 (предоставленные докторами Siegel и Ross, Университет центра медицинских наук Колорадо, Денвер, США), козьи поликлональные антитела, специфичные для P450R (Santa Cruz Biotechnology, США), мышиные моноклональные антитела против Ki67 (BD Biosciences, UK) и кроличьи поликлональные антитела, специфичные для транспортера глюкозы-1 (GLUT-1; Dako, UK).
D. Иммуногистохимия
Иммунолокализацию NQO1, P450R, GLUT-1 и Ki67 определяли с помощью иммуногистохимии, как было описано ранее (9, 10, 12, 13) и понятно обычным специалистам в данной области. В кратком изложении, после высвобождения антигена и блокирования связывания неспецифических иммуноглобулинов TMA инкубировали с соответствующим первичным антителом: инкубировали в течение приблизительно 60 минут с анти-NQO1 антителом, разведенным в соотношении 1:1 TBSTM (10 мМ Трис-HCl, 150 мМ NaCl, 0,2% Tween 20, 5% нежирное сухое молоко); инкубировали в течение приблизительно 90 минут для P450R, разведенного в соотношении 1:100 в PBS; инкубировали в течение приблизительно 90 минут с анти-Glut-1 антителом, разведенным в соотношении 1:25 в PBS; или инкубировали всю ночь при 4°C с анти-Ki67 антителом, разведенным в соотношении 1:100 в PBS. Контроли выполняли с использованием нормального IgG вместо первичного антитела. Иммунолокализацию выполняли с использованием соответствующего биотинилированного вторичного антитела (разведенного 1:200; Vector Labs., США), за которой следовала амплификация с использованием набора Vectastain ABC (Vector Labs., США) и визуализация с 3,3'-диаминобензидином (DAB) (Vector Labs., США). Срезы затем контрастировали гематоксилином Харриса, дегидрировали, отмывали и помещали в среду для заключения DPX (Sigma, Великобритания).
E. Полуколичественный анализ иммуногистохимического окрашивания
Положительное иммунопрокрашивание подсчитывали полуколичественно с помощью трех независимых экспертов. Оба NQO1 и P450R были локализованы цитоплазматически внутри опухоли. Шкалу для эпителиального компонента каждого опухолевого внутреннего сектора, основанную на интенсивности и распределении окрашивания, устанавливали от 0 (нет окрашивания) до 4 (максимальная интенсивность окрашивания). Среднюю вычисленную интенсивность рассчитывали для каждого внутреннего сектора и каждой опухоли TMA исходя из результатов независимых экспертов. Результаты сравнивали для выявления каких-либо взаимосвязей и корреляций с клинико-патологическими параметрами.
Степень положительного ответа Glut-1 в каждом внутреннем секторе TMA анализировали и устанавливали бальную шкалу от 0 до 4, отображающую приблизительный процент опухолевых клеток, показывающих мембранное (0=нет окрашивания; 1=0-5% положительно; 2=5-15% положительно; 3=15-30% положительно; 4=>30% положительно). Среднюю вычисленную интенсивность рассчитывали для каждого внутреннего сектора и каждой опухоли TMA исходя из результатов независимых экспертов. Результаты сравнивали для выявления каких-либо взаимосвязей и корреляций с клинико-патологическими параметрами.
Процент положительных ядер по Ki67 в опухолевых клетках подсчитывали с применением 40× увеличения для каждого внутреннего сектора и опухоли, как описано Santos и др. (13,14), что включено в настоящий документ в качестве ссылки. Суммарно 200 клеток на внутренний сектор и 800 клеток на опухоль были проанализированы и вычислен процент положительного ответа. Подсчет выполняли с помощью двух экспертов. Результаты сравнивали для выявления каких-либо взаимосвязей и корреляций с клинико-патологическими параметрами.
F. Статистический анализ
Экспрессию NQO1 и P450R сравнивали со следующими клинико-патологическими параметрами: стадия опухоли, степень дифференцировки опухоли, гипоксия опухоли (экспрессия Glut-1) и пролиферация. Статистический анализ выполнили с применением пакета программного обеспечения SPSS, версия 11,0 (SPSS Inc., Чикаго, ИЛ). Из-за того что экспрессия не является нормально распределенной, в иммуногистохимическом исследовании средние значения экспрессии для каждой категории рассчитывали как медианы с интерквартильными отклонениями. Различия между независимыми переменными определяли с помощью U теста Манна-Уитни. При двустороннем анализе достоверными считали различия при значениях P менее чем 0,05.
II. Результаты
A. Взаимосвязь между уровнями белка NQO1, стадией опухоли и степенью дифференцировки опухоли.
NQO1 был локализован цитоплазматически в эпителии опухолей мочевого пузыря всех патологических степеней дифференцировки и стадий и экспрессия NQO1 варьировала между опухолями. (Фиг.1, Таблица 1). Во многих случаях профиль гетерогенной экспрессии NQO1 наблюдал в одной и той же опухоли с областями высокой и низкой экспрессии NQO1 в одном и том же образце (данные не показаны). NQO1 был экспрессирован в опухолях всех патологических стадий (pTa, pT1, ≥pT2), хотя уровни экспрессии NQO1 варьировали между различными стадиями (Таблица 1). Достоверное различие в уровне экспрессии NQO1 было обнаружено между поверхностными опухолями (pTa+pT1) и опухолями с инвазией в мышечный слой (>pT2) с достоверно сниженной экспрессией в опухолях с инвазией в мышечный слой (P=0,02). Обратная зависимость экспрессии NQO1 со способностью опухоли к инвазии дополнительно была подкреплена достоверным различием в экспрессии, обнаруженной между неинвазивными (pTa) и инвазивными (pT1+≥pT2) опухолями (P=0,03). Все патологические степени дифференцировки TCC экспрессировали NQO1 (Таблица 1). Экспрессия NQO1 была достоверно выше в опухолях со степенью дифференцировки 2 по сравнению и со степенью дифференцировки 3 (Таблица 1). Достоверных различий между высокодифференцированными (степень дифференцировки 1) и низкодифференцированными (степень дифференцировки 3) опухолями обнаружено не было (Таблица 1).
B. Взаимосвязь между экспрессией белка P450R, стадией опухоли и степенью дифференцировки опухоли.
Все исследуемые опухоли экспрессировали заметные уровни P450R, локализованного цитоплазматически. В отличие от NQO1 P450R экспрессия, как правило, была равномерной внутри опухоли. Типичное иммуноокрашивание представлено на фиг.1. P450R был экспрессирован на всех стадиях TCC (Таблица 1). Уровни P450R были достоверно выше в опухолях с инвазией в мышечный слой (≥pT2) по сравнению с поверхностными (pTa+pT1) опухолями (P<0,01). В отличие от NQO1 экспрессия P450R показывает положительную зависимость с увеличением опухолевой стадии, но не показывает ассоциацию со способностью опухоли к инвазии, что очевидно при отсутствии достоверной разницы между инвазивными (pT1+≥pT2) и неинвазивными (pTa) опухолями (Таблица 1). P450R был экспрессирован при всех патологических степенях дифференцировки TCC (Таблица 1). Положительная корреляция была обнаружена между уровнем P450R и снижением степени дифференцировки опухоли (Таблица 1).
C. Зависимость между Glut-1 и стадией опухоли и степенью дифференцировки опухоли
Экспрессия белка Glut-1 была гетерогенна как в отдельных опухолевых образцах, так и между отдельными образцами одного пациента. Типичное иммуноокрашивание и его зависимость со стадией опухоли и степенью дифференцировки опухоли представлены на фиг.1 и в таблице 1 соответственно. Белок Glut-1 был экспрессирован на всех опухолевых стадиях и при всех степенях дифференцировки опухоли, которые исследовали, однако уровни Glut-1 были достоверно выше в опухолях >pT2 (относительно опухолей pTa, P=0,05) и опухолях со степенью дифференцировки 3 (относительно опухолей и со степенью дифференцировки 1 [P=0,03] и со степенью дифференцировки 2 [P<0,01]). Кроме того, статистически достоверные различия (P=0,02), существующие между неинвазивными (pTa) и инвазивными (pT1+≥pT2) опухолями, предполагают, что инвазивные заболевания ассоциированы с высокой экспрессией белка Glut-1 и, следовательно, с высокими степенями гипоксии.
D. Зависимость между Ki67, стадией опухоли, степенью дифференцировки опухоли и энзимологией.
Степени экспрессии антигена Ki67 применяли в качестве индикатора опухолевого пролиферативного индекса (Таблица 1). Как и следовало ожидать, достоверную корреляцию наблюдали между увеличением стадии дифференцировки опухоли (уменьшением степени дифференцировки) и пролиферативным индексом (P<0,01). Зависимости между опухолевой пролиферацией и способностью опухоли к инвазии (pTa против pT1+>pT2) обнаружено не было. Напротив, опухолевая пролиферация была достоверно выше в опухолях с инвазией в мышечный слой (≥pT2) по сравнению с поверхностными опухолями (pTa+pT1 [P<0,01]), что возможно как результат взаимосвязи между инвазией в мышечный слой и высокой стадией дифференцировки опухоли. Интересно, что достоверная зависимость была обнаружена между опухолевым пролиферативным индексом и экспрессией как Glut-1 (P=0,01), так и P450R (P<0,01), но не обнаружена с экспрессией NQO1.
Результаты данного исследования показывают, что белковая экспрессия ключевых ферментов связана с биоредуктивной активацией соединений на основе хинона и наличием гипоксии, что определено посредством уровней белка Glut-1, изменяющихся со стадией степенью дифференцировки TCC мочевого пузыря. Наиболее поразительным наблюдением является тот факт, что экспрессия белка NQO1 достоверно снижается с увеличением опухолевой стадии (Таблица 1). Что касается степени дифференцировки опухоли, существуют также свидетельства, что опухоли G3 имеют более низкие уровни NQO1, чем опухоли G2 (но не G1). Данные наблюдения находятся в соответствии с раннее опубликованными работами, где была описана обратная зависимость между экспрессией мРНК NQO1 и возрастанием опухолевой стадии (15). Аналогичным образом для Glut-1 увеличение белковой экспрессии со стадией дифференцировки опухоли (P=0,03 и <0,01, где G1 и G2 сравнивали с опухолями G3 соответственно) и опухолевой стадией (P=0,05, когда опухоли pTa сравнивали с опухолями ≥pT2) согласуется с предыдущими публикациями (16). В отличие от ранее опубликованных работ, демонстрирующих более высокие уровни мРНК P450R в поверхностных TCC по сравнению с инвазивными в мышечный слой (15), в данной работе белковые уровни P450R были достоверно выше для заболеваний с инвазией в мышечный слой (≥pT2 по сравнению с pTa+pT1) (P<0,01). Кроме того, белковая экспрессия P450R показывает положительную корреляцию с увеличением стадии дифференцировки (уменьшением степени дифференцировки) (Таблица 1). Интересно, что экспрессия P450R также демонстрирует выраженную положительную корреляцию с индексом пролиферации (P<0,01), возможно, как следствие значительной зависимости между P450R, Ki67 и увеличением стадии дифференцировки опухоли (снижения степени дифференцировки). Как бы то ни было, следует иметь в виду, показано, что оценивание биоредуктивного лечения, в которое вовлечен P450R, с высоким пролиферативным индексом связано с неблагоприятным прогнозом при раке мочевого пузыря (17,18). Таким образом, исходя из анализа белковой экспрессии с помощью иммуногистохимии предполагается, что гипоксия, как показано посредством экспрессии Glut-1, связана со стадией опухоли, степенью дифференцировки опухоли и опухолевой инвазией. В отношении опухолевой энзимологии данное исследование предполагает, что уровни NQO1 достоверно снижаются как результат увеличения опухолевой стадии (и способности к инвазии), тогда как уровни P450R увеличиваются со стадией дифференцировки опухоли и способностью к инвазии.
Полученные результаты имеют важное значение для возможного терапевтического планирования с применением биоредуктивных лекарственных веществ на основе хинона в лечении TCC мочевого пузыря. Большое количество данных, полученных на доклинических испытаниях, свидетельствует, что ответ клеток на MMC, EO9 и RH1 зависит не только от уровней NQO1, но также от степени опухолевой гипоксии. В отношении MMC роль NQO1 в определении клеточного ответа в аэробных условиях является противоположной, но в условиях гипоксии достоверное усиление активности происходит только в клетках, которые имеют низкую активность NQO1 или не имеют ее (19). В случае EO9 и RH1 схожие результаты получены в условиях гипоксии со значительным усилением активности, наблюдаемой только в клетках с низким NQO1 (20, 21). Однако в аэробных условиях существует хорошая корреляция между активностью NQO1 и чувствительностью к химиокомпозициям, которая свидетельствует, что в присутствии кислорода NQO1 играет заметную роль в активации EO9 и RH1 (22, 23). Основы механизмов, объясняющих подобные результаты, не ясны (24), но в условиях гипоксии одноэлектронные редуктазы, такие как P450R, имеют более существенное значение в процессе биоредуктивной активации (25). На основании данных результатов такие соединения, как EO9 и RH1, могли бы поражать аэробную фракцию NQO1 богатых опухолей (и таким же образом мог бы MMC, но в меньшей степени) или гипоксическую фракцию NQO1 дефицитных опухолей, допуская, что присутствуют одноэлектронные редуктазы, такие как P450R. Таким образом, в случае NQO1 богатых опухолей было бы целесообразным применение соединений, таких как EO9 и RH1, в качестве отдельных композиций, нацеленных на аэробную фракцию. Для NQO1 дефицитных опухолей со значительной гипоксической фракцией данные композиции следует применять в сочетании с лучевой терапией или другими химиотерапевтическими средствами, которые нацелены на аэробную фракцию. Результаты данного исследования предполагают, что данная вторая стратегия может быть эффективной в случае более поздней TCC мочевого пузыря (т.е. ≥pT2) или более агрессивного заболевания (т.е. опухолей со стадией дифференцировки 3), т.к. они, как правило, имеют низкую экспрессию белка NQO1 (и, возможно, более высокую экспрессию P450R) и включают значительные области гипоксии. В данном конкретном аспекте интересно зам