Комбинированная противоопухолевая терапия и фармацевтические композиции для нее
Иллюстрации
Показать всеДанное изобретение относится к области медицины и касается комбинации для лечения опухолевого заболевания, включающей в качестве активного ингредиента, по меньшей мере, одно иммуностимулирующее средство общей формулы (II) и одно или более химиотерапевтических средств, выбранных из группы, состоящей из алкилирующих средств, включающих карбоплатин, цисплатин и оксалиплатин, цитостатических средств, выбранных из циклофосфамида и его производных, и антиметаболитов, выбранных из фторурацила и его производных, и способу лечения опухолевых состояний. Изобретение обеспечивает повышенную эффективность лечения. 2 н. и 16 з.п. ф-лы, 8 ил., 5 табл.
Реферат
Данное изобретение относится к иммунологическому контролю злокачественных опухолей.
Данное изобретение относится к фармацевтическим композициям, увеличивающим или улучшающим эффективность известных антинеопластических средств или способов лучевой терапии посредством стимуляции иммунной системы онкологических пациентов.
Более точно данное изобретение относится к фармацевтическим композициям, включающим сочетание иммуностимулирующего средства и известного или экспериментального антинеопластического средства в качестве активных ингредиентов в смеси или сочетании с одним или несколькими разбавителями или эксципиентами.
В частности, данное изобретение также относится к сочетанию иммуностимулирующего средства и общепризнанных способов лучевой терапии для борьбы со злокачественными опухолями в смеси или сочетании с носителем или наполнителем, предназначенным для перорального или инъекционного пути введения.
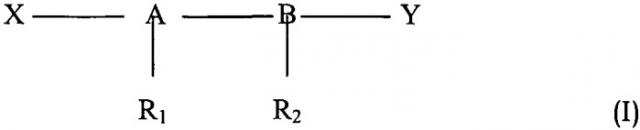
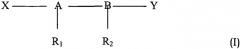
Более конкретно объектом настоящего изобретения являются фармацевтические композиции, содержащие в качестве активных ингредиентов по меньшей мере одно иммуностимулирующее средство с заряженными или нейтральными группами общей формулы (I):
где
А-В представляют собой дисахариды,
X и Y представляют собой заряженные или нейтральные функциональные группы,
R1 и R2 представляют собой гидроксиацильные группы, которые могут быть ацилированы алифатической карбоновой кислотой,
применимые для борьбы со злокачественной опухолью вместе со способом лучевой терапии или вместе с известным антинеопластическим химиотерапевтическим средством, выбранным из группы, состоящей из алкилирующих средств, антиметаболитов, средств, действующих на микротрубочки, ингибиторов тирозинкиназы, в соединении или смеси с инертным нетоксичным фармацевтически приемлемым разбавителем или носителем.
Изобретение также относится к солям соединения общей формулы (I) с минеральным или органическим основанием, а именно фармацевтически приемлемым основанием.
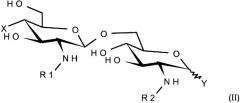
Данное изобретение также относится к фармацевтической композиции, где иммунологически активное соединение представляет собой диацилированное соединение с заряженными или нейтральными группами общей формулы I:
где
А и В представляют собой β-(1,6)-связанный диглюкозаминовый дисахаридный скелет липида А формулы (II):
где
R1 и R2 каждый обозначает ацильную группу, являющуюся производной насыщенной или ненасыщенной, линейной или с разветвленной цепью карбоновой кислоты, имеющей от 2 до 24 атомов углерода, которая является незамещенной или содержащей один или более заместителей, выбранных из гидроксила, алкила, алкокси-, ацилокси-, амино-, ациламино-, ацилтио- и алкилтиогрупп.
Х обозначает нейтральную или заряженную группу, выбранную из следующих групп: дигидроксифосфорилокси, гидроксисульфонилокси, гидроксил, карбоксиалкокси, карбоксиалкилтио, карбоксиацилокси, карбоксиаминоацилокси или диаминоацилокси и аминоацилокси, и волнистая линия показывает α- или β-конфигурацию;
Y обозначает нейтральную или заряженную группу, выбранную из следующих групп: дигидроксифосфорилокси, гидроксисульфонилокси, гидроксил, карбоксиалкокси, карбоксиалкилтио, карбоксиаминоалкокси и аминоалкокси,
в сочетании с химиотерапией или биологической терапией, то есть стандартной или экспериментальной химиотерапией или иммунотерапией, или ионизирующим излучением, в смеси или в сочетании с одним или более нетоксичными, инертными, фармацевтически приемлемыми разбавителями или носителями.
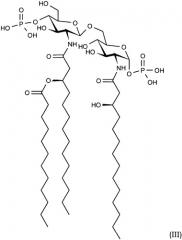
Настоящее изобретение также относится к фармацевтическим композициям, в которых иммунологически активный ингредиент представляет собой триацилированные дифосфорилированные производные липида А структурной формулы (III):
в сочетании или смеси с инертным, нетоксичным, фармацевтически приемлемым носителем или наполнителем.
Настоящее изобретение также относится к способам лечения злокачественной опухоли у теплокровных животных, включая людей, страдающих злокачественной опухолью, которые включают введение сочетания терапевтически эффективного количества смеси соединений общей формулы (I):
где
X, Y, A, B, R1 и R2 имеют вышеприведенные определения,
в сочетании с известным антинеопластическим средством, выбранным из группы, включающей любые из:
1) общепринятых или экспериментальных техник лучевой терапии или источника излучения, или химиосенсибилизатора,
2) одного или более средств, выбранных из группы, состоящей в качестве химиотерапевтического средства из алкилирующего средства, антиметаболического средства, средства, действующего на микротрубочки, ингибиторов тирозинкиназы,
в фармацевтически приемлемом носителе, эксципиенте или наполнителе, пригодном для перорального, парентерального, ректального, местного, подкожного или подслизистого пути введения.
Активные ингредиенты могут вводиться совместно в единичной стандартной дозировке или отдельно, или последовательно в отдельных стандартных дозировках, преимущественно в качестве набора, содержащего в отдельных контейнерах различные активные ингредиенты.
Данные фармацевтические композиции и способ их использования также основываются на широко признанных средствах, как и на заново развитых способах лечения неопластических заболеваний.
УРОВЕНЬ ТЕХНИКИ
Контроль злокачественных опухолей посредством иммунной системы
Здоровые клетки, нормально делящиеся, растут и, наконец, умирают, когда это необходимо, спланированным и хорошо контролируемым способом. Часто во время жизненного цикла случайно происходит, что индивидуальная клетка начинает развиваться бесконтрольно. Так как природа хорошо подготовилась, обычно на поверхности порожденных неконтролируемых клеток попутно возникают модифицированные антигены (антигены, ассоциированные с опухолью), которые обычно не присутствуют в нормальных неопухолевых клетках, таким образом позволяя в подавляющем большинстве случаев иммунной системе предотвратить появление многих злокачественных опухолей.
Опухолевые клетки могут остаться неопознанными иммунной системой
Однако некоторые опухолевые антигены представляют собой тканеспецифичные молекулы, общие для опухолевых клеток и здоровых клеток. Таким образом, данные слабые антигены не производят типичного вызова иммунитета. Дополнительно опухоли имеют различные признаки, которые делают сложными их распознавание и разрушение иммунной системой. Действительно, известные опухолевые клетки высвобождают иммуносупрессивные вещества (такие как, например, цитокин TGF-бета или простагландин PGE2), избегая иммунного распознавания.
Если иммунная система, вследствие какой-либо причины, не распознает опасность и не уничтожает пролиферирующие клетки, появляются злокачественные опухоли и метастазы.
Комбинирование иммунотерапии со стандартными химиотерапевтическими лекарствами
Когда диагностируется злокачественная опухоль, часто она является, к несчастью, не полностью излечимой посредством весьма агрессивных химиотерапевтических лекарств или способов, которые могут способствовать повреждению ослабленной иммунной системы человека.
Обычной практикой сегодня является применение иммуностимуляции (например, филграстим или NEUPOGEN®, лечение, которое стимулирует пролиферацию клеток крови, борясь с потенциальными осложнениями нейтропении), главным образом восстанавливая иммунную систему, часто сильно поврежденную посредством примененного химиотерапевтического средства или после лучевой терапии. Обычным рациональным стандартом является применение иммуностимулирующих средств в порядке восстановления “нормальной” клеточной формулы крови, избегая, насколько это возможно, оппортунистических инфекций у онкологических пациентов, подвергающихся противоопухолевой терапии.
Противоположно, в данной заявке предлагается, чтобы клиническое лечение иммуностимулирующим средством, представляющим собой производное триацилированного липида А проводилось до, одновременно или после применения широко признанных стандартов или экспериментальных противоопухолевых цитотоксических лекарств, или лечения посредством лучевой терапии в порядке улучшения эффективности противоопухолевого лечения, как показано ниже в примерах.
Тяжесть злокачественных опухолей
Злокачественные опухоли в настоящее время относятся к семейству пролиферативных заболеваний, которые убивают миллионы людей каждый год. Несмотря на современные достижения, такие как применение Gleevec®, остается необходимость в эффективных терапевтических средствах для борьбы со злокачественной опухолью и доля злокачественной опухоли может вырасти в дальнейшем на 50% - до 15 миллионов новых случаев к 2020 году (World Cancer Report, www.who.int/mediacentre/releases/2003/pr27/en/-40k).
В 2000 году злокачественные опухоли были ответственными за 12 процентов из около 56 миллионов смертей во всем мире от всех случаев. В 2000 году у 5,3 миллиона мужчин и 4,7 миллиона женщин развились злокачественные опухоли и в общей сложности 6,2 миллиона умерли от заболевания. Злокачественные опухоли остаются на третьем месте по летальности, после инфекционных и паразитарных заболеваний, с одной стороны, и коронарных заболеваний и заболеваний сердца, с другой стороны.
Рак легкого представляет собой наиболее распространенный рак в мире, представляя 1,2 миллиона новых случаев ежегодно: следующим является рак молочной железы - свыше 1 миллиона случаев; рак толстой и прямой кишок - 940000; желудка - 870000; печени - 560000; шейки матки - 470000; пищевода - 410000; головы и шеи - 390000; мочевого пузыря - 330000; злокачественная неходжкинская лимфома - 290000; лейкемия - 250000; простаты и тестикул - 250000; поджелудочной железы - 216000; яичников - 190000; почки - 190000; эндометрия - 188000; нервной системы - 175000; меланома - 133000; щитовидной железы - 123000; глотки - 65000; и заболевание Ходжкина - 62000 случаев.
Три ведущих вида рака различают три наиболее распространенные формы: рак легкого, ответственный за 17,8 процента всех летальных случаев, желудка - 10,4 процента и печени - 8,8 процента.
Основная терапия для борьбы со злокачественными опухолями
Большинство злокачественных опухолей классически лечатся:
- хирургическим путем,
- лучевой терапией,
- химиотерапией,
- и/или биологической терапией.
Хирургия
Во время данного вмешательства солидные опухолевые массы извлекаются из тела. Однако если уже имеются распространенные метастазы, данное лечебное вмешательство обычно становится неприменимым.
Лучевая терапия
Данный способ относится к применению излучения высокой энергии рентгеновских лучей, гамма-лучей, нейтронов и других источников уничтожения опухолевых клеток и уменьшения опухолей.
Данный способ может назначаться перед хирургическим вмешательством (новая вспомогательная терапия) для уменьшения опухоли, чтобы облегчить ее удаление. В другом случае лучевая терапия назначается после хирургического вмешательства (вспомогательная терапия) для разрушения каких-либо опухолевых клеток, которые могут оставаться в данной области.
Интересно, что недавно было продемонстрировано (De Ridder et al., Int J Radiat Oncol Biol Phys. 2003 Nov 1;57(3):779-86), что гипоксические клетки опухоли молочной железы (клетки ЕМТ-6) показывают уменьшенную чувствительность к излучению (от 0 до 20 Гр) 16 часов после активации NF-kB (и, следовательно, оксидом азота). Так как триацилированные производные липида А показали стимуляцию даже более высоких уровней оксида азота из макрофагов, чем LPS, установлено, что триацилированные производные липида А будут сильными противоопухолевыми средствами при применении в сочетании с лучевой терапией. Макрофаги изменяют радиосенситивную активность липида А (de Ridder et al., Int J Radiat Oncol Biol Phys. 2004 Oct 1;60(2):598-606), таким образом предполагая новую роль для иммунных клеток в реакции опухолевых клеток на лучевую терапию. Эффект одного триацилированного производного липида А соответственно общей формуле I показан ниже в данной системе.
Химиотерапия
Химиотерапия обычно назначается циклами: период лечения, один или более дней, последующий восстановительный период, несколько дней или недель, затем следующий период лечения и так далее. Здесь предлагается, что между или совместно с данными химиотерапевтическими циклами (предназначенными для уменьшения опухоли и выявления опухолевых антигенов) может выполняться стимуляция иммунной системы посредством триацилированных соединений по изобретению.
Рациональная поддерживающая химиотерапия
Любое эффективное и безопасное химиотерапевтическое средство уничтожит опухолевые клетки и не нанесет ущерба расположенным рядом здоровым клеткам. Данное может достигаться в теории посредством определения у опухолевых клеток уникальных свойств, которые не обнаружены в нормальных тканях.
Стратегия снижения клинического применения химиотерапевтических лекарств основывается на простом фактическом наблюдении, что большинство опухолевых клеток растет быстрее, чем нормальные клетки. Поэтому представляется рациональным нацеливание на некоторые специфические ферменты или клеточные элементы, связанные с циклом клеточного роста. Данная цитотоксическая стратегия предполагает, что быстрорастущие клетки были бы более поражены, а клетки, растущие медленно, подверглись бы меньшему поражению. Данный рациональный подход действительно применяется для развития многих химиотерапевтических средств, которые в настоящее время используются в клинике.
Химиотерапевтические средства являются активными преимущественно в течение фаз S и М клеточного цикла.
Ограничения химиотерапии
Помимо недостаточной клинической эффективности, данная стратегия имеет собственные токсикологические ограничения, так как некоторые нормальные клетки (такие как, например, пролиферирующие Т- и В-клетки) также нуждаются в отделении, когда это необходимо. Действительно, когда пациент страдает от поражения почек или печени и не может поэтому нормально элиминировать химиотерапевтическое средство, введение рекомендованного количества лекарства может также проявлять токсичность для пациента, неспособного метаболизировать и/или выделить его. Поэтому являются абсолютно необходимыми регулировки дозы, избегая неприемлемой токсичности или субтерапевтического дозирования.
Фармакокинетика для онкологических пациентов часто является очень сложной и, иногда, ограничивает методики химиотерапии пациентов.
Как изменить эффективность химиотерапии и уменьшить побочные эффекты
Здесь рассматривается, что адекватная и своевременно контролируемая комбинированная клиническая терапия широко признанными или экспериментальными химиотерапевтическими лекарствами, используемая в первую очередь для уменьшения количества и уничтожения опухолевых клеток (и, таким образом, потенциально обнаруживая связанные с опухолью антигены), последующая неспецифическая иммуностимуляция триацилированным соединением по настоящему изобретению изменяет эффективность онкостатического лекарства и дает возможность приобретения иммунологической (специфичной) памяти для достижения освобождения от клеток, производящих ассоциированный с опухолью антиген, и также ограничивает уровень наблюдаемых побочных эффектов, обеспечивая, например, снижение количества введений и/или доз химиотерапевтического лекарства.
Основные химиотерапевтические лекарственные средства
Текст адаптирован из
A Chemotherapy Primer: Why? What? and How?, Julia Draznin Maltzman, M.D, November 5, 2003, OncoLink, Abramson Cancer Center of the University of Pennsylvania
Химиотерапевтические средства могут разделяться на следующие классы:
- Алкилирующие средства
Например, Алретамин, BCNU, Бусульфан, Кармустин, CCNU, Хлорамбуцил, Хлорметин, Карбоплатин, Цисплатин, Циклофосфамид, Дакарбазин, Эстрамустин, Фотемустин, Ифосфамид, Ломустин, Мафосфамид, Мелфалан, Митомицин, Нимустин, Оксалиплатин, Прокарбазин, Стрептозоцин, Тиотепа, Лобаплатин, Мибоплатин и т.д.
- Интеркаланты/ингибиторы топоизомеразы II
Азакрин, Дактиномицин, Даунорубицин, Доксорубицин, Ацетат Эллиптиния, Эпирубицин, Идарубицин, Митоксантрон, Пирарубицин.
Пликамицин
Вабрубицин
Зорубицин
и т.д.
Они являются известными как обладающие высокой и необратимой кардиотоксичностью.
- Ингибиторы топоизомеразы I
Иринотекан и Топотекан
- Антиметаболиты
Они подклассифицированы на три класса:
- антагонисты фолиевой кислоты,
- аналоги пурина, и
- аналоги пиримидина.
Их примерами являются Капецитабин, Кладрибин, Цитарабин, Флударабин, Фторурацил (5-FU), Гемцитабин, Меркаптопурин, Метотрексат, Тиогуанин и т.п.
- Средства, действующие на микротрубочки (например, алкалоиды и токсоиды)
Паклитаксел, Доцетаксел, Таксол, Винбластин, Винкристин, Виндезин, Винорелбин и т.п.
- Ингибиторы тирозинкиназы
Ингибиторы протеинкиназы используются в качестве противоопухолевых терапевтических средств и биологических инструментов в сигнализации клеток. Двумя характерными членами данного семейства соединений являются Мезилат Иматиниба (Gleevec®) и Гефитиниб (Iressa®).
- Другие химиотерапевтические средства: они представляют собой ферменты или антибиотики, такие как:
- Аспарагиназа,
- Блеомицин,
Алкилирующие средства
Алкилирующие средства участвуют в общем механизме действия ядовитых горчичных соединений азота, первоначально разработанных для военного применения. Поэтому неудивительно, что такие средства показывают полный набор неблагоприятных результатов.
Они действуют на отрицательно заряженные участки ДНК. Посредством связывания ДНК изменяются репликация и транскрипция, прекращается клеточная активность и клетки начинают погибать. Данный класс противоопухолевых лекарств является очень мощным и применяется при многих типах опухолей (солидные опухоли и лейкемия). К несчастью, описанные побочные эффекты являются значительными (преимущественно снижение выработки спермы, прекращение менструаций и могут служить причиной стойкого бесплодия). Алкилирующие средства могут служить причиной вторичных опухолей. Наиболее распространенной вторичной опухолью является лейкемия (острая миелоидная лейкемия), которая может возникать спустя годы после окончания терапии.
Производные природных металлов, такие как производные платины, например цисплатин, демонстрируют некоторую активность против опухолей, главным образом против рака легкого и тестикул. Наиболее значительна токсичность цисплатина в повреждении почек. Второе поколение производных платины, называемое карбоплатин, имеет мало почечных побочных эффектов и может быть подходящим заменителем режимов, содержащих цисплатин. Оксалиплатин представляет собой третье поколение производных платины, которые активны при раке толстой кишки и не обладают ренальной токсичностью. Однако его главными побочными эффектами являются нейропатии.
Как предоставляется ниже, примеры на различных моделях, в которых используется аналог триацилированного липида А после лечения алкилирующими средствами, такими как циклофосфамид или цисплатин, показывают очень хорошую синергическую противоопухолевую активность. В предоставленных примерах “in vivo” (см. соответствующие разделы) в использованных условиях каждое средство индивидуально не дает удовлетворительных противоопухолевых результатов, и, довольно неожиданно, неспецифическая стимуляция иммунной системы посредством триацилированных производных липида А после первого неспецифического химиотерапевтического лечения предоставляет обнадеживающие противоопухолевые результаты, заслуживающие тестирования в клинических противоопухолевых испытаниях.
Интеркаланты/ингибиторы топоизомеразы II
Данные соединения формируют комплекс с ферментом и ДНК и таким образом ингибируют повторное лигирование ДНК. Они применяются преимущественно в лечении злокачественных заболеваний крови, раке молочной железы, раках пищеварительного тракта, раках половых органов, бронхиальных или конъюнктивальных саркомах. Их главными неблагоприятными эффектами являются миелосупрессия, рвота, кардиотоксичность и облысение.
Ингибиторы топоизомеразы I
Они специфично ингибируют топоизомеразу-I и, таким образом, транскрипцию и репликацию во время фазы S клеточного цикла.
Они преимущественно применяются для борьбы с раком толстой и прямой кишок. Их основными неблагоприятными эффектами являются миелосупрессия, нейтропения, рвота, облысение и холинергический синдром.
Антиметаболиты
Они применяются преимущественно против трофобластической карциномы, рака молочной железы, рака яичника, острой лейкемии, остеосаркомы, лимфомы.
Их основные неблагоприятные эффекты касаются преимущественно миелосупрессии, токсичности в отношении кожи и слизистых оболочек, диареи, рвоты.
В 1948 году Farber продемонстрировал, что аналог фолиевой кислоты вызывает ремиссию детской лейкемии. Затем были синтезированы другие аналоги, ингибирующие ключевые ферментативные реакции. Антиметаболиты вмешиваются в нормальные пути метаболизма, включая необходимые для производства новой ДНК (фаза S клеточного цикла). Антифолатом, наиболее широко применяющимся в противоопухолевой терапии с активностью против лейкемии, лимфомы, рака молочной железы, рака головы и шеи, сарком, рака толстой кишки, рака мочевого пузыря и хориокарцином, является метотрексат, который ингибирует ключевой фермент (дигидрофолатредуктаза), необходимый для синтеза ДНК.
Другим широко применяющимся антиметаболитом, нарушающим синтез ДНК, является аналог пиримидина 5-фторурацил, который преобразуется в монофосфат фтордезоксиуридина (5-FdUMP), который блокирует фермент тримидилатсинтазу, необходимый для эндогенного синтеза пиримидиновых оснований (С и Т). Пример сочетания триацилированного соединения структурной формулы I с 5-фторурацилом будет предоставлен ниже. Соединение имеет широкий диапазон активности, включающий рак толстой кишки, рак молочной железы, рак головы и шеи, рак поджелудочной железы, рак желудка, рак заднего прохода, рак пищевода и гепатомы. Однако 5-фторурацил метаболизируется посредством фермента дигидропиримидиндегидрогеназы (DPD), который не выражен у небольшой популяции пациентов. Когда данные пациенты получают инъекцию данного химиотерапевтического средства, они получают острую и тяжелую интоксикацию (супрессия костного мозга, тяжелая гастроинтестинальная токсичность и нейротоксичность, которая может включать судороги и даже кому). Капецитабин представляет собой пероральное соединение про-5-фторурацила, которое имеет сходные потенциальные побочные эффекты. Преметрексед представляет собой антифолатное антинеопластическое средство, препятствующее репликации клетки, предназначенное для инъекций (Alimta®), производимое Eli Lilly and Company.
Другие антиметаболиты, ингибирующие синтез ДНК и восстановление ДНК, включают: Цитарабин, Гемцитабин (Gemzar®), 6-меркаптопурин, 6-тиогуанин, Флударабин и Кладрибин.
Средства, действующие на микротрубочки (например, алкалоиды и анатоксины)
Алкалоиды, такие как Винбластин, Винкристин, Виндезин или Винорелбин, связывают тубулин, цитоплазматический белок и таким образом препятствуют формированию митотических веретен и блокируют митоз в метафазе.
Винкристин, винбластин и винорелбин были экстрагированы из листьев растения барвинок, Vinca rosea. Они преимущественно применяются для лечения злокачественных болезней крови (включая болезнь Ходжкина), аэродигестивных раков, нефробластом, раков молочной железы.
Их главными неблагоприятными эффектами являются миелосупрессия, тошнота, рвота, облысение, жгучесть, нейропатия и нейротоксичность.
Таксаны, впервые выделенные из коры Тихоокеанского тиса Taxus brevifolia в 1963 году, являются специфичными для фазы М клеточного цикла. Семейство включает паклитаксел и доцетаксел. Таксаны с высоким сродством связываются с микротрубочками и ингибируют их нормальное функционирование. Они являются эффективными против рака молочной железы, рака легкого, рака головы и шеи, рака яичника, рака мочевого пузыря, рака пищевода, желудка и рака предстательной железы. Данные средства, однако, снижают количество клеток крови.
Их главными неблагоприятными эффектами являются преимущественно миелосупрессия (нейтропения) и лимфатический отек.
Ингибиторы тирозинкиназы
Ингибитор тирозинкиназы Гефитиниб (Iressa®, AstraZeneca) применяется для лечения прогрессивного немелкоклеточного рака легкого (NSCLC), наиболее распространенной формы рака легкого в Соединенных Штатах.
Гефитиниб блокирует действие рецепторов EGF на клетках определенных раков легкого и имеет некоторые видимые эффекты против данных раков.
Некоторые распространенные побочные эффекты Iressar® включают в числе других: диарею, сыпь, прыщи, сухость кожи, тошноту, рвоту, зуд, снижение аппетита, слабость и потерю веса.
Ингибитор тирозинкиназы Мезилат Иматиниба (Gleevec®, Novartis) одобрен для лечения пациентов с несомненно неоперабельными и/или метастазирующими злокачественными стромальными гастроинтестинальными опухолями (GIST) и для лечения хронической миелоидной лейкемии (CML).
Мезилат Иматиниба представляет собой ингибитор сигнальной трансдукции, который действует посредством поражения активности тирозинкиназ. Активность одной из данных тирозинкиназ, известной как c-kit, считается управляющей ростом и делением большинства GIST. Иматиниб представляет собой ингибитор рецептора тирозинкиназ для тромбоцитарного фактора роста (PDGF) и фактора стволовой клетки (SCF), c-kit и ингибирует PDGF- и SCF-опосредованные клеточные события. In vitro иматиниб ингибирует пролиферацию и вызывает апоптоз в клетках GIST, который экспрессирует активация c-kit мутации.
Большинство пациентов, принимавших Gleevec® в клинических исследованиях испытывали побочные эффекты, такие как тошнота, задержка жидкости (отечность вокруг глаз, на стопах и т.п.), мышечные спазмы, диарея, рвота, кровоточивость, боли в мышцах и костях, сухость кожи, головная боль, утомление, суставные боли, нарушение пищеварения и одышка.
Другие химиотерапевтические средства
Блеомицин представляет собой малый белок, выделенный из грибка Streptomyces verticillus. Механизм его действия сходен с антрациклинами. Свободные радикалы кислорода формируются в результате разрыва ДНК и вызывают гибель опухолевых клеток. Данное лекарство редко применяется в качестве монотерапии, предпочтительнее в сочетании с другой химиотерапией. Блеомицин является активным средством в режимах для рака тестикул, а также лимфомы Ходжкина. Наиболее частым побочным эффектом данного лекарства является токсическое воздействие на легкие по причине образования свободных радикалов кислорода.
Аспарагиназа катализирует гидролиз аспарагина в аспарагиновой кислоте и аммонии и таким образом убивает опухолевые клетки, чувствительные к недостатку аспарагинсинтетазы (лимфоциты и клетки лимфоидного происхождения). Она используется для лечения заболеваний крови (острые лейкемии, лимфомы Ходжкина). Ее основными неблагоприятными эффектами являются гепатотоксичность, тошнота и, иногда, анафилактические шоки.
Биологическая терапия
Данный раздел содержит 3 части: моноклональные антитела, цитокины и иммуностимуляция посредством бактериальных средств. Соединения по настоящему изобретению принадлежат к данному классу средств.
Моноклональные антитела
Мышиные, химерные, ослабленные и моноклональные антитела человека (huMoAb) применяются для лечения рака у человека [Untch m, Ditsch N, Hermelink K., Immunotherapy: new options in breast cancer treatment., Expert Rev Anticancer Ther. 2003 Jun; 3(3):403-8].
Предполагается, что к 2010 году будут клинически применяться около 20 антител.
Применение моноклональных антител вызывает выработку специфических антител, направленных против антигенов, расположенных на поверхности опухолевых клеток. Образец опухолевых клеток пациента забирается и обрабатывается для производства специфических антител к опухолеспецифическим антигенам. Таким образом, при данном подходе к работе должно предоставляться достаточное количество уникальных антигенов к опухолевым клеткам. Кроме того, опухолевые антигены должны быть достаточно отличными от антигенов, произведенных нормальными клетками, провоцирующими ответную выработку антител.
Данные антитела (распознающие опухолевые клетки) могут применяться для уничтожения опухолевых клеток как самостоятельно, так и в качестве носителей других веществ, используемых для терапевтических или диагностических целей. Например, химиотерапевтические средства могут прикрепляться к моноклональным антителам, доставляющим высокие концентрации данных токсических веществ прямо к опухолевым клеткам. Теоретически данный подход является менее токсичным и более эффективным, чем общепринятая химиотерапия, поскольку уменьшает доставку вредных средств к нормальным тканям.
Эрбитукс (цетуксимаб) представляет собой моноклональное антитело, которое нацелено на рецептор эпидермального фактора роста (EGFR) и, таким образом, регулирует рост клеток. Предполагается, что эрбитукс влияет на рост опухолевых клеток посредством связывания EGFR так, что эндогенный эпидермальный фактор роста не может связаться и стимулировать рост клеток. Эрбитукс применяется для лечения метастазов раков толстой и прямой кишок. Инфузия эрбитукса может вызывать серьезные побочные эффекты, которые могут включать затруднение дыхания и снижение артериального давления, которые обычно регистрируются во время первого лечения. Также, иногда, было зарегистрировано интерстициальное заболевание легких (ILD). Другими, более общими побочными эффектами эрбитукса являются: сыпь (угри, сыпь, сухость кожи), утомляемость/слабость, лихорадка, запор и боль в животе.
Ритуксимаб (анти-CD20) был первым зарегистрированным МАВ для терапии фолликулярной лимфомы. Впечатляющие результаты были отмечены в сочетании с CHOP химиотерапией (циклофосфамид, доксорубицин, винкристин и преднизон) при фолликулярной и выраженной лимфомах.
Другими представленными на рынке моноклональными антителами являются: Алемтузамаб (Campath®, нацеленный на CDw52, выраженный на лимфоидных опухолях); Гемтузумаб-озогамицин (Mylotarg®, нацеленный на CD33, выраженный на бластах миелоидной лейкемии) и Тоситумаб (Bexxar®).
Цитокины
Большинство проверенных цитокинов для лечения злокачественных опухолей являются интерлейкином-2 и интерферонами.
Интерлейкин-2
Интерлейкин-2 (IL-2) представляет собой вещество, производимое лимфоцитами. В дополнение к существующему первичному фактору роста Т-клеток IL-2 усиливает различные функции натуральных клеток-киллеров (NK-клеток) и Т-клеток. IL-2 также активирует лимфокинактивированные клетки-киллеры (LAK-клетки). LAK-клетки разрушают опухолевые клетки и улучшают восстановление иммунных функций при определенных иммунодефицитных состояниях. Пациенты с почечноклеточным раком, меланомой и неходжкинской лимфомой демонстрировали некоторые реакции на терапию IL-2.
Наиболее сильным токсическим эффектом IL-2 является способность повышения проницаемости капилляров. Это может вызывать гипотензию, асцит, генерализованный отек тела (анасарка) и отек легких. Также часто встречаются озноб и жар в пределах нескольких часов после введения IL-2. Головная боль, недомогание и другие гриппоподобные симптомы также являются обычными. Гастроинтестинальные эффекты включают тошноту, рвоту, снижение аппетита, диарею и мукозит (воспаление слизистых оболочек).
Интерфероны
Интерфероны (IFN) представляют собой малые белки, которые ингибируют репликацию вируса и стимулируют клеточный (Т-клеточный) иммунный ответ. В настоящее время различают три больших типа IFN: альфа, бета и гамма. Каждый тип имеет сходные, но характерные способности для изменения биологических ответов. Альфа-IFN главным образом показан при применении в лечении гепатита С, но в настоящее время также назначается при лечении волосато-клеточного лейкоза и ассоциированной со СПИДом саркомы Капоши. Он также показывает некоторую терапевтическую эффективность против гематологических заболеваний, таких как слабо выраженная лимфома Ходжкина, кожная Т-клеточная лимфома, хронический миелоидный лейкоз и множественная миелома. Он также является отчасти эффективным при некоторых солидных опухолях, таких как почечноклеточный рак.
Бета-интерферон в настоящее время применяется для лечения рассеянного склероза.
Одним из наиболее распространенных побочных эффектов терапии IFN является гриппоподобный синдром. Симптомы включают лихорадку, озноб, тахикардию, мышечную боль, недомогание, утомление и головную боль.
Другие основные побочные эффекты IFN включают снижение количества белых кровяных клеток, анемию (при продленной терапии) и снижение количества тромбоцитов. Также могут быть представлены гастроинтестинальные симптомы, такие как снижение аппетита, тошнота, рвота и диарея. Диапазон токсического воздействия на центральную нервную систему от легкой спутанности и сонливости до судорожных припадков. Острая почечная недостаточность редка, но может случаться. Также может быть проблемой выпадение волос.
Иммуностимуляция посредством бактериальных средств
После многообещающих результатов испытаний на животных в шестидесятые годы специалисты начали крупномасштабные клинические испытания стимуляции иммунной системы онкологических пациентов с применением бактериальных средств, таких как Corinebacterium parvum (C. parvum) и Bacillus Calmette-Guerin (BCG). К несчастью, результаты данных ранних иммунотерапевтических испытаний были обескураживающими и лечение опухолей с применением иммуностимулирующих лекарств в чистом виде утратили актуальность.
Токсичность поступающих извне иммуностимуляторов сильно ограничивало их применение у онкологических пациентов. В 1976 году Morales et al. ввел интравезикально Bacillus Calmette-Guerin (BCG) для лечения поверхностного рака мочевого пузыря (Morales et al. 1976, повторно обсуждено в J Urol. 2002 Feb; 167(2 Pt 2):891-3; обсуждение 893-5). BCG, неспецифическая иммунотерапия для поверхностного рака мочевого пузыря, может рассматриваться в качестве наиболее успешной из всех способов иммунотерапии у человека (последний обзор см. Boyd, Urol Nurs. 2003 Jun; 23(3):189-91, 199; вопросы 192).
Противоопухолевый эффект липополисахаридов (LPS) хорошо доказан. В XIX веке Coley разработал противоопухолевую терапию, основанную на бактериальных токсинах (см. Coley WB, the Practitioner, November 1909). В 1940 годах было показано, что бактериальные липополисахариды (LPS) были по крайней мере частично ответственными за наблюдаемую противоопухолевую активность токсинов Coley. Более новые публикации показывают противоопухолевые эффекты LPS в экспериментальных моделях на животных и очень ограниченном количестве исследований, проведенных у человека. Поскольку LPS является очень токсичным и может вызвать эндотоксический шок, терапевтическое окно оказалось очень маленьким и пациенты могут лечиться только очень маленькими количествами LPS, которые часто также являются низкими для достижения желаемых благотворных эффектов.
Биологическая и токсическая активности LPS связаны с их липидным компонентом, называемым "липид А". Различные виды бактерий синтезируют различные структуры липида А, и они имеют варьирующиеся степени токсичности. Это позволяет предположить, что посредством модификации природного бактериального липида А может быть возможным приготовление производных, которые имеют ослабленную токсичность, но сохраняют бла