Способ получения фенола
Иллюстрации
Показать всеИзобретение относится к способам (вариантам) получения фенола путем гидродеоксидирования полигидроксилированных производных бензола, а также путем селективного гидроксилирования бензола, в которых используется катализатор на основе многокомпонентных оксидов металлов, отличающийся тем, что указанные оксиды включают по меньшей мере одну активную фазу оксида, которая соответствует структуре шеелита, и материалы с кристаллической структурой, не являющейся шеелитом, или аморфной структурой, где кристаллическую структуру шеелита выбирают из следующих составов:
Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoO4,
Cu(1-z)ZnzW(1-y)MoyO4
где каждый из w, x, у и z составляет от 0 до 1,
и где материалы с кристаллической структурой, не являющейся шеелитом, или аморфной структурой выбирают из оксида церия или смеси оксид церия - оксид циркония. 2 н. и 21 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к способу получения фенола путем гидродеоксидирования бензолдиолов водородом или посредством прямого окисления бензола.
Более конкретно, оно относится к способу получения фенола, в котором вышеупомянутые реакции проводят в присутствии катализатора на основе многокомпонентных оксидов металлов.
Фенол является промежуточным продуктом, имеющим большое значение и применяемым во многих отраслях промышленности, например в производстве поликарбонатов или других фенольных смол, волокон, моющих средств, антиоксидантов и во многих других областях.
В промышленном масштабе фенол получают исходя из кумола посредством многостадийного процесса, который начинается с бензола и пропилена и приводит к совместному образованию фенола и ацетона. Совместное получение ацетона может далее вызвать проблемы с его использованием, поскольку, как предполагают, рынок этого продукта развивается медленнее, чем рынок фенола.
Поэтому с целью упрощения существующего способа активно проводят исследования в поисках альтернативного коммерческого процесса.
Рассматриваемые в настоящее время направления исследований предлагают процессы как в жидкой, так и в газовой фазе.
Например, в патентах США 6573413 и 5110995 описан «одностадийный» способ в газовой фазе, исходя непосредственно из бензола и закиси азота (процесс Alphox). Одна из основных проблем этого способа связана с доступностью окислителя. Специальное получение закиси азота (N2O) в качестве окислителя исходя из аммиака фактически является обременительным, в то время как возможность использования N2O - побочного продукта производства адипиновой кислоты из фенола, по-видимому, является важным фактором экономической целесообразности процесса Alphox. Это, однако, требует сильной интеграции между этими двумя процессами, что неудобно для проведения независимого продвижения на товарном рынке.
Исследование альтернативных способов получения фенола, основанных на прямом окислении бензола при высокой температуре в газовой фазе посредством молекулярного кислорода или воздуха в присутствии различных катализаторов окисления, до сих пор не дало приемлемых результатов как в отношении присущей процессу безопасности, так и в отношении параметров процесса.
К сожалению, при используемых в этих процессах температурах также происходит значительное окисление бензольного кольца, которое приводит к образованию таких продуктов, как диоксид углерода, карбоновые кислоты или ангидриды, с вытекающей из этого потерей селективности (патент США 5981424; G.I.Panov САТТЕСН 4 (2000), 18-32; J. Plotkin, European Chemical News 25/09-1/10 2000, 59-62).
Другим недостатком прямого окисления в газовой фазе, в которую одновременно подают окислители (например, кислород) и углеводороды, является возможность попадания в пределы воспламеняемости или взрываемости смеси реагентов; часто эти пределы известны только приблизительно для условий промышленных установок в отношении температуры, давления, геометрических характеристик (P.Arpentier, F.Cavani, F.Trifiro, Технология каталитического окисления. Т.2. Аспекты безопасности. (The technology of catalytic oxidation, vol. 2, Safety aspects), Ed. Technip, 2001).
Патенты ЕР 0919531 и ЕР 0958861 описывают селективное окисление бензола без разрыва бензольного кольца, проводимое в жидкой фазе с использованием таких окислителей, как перекись водорода, в присутствии специфических растворителей и пригодных для этого каталитических систем. Эти способы, однако, не позволяют достичь высоких уровней производительности, поскольку их необходимо осуществлять при низких степенях превращения бензола, чтобы ограничить последующие реакции окисления фенола до побочных продуктов (пирокатехина и гидрохинона).
Например, в патентной заявке WO 03042146 указано, что на каждую тонну фенола одновременно получают 111 кг гидрохинона и пирокатехина (в смеси 55/45), при степени превращения бензола 12,2% и селективности по отношению к фенолу 90%. Эти побочные продукты получают в таком количестве, что рынок не может их поглотить, и, таким образом, их следует утилизовывать, что приводит к увеличению затрат на проведение процесса.
Другой способ получения фенола предусматривает в качестве исходных веществ бензолдиолы (диоксибензолы); эти соединения подвергают процессу гидродеоксидирования водородом, проводя процесс в присутствии воды и с катализатором на основе элементов VIB или VIII группы Периодической системы, как описано в Европейской патентной заявке ЕР 1411038.
Интегрированный способ получения фенола, описанный в итальянской патентной заявке ЕР 1424320 А1, в котором побочные продукты реакции - гидрохинон и пирокатехин - селективно превращают в фенол и рециклируют в потоки, участвующие в процессе, позволяет полностью устранить одновременное образование побочных продуктов, получая рост производительности по фенолу.
В настоящее время установлено, что фенол можно получить исходя как из полигидроксилированных производных бензола (например, бензолдиолов) посредством гидроксидеоксидирования в присутствии водорода, так и из бензола посредством окислительного гидроксилирования (называемого также прямым частичным окислением), проводимого в среде с недостатком реагентов, при работе в присутствии конкретных каталитических композиций.
Проведение реакции в среде с недостатком реагента означает, что реакцию проводят с дефицитом молекулярного кислорода или других окислителей по отношению к стехиометрии реакций.
Этих условий достигают, подавая кислород или другие окислители в реакцию в меньших количествах по сравнению со стехиометрическим количеством в расчете на вступающий в реакцию бензол или совсем не подавая их, как более ясно проиллюстрировано ниже.
Таким образом, предметом данного изобретения является способ получения фенола посредством гидродеоксидирования полигидроксилированных производных бензола или посредством селективного гидроксилирования бензола в условиях недостатка реагента, характеризующийся тем, что указанные реакции проводят в присутствии катализатора на основе многокомпонентных оксидов металлов, включающего по меньшей мере один металл, выбранный из групп VB, VIB, VIII, IB, ИВ, IVA, VA.
Возможность использования катализаторов по данному изобретению при окислительном гидроксилировании бензола в условиях недостатка реагента или при гидродеоксидировании полигидроксилированных производных бензола в присутствии водорода является еще более неожиданной, учитывая то, что обычные катализаторы окисления и восстановления неспособны осуществить описанные реакции, как показано приведенными сравнительными примерами.
В случае окислительного гидроксилирования в условиях недостатка реагента недостающий до стехиометрии кислород обеспечивает катализатор, который в то же время изменяет свой состав (стадия превращения бензола в фенол и стадия восстановления катализатора). В последующей фазе катализатор снова возвращается в свое первоначальное состояние посредством кислорода или другого окисляющего соединения (стадия повторного окисления катализатора). Стадии реакции и повторного окисления осуществляют циклически.
На стадии окисления бензола до фенола используют катализатор в частично или полностью окисленной форме, и в условиях реакции поддерживают дефицит кислорода или другого окисляющего агента.
На практике реакцию окисления бензола до фенола проводят в отсутствие молекулярного кислорода или других окисляющих агентов или путем подачи меньших количеств кислорода или других окислителей, чем количество, необходимое согласно стехиометрии участвующего в реакции бензола.
Из реакции (1), приведенной ниже, видно, что катализатор участвует в стехиометрии реакции, действуя также в качестве реагента, когда он находится в окисленном состоянии («catox») и способен предоставить часть своего кислорода, и впоследствии предполагает переход в восстановленное состояние («catred»).
Для того чтобы реакция была каталитической, необходимо, чтобы восстановленный катализатор был способен легко получать кислород от агента-окислителя (например, воздуха, кислорода, N2O и т.д.), чтобы снова превратиться на второй стадии (2) в более высокую степень окисления, способную инициировать новый цикл окисления.
Степень окисления катализатора в его окисленной форме может быть максимальной степенью окисления или промежуточной степенью окисления, оптимальной для приведения к максимуму желаемых параметров реакции (выходы, производительность и т.д.).
где «ох» представляет собой один из вышеуказанных окисляющих агентов.
В области реакций селективного каталитического окисления известно проведение реакции в условиях недостатка реагента (далее называемое «Окислительно-восстановительная технология» (RedOx - технология)) (Ind. Eng. Chem., 41(6), 1949, p.1227).
Этот подход был разработан как для реакций селективного окисления, так и для окислительной дегидрогенизации.
В частности, можно проследить историю RedOx - технологии для реакций селективного окисления, как описано во введении к данному патенту, до инженерных концепций, которые предполагали работу в периодическом режиме. Самые последние разработки таких технологий описаны в работах G.Emig и M.A.Liauw, Topics in Catalysis, vol.21, Nos. 1-3 (2002), pp.11-24, и P.Silveston, R.R.Hudgins, A.Renken, Catalysis Today 25 (1995) 91-112.
Процесс окисления бензола с применением RedOx-технологии осуществляют в реакторе, работающем при температурах в диапазоне от 150 до 700°С, предпочтительно от 200 до 600°С, еще более предпочтительно от 250 до 550°С, при давлении в диапазоне от 0,01 до 10 МПа (от 0,1 до 100 бар), предпочтительно от 0,1 до 3 МПа (от 1 до 30 бар) с объемными скоростями, имея в виду массовую объемную скорость в час, WHSV (г питающей смеси на г катализатора в час) в диапазоне от 0,01 до 1000 ч-1, предпочтительно от 1 до 100 ч-1, еще более предпочтительно от 2 до 50 ч-1.
Реакцию можно проводить в присутствии разбавителя (N2, СН4, Н2О, СО2 и т.д.). Каталитическую систему восстанавливают в регенераторе при температуре выше 100°С, восстанавливая, таким образом, степень окисления, более полезную для катализатора, и, возможно, устраняя по меньшей мере часть углеродистых отложений, образовавшихся в ходе реакции.
Окислительная среда, применяемая в этой секции, может состоять из кислорода, воздуха, подходящих смесей азота и кислорода, других окислителей, таких как, например, N2O и ее смеси. Возможно также присутствие разбавителей, таких как СО2, Н2О и т.д.
Реакцию окисления органического субстрата предпочтительно проводят за пределами диапазона взрываемости газообразной смеси реагентов для используемых диапазонов температуры, давления и соотношения кислород/воздух.
Реакцию гидроксилирования бензола по данному изобретению проводят предпочтительно в двух реакторах: один предназначен для проведения реакции, другой - для регенерации.
Таким образом можно отделить углеводород от окисляющего агента, получая таким образом различные преимущества по сравнению с окислением в газовой фазе, где одновременно подают субстрат и окисляющий агент.
В частности, разделение потока органических веществ и потока окислителя в реакторе позволяет обеспечить:
использование в качестве окисляющего агента воздуха вместо кислорода без воздействия азота, мешающего при разделении продукта;
более высокую селективность, поскольку отсутствует прямое взаимодействие между подаваемым органическим субстратом и молекулярным кислородом;
возможность подачи более концентрированных потоков без риска взрыва, благодаря разделению смеси воздух/окисляющий газ и углеводородов;
образование более концентрированного продукта на выходе из реактора;
оптимизацию выходов с помощью соответствующего регулирования условий реакции (состав и расход питания, частота повторного окисления катализатора, состояние окисления катализатора в начале и в конце реакционной стадии).
Процесс селективного гидроксилирования бензола обычно осуществляют в нескольких реакторах, по меньшей мере один из которых предназначен для регенерации катализатора; в этом случае по меньшей мере один реактор предназначен для регенерации катализатора, которую проводят либо посредством физического перемещения катализатора из реактора, где протекает реакция, в реактор регенерации, либо посредством обмена потоков между ними.
Если используют реакторы с псевдоожиженным слоем, стадии реакции и регенерации можно проводить в этом же оборудовании, в соответствии с существующим уровнем техники.
Реакторы с быстрым движением в псевдоожиженном слое, или реакторы типа разделительной колонны с перетоком можно с успехом использовать для проведения гидроксилирования при малых временах контакта.
Если фенол получают путем гидродеоксидирования полигидроксилированных производных бензола, например бензолдиолов, процесс проводят путем реакции полигидроксилированного производного бензола с водородом в паровой фазе при температуре 250-500°С, предпочтительно 300-450°С, при давлении 0,1-10 МПа (1-100 бар), предпочтительно в диапазоне 0,3-5 МПа (3-50 бар), и с объемной скоростью (WHSV - массовая часовая объемная скорость, кг бензолдиолов/ч/кг катализатора) 0,1-10 ч-1, предпочтительно 0,5-5 ч-1.
Вода является обычной реакционной средой для этой реакции, она фактически является оптимальным растворителем для реагентов и продуктов реакции и также является полностью инертной по отношению к ним обоим.
Вода также имеет то преимущество, что она обладает высокой теплоемкостью и, следовательно, имеет свойство ограничивать повышение температуры из-за энтальпии реакции деоксидирования. Наконец, вода является также особенно экономичной.
В процессе, использующем гидродеоксидирование бензолдиолов, можно превратить в фенол с высокой эффективностью и селективностью 1,2-бензолдиол (пирокатехин, далее сокращенно 1,2-БД), 1,3-бензолдиол (резорцин, далее 1,3-БД), 1,4-бензолдиол (гидрохинон, далее 1,4-БД) и их смеси.
Реакцию проводят в паровой фазе при температуре 250-500°С, предпочтительно 300-450°С, при давлении 0,1-10 МПа (1-100 бар), предпочтительно в диапазоне 0,3-5 МПа (3-50 бар), и при объемной скорости (WHSV - массовая часовая объемная скорость, кг бензолдиолов/ч/кг катализатора) 0,1-10 ч-1, предпочтительно 0,5-5 ч-1.
Питание реактора состоит из раствора бензолдиолов в воде с концентрацией 5-60 мас.%, предпочтительно 10-40 мас.%, и водорода при массовом соотношении с бензолдиолами 2-50, предпочтительно 5-30.
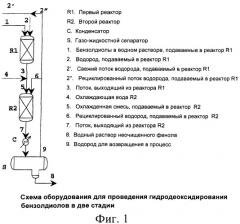
В варианте реализации данного изобретения реакцию проводят внутри адиабатического реактора с неподвижным слоем, содержащим катализатор, как описано выше, в который подают поток, содержащий водный раствор бензолдиолов с концентрацией в диапазоне от 5 до 60 мас.%, совместно с потоком водорода в таком количестве, чтобы отношение между общим количеством молей водорода и бензолдиола находилось в диапазоне от 2:1 до 50:1. Питающий поток испаряют и нагревают до температуры в диапазоне от 250 до 500°С, а давление поддерживают в диапазоне от 0,1 до 10 МПа (от 1 до 100 бар). Поток на выходе из реактора состоит из сырого реакционного материала, содержащего возможные остаточные бензолдиолы и полученный фенол в водном растворе, а также остаточный водород, который снова возвращают в процесс.
В другом варианте реализации данного изобретения реакцию осуществляют в двух или более адиабатических реакторах с неподвижным слоем, соединенных последовательно, с целью охлаждения потока на выходе из реактора перед входом в последующий реактор, так, чтобы ограничивать возрастание температуры в каждом реакторе, например, поддерживая его ниже 40°С. В этой форме реализации как воду, так и питающий поток водорода можно разделить между отдельными реакторами. Разделение особенно полезно, поскольку при этом избегают использования промежуточного теплообменника для охлаждения.
Обычно для поддержания роста температуры внутри каждого реактора в пределах 40°С достаточно двух реакторов, что позволяет получить более высокую селективность по фенолу.
На фиг.1 схематически изображено оборудование, пригодное для реализации способа в соответствии с описанной выше конфигурацией установки.
Возможно поддерживать работу реактора в течение нескольких сотен часов при наличии катализатора и при наиболее подходящих рабочих условиях, при степени превращения бензолдиолов и селективности по фенолу >85%.
Если реактор работает в течение более продолжительного времени, степень превращения имеет тенденцию снижаться, в то время как селективность остается очень высокой. В такой ситуации температуру реакции можно постепенно увеличивать в диапазоне 250-500°С, и можно поддерживать желаемую степень превращения.
Причиной снижения активности является отложение углеродистого материала на катализаторе при его использовании в реакции. Было установлено, что катализаторы, пригодные для целей данного изобретения, можно подвергать периодической регенерации без каких-либо особых проблем, в соответствии с тем, что известно в технике (температура 400÷550°С, давление 0,1÷0,3 МПа (1÷3 бар), смесями кислорода и азота в отношении 0,1÷20% об. и объемной скоростью 3000÷6000 ч-1, выраженной в литрах газовой смеси /ч/литры катализатора).
Каталитическая композиция по данному изобретению на основе многокомпонентных оксидов металлов, содержащая по меньшей мере один металл, выбранный из групп VB, VIB, VIII, IB, IIB, IVB, IVA, VA, предпочтительно включает по меньшей мере один элемент, выбранный из меди, ванадия, висмута, молибдена, ниобия, железа, вольфрама, цинка, никеля и их смесей, и, возможно, содержит сурьму и/или фосфор.
Активную фазу можно получить способами, известными в технике, включая осаждение, использование носителей или использование в любой форме смесей оксидов или смешанных оксидов (М.Campanati, G, Fornasari, А.Vaccari, Основы получения гетерогенных катализаторов (Fundamentals in the preparation of heterogeneous catalysts), Catalysts Today 77 (2003) 299-314).
Активную фазу предпочтительно наносят на носитель (например, оксид алюминия, диоксид кремния и т.д.) или формуют с использованием связующих и способов, известных в технике.
Катализатор можно соответствующим образом формовать, например, путем нанесения его на подложку, путем его компактирования (например, таблетированием, экструзией и т.д.) или же путем сушки при распылении, так, чтобы получить соответствующие формы и размеры катализатора для проведения конкретной реакции, в соответствии со способами, известными в технике. При необходимости можно применять вспомогательные продукты, такие как смазки на основе графита или стеариновой кислоты и т.д. Твердые предшественники активной фазы можно соответствующим образом формовать даже до окончательного обжига.
Для улучшения окислительно-восстановительных, кислотно-основных характеристик и емкости по кислороду катализатор может также включать дополнительные ионы металлов (легирующие агенты), такие как, например: ионы металлов, выбранных из группы, состоящей из щелочных металлов (Na, К) и щелочноземельных металлов (Mg, Са, Sr), из группы IVB (предпочтительно Ti, Zr, Hf) и VIIB, из ряда лантаноидов (La, Се, Sm, Gd, Dy, Yb) и из группы благородных металлов (например, Pt, Pd, Rh, Ru, Ir и их смеси).
Благородные металлы можно нанести на катализатор посредством обычных способов, таких как импрегнирование, ионный обмен, сушка при распылении и т.д., используя раствор соединения благородного металла. Соединения благородных металлов, которые можно использовать, включают соли, такие как галогениды, нитраты, ацетаты и сульфаты, или их растворы.
Ряд конкретных примеров металлосодержащих предшественников и их растворов, известных в технике и легкодоступных на рынке, включают, например:
Гексахлорплатиновую кислоту, гексахлорплатинат калия, хлорид тетраминплатины, нитрат тетраминплатины, гидроксид тетраминплатины, бис-ацетилацетонат палладия, тетрахлорпалладат натрия, хлорид тетраминпалладия, нитрат родия, трихлорид родия, трихлорид рутения, хлороиридат аммония.
Носитель, обработанный предшественником благородного металла, можно подвергнуть химической обработке, возможно попеременно с термической обработкой. Обычной химической обработкой является, например, восстановление металла, предварительно нанесенного на подложку путем пропитки соединением палладия - предшественником, раствором формиата натрия при 85-95°С, согласно существующему уровню техники.
Катализаторы предпочтительно содержат фазы активных оксидов по существу в кристаллической форме.
Особенно предпочтительными являются многокомпонентные составы оксидов металлов, содержащие по меньшей мере одну кристаллическую структуру, которая может соответствовать структуре шеелита.
Особенно предпочтительны кристаллические структуры, которые могут быть связаны со структурой шеелита, имеющие следующие общие составы:
Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4
Cu(1-z)ZnzW(1-y)MoyO4
Кристаллическая структура, которая может соответствовать структуре шеелита, относится к фазе класса АВO4 со строением, изоморфным фазе, присутствующей в минерале шеелит (CaWO4).
Заряд различных ионов металлов А и В может изменяться в соответствии с характеристиками электронейтральности кристалла. Общая формула АВО4 может, таким образом, включать тройные оксиды металлов (от А+1В+7O4 до А+4В+4O4) или многокомпонентные оксиды металлов, заряды ионов которых удовлетворяют требованиям электронейтральности.
Описание, относящееся к кристаллическим материалам типа шеелита можно найти в R.W.G.Wickoff «Кристаллическая структура» («Crystal Structure»), т.2, второе издание, с.VIII а6 и таблица VIII а5; дополнительные указания можно получить из патента США 3843553 и патента США 3806470 Aykan et al. (DuPont 1974).
Таким образом, определенная кристаллическая структура, которая может соответствовать структуре шеелита, также предполагает включение в нее кристаллографических вариаций, полученных в результате соответствующих замещений ионов Са и W в классической структуре. Эти кристаллографические вариации предполагают вариации в расположении атомов в элементарной ячейке и, следовательно, в ее объеме.
Применение специалистами дифрактометрических методов позволяет выявить присутствие кристаллических структур, которые могут соответствовать структуре шеелита.
Более конкретно, присутствие такой кристаллической структуры можно выявить, используя метод дифракции рентгеновских лучей.
Дифракционные спектры, связанные с этими кристаллическими структурами, могут отличаться друг от друга либо из-за влияния различных объемов элементарной ячейки, либо из-за влияния изоморфных замещений; иногда также может быть обнаружено снижение симметрии решетки.
Для катализаторов, упомянутых в этом патенте, использовали автоматический порошковый дифрактометр Philips X'Pert θ/2θ с геометрией Брэгга - Брентано, с применением излучения Сu Кα λ=1,5416 А и мощностью 1,6 кВт; используемый угловой диапазон составляет от 5 до 90° (2θ) с величиной шага 0,02° (2θ) и временами обнаружения 10 секунд на шаг.
Структуру шеелита можно распознать с помощью рентгеновской дифракции, используя различные способы, известные специалистам в данной области, в частности, можно использовать информацию, содержащуюся в базе данных PDF-2 (Powder Diffraction File, Файл данных по дифракции на порошках), изданной ICDD (The International Centre for Diffraction Data, Международный центр по дифракционным данным).
Материалы, имеющие структуру шеелита или которые могут коррелировать с ней, типа Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4, можно идентифицировать с помощью дифрактограмм, приведенных в эталонных картах, например, 14-0688 (BiVO4; х=0, w=1), 85-629 (х=0, w=1), 85-630 (х=0,37, w=1), 85-631 (х=0,55; w=1) и 70-0031 (Bi3(FeO4)MoO4)2).
Материалы со структурой шеелита, или которые могут коррелировать с ней, типа Cu(1-z)ZnzW(1-y)MoyO4, можно идентифицировать с помощью кристаллограмм, содержащихся в эталонных картах, например, 88-0269 (шеелит с замещением на медь).
Было доказано, что присутствие других кристаллических фаз на основе оксидов дает существенные преимущества для получения фенола.
Катализатор может также содержать материалы с не являющейся шеелитом кристаллической или аморфной структурой, получающиеся, например, из некоторых используемых предшественников.
Катализатор может также преимущественно содержать материалы, также с не являющейся шеелитом кристаллической или аморфной структурой, способные увеличивать емкость накопления структурой кислорода (ЕНК, емкость накопления кислорода), такие как оксиды лантаноидов (LnOx), и в частности оксид церия или его смеси с другими оксидами, например оксид церия - оксид циркония.
Типичными оксидами или смесями оксидов могут быть таковые на основе лантана, церия, празеодима, неодима, европия, самария, гадолиния; оксиды лантаноидов (лантаноиды для краткости обозначены Ln, их оксиды LnOx) или их смеси также можно использовать в качестве носителя и/или в составе связующего.
В соответствии с вышеуказанным, катализатор может состоять не только из оксидных материалов со структурой шеелита; примерами нешеелитных компонентов могут быть ионы щелочных или щелочноземельных металлов, благородные металлы или их соединения в высокой степени окисления, или их смеси.
Из-за изменчивости активной фазы не существует конкретных ограничений в способах формования катализатора.
Ниже, для лучшего понимания данного изобретения и приведения вариантов его реализации, приведены несколько иллюстративных примеров, которые никоим образом не следует рассматривать как ограничивающие объем данного изобретения.
ПРИМЕРЫ
Примеры получения катализатора
Пример 1
Катализатор типа Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4
A. 7,22 г метаванадата аммония [NH4VO3; состав по анализу >99,5%; ММ 116,98; CAS 7803-55-6] растворили при 80°С в 450 г деминерализованной воды и довели до рН 10 посредством 32% гидроксида аммония (окончательная масса раствора 340 г, из-за частичного испарения).
B. 17,2 г пентагидрата нитрата висмута [(ВiМО3)3·5Н2О; состав по анализу 98%; ММ 485,08; CAS 10035-06-0] растворили в растворе 500 г деминерализованной воды и 5,0 г 65% раствора азотной кислоты.
C. 195,4 г из 340 г раствора А смешали с раствором В. Растворитель испарили при 80°С при перемешивании на магнитной мешалке. Полученный таким образом твердый продукт высушили в печи при 120°С в течение 18 часов, затем прокалили при 500°С в течение 4 часов.
Мольное соотношение реагентов было таким, что:
х=0; w=1 в Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4
Спектр дифракции рентгеновских лучей полученного таким образом материала имел типичные пики клиносбиванита (Clinosbivanite BiVO4, карточка 14-0688).
Пример 2
Катализатор типа Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4
А. 4,74 г хлорида ниобия [NbCl4; состав по анализу 99,8%; ММ 270,16] поместили при перемешивании на магнитной мешалке в стакан, содержащий 50 г деминерализованной воды. Примерно через 5 минут всю эту смесь довели до рН 8 посредством 32% раствора гидроксида аммония. Осадок отфильтровали и тщательно промыли примерно 500 мл деминерализованной воды. Полученный таким образом осадок растворили при 90°С в растворе, содержащем 140 г деминерализованной воды и 16 г щавелевой кислоты.
B. Приготовили раствор, состоящий из 5,08 г тетрагидрата гептамолибдата аммония [(NH4)6Mo7O24·4H2O; состав по анализу 81,0 83,0% (МоO3); ММ 1235,86; CAS 12054-85-2] и 2,055 г метаванадата аммония (NH4VO3; состав по анализу >99,5%; ММ 116,97; CAS 780305506), растворенных в 400 г деминерализованной воды при 80°С, доведенной до рН 10 посредством 32% раствора гидроксида аммония.
C. Смешали растворы, полученные на стадиях А и В, и добавили третий раствор, состоящий из 50 г деминерализованной воды, 7 г 65% азотной кислоты и 26,35 г пентагидрата нитрата висмута [(ВiNО3·5Н2О; состав по анализу 98%; ММ 485,08; CAS 100035-06-0]. Растворитель испарили при 120°С при перемешивании на магнитной мешалке. Полученный таким образом твердый продукт высушили в печи при 120°С в течение 18 часов, а затем прокалили при 500°С в течение 4 часов.
Мольное соотношение реагентов было таким, что:
X=0,45; w=0,5 в Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4.
Анализ полученного таким образом материала методом дифракции рентгеновских лучей показал кристаллическую структуру, которую можно приписать структурам, коррелирующим с разупорядоченными структурами шеелита, такими, как уже упомянутые структуры, присутствующие в смешанных оксидах висмута, железа и молибдена (например, Bi3(FeO4)(MoO4)2, карточка 70-0031). Рентгеновский анализ этого материала показывает также строение кристаллов, которое можно приписать таким структурам шеелита, как упомянутые в примере 1, примере 3 и примере 4.
Пример 3
Катализатор типа Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4.
Приготовили раствор, состоящий из 3,0 г тетрагидрата гептамолибдата аммония [(NH4)6Mo7O24·4H2O; состав по анализу 81,0÷83,0% (MoO3); ММ 1235,86] и 5,38 г метаванадата аммония (NH4VO3; состав по анализу >99,5%; ММ 116,97), растворенных при 80°С в 400 г деминерализованной воды, доведенной до рН 10 посредством 32% раствора гидроксида аммония. Добавили раствор, состоящий из 60 г деминерализованной воды, 6 г 65% азотной кислоты и 27,83 г пентагидрата нитрата висмута [(ВiNО3)3·5Н2О; состав по анализу 98%; ММ 485,07]. Растворитель испарили при 80°С при перемешивании на магнитной мешалке. Полученный таким образом твердый продукт высушили в печи при 120°С в течение 66 часов, а затем прокалили при 500°С в течение 4 часов.
Мольное соотношение реагентов было таким, что:
х=0,27; w=1 в Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4
Рентгенодифракционный анализ полученного таким образом материала показал строение кристаллов, которое можно приписать структурам шеелита, подобным приведенным в карточках 14-0688 (BiVO4; х=0; w=1); 85-629 (х=0,21; w=1); 85-630 (х=0,37; w=1); 85-631 (х=0,55; w=1).
Пример 4
Катализатор типа Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4.
Приготовили раствор, состоящий из 5,08 г тетрагидрата гептамолибдата аммония [(NH4)6Mo7O24·4H2O; состав по анализу 81,0…83,0%(MoO3); ММ 1235,85] и 4,11 г метаванадата аммония (NН4VO3; состав по анализу >99,5%; ММ 116,97), растворенных при 80°С в 400 г деминерализованной воды, доведенный до рН 10 посредством 32% раствора гидроксида аммония. Добавили раствор, состоящий из 60 г деминерализованной воды, 6 г 65% азотной кислоты и 26,35 г пентагидрата нитрата висмута [(BiNO3·5H2O; состав по анализу 98%; ММ 485,07]. Растворитель испарили при 80°С при перемешивании на магнитной мешалке. Полученный таким образом твердый продукт высушили в печи при 120°С в течение 18 часов, а затем прокалили при 500°С в течение 4 часов.
Мольное соотношение реагентов было таким, что:
X=0,45; w=1 в Bi(1-x/3)V(1-x)wNb(1-x)(1-w)MoxO4.
Рентгеновский анализ полученного таким образом материала показал строение кристаллов, которое можно приписать структурам шеелита, таким как структуры, приведенные в карточках 14-0688 (BiVO4; х=0, w=1), 85-629 (х=0,21, w=1), 85-630 (х=0,37, w=1), 85-631 (х=0,55, w=1).
Пример 5
Катализатор типа Cu(1-z)ZnzW(1-y)MoyO4.
Приготовили раствор, состоящий из 60,15 г пентагидрата сульфата меди (CuSO4·5H2O; состав по анализу >99%; ММ 249,68; CAS 7758-99-8) в 1500 г деминерализованной воды, и этот раствор довели до кипения. Добавили второй раствор, полученный растворением 115 г дигидрата вольфрамата натрия (Na2WO4·2H2O; состав по анализу >99%; ММ 329,85; CAS 10213-10-2) в 1150 г деминерализованной воды. Суспензию перемешивали в течение 5 часов при 50°С и оставили ее при комнатной температуре в течение ночи. Твердое вещество отделили фильтрацией и промыли примерно 5 литрами деминерализованной воды. Твердое вещество высушили в печи при 120°С в течение 15 часов и прокалили при 600°С в течение 48 часов.
Рентгеновский анализ полученного таким образом материала показал строение кристалла, совпадающее со структурой замещенного шеелита, такой как показанный в карточке 88-0263 шеелит, замещенный медью - Cu(WO4). Для того чтобы ограничить образование фаз типа СuО, предпочтительно проводить осаждение с дефицитом ионов Сu.
Пример 6
Катализатор типа Cu(1-z)ZnzW(1-y)MOyO4/LnOx.
Приготовлен раствор, состоящий из 24,42 г паравольфрамата аммония [(NH4)10W12O41·H2O; состав по анализу 99,99%; ММ 3050,46; CAS 11120-25-5] и 400 г деминерализованной воды, при перемешивании при 70°С. Второй раствор получен путем растворения 22,4 г тригидрата нитрата меди (Сu(МО3)3·3Н2O; > 99%; ММ 241,60; CAS 10031-43-3) и 8,995 г гексагидрата нитрата церия (CeN3O9·6H2O; 99%; ММ 434,22; CAS 10294-41-4) в 150 г деминерализованной воды. Эти два раствора объединили и высушили при нагревании до 120°С при перемешивании. Смесь сушили при 120°С в течение 15 ч и прокаливали при 600°С в течение 48 ч.
Рентгеновский анализ полученного таким образом материала показывает строение кристаллов, соответствующее замещенным структурам шеелита, таким, как приведенный в карточке 88-0269 Cu-замещенный шеелит -Cu(WO4).
Следует заметить, что из-за явлений гидратации титр меди в предшественнике - нитрате меди следует считать примерно на 15% ниже, чем содержание ее в коммерческом продукте.
Пример 7
Катализатор типа Cu(1-z)ZnzW(1-y)MoyO4.
Приготовлен раствор, состоящий из 9,015 г пентагидрата сульфата меди (CuSO4·5H2O; состав по анализу >99%; ММ 249,68; CAS 7758-99-8) и 2,18 г моногидрата сульфата цинка (ZnSO4·H2O; состав по анализу >97,5%; ММ 179,45; CAS 7446-19-7) в 300 г воды. Смесь довели до кипения и затем добавили 230 г 10% раствора вольфрамата натрия в воде (CAS 10213-10-2). Смесь охладили до 50°С и выдерживали при этой температуре 4 часа. Осадок вызревал в течение ночи при комнатной температуре, затем его профильтровали, промыли, высушили при 120°С в течение 15 часов и прокалили при 600°С в течение 48 часов.
Для целей данного изобретения в качестве полезных примеров для сравнения были взяты типичные катализаторы окисления и восстановления, известные в технике.
Пример 8 (сравнительный)
Типичный пример окисления, в частности применяемый при подходе «RedOx технологии», описан R.M.Contractor et al. в Catalysis Today, 1 (1987) 49-58, для окисления бутана до малеинового ангидрида с катализаторами VPO. Как уже было упомянуто выше, этот процесс является, как указано в данном патенте, одной из RedOx-технологий, достигших наибольших успехов в промышленном масштабе. Здесь описан синтез активной фазы согласно методике, подобной описанной в вышеупомянутой статье.
90 мл изобутилового спирта и 60 мл бензилового спирта поместили в стеклянную колбу и добавили 15 г пентоксида ванадия (V2O5; состав по анализу >99,6+%; ММ 181,88; CAS 1314-62-1). Смесь нагрели на бане, кипятили с обратным холодильником в течение 4 часов при 130°С, а затем оставили на ночь при комнатной температуре. Затем добавили 21,8 г фосфорной кислоты (Н3РO4; титр 85%; CAS 766-38-2) и смесь нагревали до 130°С, при кипячении с обратным холодильником, еще в течение 4 часов. После охлаждения продукт отфильтровали и высушили на воздухе в течение 15 часов при 120°С. Часть высушенного образца прокалили при 400°С в течение 4 часов на воздухе.
Как указано в вышеприведенной статье, для получения оптимального катализатора существенно получить кристаллическую фазу (VO)2P2O7 посредством предшественника (VO)2Н2O(РО3ОН)2: эти две фазы были идентифицированы посредством дифракции рентгеновских лучей в прокаленном образце и в высушенном образце соответственно.
Пример 9 (сравнительный)
Для целей данного изобретения в качестве полезного примера для сравнения можно взять имеющийся на рынке катализатор восстановления. Можно использовать катализаторы на основе меди, нанесенные на оксид алюминия, например, такие как катализатор Т-4489, производимый и продаваемый Sud-Chemie Inc., описание которого можно найти в технико-коммерческой литературе, обеспечиваемой производителем.
ПРИМЕРЫ СВОЙСТВ КАТАЛИЗАТОРОВ
Гидроксилирование бензола: методика эксп