Композиция для ингибирования молочнокислых бактерий, загрязняющих технологическую среду при производстве топливного этанола (варианты), способ контроля загрязнения молочнокислыми бактериями указанной среды и способ контроля их роста в ферментационном процессе
Иллюстрации
Показать всеИзобретение относится к получению топливного этанола с использованием кислот хмеля. Шесть кислот хмеля альфа-кислота, бета-кислоты, изо-альфа-кислоты, ро-изо-альфа-кислоты, тетрагидроизо-альфа-кислоты и гексагидроизо-альфа-кислоты испытывали для определения, какие из них являются наиболее эффективными в ингибировании роста бактерий, обычных при получении топливного этанола. Бактериями, используемыми в этих испытаниях были Lactobacillus brevis и Lactobacillus fermentum. Минимальные ингибирующие концентрации (МИК) кислот хмеля определяли с использованием MRS-бульона, а также сред мелассного сусла и пшеничных заторов во время их ферментации. Во всех случаях кислоты хмеля контролировали рост этих двух бактерий Lactobacillus, причем тетрагидроизо-альфа-кислота, гексагидроизо-альфа-кислота и изо-альфа-кислота убивали большинство бактерий при самой низкой МИК. Обработка аппаратов для размножения дрожжей, замочных танков и ферментеров кислотами хмеля с минимальной ингибирующей концентрацией будет останавливать рост бактерий, увеличивать выход этанола и позволит избежать необходимости в антибиотиках. 4 н. и 55 з.п. ф-лы, 49 ил., 2 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ
Данное изобретение относится к усовершенствованному способу контроля микроорганизмов в водной технологической среде с использованием кислот хмеля. Кроме того, данное изобретение относится к получению топливного этанола. Более конкретно, оно относится к способу получения топливного этанола с использованием кислот хмеля.
В настоящее время в мире существует огромная потребность в жидких топливах и она обеспечивается почти целиком дистиллятными нефтяными топливами. Конечно, хорошо известно, что нефть является невосстанавливаемым источником, и что существуют ограниченные запасы этого источника топлива. В результате в настоящее время проводится очень активный поиск альтернативных жидких топлив или топливных наполнителей.
В свете постоянно увеличивающейся потребности в жидких топливах и сокращающихся источников нефтетоплива исследователи начали исследовать альтернативные жидкие топлива для определения возможности коммерческого получения таких заменителей для удовлетворения этой увеличивающейся потребности. Недавние события в мире, в том числе нехватка нефтетоплива, резкое увеличение стоимости нефтепродуктов и бензиновых продуктов и политическая нестабильность многих нефтедобывающих стран, продемонстрировали уязвимость существующих источников жидких топлив. Даже в том случае, если бы такие нестабильность запасов и экономическая нестабильность были приемлемыми, ясно, что всемирное производство нефтепродуктов при прогнозируемых уровнях неспособно ни идти наравне с увеличивающейся потребностью, ни продолжаться безгранично. Становится очевидным, что скоро придет время, когда должен будет совершен переход к источникам, которые являются изобильными и предпочтительно возобновляемыми.
Одним из наиболее часто признаваемых заменителей, которые могли бы быть сделаны доступными в значительных количествах в ближайшем будущем, является спирт и, в частности, этанол. Например, в настоящее время в Соединенных Штатах и по всему миру имеются многочисленные торговые центры, которые продают смесь бензина и приблизительно 10-процентного - 20-процентного этанола (обычно называемую «газохолом»), которая может быть использована в качестве топлива в обычных автомобильных двигателях. Кроме того, этанол может быть смешан с присадками с получением жидкого топлива на основе этанола, с этанолом в качестве главного компонента, которое пригодно для эксплуатации в большинстве типов двигателей.
Этанол может быть получен почти из любого материала, который существует в форме ферментируемого сахара или может быть превращен в ферментируемый сахар. Имеются многочисленные природные сахара, доступные для ферментации, но такие углеводы, как крахмал и клетчатка, могут быть превращены в ферментируемые сахара, которые затем ферментируются в этанол. Даже в настоящее время в большей части всего мира этанол получают посредством ферментационного процесса. Этанол может быть также получен синтетически из этилена.
Крахмал является одним из наиболее обильных возобновляемых исходных материалов. Одним ответом на потребность в альтернативных воспроизводимых топливах является превращение этого очень распространенного материала при низкой стоимости в ферментируемые сахара в качестве исходного сырьевого материала для ферментации в этанол. Термин технологическая среда, используемый в получении топливного этанола, является общим термином, включающим в себя любую из сред, в которых могут жить молочнокислые или уксуснокислые бактерии и использоваться в получении топливного этанола или спиртных напитков, и включает в себя, но не ограничивается ими, исходный сырьевой материал, любую осахаренную или гидролизованную крахмальную или сахарную среду, любую крахмальную или сахарную среду, включающую в себя дрожжи, и/или дистиллят из любого ферментационного процесса. Крахмал для этого процесса, использующего исходный сырьевой материал, обычно получают из таких сельскохозяйственных культур, как кукуруза, сорго, пшеница, осоложенный ячмень, картофель и рис. Ферментируемыми (сбраживаемыми) сахарами, получаемыми из крахмала, являются глюкоза и мальтоза, и их обычно получают из крахмала гидролизом или осахариванием, например кислотным гидролизом или ферментативным гидролизом. Большинство способов гидролиза, которые были доступными, являются обычно очень дорогими в отношении получения исходного сырьевого материала для широкомасштабного производства спирта. В отношении максимизации получения этанола из крахмального исходного сырьевого материала желательно иметь как можно больше ферментируемых веществ в ферментационном субстрате.
Практика показала, что предпочтительно добавлять ферменты солода, такие как глюкоамилаза, которые способствуют гидролизу крахмалов и превращению более сложных декстринов и декстрозных сахаров, которые присутствуют в сахарных растворах ферментационных способов предшествующего уровня. Ферменты солода могут быть куплены или, в случае получения виски, экстрагированы природным образом из осоложенного ячменя. Хотя такие ферменты солода придают желательный вкус этанолу, получаемому для потребления людьми, эти ферменты солода не делают этанол более предпочтительным заменителем жидкого топлива и фактически могут создавать проблемы для подобного применения.
После завершения стадии осахаривания ферментируемые сахара добавляют к дрожжам, где начинается ферментация (сбраживание). Альтернативно в настоящее время многие спиртовые заводы добавляют вышеуказанный фермент в ферментер с дрожжами. Это одновременное осахаривание и сбраживание позволяет ферментировать более высокие концентрации крахмала. Если источником сахара являются сельскохозяйственные культуры, такие как сахарный тростник, сахарные свеклы, плоды или мелассы, осахаривание не является необходимым и ферментация может начинаться добавлением дрожжей и воды.
В случае обычных известных систем для получения этанола из крахмала, например, с использованием двухферментной системы для разжижения и осахаривания крахмала до глюкозы с последующей периодической ферментацией обычными являются общие продолжительности обработки 60-80 часов. Обычно используют продолжительности ферментации 50-70 часов. Такие продолжительные общие периоды выдерживания приводят к требованиям огромных емкостей в системе обработки, когда предполагается крупномасштабное производство этанола.
В процессе ферментации дрожжи добавляют к раствору простых сахаров. Дрожжи представляют собой небольшой микроорганизм, который использует сахар в растворе в качестве пищи и при этом выделяет этанол и диоксид углерода в качестве побочных продуктов. Диоксид углерода выделяется в виде газа, поднимаясь вверх через жидкость, а этанол остается в растворе. К сожалению, дрожжи загнивают, когда концентрация этанола в растворе приближается приблизительно к 18 объемным процентам, независимо от того, присутствуют ли все еще ферментируемые сахара.
Для почти полной ферментации и для получения больших количеств этанола общей практикой является применение периодического процесса, в котором используют чрезвычайно большие ферментационные резервуары, способные вмещать в себя до 500000 галлонов. С такими большими резервуарами экономически нереально подавать количество дрожжей, достаточное для быстрой ферментации сахарного раствора. Таким образом, общепринятые ферментационные процессы требовали 72 и более часов, поскольку такие периоды времени требуются для размножения популяции дрожжей до необходимой концентрации. Например, в ферментационный резервуар добавляют некоторое количество дрожжей. За 45-60 минут популяция дрожжей будет удвоена; за другие 45-60 минут эта новая популяция дрожжей будет удвоена. Такое размножение занимает многие часы для получения количества дрожжей, необходимого для ферментации такого большого количества сахарного раствора.
Сахара, используемые в общепринятых ферментационных процессах, содержат обычно приблизительно от 6 процентов до 20 процентов больших, сложных сахаров, таких как декстрины и декстроза, которые требуют гораздо более длительного времени для подвергания ферментации, если они будут подвергнуты ферментации, чем простые гексозные сахара, такие как глюкоза и фруктоза. Таким образом, обычной практикой является завершение процесса ферментации после указанного периода, такого как 72 часа, даже хотя не все эти сахара были утилизированы. При рассмотрении процессов предшествующего уровня с экономической точки зрения предпочтительнее пренебречь оставшимися несброженными сахарами, чем ожидать полного сбраживания всех сахаров в данной партии.
Одной из важных проблем в случае общепринятых ферментационных систем является трудность поддержания стерильных условий, свободных от бактерий, в партиях большого размера и в случае продолжительного ферментационного периода. Если партия становится загрязненной, не только дрожжи и сахарный раствор должны быть выброшены, но и весь ферментационный резервуар должен быть опорожнен, вычищен и стерилизован. Такое действие занимает много времени и является очень дорогостоящим.
Кроме того, многие из этих бактерий конкурируют с дрожжами за сахар, уменьшая посредством этого количество продуцируемого этанола. Бактрии могут расти приблизительно в десять раз быстрее, чем дрожжи, следовательно, загрязнение в этих участках является неизбежным. При потреблении сахара эти бактерии продуцируют молочную кислоту и другие побочные продукты. Кроме того, если ферментационные резервуары не дезинфицируются или не стерилизуются должным образом между партиями или использованиями, бактерии и другие нежелательные микроорганизмы могут становиться прикрепленными к внутренним стенкам бродильных чанов, где они будут расти и усиленно размножаться. Эти нежелательные микроорганизмы могут загрязнять этанольные побочные продукты, такие как корм для животных, или они могут потреблять полезные количества субстрата, или сахара, уменьшая тем самым продуцирование этанола. Экономичность и эффективность ферментационных процессов часто являются такими, что они не могут противостоять любой такой потере продукции.
Во время производства топливного этанола бактериальное загрязнение происходит почти на каждой стадии этого процесса, где вода и крахмал/сахар присутствуют при температурах ниже 40оС. Загрязнение исходит обычно из крахмального материала, так как эти сельскохозяйственные культуры приносят бактерии с полей. Промывание материала помогает понизить количество бактерий, однако, бактериальное загрязнение является неизбежным. Примером этого являются мокрые способы помола, когда кукурузу замачивают в течение 24-48 часов. Само намачивание высушенных кукурузных зерен в воде дает такие высокие уровни молочной кислоты, как 0,5%. На каждый грамм образованной молочной кислоты теряются почти два грамма крахмала. Lactobacillus brevis и Lactobacillus fermentum являются двумя гетероферментными бактериями, обычно обнаруживаемыми в заторах спиртового производства. Эти бактерии способны превращать один моль глюкозы в один моль молочной кислоты и один моль уксусной кислоты, соответственно, наряду с одним молем этанола и одним молем диоксида углерода.
Существующие способы убивания этих нежелательных микроорганизмов, среди прочих, часто включают в себя введение чужеродных агентов, таких как антибиотики, нагревание и введение сильных химических дезинфицирующих средств, в ферментацию до или во время производства этанола. Обычно синтетические химические антибиотики добавляют в ферментационные резервуары для уменьшения роста продуцирующих молочную кислоту бактерий. Добавление каждого из этих чужеродных агентов в этот процесс значительно увеличивает время и стоимость производства этанола. Антибиотики являются очень дорогими и могут в высокой степени увеличивать стоимость крупномасштабного производства. Если антибиотики не использовать, обычной является 1-5-процентная потеря этанола. Установка для производства пятидесяти миллионов галлонов топливного этанола, работающая с уровнем молочной кислоты 0,3 мас.% в дистиллируемом растворе теряет приблизительно 570000 галлонов этанола каждый год из-за бактерий. Применение нагревания требует значительной энергии для нагревания ферментационных резервуаров, а также, возможно, требует применения особых, спроектированных для выдерживания давления резервуаров, которые могут выдерживать высокие температуры и давления, генерируемые в таких способах тепловой стерилизации. Химические обработки могут также увеличивать стоимость продукции прежде всего из-за стоимости самих химикалиев, эти химикалии часто являются вредными веществами, требующими специального обращения и предосторожностей в отношении окружающей среды и безопасности и не являются «зелеными», т.е. не являются органическими.
После ферментации общепринятыми способами удаляли этанол из ферментационного раствора и затем концентрировали этанольный продукт дистилляцией. Дистилляционные колонны, способные к такому отделению и концентрированию, хорошо известны в данной области. После ферментации, 5-15-процентный спиртовой раствор, часто называемый дистиллируемым раствором или вином, концентрировали до 50-95-процентного этанола посредством дистилляции. Этот этанол может быть использован «как таковой» для приготовления спиртных напитков. Альтернативно 95-процентный этанол, обычно получаемый в установках для топливного этанола, пропускают через молекулярные сита для удаления оставшейся воды с получением этанола топливной категории, более чем 99%-ного этанола, используемого для смешивания с бензином.
Топливный этанол получают с сухим способом помола или с мокрым способом помола. Сухой способ помола начинается размалыванием сухих зерен кукурузы почти до порошка с последующей тепловой обработкой и обработкой высокотемпературными ферментами для разрушения крахмала до ферментируемых сахаров. Этот сахаристый раствор, содержащий приблизительно 30 процентов твердых веществ, 70 процентов из которых представляет крахмал, охлаждают до 30оС, обрабатывают дрожжами и ферментируют в этанол посредством периодической или непрерывной ферментации. Этанол выделяют из этого раствора посредством дистилляции. Оставшиеся твердые вещества в этом растворе выделяют, сушат и продают в качестве корма для крупного рогатого скота.
Во время мокрого способа помола сухие зерна кукурузы замачивают с водой для обеспечения абсорбции влаги этими зернами. Замочную воду удаляют и замоченные зерна получают в рыхлоизмельченном виде и обрабатывают посредством ряда стадий для разделения зародышей, волокна, клейковины и крахмала. Крахмал обрабатывают с получением фруктозного сиропа, некоторая часть которого продается компаниям по производству конфет, пищевых продуктов и газированных напитков. Остальной фруктозный кукурузный сироп обрабатывают дрожжами и ферментируют с получением этанола.
Многого остается желать в области производства этанола в отношении эффективной стерилизации ферментационных резервуаров, которая является безопасной, недорогой и благоприятной для окружающей среды, но которая все еще увеличивает, а не разрушает или ограничивает эффективную продуцирующую спирт активность микроорганизмов. В данной области существует потребность в соединении и способе увеличения выходов топливного этанола из ферментации.
Хмелевые шишки использовали в пивоварении в течение более тысячи лет. Известно, что этот похожий на сосновые шишки ингредиент придает горький вкус (горечь), аромат и консервирующие свойства пиву. Многие из активных соединений, ответственных за горечь, являются также ответственными за консервирующие свойства хмеля. Эти соединения были идентифицированы, и они являются по своему характеру органической кислотой. Одним главным соединением в хмеле является органическая кислота, известная как гумулон, и ее называют также альфа-кислотами. Альфа-кислоты составляют 10-15 мас.% в сухом хмеле и более 50 мас.% экстракта, полученного с использованием диоксида углерода из хмеля. Во время варки пива хмель кипятят и альфа-кислоты подвергают тепловой изомеризации с образованием нового соединения, известного как изо-альфа-кислоты. Изо-альфа-кислоты являются истинными придающими горький вкус и консервирующими соединениями, обнаруживаемыми в пиве.
На протяжении последних сорока лет промышленное хмелеводство развилось в поставщика высокотехнологичных ингредиентов для пивоваренной промышленности. В настоящее время хмель экстрагируют СО2 и большую часть этого СО2-экстракта хмеля дополнительно обрабатывают для отделения фракции альфа-кислот от остального экстракта хмеля. Затем эти альфа-кислоты изомеризуют тепловой обработкой в изо-альфа-кислоты и готовят в виде точных спецификаций для облегчения применения и точного добавления к пиву. Производные изо-альфа-кислот получают также выполнением простых химических реакций. Эти восстановленные изо-альфа-кислоты, в частности ро-изо-альфа-кислоты, тетрагидроизо-альфа-кислоты (THIAA) и гексагидроизо-альфа-кислоты (HHIAA), являются очень стабильными в отношении света и нагревания.
В данной области существует потребность в соединении и способе для уменьшения роста микроорганизмов в ферментации топливного этанола для увеличения выхода этанола.
Эти и другие недостатки и проблемы предшествующего уровня техники решаются данным изобретением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Показаны и описаны способ и соединение для уменьшения продуцирующих молочную кислоту микроорганизмов в технологической среде.
В одном варианте осуществления, когда водный щелочной раствор кислоты хмеля добавляют в технологическую среду, имеющую рН меньший, чем рН щелочного раствора кислоты хмеля, эта кислота хмеля является особенно эффективной для контроля микроорганизмов. Действительно, общее применение кислоты хмеля для получения желаемого эффекта может быть в значительной степени уменьшено. Таким образом, описан способ контроля микроорганизмов в водной технологической среде, предусматривающий добавление водного щелочного раствора кислоты хмеля к технологической среде, где рН этого водного щелочного раствора кислоты хмеля является более высоким, чем рН технологической среды.
В результате низкого дозового количества добавляемого раствора в сравнении с технологической средой этот раствор адаптируется почти полностью к рН технологической среды при добавлении к этой технологической среде, и кислота хмеля переходит из диссоциированной формы (формы соли) в ассоциированную, антибактериально эффективную форму (форму свободной кислоты). Неожиданным образом, кислота хмеля является особенно эффективной в качестве антибактериального агента при применении таким образом. Кроме того, могут быть использованы различные формы кислот хмеля, которые в противном случае не могли бы использоваться или могли бы использоваться только при низкой эффективности.
Изомеризованные кислоты хмеля являются особенно эффективными в контроле бактериального роста в технологических средах или потоках перегонных установок. Действительно, посредством использования стандартизированного раствора изомеризованных кислот хмеля можно точно дозировать количество кислоты хмеля, требуемое для контроля бактериального роста.
Данное изобретение будет лучше всего понятным со ссылкой на следующее подробное описание предпочтительного варианта осуществления, взятого вместе с сопутствующим графическим материалом. Приведенное ниже обсуждение является описательным, иллюстративным и даваемым в качестве примера и не должно рассматриваться как ограничивающее объем изобретения, определенный прилагаемой формулой изобретения.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ГРАФИЧЕСКОГО МАТЕРИАЛА
Фигура 1 показывает рост Lactobacillus brevis LTH 52 90 (Lb. brevis) в диапазоне различных концентраций различных соединений хмеля и производных соединений хмеля в модифицированной среде MRS при 86°F (30°С). Среду MRS, доведенную до рН 5,2, инокулировали Lb. brevis (106 организмов/мл). После 60 часов инкубации рост оценивали фотометрически при 578 нм в ячейке с длиной пути 1 см: ▲ α-кислоты; ■ β-кислоты и эфирные масла; ♦ ро-изо-α-кислоты; Δ изо-α-кислоты; □ гексагидроизо-α-кислоты; ◇ тетрагидроизо-α-кислоты.
Фигура 2 показывает рост Lactobacillus fermentum LTH 5289 (Lb. fermentum) в диапазоне различных концентраций различных соединений хмеля и производных соединений хмеля в модифицированной среде MRS при 96,8°F (36°С). Среду MRS, доведенную до рН 5,2, инокулировали Lb. fermentum (106 организмов/мл). После 60 часов инкубации рост оценивали фотометрически при 578 нм в ячейке с длиной пути 1 см: ♦ α-кислоты; ■ β-кислоты и эфирные масла; ♦ ро-изо-α-кислоты; Δ изо-α-кислоты; □ гексагидроизо-α-кислоты; ◇ тетрагидроизо-α-кислоты.
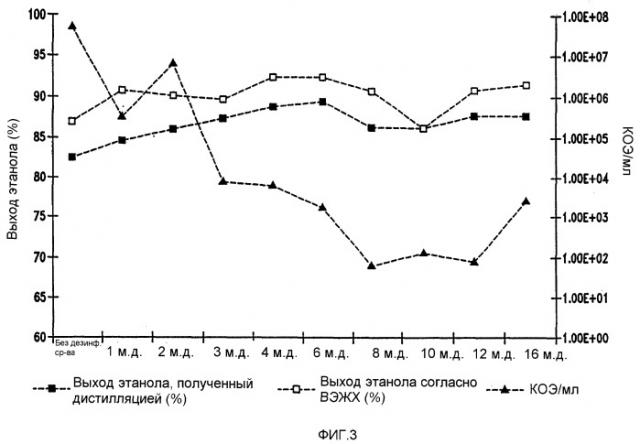
Фигура 3 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 4 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
Фигура 5 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
Фигура 6 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,7 4 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F(36°C) в течение 72 часов.
Фигура 7 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С)в течение 96 часов.
Фигура 8 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С) в течение 72 часов.
Фигура 9 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, при увеличении концентраций тетрагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 10 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, при увеличении концентраций тетрагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 11 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 12 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 13 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
Фигура 14 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
Фигура 15 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, и оставшегося сахара при увеличении концентраций тетрагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 16 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, и оставшегося сахара при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 17 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, и оставшегося сахара при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 18 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, и оставшегося сахара при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
Фигура 19 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, и оставшегося сахара при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
Фигура 20 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,7 4 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 21 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
Фигура 22 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 23 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
Фигура 24 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 25 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С) в течение 72 часов.
Фигура 26 показывает сравнение выхода этанола. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 27 показывает сравнение эффективности в ингибировании Lb. brevis. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 86°F (30°С) в течение 48 часов.
Фигура 28 показывает сравнение выхода этанола. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 29 показывает сравнение эффективности в ингибировании Lb. fermentum. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 96,8°F (36°С) в течение 48 часов.
Фигура 30 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 31 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С) в течение 72 часов.
Фигура 32 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 33 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 96,8°F в течение 72 часов.
Фигура 34 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 86°F в течение 96 часов.
Фигура 35 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 96,8°F в течение 72 часов.
Фигура 36 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе.
Фигура 37 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе.
Фигура 38 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе.
Фигура 39 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе.
Фигура 40 показывает развитие выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе.
Фигура 41 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе.
Фигура 42 показывает сравнение выхода этанола. Пшеничный затор, содержащий 59,9% ферментируемого материала, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis.
Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
Фигура 43 показывает сравнение эффективности в ингибировании Lb. brevis в пшеничном заторе. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 86°F (30°С)в течение 48 часов.
Фигура 44 показывает сравнение выхода этанола. Пшеничный затор, содержащий 59,9% ферментируемого материала, загрязняли исходными количествами бактериальных клеток 107/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
Фигура 45 показывает сравнение эффективности в ингибировании Lb. fermentum в пшеничном заторе. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 86°F (30°С) в течение 48 часов.
Фигура 46 является диаграммой одного варианта осуществления последовательности процесса для получения водного щелочного раствора бета-кислоты.
Фигура 47 является диаграммой одного варианта осуществления для контроля бактериального роста в перегонной установке, где ферментируемый раствор хранят в виде концентрата и изомеризованную кислоту хмеля вводят в потоки питания, идущие к танкам для выращивания дрожжей и ферментерам непосредственно после разбавления.
Фигура 48 является диаграммой, показывающей разбавление концентрированных меласс в перегонной установке в соответствии с примером 7.
Фигура 49 является диаграммой, демонстрирующей, каким образом дрожжи в танках для выращивания дрожжей выращиваются в перегонной установке, обработанной в соответствии с примером 7.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА
Данное изобретение относится к способу контроля микроорганизмов в водной технологической среде, предусматривающему добавление водного щелочного раствора кислоты хмеля к этой технологической среде, причем рН водного щелочного раствора является более высоким, чем рН технологической среды.
Кислота хмеля является природной кислотой хмеля или ее производным, такими как альфа-кислота, бета-кислота, тетрагидро-альфа-кислота (ТНАА) или гексагидро-бета-кислота (ННВА) или их смеси; изомеризованной кислотой или ее производным, такими как изо-альфа-кислота (IAA), ро-изо-альфа-кислота (RIAA), тетрагидроизо-альфа-кислота (THIAA) или гексагидроизо-альфа кислота (HHIAA) или их смеси. Альфа-кислоты, содержащиеся в кислоте хмеля, могут превращаться в изо-альфа-кислоты во время приготовления раствора кислоты хмеля и сохранять их антибактериальное/антимикробное действие.
В зависимости от продукта кислоты хмеля концентрация кислоты хмеля в водном растворе будет варьироваться. Например, концентрация THIAA в водном растворе равна обычно 10 мас.%, в то время как концентрация IAA может быть такой высокой, как 30 мас.%. Обычно, конечная концентрация кислоты в растворе находится в диапазоне приблизительно 2 - приблизительно 40 мас.%, в другом аспекте приблизительно 5 - приблизительно 20 мас.% и в другом аспекте приблизительно 10 - приблизительно 15 мас.%. Более высокие концентрации кислот хмеля могут быть подходящими, когда требуются более длительные периоды времени транспортировки. Обычно кислоты хмеля в их кислотной форме обнаруживают низкую растворимость в воде. Однако кислоты хмеля могут быть смешаны с гидроксидом щелочного металла, например гидроксидом калия, для получения растворимой соли щелочного металла кислоты хмеля. Таким образом, предпочтительно использовать гидроксиды щелочных металлов, например гидроксид калия или гидроксид натрия или их смеси, в качестве щелочной среды для контроля микроорганизмов. Концентрации этой щелочной среды находятся в диапазоне приблизительно 20 мас.% - приблизительно 45 мас.% или в другом аспекте приблизительно 20 мас.%.
Как обсуждалось выше, рН водного щелочного раствора кислоты хмеля является более высоким, чем рН технологической среды. В результате низкого дозируемого количества добавляемого раствора в сравнении с технологической средой этот раствор адаптируется почти полностью к рН технологи