Способ дискриминации по меньшей мере двух клеточных популяций и его применение
Иллюстрации
Показать всеИзобретение относится к биологии, а именно к цитометрическим методам анализа. Предложен способ дискриминации и подсчета по меньшей мере двух популяций биологических элементов - носителей специфических признаков, возможно присутствующих в пробе. Способ предусматривает использование трех разных зондов, каждый из которых специфично фиксируется с одной из популяций биологических элементов, которые требуется обнаружить. При этом каждый зонд сам становится обнаружимым благодаря собственному маркеру, причем два указанных разных маркера имеют два спектра испускания, содержащих по меньшей мере одну общую часть (перекрывающиеся спектры испускания), а третий имеет спектр испускания, по существу не содержащий общих частей с двумя другими (неперекрывающийся спектр). Изобретение позволяет однозначно обнаружить по меньшей мере три популяции биологических элементов путем использования всего двух средств детекции, что предполагает, что по меньшей мере две популяции биологических элементов будут обнаружены одним и тем же средством детекции. 2 н. и 6 з.п. ф-лы, 2 табл., 4 ил.
Реферат
Настоящее изобретение относится к способу детекции, дискриминации и подсчета биологических элементов, присутствующих в жидкости, с использованием принципов проточной цитометрии, адаптированных к устройствам, стандартно использующимся в гематологии.
Имеющиеся на рынке автоматические анализаторы в гематологии (гематологические автоматы) дают все больше и больше возможностей для анализа и классификации анализируемых элементов.
Измерение флуоресценции, уже широко распространенное в проточной цитометрии, используется в основном для классификации элементов посредством иммунофенотипирования. В используемых обычно гематологических автоматах она служит главным образом для выявления суправитальных красителей, использующихся в качестве молекулярных зондов для количественного определения нуклеиновых кислот или других клеточных компонентов.
Применение иммунологических зондов в стандартной гематологии еще не стало общепринятым, хотя некоторые испытания с эмбриональными клетками уже были проведены разными производителями.
Например, компания BAYER (Bayer Diagnostics, Tarrytown, New York, USA), через BAYER-TECHNICON H*1 впервые предложила при классификации лимфоцитов использовать смесь антител для определения разных типов лимфоцитов. В этом случае измерение экспрессии антигенов проводится не флуоресценцией, а путем измерения поглощения света, генерируемого соединением авидинпероксидаза, имеющим большое сродство к биотину, которое само конъюгируется с антителом. Указанное антитело является специфическим для антигенов-мишеней поверхностных молекул, специфичных для характеризуемых клеточных типов (CD4, CD8, CD2, CD19).
Система ABBOTT CD4000 производства компании ABBOTT (Abbott Laboratories, Abbott Park, Illinois, USA) предлагает анализ с использованием двух длин волн флуоресценции для осуществления, помимо прочего, иммунофенотипировния. В патенте WO 98/02727, принадлежащем Abbott Laboratories, описана аппаратура этого типа, позволяющая осуществить мечение антителами на пробе цельной крови. ABBOTT подробно описывает в патенте приборы, предназначенные для проведения реакций антитело - антиген на пробе цельной крови.
Простой, быстрый, эффективный и специфичный способ фенотипирования должен быть применим в очень простых автоматах типа гематологических автоматов, позволяющих работать с ограниченным числом детекторов. Даже если эти методы сами по себе являются высокочувствительными, обычные автоматы, использующиеся в гематологии, имеют характеристики, отличные от проточных цитометров, в частности, в том, что касается параметров измерения, число которых сокращено до самых необходимых, особенно в рутинных измерениях. Кроме того, поскольку очень важным лимитирующим фактором является стоимость, упрощение устройств и анализов, которые они могут выполнять, может проводиться только в направлении общей экономии.
Проточная цитометрия является методом, позволяющим одновременно измерить несколько параметров, соответствующих разным физическим характеристикам биологического элемента, такого как, например, клетка или клеточная органелла. Биологические элементы увлекаются в жидкий поток, и устройство регистрирует свойства каждого из них, когда они проходят в измерительной ячейке перед источником света. Этот метод является на самом деле комбинацией трех систем:
1) Жидкостная система: ламинарное течение, которое позволяет биологическим элементам в суспензии проходить друг за другом перед светом в измерительной ячейке.
2) Оптическая система: луч лазера или другого источника света и различные фильтры, которые позволяют выбрать подходящие длины волн как при возбуждении, так и при испускании.
3) Электронная система: PMT (фотоэлектронный умножитель) или фотодиод, который перехватывает испущенный свет, позволяя преобразовать его в электрический, а затем в цифровой сигнал.
Итак, источник света позволяет генерировать свет, который будет проходить через линзы и освещать биологические элементы, движущиеся в измерительной ячейке. При контакте с биологическим элементом часть света будет рассеиваться. Этот свет проходит через несколько линз и других диафрагм и фокусируется на датчике типа фотодиода, чтобы сгенерировать измерение FSC (Forward Scatter). Это измерение в выбранном диапазоне углов дает информацию о размере биологического элемента.
Другая часть света отклоняется под прямым углом и проходит через другое множество линз и набор частично отражающих зеркал, чтобы быть измеренной на уровне датчика и сгенерировать сигнал SSC (Side Scatter). Это измерение бокового света дает информацию о плотности биологического элемента, а также о его гранулярности (структуре).
Наконец, измерения интенсивности света могут быть выполнены благодаря как фотоэлектронным умножителям или фотодиодам, так и длинам волн и анализируемым оптическим сигналам.
Прохождение биологических элементов через цитометр требует предварительного этапа, на котором биологический элемент делают поддающимся обнаружению, то есть маркируют зондом, специфическим для структуры или функции указанного биологического элемента, причем сам указанный зонд был сделан обнаружимым заранее.
Когда маркер зонда является флуоресцирующей молекулой, он может поглотить фотон в характерном для него диапазоне длин волн (спектр возбуждения). После возбуждения флуоресцирующая молекула снова вернется в свое основное состояние и отдаст фотон с меньшей энергией. Таким образом, флуоресцирующая молекула имеет свой собственный спектр длин волн возбуждения, в котором она будет поглощать энергию, чтобы снова испустить ее в виде флуоресценции (испущенная флуоресценция), также в соответствии с характеристическим спектром испускания. Длина волны испущенной флуоресценции всегда больше (то есть частота меньше), чем длина волны возбуждения.
Сигналы от рассеяния (FSC, SSC) и флуоресценции будут преобразованы в электрические сигналы подходящими детекторами, а затем проанализированы вычислительной системой.
В проточной цитометрии также является общепринятым каждому использующемуся зонду или смеси зондов ставить в соответствие полосу длин волн флуоресценции. Так, каждый зонд соединен с флуорохромом (флуоресцирующим маркером), сигналы от которого измеряются только на одном канале флуоресценции, причем указанный флуорохром прививают на один или несколько типов зондов.
Затраты можно было бы уменьшить путем стандартизации параметров иммунофенотипирования с ограниченным числом каналов измерения флуоресценции в дополнение к классическим физическим параметрам, выбранным из рассеяния по оси (Forward Scatter или FSC), бокового рассеяния (Side Scatter, или SSC), объема по импедансометрии и т.д.
Возможность суммировать отклики флуоресценции позволила бы экспрессировать несколько разных меток на одном и том же измерительном канале и, таким образом, увеличить аналитические возможности системы и тем самым ее отношение цена/качества, без повышения сложности устройства из-за добавления измерительных каналов.
Трудность, когда несколько зондов конъюгированы на одном и том же флуорохроме, состоит в том, что экспрессия биологических признаков, распознаваемых соответственно разными зондами, будет напрямую влиять на полное количество испущенной флуоресценции.
Так, например, если один биологический признак выражен сильно (например, антиген на поверхности клетки), количество фиксированных меченых зондов будет пропорционально количеству указанного биологического признака. Как следствие, количество флуоресценции, испущенной указанным зондом, будучи пропорционально количеству биологических признаков, фиксированных указанным меченым зондом, будет высоким.
Одновременно, если другой биологический признак этой же пробы представлен слабо, количество флуоресценции, испущенной соответствующим зондом, конъюгированным с тем же флуорохромом, будет слишком слабым и может остаться незамеченным, так как будет скрыт флуоресценцией первого зонда.
Разумеется, эти же трудности встречаются при использовании других типов мечения.
Одна из целей настоящего изобретения состоит именно в том, чтобы позволить четко и недвусмысленно обнаружить по меньшей мере три зонда при использовании только двух средств детекции. Это предполагает, что по крайней мере два зонда будут детектироваться одним и тем же средством детекции. Это может быть осуществлено, если использовать три разных зонда, каждый из которых распознает и фиксируется с одним из биологических элементов, которые нужно обнаружить, или с одним из признаков биологического элемента или элементов, причем каждый зонд сам делается обнаружимым с помощью другого маркера, причем два указанных маркера имеют два спектра испускания, содержащие по меньшей мере одну общую часть (перекрывающиеся спектры испускания), а третий имеет спектр испускания, по существу не имеющий общих частей с двумя другими (неперекрывающийся спектр). Эти два (или n) маркера, имеющих перекрывающийся спектр испускания, измеряются первым средством детекции, а маркер, имеющий неперекрывающийся спектр испускания, измеряется вторым средством детекции.
Итак, настоящее изобретение заключается в том, чтобы:
(1) - уравнять разницу в антигенной экспрессии или клеточных характеристиках через квартовый выход эмиссии n зондов, связанных с n маркерами, измеренный в одной и той же полосе детекции;
(2) - составить отношение между сигналами, испущенными вторым средством детекции с одной стороны, и сигналами, испущенными первым средством детекции, с другой стороны, чтобы использовать его как основную ось матрицы;
(3) - скомбинировать в двух измерениях отношение, полученное в пункте (2), с одной стороны, и сигналы, испущенные первым средством детекции, с другой стороны, с целью улучшить графическое представление и тем самым улучшить охарактеризование и определение количества интересующих биологических элементов.
Под "биологическим элементом", согласно изобретению, понимается, например, эукариотическая или прокариотическая клетка, группа клеток, фрагмент клетки.
Под "биологическим признаком" понимается особый компонент исследуемого биологического элемента, например, биологическая составляющая клетки, такая как клеточная органелла, белок, липид, углевод или нуклеиновая кислота (РНК или ДНК).
Под "зондом", согласно изобретению, понимается любое средство, позволяющее специфически идентифицировать биологический или химический признак, присутствующий в или на исследуемых биологических элементах. Указанные средства, подходящие для изобретения, отлично известны, в частности, в области клеточной биологии, молекулярной биологии, иммунологии и проточной цитометрии. Можно назвать, без ограничений, антитела, нуклеиновые кислоты (ДНК или РНК), химические соединения, в частности интеркалирующие химические соединения, соединения, активные к ионной среде (H+, Ca+4" и т.д.), лектины, лиганды или другие красители для оценки жизнеспособности клеток.
Под "маркером зонда" понимается любое соединение, которое по своей природе поддается прямому обнаружению, визуально или с помощью подходящего устройства, или становится обнаружимым после возбуждения. Такое соединение, после того как присоединится к зонду, делает его обнаружимым. Можно назвать флуоресцирующие молекулы, будь то, например, химические соединения или биологические молекулы, как белки. Все эти продукты имеются в продаже и предлагаются различными поставщиками лабораторных химических продуктов, такими как, например, компании Sigma, Aldrich, Fluka, Riedel de Haen и т.д.
Следует отметить, что в одном и том же опыте по дискриминации популяций биологических элементов, в котором используется способ по изобретению, можно будет использовать зонды разной природы (например, конъюгированные антитела и меченые нуклеиновые кислоты или красители для оценки жизнеспособности клеток,) если их детекцию можно осуществить по критериям, определенным согласно изобретению (по меньшей мере два перекрывающихся спектра испускания и один неперекрывающийся спектр).
Под "средством детекции", согласно изобретению, понимается любое средство для обнаружения и даже определения количества маркера зонда. Разумеется, указанное средство детекции является характеристическим для способа, используемого, чтобы сделать зонд обнаружимым. Во всех случаях указанное средство детекции состоит из совокупности физических компонентов, способных обнаружить маркер конкретного зонда. Например, если речь идет о маркере, испускающем флуоресценцию, средством детекции будет система, состоящая из оптических линз контроля пробы, пространственных фильтров (диафрагма, "pin hole" и т.д.), стереоскопических фильтров (дихроичных, интерференционных), специально сконструированных так, чтобы пропускать к датчику только часть спектра, называемую "полосой детекции", специфическую для маркера или маркеров, которые будут измерять, и самого оптоэлектронного датчика (фотодиод, фотоэлектронный умножитель и т.п.). Затем этот датчик будет соединен с помощью электроники с электронным каналом сбора данных, который будет проводить обработку сигнала в аналоговом и/или цифровом режиме и, наконец, вычислительную обработку данных компьютером.
Может также использоваться, например, детектор флуоресценции, если зонд мечен флуоресцирующим маркером или если зонд сам флуоресцируют, или спектрофотометр, если зонд является маркером, поглощающим в определенной части цветового спектра возбуждающего света.
Под "спектром испускания", согласно изобретению, понимается распределение интенсивности флуоресценции в зависимости от длины волны в характеристической полосе маркера или самого зонда. Обычно такой спектр имеет пик интенсивности, соответствующий максимуму испускания. Обнаружение можно провести в полосе, заключающейся между двумя длинами волн, охватывающей обычно промежуточную длину волны, соответствующую максимальному пику излученной флуоресценции (максимальный пик обнаружения).
Под "полосой детекции" понимают диапазон длин волн, выбранный в спектре испускания рассматриваемого маркера или маркеров (например, если речь идет о флуоресцирующем маркере, полосой детекции будет полоса, выбранная предпочтительно вокруг максимального пика испускания флуоресценции). Эта полоса детекции определяется спектральной фильтрацией, встроенной в средство детекции, посредством по меньшей мере одного интерференционного светофильтра, или полосового фильтра, в случае необходимости собранную за одним или несколькими дихроичными зеркалами.
Под "перекрывающимися спектрами испускания" понимается, что в одном и том же средстве детекции у двух разных маркеров их спектры испускания имеют общую зону. Например, если используют два флуоресцирующих маркера, их спектры испускания будут называться перекрывающимися спектрами испускания, когда они имеют общую полосу испускания, заключенную между двумя длинами волн, общими для их спектров испускания. Обычно такие спектры имеют разные пики максимальной эмиссии.
Под "по существу неперекрывающимся спектром испускания" понимается, что в случае трех разных маркеров, два из которых имеют перекрывающиеся спектры испускания, третий имеет спектр испускания, не содержащий существенной зоны перекрытия ни с одним из спектров двух других маркеров.
Таким образом, из написанного выше понятно, что если используются три зонда, которые распознают три разных биологических признака, меченых тремя маркерами, имеющими три разных спектра испускания, причем два являются перекрывающимися, а один неперекрывающимся, то в способе используются только два средства детекции в измерении, в котором маркеры с перекрывающимися спектрами имеют общую полосу детекции.
Именно это сильно отличает способ, являющийся объектом изобретения, от способов, известных в предшествующем уровне техники, в которых для детекции трех биологических признаков используются три зонда, имеющих три независимых спектра испускания, которые анализируются тремя разными средствами детекции.
Что касается перекрывающихся маркеров, разумный выбор маркеров с точки зрения их обнаружения заставляет выбирать два маркера, которые могут давать отклик, один более эффективно, чем другой, в одной и той же полосе детекции.
Согласно одному варианту изобретения квантовый выход эмиссии в полосе детекции может быть выбран так, чтобы быть обратно пропорциональным экспрессии рассматриваемых биологических признаков. Выбор полосы детекции будет также определяться в зависимости от этой экспрессии, чтобы не скрыть слабую положительную экспрессию (это есть первая фаза уравнивания в изобретении).
Так, например, для слабо экспрессированного антигена следует выбирать маркер, имеющий повышенный квантовый выход эмиссии в выбранной полосе детекции, а для сильно экспрессированного антигена выбирают маркер, имеющий не очень высокий квантовый выход эмиссии в той же полосе детекции. Это позволяет контролировать количество измеренных маркеров, чтобы уравнять эмиссии в пропорции, обратной к уровню экспрессии рассматриваемых антигенов или зондов.
Способ, согласно изобретению, позволяет просто, быстро и эффективно дискриминировать и подсчитать биологические элементы. Кроме того, он позволяет использовать простые устройства, что имеет следствием уменьшение затрат как на изготовление, так и на обслуживание. Кроме того, облегчается автоматизированный анализ.
Итак, объектом изобретения является способ дискриминации по меньшей мере двух популяций биологических элементов - носителей специфических признаков, возможно, присутствующих в пробе, включающий:
- одновременное мечение указанных популяций биологических элементов тремя разными зондами, которые можно обнаружить или которые становятся обнаружимыми благодаря трем разным маркерам, причем два из указанных маркера (перекрывающиеся маркеры, или MC) имеют каждый свой спектр испускания, и указанные спектры испускания перекрываются, а третий (неперекрывающийся маркер, или MnC) имеет спектр испускания, не перекрывающийся со спектрами двух других маркеров (неперекрывающийся спектр испускания);
- измерение любым подходящим средством полного количества неперекрывающегося маркера (qMnC) в полосе детекции, выбранной в спектре испускания указанного неперекрывающегося маркера;
- измерение любым подходящим средством полного количества перекрывающихся маркеров (qMC) в полосе детекции, общей для спектров испускания указанных перекрывающихся маркеров;
- установление для каждого анализируемого биологического элемента отношения (R) полного количества неперекрывающихся маркеров к полному количеству перекрывающихся маркеров (R= (qMnC)/(qMC));
- построение любым средством диаграммы, показывающей отношение (R) в зависимости от количества биологических элементов, меченых перекрывающимися маркерами (R=f(qMC)), и/или
- количественное определение любым подходящим средством, обычно компьютером, биологических элементов, идентифицированных на указанной диаграмме или диаграммах и соответствующих статистических данных.
Способ, согласно изобретению, является способом, который позволяет различить и подсчитать биологические элементы, отвечающие положительно или нет на заданный критерий. Способ не имеет целью определить число зондов, фиксированных биологическим элементом. Способ позволяет однозначно выявить в пробе, в частности, в биологической пробе, популяции биологических элементов, имеющие искомый признак или признаки.
В соответствии с последней стадией способа по изобретению анализ двухпараметрической матрицы с ординатой R и абсциссой qMC позволяет улучшить графическое представление и тем самым улучшить охарактеризование и определение количества интересующих биологических элементов.
Согласно изобретению проба может быть натуральной биологической пробой, в частности жидкой натуральной биологической пробой. Она может также быть ненатуральной клеточной суспензией, как, например, культурная среда. В качестве натуральной биологической жидкости можно назвать, без ограничений, кровь, мочу, диссоциированную ткань, костный мозг, спинномозговую жидкость, плевральную жидкость или синовиальную жидкость, продукт процесса афереза, а в качестве синтезированной клеточной суспензии - культурную среду клеток или микроорганизмов.
Согласно изобретению биологические элементы, содержащиеся в пробе, могут быть эукариотическими или прокариотическими клетками или их смесью, или фрагментами указанных клеток, огранеллами. Зондами, применимыми согласно способу по изобретению, могут быть одинаковые или разные антитела, нуклеиновые кислоты (ДНК или РНК), а также любые молекулярные зонды, такие как, например, красители, специфически распознающие нуклеиновые кислоты, ферментные субстраты, а также специфические маркеры белков, лигандов рецепторов, молекул, чувствительных к ионной среде (зонды к pH, Ca4+ и т.д.), или любой другой молекулой, специфической для искомого биологического признака.
Когда зонды являются антителами, они могут быть моноклональными или поликлональными, натуральными или рекомбинатными антителами человека или животных.
Если зонды не являются обнаружимыми по своей природе, то чтобы сделать их поддающимися обнаружению, их нужно конъюгировать с маркером, который может быть распознан средством детекции в выбранной полосе детекции.
Согласно изобретению маркерами, служащими для того, чтобы сделать зонд поддающимся обнаружению, могут быть обнаружимые химические соединения, способные прививаться на зонды, интеркалирующие или неинтеркалирующие маркеры нуклеиновых кислот, а также специфические маркеры белков или любая другая молекула, специфическая для искомого биологического признака. В этой связи можно назвать такие флуоресцентные красители, а также абсорбенты, как: Alexa Fluor® 350, Alexa Fluor® 488, Alexa Fluor® 532, Alexa Fluor® 633, Alexa Fluor® 647, Alexa Fluor® 660, Alexa Fluor® 680, аллофикоцианин, аминометилкумарин в уксусной кислоте, Cy2®, Cy5.1®, Cy5®, Cy5.5®, дихлорфлуоросцеин (DCFH), дигидрородамин (DHR), "усиленный GFP" (EGFP), Fluo-3, FluorX®, флуоресцеин, 5-малеимид флуоресцеин, изотиоцианат флуоресцеина (FITC), PerCP, r-фикоэритрин (PE), тандем r-фикоэритрин-Цианин 5 или Спектральный красный® или CyChrome®, r-фикоэритрин-Цианин 5.5 (PE-CY 5.5®), r-фикоэритрин-Цианин 7 (PE-CY 7®), r-фикоэритрин-Техас красный-x®, Красный 613®, родамин 110, родамин 123, S65L, S65T, изотиоцианат тетраметилродамина, Техас красный-x®, Настоящий красный®, индо-1, нанокристаллы (Quantum Dots), Fura 2, Fura 3, квин, DS красный, а также специфические маркеры, в частности, нуклеиновых кислот (будь то ДНК или РНК), такие как, например, интеркалянты или другие красители для оценки клеточной жизнеспособности, такие как бромид этидия, а также тиазол оранжевый, тиазол синий и их производные, тиофлавин S, тиофлавин T, тиофлавин TCN®, диэтил-хинолитоцианин иодид (DEQTC), TOTO-l®, TO-PRO-1®, а также YOYO-1®, Хехст® 33258, Хехст® 33342, Хехст® 34580, диамидинофенилиндол (DAPI), йодид пропидия, пиронин Y, 7-аминоактиномицин D (7 AAD), акридин оранжевый, аурамин O, калцеин, новый метиленовый синий, оламин-O, оксазин 750, голубая астра, SYTOX® Зеленый, SYTO 11®, SYTO 12®, SYTO 13®, SYTO 16®, SYTO 18®, SYTO 80®, SYTO 81® и т.д.
В частной форме осуществления изобретения, когда клеточные признаки, например, антигены, распознаются зондами, ставшими обнаружимыми благодаря перекрывающимся маркерам, можно выбрать первый клеточный признак, называемый родовым, то есть присутствующий во всех и характерный для всех рассматриваемых биологических элементов. Поскольку экспрессия этого клеточного признака в биологических элементах обычно высока, маркер, который будет привит на распознающий его зонд, может быть маркером, дающим более слабый отклик в полосе детекции, общей для двух перекрывающихся маркеров (MC). Такой зонд позволяет удостовериться, что он все же представляет интерес для хороших клеточных популяций.
Вторым клеточным признаком, распознаваемым зондом, ставшим обнаружимым благодаря перекрывающемуся маркеру, может быть клеточный признак, слабее экспрессируемый только одной популяцией исследуемых биологических элементов. Маркер, который будет привит на указанный зонд, должен быть маркером, который дает более сильный отклик в полосе детекции, общей для двух перекрывающихся маркеров (MC).
Третьему исследуемому клеточному признаку соответствует зонд, меченый третьим маркером, который является неперекрывающимся (MnC) и который будет детектироваться во второй полосе детекции, отличной от первой.
Способ согласно изобретению может быть осуществлен в любом устройстве, позволяющем обнаружить маркеры. В этой связи назовем для примера обнаружение флуоресценции, которая испускается красителем, конъюгированным с молекулярным зондом, таким как антитело, или напрямую флуоресцирующим суправитальным красителем, таким как интеркалирующий или неинтеркалирующий краситель, специфический для нуклеиновых кислот, а также детектирование поглощения или рассеяния света, в частности, в определенном диапазоне длин волн спектра, проводятся ли эти измерения посредством экстинкции или рассеяния в диапазоне длин волн или путем спектрометрии в полосе, выбранной от ультрафиолета до инфракрасного излучения. Это поглощение может быть поглощением, вызываемым либо красителем, конъюгированным с молекулярным зондом, таким как антитело, или напрямую суправитальным красителем, таким как интеркалирующий или неинтеркалирующий краситель, специфический к нуклеиновым кислотам.
Объектом изобретения является также применение описанного выше способа для дискриминации по меньшей мере двух клеточных популяций - носителей особых признаков, возможно присутствующих в пробе. Способ может применяться в диагностической медицине, например, в области хронической лимфоидной лейкемии (LLC) и острой лейкемии (LA), с помощью антител анти-CD45, анти-CD19 и анти-CD5; в области обнаружения остаточного заболевания (Minimum Residual Desease - минимальное остаточное заболевание, MRD) и лейкоцитарной дифференцировки с помощью антител анти-CD45, анти-CD16 и анти-CD11b; в области кроветворных клеток-предшественников с помощью антител анти-CD45, анти-CD34, анти-CD33 и 7-AAD, или DAPI, или другого маркера для оценки жизнеспособности; в области воспалений и клеточной активации с помощью антител анти-CD45, анти-CD64 и анти-CD163; в области обнаружения или мониторинга заражения вирусом ВИЧ с помощью антител анти-CD45, анти-CD8 или анти-CD4 и анти-CD3; в области острой лимфобластной лейкемии типа b (LALb) у детей; в области обследования костного мозга с помощью антител анти-CD45, анти-CD19 и анти-CD10, а также в области дифференцировки предшественников B-лимфоцитов (гематогенов) с помощью антител анти-CD19, анти-CD10 и анти-CD38. Этот список не является ни исчерпывающим, ни ограничивающим и отражает только современное состояние медицинских знаний.
Другие характеристики изобретения выявятся при рассмотрении фигур и следующих примеров, которые даны только в качестве иллюстрации и не ограничивают изобретения.
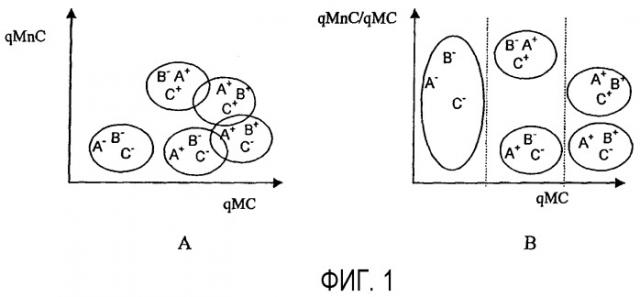
Так, фиг.1 дает схематическое изображение фенотипов биологических элементов, причем A и B являются перекрывающимися маркерами, а C - неперекрывающимся маркером, которые отвечают соответственно зондам (SA, SB и SC), ставшими обнаружимыми и которые распознают особые признаки (CPA, CPB и CPC) рассматриваемых биологических элементов.
Фиг.1A показывает классическое представление измеренной проточной цитометрией флуоресценции A+B (qMC) в зависимости от флуоресценции C (qMnC).
Фиг.1B дает графическое представление, полученное согласно изобретению, определенное методом проточной цитометрии отношения флуоресценции C (qMnC), отнесенного к полной флуоресценции A+B (qMC) (qMnC/qMC) в зависимости от полной флуоресценции A+B (qMC) (qMnC/qMC=f(qMC)).
Осуществление изобретения позволяет на одной и той же оси флуоресценции (оси абсцисс) различить биологические элементы, экспрессирующие (A+ B+) с одной стороны (A- B-) с другой стороны, и (A+ B-) или (A- B+) с третьей стороны.
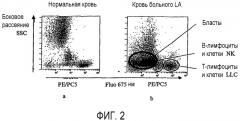
Фиг.2 показывает применение способа согласно изобретению, для анализа лейкоцитов крови в пробе нормальной крови (2a) и в пробе крови пациента, страдающего острой лейкемией (2b), после мечения антителами анти-CD45, конъюгированными с r-фикоэритрином (PE), антителами анти-CD5, конъюгированными с фикоэритрин-цианином 5 (PC5), и антителами анти-CD19, конъюгированными с FITC. Экспрессия одного CD45 позволяет идентифицировать бласты, присутствующие в этой патологии.
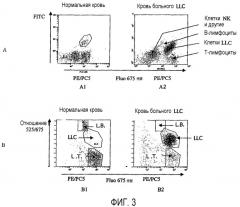
Фиг.3 показывает пробы нормальной крови и крови больного, страдающего хронической лимфоидной лейкемией (A2 и B2). Фиг.3A1 и 3A2 показывают результаты анализа методом проточной цитометрии, а фиг.3B1 и 3B2 показывают те же результаты после применения способа по изобретению.
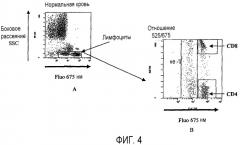
Фиг.4 показывает применение способа по изобретению для анализа кровяных лимфоцитов T после мечения антителами анти-CD45, конъюгированными с PE, антителами анти-CD3, конъюгированными с PC5, и антителами анти-CD8, конъюгированными с FITC. Фиг.4A показывает результаты анализа методом проточной цитометрии, а фиг.4B показывает те же результаты после применения способа по изобретению.
Пример 1:
Наиболее частыми патологиями в онкогематологии являются различные типы острой лейкемии (LA) и лимфоидной гемопатии B, причем частота заболеваний хронической лимфоидной лейкемией (LLC) обнаруживает постоянный рост (30/106).
Острая лейкемия (LA) может быть охарактеризована поражением костного мозга в результате пролиферации кроветворных клеток.
Хроническую лимфоидную лейкемию (LLC) можно охарактеризовать пролиферацией лимфоцитарных моноклональных клеток, лимфоидных клеток атипичной линии B.
Лейкемические бласты LA характеризуются умеренной экспрессией CD45 по сравнению с нормальными лимфоцитами и моноцитами крови.
Аномальные лимфоциты LLC типа B отличаются неправильной одновременной экспрессией антигенов CD5 и CD19 на одних и тех же клетках, тогда как нормальные лимфоциты экспрессируют либо CD5 (лимфоциты линии T), либо CD19 (лимфоциты линии B).
Фенотипы этих клеток могут быть сведены в нижеследующую таблицу:
| Антигены | CD19 | CD45 | CD5 |
| Нормальные Т-лимфоциты | - | ++ | ++ |
| Нормальные В-лимфоциты | + | ++ | - |
| Бласты LA | +/- | ||
| B-лимфоциты при LLC | + | ++ | + |
До настоящего времени анализ и идентификация этих разных популяций в пробе крови методом проточной цитометрии требовали применения трех разных антител, направленных против трех антигенов CD5, CD19 и CD45, и бокового рассеяния SSC. Для этого анализа каждое антитело связывают с разным флуорохромом и каждую экспрессию измеряют на разной длине волны с помощью разных фотоэлектронных умножителей.
Применение способа по изобретению позволяет предложить систему мечения и цитометрического анализа, позволяющую обнаружить и количественно охарактеризовать в одной и той же пробе крови и при одном и том же измерении фактическое присутствие лейкемических клеток с помощью всего двух фотоэлектронных умножителей и бокового рассеяния SSC.
На проточном цитометре оптимизируется оптическая фильтрация световых сигналов для данного флуорохрома, чтобы измерить флуоресценцию в полосе длин волн с центром в его максимуме испускания: флуоресцеин (FITC) обычно анализируется на 525 нм, r-фикоэритрин (PE) на 575 нм и тандем r-фикоэритрин-цианин 5 (PC5) на 675 нм, все это при ширине полосы примерно 30 нм.
Спектры испускания PE и PC5 являются перекрывающимися. Общей у них является, например, длина волны 675 нм, на которой PE имеет намного более слабый квантовый выход флуоресценции, чем PC5. Одно из отличий способа по изобретению состоит в измерении флуоресценции одного из флуорохромов (PE) на длине волны, отличной от его максимума испускания (здесь измерение PE на 675 нм). Таким образом, на этой длине волны становится возможным, играя на разной эффективности измерительной системы в отношении двух флуорохромов, выбранных с этой целью, компенсировать существенную разницу в экспрессии анализируемых антигенов.
Этот принцип применен к анализу кровяных лейкоцитов после мечения антителами анти-CD45, конъюгированными с PE (λmax=575 нм), антителами анти-CD5, конъюгированными с PC5 (λmax=675 нм), и антителами анти-CD19, конъюгированными с FITC (λmax=525 нм).
Это мечение анализируется в первой полосе детекции с центром на 675 нм, которая представляет собой длину волны максимального испускания PC5. Спектр PE перекрывает спектр PC5. Таким образом, анализом на 675 нм будет определено полное количество флуоресценции, испущенной PC5 и PE (qMC).
С другой стороны, анализируется количество флуоресценции, испущенной антителами анти-CD19, конъюгированными с FITC, на 525 нм (qMnC).
Гранулоциты и моноциты исключены из анализа из-за влияния на их свойства светорассеяния.
Протокол:
1) Из пробы общей периферической крови отбирают аликвоту крови в несколько миллилитров (5-50), которую смешивают с аликвотой в несколько миллилитров (3-50) раствора трех описанных выше конъюгированных антител.
2) Смесь инкубируют при температуре среды или при контролируемой температуре, защищая от света, в течение нескольких минут (от 1 до 30).
3) После инкубационного периода в смесь добавляют реактив лизиса красных телец, чтобы получить конечный раствор крови с особой желаемой концентрацией (1/40, 1/80, 1/100 и т.д.).
4) Полученный так раствор лизированной крови оставляют выдерживаться в течение нескольких секунд, в зависимости от реактива лизиса и температуры инкубации (обычно от 15 до 30 секунд).
5) Затем раствор вводят в измерительный комплекс типа проточного цитометра, чтобы измерить для всех клеток, пересекающих световой пучок (чаще всего лазер 488 нм для специфических красителей), параметры рассеяния по оси FSC, бокового рассеяния SSC, зеленой флуоресценции на 525 нм (FL1) и красной флуоресценции на 675 нм (FL2). Этапы 3-5 могут быть осуществлены автоматически на полуавтоматическом устройстве проточной цитометрии или на специально сконструированном гематологическом автомате, а этапы 1-5 могут быть автоматизированы на специально сконструированном автоматическом устройстве проточной цитометрии.
Анализ флуоресценции на 675 нм (FL1) в зависимости от бокового рассеяния SSC (фиг.2A) позволяет различить:
- очень слабо флуоресцирующую популяцию, соответствующую бластам LA, экспрессирующим мало CD45,
- популяцию с промежуточной флуоресценцией, соответствующую лимфоцитам, экспрессирующим CD45, но не экспрессирующим CD5 (B-лимфоциты и клетки NK), и
- сильно флуоресцирующую популяцию, соответствующую лимфоцитам, экспрессирующим также CD5 (T-лимфоциты и клетки LLC).
В этой последней популяции анализ флуоресценции на 525 нм позволяет идентифицировать клетки LLC, экспрессирующие также CD19.
Применение способа согласно, изобретению позволяет различить лимфоциты не-T, лимфоциты T и клетки LLC, учитывая для каждой клетки отношение флуоресценции на 525 нм к флуоресценции на 675 нм (qMnC/qMC). Это отношение выражено в нижеследующей таблице истинности:
| CD19 | CD45 | CD5 | CD19/(CD19+CD5)(qMnC/qMC) |
| - | ++ | ++ | - |
| + | ++ | - | ++ |
| + | ++ | + | +/- |
Гистограмма распределения, полученного согласно изобретению ((qMnC)/(qMC)=f(qMQ)) (фиг.2C), позволяет идентифицировать, разделить и количественно охарактеризовать три очень заметно отличающиеся популяции.
- Нормальные лимфоциты T (L.T.) не флуоресцируют на 525 нм, но сильно флуоресцируют на 675 нм, таким образом, они имеют очень низкое отношение.
- Нормальные лимфоциты B (L.B.) флуоресцируют на 525 нм с промежуточной флуоресценцией на 675 нм, таким образом, они имеют повышенное отношение.
- Клетки LLC экспрессируют одновременно CD5, CD45 и CD19, флуоресцируют на 525 нм и 675 нм и, следовательно, их отношение является промежуточным (фиг.2).
- Клетки NK, которые не экспрессируют ни CD5, ни CD19, исключены из анализа из-за их флуоресценции на 675 нм (CD45+, CD5- и CD19-).
Так, исходя из пробы крови, после мечения тремя флуоресцентными антителами и лизиса эритроцитов можно в одном анализе дискриминировать и подсчитать лимфоциты T, лимфоциты B и клетки NK путем измерения толь