Нетканый материал медицинского назначения, обладающий ранозаживляющей, антибактериальной и противовирусной активностью, и перевязочное средство на его основе
Иллюстрации
Показать всеИзобретение относится к медицине. Описан нетканый материал медицинского назначения, содержащий волокнистую основу и неорганический порошок, предназначенный для закрытия ран. Нетканый материал, обладающий ранозаживляющей, антибактериальной и противовирусной активностью, содержит, по меньшей мере, один слой нетканого полимерного волокнистого материала, при этом на его волокнах закреплены высокопористые частицы гидрата оксида алюминия. Описано перевязочное средство, обладающее ранозаживляющей, антибактериальной и противовирусной активностью, которое содержит, по меньшей мере, один слой вышеописанного нетканого материала и, по меньшей мере, один второй слой атравматичного материала. Описано применение фильтрующего материала, содержащего в качестве основы нетканый полимерный волокнистый материал, полученный методом электроформования, на волокнах которого закреплены частицы гидрата оксида алюминия, для изготовления материалов медицинского назначения, обладающих ранозаживляющей, антибактериальной и противовирусной активностью. Описанное перевязочное средство является гибким и эластичным. 4 н. и 12 з.п. ф-лы, 21 табл., 5 ил.
Реферат
Изобретение относится к абсорбирующим нетканым материалам, содержащим неорганические порошки, и может быть использовано в медицине, особенно относится к производству перевязочных средств (медицинских салфеток, повязок и т.п.), предназначенных для закрытия ран.
В настоящее время известно значительное количество перевязочных средств, используемых в клинической практике. Однако нет универсального средства, которое соответствовало бы всем критериям, предъявляемым к перевязочным средствам.
Наиболее известными средствами, используемыми в качестве перевязочного материала, накладываемого непосредственно на рану, являются стерильные марлевые салфетки, либо пропитанные различными лечебными препаратами либо прикрывающие наложенные на ткани мази и порошки. Основным недостатком марлевых повязок являются высокие адгезивные свойства по отношению к раневой поверхности. Это замедляет заживление, приводит к болевым ощущениям и травматизации тканей при смене повязки. Смена повязки приводит к повторному болевому и механическому раздражению раны, что, в свою очередь, не способствует сокращению сроков регенерации раны.
Известно раневое покрытие [RU 2314834 C1, 2008] на основе тканых и нетканых материалов природного или синтетического происхождения, содержащее частицы металла, обладающего биологической активностью к патогенной флоре, при этом в качестве частиц металла оно содержит наночастицы серебра от 80 до 99,7%, железа от 0,1 до 20%, алюминия от 0,1 до 20%, меди от 0,1 до 20%, которые нанесены в вакуумной камере с помощью магнетронного напыления.
Использование частиц металлов, относящихся к тяжелым металлам, придает раневому покрытию некоторую токсичность.
Известна [US 200810026041 A1, 2008] медицинская нетканая структура, включающая: а) нановолокна оксида алюминия, б) вторые волокна, смешанные с нановолокнами оксида алюминия, и вторые волокна, служащие для создания асимметричных пор; и в) большое количество частиц, распределенных на нановолокнах оксида алюминия, где вышеупомянутые частицы отобраны из группы, состоящей из сорбента, лекарственного препарата и бактерицидного средства.
Образующаяся в результате этого масса (состав) преобразуется в волокнистую структуру с использованием вакуумной системы на нижней поверхности экрана, как в технологии, когда лист бумаги отливается вручную или на установке для изготовления бумаги, это - хорошо известные способы создания нетканого материала с помощью технологии влажной обработки.
Назначение и свойства такой медицинской структуры обусловлены закрепленными на нановолокнах частицами металлов, относящихся к тяжелым металлам, что придает перевязочному средству некоторую токсичность.
Известно [WO 2009024909 A2] адсорбирующее изделие, содержащее адсорбирующий слой с покрытием, содержащим неорганические наноразмерные порошки на основе алюминия, кремния и др., для улучшения гидрофильности адсорбирующего слоя.
Известно [US 5795836, 1998], относящееся к медицинским нетканым материалам, содержащим комплексы неорганических порошков. В частности, оно относится к медицинским нетканым материалам, содержащим комплекс неорганических порошков, который состоит по существу из TiO2, Al2O3 и SiO2, пригодный для обработки открытых ран и повреждений мягких тканей. Данный материал является наиболее близким к заявляемому материалу и выбран в качестве прототипа.
Используемый комплекс неорганических порошков не обладает антимикробным действием.
Известно перевязочное средство [RU 2134126 C1, 1999], выбранное в качестве прототипа для заявляемого перевязочного средства, выполненное из абсорбирующего листового волокнистого слоя, содержащего целлюлозу и вискозное волокно, и атравматичного паропроницаемого слоя, обращенного к ране, при этом абсорбирующий листовой волокнистый слой дополнительно содержит модифицированный углеродом оксид алюминия, имеющий удельную поверхность 80-300 м2/г, объем пор 0,08-0,250 см3/г. Данное средство является наиболее близким к заявляемому перевязочному средству и выбрано в качестве прототипа.
Недостатком прототипа является то, что технология изготовления материала не позволяет получать достаточно гибкие и эластичные перевязочные средства, к тому же приведенные значения впитываемости в настоящее время не являются оптимальными.
Задачей изобретения является расширение арсенала нетканых материалов медицинского назначения и перевязочных средств, обладающих ранозаживляющей, антибактериальной и противовирусной активностью.
Поставленная задача достигается тем, что, как и известный предлагаемый нетканый материал медицинского назначения, обладающий ранозаживляющей, антибактериальной и противовирусной активностью, содержит волокнистую основу и неорганический порошок.
Новым является то, что в качестве волокнистой основы он содержит, по меньшей мере, один слой нетканого полимерного волокнистого материала, при этом на его волокнах закреплены высокопористые частицы гидрата оксида алюминия.
Кроме того, нетканый полимерный волокнистый материал образован волокнами, имеющими диаметр 0,1-10 мкм, предпочтительно 1-3 мкм, из ацетилцеллюлозы, полисульфона или другого биологически инертного полимера.
Кроме того, нетканый полимерный волокнистый материал получен методом электроформования, мельт-блаун-технологии или другими методами, позволяющими получать нетканые материалы с упомянутым диаметром волокна.
Целесообразно, чтобы высокопористые частицы гидрата оксида алюминия были закреплены на волокнах как на поверхности, так и в объеме материала.
Кроме того, высокопористые частицы гидрата оксида алюминия, закрепленные на волокнах нетканого полимерного волокнистого материала, имеют размер 0,2-5,0 мкм, удельную поверхность 100-250 м2/г и пористость 50-95% и образованы нановолокнами. При этом нановолокна имеют диаметр 5,0-8,0 и длину 100-200 нм.
Целесообразно, чтобы он дополнительно содержал, по меньшей мере, один слой атравматичного материала, предназначенного, например, для размещения на раневой поверхности.
Дополнительно он может содержать, по меньшей мере, один слой защитного материала расположенного либо на одной, либо на обеих его сторонах.
Кроме того, он может являться перевязочным материалом.
Поставленная задача достигается также тем, что как и известное предлагаемое перевязочное средство, обладающее ранозаживляющей, антибактериальной и противовирусной активностью, содержит, по меньшей мере, один первый слой абсорбирующего материала и, по меньшей мере, один второй слой атравматичного материала.
Новым является то, что в качестве первого упомянутого слоя использован вышеописанный нетканый материал.
Целесообразно, чтобы оно дополнительно содержало, по меньшей мере, один слой защитного материала, расположенного либо на одной, либо на обеих его сторонах.
К тому же дополнительно оно может быть снабжено элементами фиксации его к телу человека.
Поставленная задача достигается также тем, что осуществляют применение известного фильтрующего материала по патенту РФ №2317843, содержащего в качестве основы нетканый полимерный волокнистый материал, полученный методом электроформования, на волокнах которого закреплены частицы гидрата окиси алюминия, для изготовления материалов и изделий медицинского назначения, обладающих ранозаживляющей, антибактериальной и противовирусной активностью.
Кроме того, осуществляют применение известного фильтрующего материала, содержащего в качестве основы нетканый полимерный волокнистый материал, полученный методом электроформования, на волокнах которого закреплены частицы гидрата оксида алюминия, предпочтительно, для изготовления перевязочных средств, обладающих ранозаживляющей, антибактериальной и противовирусной активностью
Поставленная задача достигается также тем, что осуществляют применение известного фильтрующего материала по патенту РФ №2317843, содержащего в качестве основы нетканый полимерный волокнистый материал, полученный методом электроформования, на волокнах которого закреплены частицы гидрата оксида алюминия в качестве нетканого медицинского материала, обладающего ранозаживляющей, антибактериальной и противовирусной активностью.
Предпочтительно, чтобы нетканый медицинский материал дополнительно содержал, по меньшей мере, один слой атравматичного материала, расположенного на стороне, предназначенной для размещения его на раневой поверхности.
Дополнительно медицинский материал может содержать, по меньшей мере, один слой защитного материала, расположенного либо на одной, либо на обеих сторонах медицинского материала.
Современные медицинские нетканые материалы, особенно используемые в качестве должны обладать перевязочных средств, должны отвечать ряду требований, в том числе должны обладать хорошей впитывающей и сорбционной способностью, чтобы впитывать экссудат и хорошо удерживать его в своем объеме, захватывать и надежно изолировать патогенные микроорганизмы и в то же время препятствовать попаданию микроорганизмов в рану извне. Кроме того, требуется, чтобы перевязочное средство позволяло поддерживать в ране оптимальный влажностный режим, было паро- и воздухопроницаемым, а также имело не приклеивающуюся к ране поверхность для атравматичного удаления с раны, что достигается за счет гладкой гидрофобной безворсовой поверхности перевязочного средства со стороны, контактирующей с раневой поверхностью.
Нетканые полимерные материалы с диаметром волокон до 10 мкм обладают более развитой поверхностью и высокопористой структурой, чем материалы из более толстых волокон, что обеспечивает их способность быстро впитывать и хорошо удерживать впитанную жидкость, например эффективно удалять экссудат из раны. Материалы с такой толщиной волокон из ацетата целлюлозы, полисульфона, полипропилена, полиамида и других биоинертных полимеров могут быть получены методами электроформования или мельт-блаун-технологии, или другими методами, позволяющими получать нетканые материалы с упомянутым диаметром волокна.
Это свойство в настоящем изобретении предлагается усиливать за счет дополнительного введения в основу высокопористых частиц гидрата оксида алюминия.
Антимикробная активность основы также обеспечивается за счет входящих в ее состав высокопористых частиц гидрата оксида алюминия, имеющих высокий электроположительный заряд, высокую удельную поверхность и пористость, оптимальную структуру пор. Частицы с такими характеристиками образуются при гидролизе нанопорошков алюминия, полученных методом электрического взрыва проводника в атмосфере аргона или азота.
Известны материалы, имеющие электроположительный заряд, являющиеся эффективными адсорбентами микроорганизмов, например, при микробиологической очистке воды и других жидкостей. Однако величина их дзета-потенциала, являющегося количественной характеристикой заряда частицы, как правило, лежит в пределах 10-20 мВ, в то время как частицы гидрата оксида алюминия, полученные из электровзрывных нанопорошков алюминия, имеют дзета-потенциал выше 30 мВ. Более высокий заряд частиц способствует более высокой эффективности адсорбции микроорганизмов не только при очистке воды, но и при использовании их в качестве медицинского материала.
Продукты гидролиза порошков алюминия с частицами микронных размеров содержат, как правило, большее или меньшее количество крупных непористых частиц и их удельная поверхность составляет обычно 50-150 м2/г. Продукты гидролиза электровзрывных нанопорошков представляют собой высокопористые агломераты нановолокон и имеют удельную поверхность более 300 м2/г.Сравнимую удельную поверхность имеют золи гидроксида алюминия, получаемые осаждением из алюминатов или солей алюминия. Однако отсутствие высокого электроположительного заряда и значительно более мелкие поры, чем у частиц гидрата окиси алюминия, полученных из электровзрывных порошков, делают их значительно менее активными адсорбентами микроорганизмов.
Кроме того, частицы гидрата оксида алюминия, полученные из электровзрывных нанопорошков алюминия, обладают высокой впитывающей способностью за счет гидрофильности и высокой удельной поверхности.
Таким образом, частицы гидрата оксида алюминия способны в прилегающих к ране слоях материала адсорбировать микроорганизмы из влажной раневой поверхности, способствуя тем самым ее очищению, и в то же время препятствовать проникновению микроорганизмов в рану из внешней среды.
Высокопористая структура основы, образованная микроволокнистой основой, обеспечивает хорошую воздухопроницаемость и паропроницаемость материала, что позволяет поддерживать в ране оптимальный влажностный режим.
Для эффективного ранозаживления при использовании предлагаемого нетканого материала в качестве перевязочного средства необходима гидрофильная микроволокнистая поверхность. При непосредственном наложении на рану частицы микроволокон с нанесенными частицами гидрата окиси алюминия могут прилипать к поверхности раны и при удалении повязки оставаться в ране и загрязнять ее, а также служить причиной травматичного болезненного удаления повязки. Однако этот недостаток легко преодолевается путем применения дополнительного слоя из гладкого гидрофобного безворсового пористого полимерного материала (сетки), например из полипропилена, который располагается со стороны, предназначенной для контакта с раневой поверхностью, или с обеих сторон материала. Целесообразно, чтобы этот слой был интегрирован с нетканым материалом, чтобы не создавать барьерный слой между раневой поверхностью и сорбирующим и впитывающим материалом.
Согласно изобретению также установлено, что фильтрующий материал по патенту РФ №2317843 (материал выпускается ООО «Аквазон» под торговой маркой AquaVallis), предназначенный для микробиологической очистки воды, обладает основными характеристиками, перечисленными выше, и поэтому применим для изготовления материалов медицинского назначения, обладающих ранозаживляющей, антибактериальной и противовирусной активностью, преимущественно перевязочных средств.
Фильтрующий материал AquaVallis представляет собой нетканый полимерный волокнистый материал, полученный методом электроформования (ткань Петрянова), на волокнах которого закреплены частицы гидрата окиси алюминия, представляющие собой агломераты нановолокон. Основу материала AquaVallis составляет нетканый микроволокнистый материал из биологически инертного полимера, предпочтительно из ацетата целлюлозы или полисульфона. При этом высокопористые частицы гидрата оксида алюминия закреплены на волокнах как на поверхности, так и в объеме материала основы. Высокопористые частицы гидрата оксида алюминия имеют размер 0,2-5,0 мкм, удельную поверхность 100-250 м2/г и пористость 50-95% и образованы нановолокнами, имеющими в свою очередь диаметр 5,0-8,0 и длину 100-200 нм.
В зависимости от назначения медицинские изделия на основе фильтрующего материала могут быть выполнены в различных формах - бинты, салфетки, подушечки, пластыри различных размеров и толщины.
Для удобства крепления изделия, например перевязочного средства, оно может иметь дополнительно элементы фиксации к телу человека.
Изобретение иллюстрируется графическими материалами.
На фиг.1 приведена микрофотография фильтрующего материала AquaVallis - волокна основы (ткань Петрянова ФПА - 15-2,0 из ацетилцеллюлозы), модифицированные пористыми частицами гидрата окиси алюминия.
На фиг.2 приведено схематическое изображение многослойной медицинской подушки (перевязочное средство), где 1-14 слоев материала AquaVallis 2 - слой гидрофобного безворсового термопластичного материала, создающий атравматичный слой подушки и 3 - защитный слой воздухопроницаемого материала.
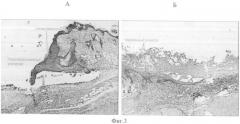
На фиг.3 изображен край кожной раны на 7 сутки наблюдений.
А - Марля. Развиты гнойно-некротический слой, грануляционная ткань. Новообразованный эпителий с явлениями гиперкератоза и акантоза. Отслоение эпителия от подлежащей грануляционной ткани;
Б - Заявленное средство. Наблюдается эпителизация раны с умеренными явлениями гиперкератоза и акантоза. Отмечается отсутствие гнойно-некротического слоя.
На фиг.4 изображен край кожной раны на 21 сутки наблюдений.
А - Марля. Полная эпителизация раны. Незавершенная дифференцировка эпидермиса. Неровный пласт и увеличение толщины эпителия. Гиперкератоз;
Б - Заявленное средство. Более совершенная органотипическая дифференцировка новообразованного эпителия. Созревание грануляционной ткани.
На фиг.5 изображено состояние ран у животных на фоне обсеменения раны St. Aureus.
А - Заявленное средство.
Б - Марля
В дальнейшем изобретение поясняется примерами его конкретного выполнения.
Пример 1. Для изготовления нетканого материала медицинского назначения, обладающего ранозаживляющей, антибактериальной и противовирусной активностью, использовали лист размером 1400×950 мм двухслойного фильтрующего материала AquaVallis, изготовленного на основе ткани Петрянова ФПА - 15-2,0 из ацетата целлюлозы и содержащего 30% частиц гидрата окиси алюминия (фиг.1).
Пример 2. Для получения материала медицинского назначения с атравматичным слоем дополнительно на материал по примеру 1 с обеих сторон наносили методом термопрессования полипропиленовое нетканое полотно с поверхностной плотностью 22 г/м2.
Пример 3. Лист материала по примеру 1 разрезают на прямоугольники требуемых размеров и формируют из них многослойные салфетки (перевязочное средство), состоящие из 6 слоев материала и двух слоев полипропиленового нетканого полотна, расположенного с обеих сторон многослойной салфетки и интегрированного с ее поверхностью методом термопрессования (пример 2).
Пример 4. Для изготовления многослойной подушечки (перевязочное средство) (Фиг.2), состоящей из 14 слоев фильтрующего материала AquaVallis, наносили один слой полипропиленового нетканого полотна (пример 2), расположенного со стороны, предназначенной для наложения на рану, интегрированного с поверхностью фильтрующего материала термопрессованием и защитного фиксирующего слоя из сетчатого трикотажного полиэфирного полотна большего размера с противоположной стороны.
Пример 5. Впитывающую способность изделий в зависимости от толщины слоев на основе фильтрующего материала AquaVallis определяли по массе дистиллированной воды, удерживаемой 1 г образца изделия материала после его полного погружения в воду. Результаты приведены в таблице 1.
| Таблица 1 | ||||
| Характеристика образца | Масса сухого образца, г | Масса влажного образца, г | Впитываемость, г/г | |
| кол-во слоев | размер, см | |||
| 2 | 22,0×9,0 | 1,8 | 32,2 | 18 |
| 6 | 8,0×5,5 | 1,1 | 19,6 | 18 |
| 10 | 7,4×4,6 | 1,6 | 26,2 | 16 |
| 14 | 7,5×4,5 | 2,8 | 34,8 | 12 |
Пример 6. Определение способности заявляемого перевязочного средства оказывать антибактериальный эффект было выполнено in vitro согласно «Методическим рекомендациям по экспериментальному (доклиническому) изучению лекарственных препаратов для местного лечения гнойных ран" (М., 1989, под ред. Доценко). Были использованы бактериальные культуры: Staphylococcus aureus (Стафилококк золотистый) Р-209 и 8538-р, Pseudomonas aeruginosa (Синегнойная палочка) - штамм б/н, Escherichia coli (кишечная палочка), Klebsiella pneumoniae (Клебсиелла пневмонии), Proteys vulgaris (вульгарный протей), Candida albicans (грибы рода Candida). Готовили взвесь суточных культур всех указанных штаммов микроорганизмов в концентрации 2000 микробных тел в 1 мл стерильного физиологического раствора, общий объем 5 мл (6 опытных пробирок для каждого микроорганизма). В каждую опытную пробирку опускали исследуемый стерильный материал (заявляемое перевязочное средство) одинаковых размеров. Контроль: в контрольные пробирки с культурами опускали стерильное базовое средство соответствующего размера (6 пробирок для каждого микроорганизма). Исходная концентрация колониеобразующих единиц во всех опытах составляла 107 КОЕ/мл. Опытные и контрольные пробирки помещали в термостат при 37°С. Через 1 ч, 12 ч, 24 ч, 48 ч из всех пробирок производили высев 0,1 мл бактериальной взвеси на чашки Петри с питательной средой и распределяли по поверхности среды стерильным шпателем. Чашки помещали в термостат на 24 ч. Подсчитывали количество выросших колоний и рассчитывали число колониеобразующих единиц (КОЕ) на 1 мл.
При исследовании антимикробного спектра действия заявленного средства было показано, что при непосредственном контакте заявленное средство оказывало выраженный антимикробный эффект на все группы возбудителей уже через 24 часа (табл.2). Через 72 часа этот эффект сохранялся.
В таблице 2 приведен антимикробный спектр заявляемого перевязочного средства (высеваемость микроорганизмов, выраженное в колониеобразущих единицах - КОЕ)
| Таблица 2 | |||||
| Проба | Микробы | Концентрация микроорганизмов, КОЕ/мл | |||
| 1 ч | 12 ч | 24 ч | 48 ч | ||
| Контроль | St.aureus | 200 | 200 | 200 | 200 |
| №1 | St.aureus | 200 | 200 | 11 | 0 |
| Контроль | P.aeruginosa | 200 | 200 | 200 | 200 |
| №2 | P.aeruginosa | 200 | 152 | 18 | 18 |
| Контроль | E.coli | 200 | 200 | 200 | 200 |
| №3 | E.coli | 200 | 200 | 5 | 6 |
| Контроль | P.vulgaris | 200 | 200 | 200 | 116 |
| №4 | P.vulgaris | 200 | 58 | 0 | 0 |
| Контроль | K.pneumoniae | 200 | 200 | 200 | 130 |
| №5 | K.pneumoniae | 200 | 18 | 10 | 10 |
| Контроль | C.albicans | 200 | 200 | 200 | 154 |
| №6 | C.albicans | 200 | 118 | 63 | 35 |
Пример 7. Вирулицидные свойства изделий на основе фильтрующего материала AquaVallis определяли на примере модельного вируса - колифага MS-2, который широко используется в различных экспериментальных исследованиях как в нашей стране, так и за рубежом. Использовали колифаг MS-2 штамм РН-1505, в качестве супрессибельной культуры использовали E.coli К12 KS507 штамм 3254 F+Str-r. Оба штамма получены из Всероссийской коллекции промышленных микроорганизмов ФГУПГосНИИГенетика. На образец 14-слойного материала в виде диска диаметром 47 мм наносили колифаг путем фильтрования через образец 300 мл водопроводной воды, содержащей колифаг в концентрации 102 БОЕ/100 мл. При этом все колифаги поглощались образцом материала, что устанавливали по отсутствию колифага в фильтрате. Затем исследуемый образец помещали в стерильную чашку Петри и заливали мясо-пептонным агаром, содержащим ТТХ и взвесь E.coli. Инкубировали чашки Петри с образцами при 37°С в течение 24 часов, после чего определяли наличие колифагов в образце по появлению или отсутствию зон лизиса. Отсутствие колифагов в образцах материала указывало на его вирулицидную активность.
Пример 8. В экспериментах на животных использовали многослойное перевязочное средство, полученное из материала по примеру 4, состоящее из 14 слоев фильтрующего материала AquaVallis, одного слоя полипропиленового нетканого полотна, расположенного со стороны, предназначенной для наложения на рану, интегрированного с поверхностью фильтрующего материала термопрессованием и одного защитного фиксирующего слоя из сетчатого трикотажного полиэфирного полотна большего размера с противоположной ране стороне. Деление животных на группы проводилось следующим образом:
1. Группа с экспериментальной раной без лечения (струп с раны снимали через каждые сутки в течение 21 суток) - контроль 1 (20 шт.).
2. Группа с экспериментальной раной с марлевой повязкой (наиболее широко используемый материал) (струп с раны снимали через каждые сутки в течение 21 суток) - контроль 2 (20 шт.).
3. Группа с экспериментальной раной с композиционным перевязочным материалом (струп с раны снимали через каждые сутки в течение 21 суток) - опыт (20 шт.).
Влияние перевязочного средства на заживление раневого дефекта изучали на модели “кожного лоскута” [1]. На депилированном участке спины у мышей под эфирным наркозом вырезали лоскут кожи размером 10×10 мм. Для моделирования более длительного заживления струп с экспериментальной раны регулярно (через каждые сутки) удаляли. Критериями развития патологического процесса служили следующие показатели: общее состояние животных, визуальная оценка состояния самого дефекта и окружающей ткани, средний диаметр раны, число животных (%) с зажившими ранами, ускорение сроков заживления (УСЗ = время полного заживления ран в контроле - время полного заживления ран в опыте/время полного заживления ран в контроле × 100%), число животных (%) с вокализацией при снятии струпа с раны, анализ морфологической структуры раневого дефекта. Все экспериментальные манипуляции совершались в первой половине светового дня.
Для гистологического исследования забирали участок кожи с нанесенной раной, фиксировали в 10% формалине, заливали в парафин и изготавливали вертикальные срезы толщиной 7 мкм через все слои раны. Депарафинированные срезы окрашивали гематоксилином и эозином и пикрофуксином на соединительную ткань. Морфометрическую оценку результатов проводили методом компьютерного графического анализа с использованием микровидеокамеры “Digital micro” с программой передачи изображения на компьютер фирмы «Элекард» (Томск). На стандартной площади гистологического среза кожи в зоне грануляционной ткани измеряли площадь кровеносных сосудов на препаратах, окрашенных гематоксилином и эозином, и площадь коллагеновых волокон на препаратах, окрашенных по Ван-Гизону. Толщину новообразованного эпидермиса измеряли с помощью окуляр-микрометра.
Статистическую обработку полученных результатов проводили с использованием параметрического (критерий Стьюдента) и непараметрического (критерий Вилкоксона) методов. Для сравнения результатов экспериментов, где показатели выражались в долях, достоверность определяли с помощью метода углового преобразования Фишера. Значимость различий считали достоверной при Pt, Pu, Pφ≤0,05 [2].
Применение перевязочного средства способствовало достоверному уменьшению (на 79%) среднего диаметра ран на 14-е сутки наблюдения в сравнении с контролем 2, где животным наносили марлевую повязку. Ускорение сроков заживления (УСЗ) под влиянием заявленного средства составило 11% как в сравнении с контролем 1 (без лечения), так и в сравнении с марлей (контролем 2) (табл.3). Из полученных данных также следует, что к 14 суткам у 73,3% животных опытной группы наблюдалось полное заживление ран, в то время как в контрольной группе 1 (без лечения) таких животных в 1,6 раз было меньше. В виде отчетливой тенденции зафиксировано различие этого показателя с контролем 2 (марля), только у 53,8% животных этой группы зафиксировано полное заживление ран в этот срок.
Интересные данные были получены при регистрации вокализации при удалении струпов с ран. Достоверные различия на 5-е сутки наблюдения зафиксированы с контролем 1 (без лечения) - в 1,9 раз было меньше животных в опытной группе, которые издавали писк при удалении струпа. На 7 и 9 сутки эти различия зафиксированы в сравнении с контролем 2 (базовое средство) - в 1,9 и 5,7 раз соответственно было меньше животных с вокализацией. Этот факт свидетельствует о том, что мыши, которым на рану наносили заявленное средство, испытывали меньшую болевую реакцию при удалении струпа, чем мыши с марлевой повязкой.
| Таблица 3 | ||||||||||
| Группа животных | Число животных | Средний диаметр раны (мм) | ||||||||
| Сутки наблюдения | ||||||||||
| 1-е | 3-е | 5-е | 7-е | 9-е | 11-е | 14-е | 16-е | 18-е | ||
| Контроль 1 (без лечения) | 19 | 12,5±0,2 | 10,4±0,3 | 9,3±0,3 | 8,4±0,4 | 6,6±0,4 | 5,3±0,4 | 1,1±0,4 | 0,2±0,1 | 0 |
| Контроль 2 (марля) | 20 | 12,4±0,2 | 10,6±0,3 | 9,3±0,4 | 8,6±0,5 | 7,1±0,4 | 5,1±0,5 | 1,4±0,5 | 0,5±0,2 | 0 |
| Заявленное средство | 21 | 12,5±0,1 | 10,2±0,3 | 9,3±0,2 | 9,0±0,3 | 7,3±0,3 | 4,4±0,4 | 0,3±0,1∗ | 0 | |
| ПРИМЕЧАНИЕ: * - различия статистически достоверны в сравнении с контролем 2 при Pu,t<0,05. |
Гистологические исследования продемонстрировали преимущества заявленного перевязочного средства уже на седьмой день использования (фиг.3). У мышей с повязкой из заявляемого перевязочного средства на 14 сутки опыта произошла практически полная эпителизация кожной раны. Пласт новообразованного эпителия - такой же толстый и неровный, как при использовании марлевой повязки, но явления акантоза и гиперкератоза выражены в значительно меньшей степени. На 21 сутки опыта полная эпителизация кожной раны произошла у мышей всех групп. Однако степень органотипической дифференцировки эпидермиса в контрольных группах и при использовании заявленного средства - различная. Новообразованный эпителий при использовании прототипа остается неодинаковым по толщине на всем протяжении. Сохраняются явления гиперкератоза (фиг.4). У мышей с повязкой из заявленного средства в этот срок наблюдения пласт эпителиальных клеток более тонкий и ровный. Толщина рогового слоя достоверно меньше, чем при использовании марлевой повязки. В этой же группе происходит более активное созревание грануляционной ткани. В ней достоверно уменьшается относительная площадь кровеносных сосудов - они дифференцируются в артерии и вены и увеличивается относительная площадь коллагеновых волокон. Результаты проведенного исследования позволили установить, что заявленное средство оказывает положительное влияние на заживление кожной лоскутной раны, сокращая сроки заживления раневого повреждения, увеличивая количество животных с полной эпителизацией раневого дефекта, снижая количество животных с вокализацией. Заявляемый перевязочный материал приводит к более совершенной органотипической дифференцировке образующегося эпидермиса и ускоряет созревание грануляционной ткани.
Проводили также бактериологический анализ гнойного отделяемого инфицированной раны. Животным под наркозом выполнялось бритье кожи на спинке в межлопаточной области. В это место вводилось по 1 мл взвеси бактерий золотистого стафилококка и синегнойной палочки в дозе по 5×108 КОЕ/мл. Через сутки производилось вскрытие полостей абсцессов, посевы из ран с помощью тампонов, введение в полости заявленного средства (по 5 крыс в группе) и марлевых шариков (по 5 крыс в группе), аналогичных по объему. Раны ушивались наглухо. Визуальная оценка, взятие материала для микробиологического исследования, смена заявляемого перевязочного средства и марлевых шариков выполнялись на следующие сутки, через 3 и 7 суток. Анализ гнойного отделяемого инфицированной раны проводили путем высева тампоном на чашки Петри с кровяным агаром. Чашки помещали в термостат при 37°С, через сутки оценивали интенсивность роста бактерий с последующим микроскопическим контролем. Показано, что антибактериальное действие было выражено в течение первых трех суток (табл.4). Таким образом установлено, что заявленное средство обладает антибактериальным и противогрибковым действием. Начало эффекта регистрируется спустя 12 ч после контакта заявляемого средства с микроорганизмами (синегнойная палочка, протей, клебсиелла пневмонии, кандида) и отчетливо выражено к 24-48 часам исследования (стафилококк, кишечная палочка). В таблице 4 приведена высеваемость бактерий из отделяемого раны экспериментальных животных (крыс), зараженных S.aureus и P.aeroginosa
| Таблица 4 | ||||
| № | Проба | 1 сут | 3 сут | 7 сут |
| 1 | S.aureus + заявленное средство | 0 | 0 | 300 |
| 2 | S.aureus + марля | 1 | >300 | >300 |
| 3 | Ps.aerug + заявленное средство | 120 | 0 | 0 |
| 4 | Ps.aerug + марля | 500 | 500 | 300 |
При использовании заявленного средства в качестве перевязочного материала наблюдается снижение бактериальной обсемененности в ране на 3-4 сутки, что особенно показательно при инфицировании синегнойной палочкой. Можно предположить, что механизм данного эффекта связан с сорбционными свойствами материала. Способность заявляемого средства оказывать антибактериальный эффект по отношению к возбудителям гнойно-воспалительных процессов (стафилококк, синегнойная палочка, протей) делает возможным его использования в качестве основы для перевязочного материала в гнойной хирургии. Антимикотический эффект (таблица 2) по отношению к грибку Кандида может быть использован в гинекологической практике и для местного лечения кандидомикоза (молочницы) у детей.
Исследование ранозаживляющего действия перевязочного средства in vivo на модели гнойной раны проводили согласно [3]. Эксперименты проведены на 15 белых беспородных половозрелых крысах-самцах массой 300-350 г разводки питомника «Рассвет». Содержание животных осуществлялось в соответствии с Приказом №267 от 19 июня 2003 г. «Об утверждении правил лабораторной техники» и правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). Экспериментальные животные содержались в стандартных условиях типового вивария в пластиковых клетках (по одной особи в клетке) на подстилке из опилок в условиях свободного доступа к воде и пище (стандартный рацион) при естественном световом режиме. Распределение животных в данной серии экспериментов проводилось следующим образом:
Группа №1. Раны, инфицированные St.aureus - заявленное средство (4 крысы);
Группа №2. Раны инфицированные St.aureus - марля (4 крысы);
Группа №3. Раны, инфицированные Ps.aerogynosa - заявленное средство (4 крысы);
Группа №4. Раны, инфицированные Ps.aerogynosa - марля (3 крысы).
Задача наблюдения: сравнительная оценка влияния заявленного средства и стерильной марли на степень микробной обсемененности инфицированной раны St.aureus и Ps.aerogynosa в динамике 4-7 дней и визуально оцениваемые параметры состояния ран в динамике 1-7 дней.
Животным из всех групп под эфирным наркозом в асептических условиях операционной после эпиляции шерсти в межлопаточной области наносились резаные округлые плоскостные кожные раны скальпелем путем снятия дермы до сосочкового слоя и появления стойкой кровянистой росы диаметром 20 мм и площадью, равной 3,14±0,31 см2. Перед дальнейшими манипуляциями крысы отсаживались и содержались в течение всего эксперимента в клетках по одной особи, чтобы предотвратить взаимное разгрызание повязок. Для моделирования гнойной раны животным групп №1 и №2 на полученные раны наносили по 1 мл взвеси суточных агаровых культур бактерий St. aureus штамма 638П в разведении 104 (50 млн×мл), а животным групп №3 и №4 Ps.aerogynosa штамма б/н в разведении 104 (50 млн×мл). Через 2 часа после обсеменения раны и в последующем ежесуточно (1 раз в сутки, в одно и тоже время) в течение 7 дней на раны накладывались кусочки из заявленного средства (по размеру и форме раны) или тампоны из стерильной марли соответственно. Ежедневно проводили визуальную оценку раневой поверхности, определяли характер и фазу раневого процесса. На 4, 5, 6 и 7-е сутки после нанесения раны (после появления гнойного инфильтрата у животных контрольных групп) проводили забор материала (мазки со дна раны, гнойное отделяемое) из инфицированной раны для бактериологического анализа путем высева на питательные среды с микроскопическим контролем. При исследовании ранозаживляющего действия на модели гнойной раны было показано, что к 7 суткам от начала подкожного размещения перевязочных материалов развивается защитная воспалительная реакция как на базовое (марля), так и на заявленное средство. Однако эта реакция менее выражена в присутствии заявляемого материала. В эти же сроки наблюдения инфицированные раны с заявляемым средством стали более чистыми, без неприятного специфического запаха и гноя, который стал более выраженным в ранах с марлей. Дно раны было выполнено розовыми грануляциями, некротические ткани и гнойное воспаление представлено ободком в 3-5 мм у края композиционного материала (фиг.5).
Таким образом, заявленное средство обладает выраженными ранозаживляющими и антибактериальными