Способ извлечения брома из природных вод с получением бромидов металлов
Иллюстрации
Показать всеИзобретение может быть использовано в химической технологии неорганических веществ. Способ извлечения брома из природных вод с получением бромидов металлов включает окисление бромида до элементного брома хлором и отделение брома от исходного раствора. Хлор, используемый для окисления бромид-иона, получают анодным разложением хлоридной соли в двух двухкамерных электролизерах, разделенных катионообменной мембраной. Бром отделяют от исходного раствора отдувкой, экстракцией, сорбцией. После этого извлекают бром из фазы носителя ее контактом с оборотным католитом, который затем подают в первый - основной электролизер, где восстанавливают на катоде бром с выделением бромида металла одноименной хлоридной соли. Катод второго -вспомогательного электролизера, используют для разложения воды с выделением водорода в количестве, эквивалентном количеству кислорода, образующегося при анодном получении хлора. Изобретение позволяет получать бромиды металлов с использованием в качестве исходных реагентов дешевых хлоридов соответствующих металлов и устранить использование восстановителей брома. 3 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области химической технологии неорганических веществ и касается получения бромидов металлов, в частности лития, натрия, калия и кальция.
Известен и широко используется на практике способ извлечения брома из природных вод с получением бромидных солей железа. Процесс заключается в окислении бромид-иона элементным хлором, отгонке выделяющегося брома воздухом или паром и поглощении брома из газовой фазы раствором бромида железа(II) (Ксензенко В.И., Стасиневич Д.С. Химия и технология брома, йода и их соединений. М.: Химия, 1995). Метод прост и эффективен, однако ограничен получением только солей железа. Для получения бромидов других металлов он не пригоден.
Ряд способов основан на реакциях брома с гидроокисями, окисями и карбонатами металлов в присутствии восстановителей. Предварительно бром извлекают из природной воды окислением хлором и отгонкой. В частности, для получения бромида кальция предложено смешивать известковое молоко с элементным бромом, а в качестве восстановителей использовать аммиачную воду или мочевину (А.с. СССР №138232, от 1961.01.01, А.с. СССР №1279965, от 1986.12.30). Известны способы получения бромистого лития путем взаимодействия гидроксида лития (А.с. СССР №162517, от 1964.01.01) или карбоната лития (А.с. СССР №929557, от 1982.05.23 и №1038282, от 1983.08.30) с жидким бромом в присутствии перекиси водорода (А.с. СССР №162517, от 1964.01.01 и №929557, от 1982.05.23) или аммиачной воды (А.с. СССР №1038282, от 1983.08.30), которые используются в качестве восстановителей брома. Недостатками этих способов являются использование дорогостоящих гидроокисей (при получении бромидов щелочных металлов) и восстановителей брома, а также многостадийность процесса, обусловленная промежуточными стадиями выделения и очистки жидкого брома.
Наиболее близким к предлагаемому изобретению является способ получения бромидов путем поглощения брома непосредственно из бромовоздушной смеси щелочными растворами, содержащими восстановитель, что позволяет получать бромиды, минуя стадию выделения элементарного брома в полупродукт (Ксензенко В.И., Стасиневич Д.С. Химия и технология брома, йода и их соединений. М.: Химия, 1995). В качестве восстановителя предлагается использовать аммиак, формальдегид, карбамид, уротропин и др. Недостатками процесса по этому способу является использование дорогостоящих щелочных реагентов и восстановителей брома.
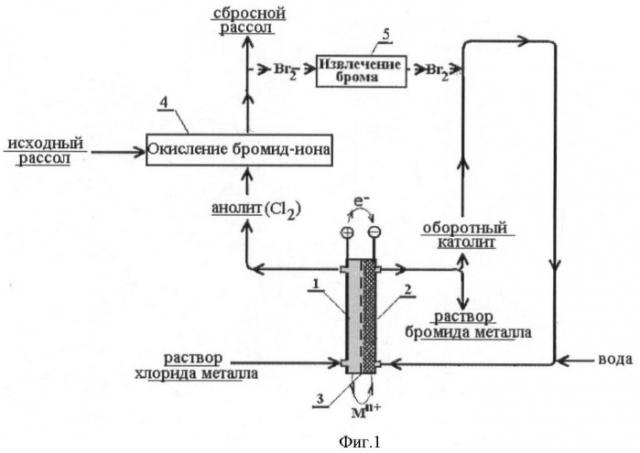
Предлагаемое изобретение направлено на разработку процесса получения бромидов металлов с использованием в качестве исходных реагентов дешевых хлоридов соответствующих металлов и устранение использования восстановителей брома. Поставленная задача решается путем генерирования элементарного хлора в анодном пространстве двухкамерного электролизера, разделенного катионообменной мембраной, окисления бромид-иона полученным хлором, межфазного переноса брома из природной воды в оборотный католит (отдувкой, экстракцией, сорбцией), восстановления элементарного брома на пористом катоде с одновременной доставкой требуемого катиона из анодного пространства в катодное электромиграцией через катионообменную мембрану. Для обеспечения получения требуемой бромидной соли в анодное пространство подается соответствующий хлорид металла.
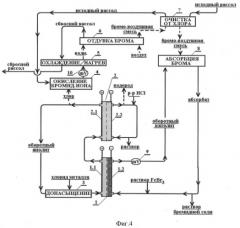
Принципиальная схема процесса приведена на фиг.1.
На первой стадии при использовании хлоридной соли МСln на аноде реализуется окислительный процесс (1):
окисление на аноде:
При продувке элементарного хлора через бромсодержащее сырье выделяется эквивалентное количество брома (2):
окисление бромид-иона:
Получение бромида соответствующего металла (МBrn) осуществляется в катодном пространстве электролизера путем межфазной транспортировки брома из фазы рассола в фазу католита (3), транспорта катиона Мn+ через катионообменную мембрану электромиграцией (4) и катодного восстановления брома (5):
межфазный перенос брома:
транспорт катиона (электромиграция)
восстановление на катоде:
Для повышения эффективности поглощения брома католитом, например при использовании извлечения брома воздушной отдувкой, в католит может быть добавлено небольшое количество бромида железа. В этом случае эффективность поглощения брома обеспечивается за счет протекания реакции окисления железа(II):
которое регенерируется затем на катоде по реакции (7):
Относительное количество бромида железа в оборотном католите (бромидном концентрате) невелико (0,05-0,1 моль/л, при содержании бромид-иона 4-6 моль/л). При необходимости бромный концентрат очищают от железа экстракцией трибутилфосфатом и реэкстракцией его водой.
Поскольку выходы по току реакций катодного восстановления брома и железа(III) близки к 100%, а анодного окисления хлора - к 91-93%, то для избежания осложнений, связанных с выделением водорода на пористом катоде, предложено окислительно-восстановительный процесс проводить в 2-х электролизерах. В основном электролизере-1 обеспечивают катодное восстановление брома (бромида железа), а в электролизере-2 - катодное разложение воды с выделением водорода, компенсирующее анодное выделение кислорода (фиг.2-4). Суммарный ток на электролизерах поддерживается на уровне, обеспечивающем полное окисление брома в природной воде, и контролируется по окислительно-восстановительному потенциалу природной воды после окисления брома хлором. Величина тока на основном электролизере-1 определяется полнотой катодного восстановления брома до бромид-иона и контролируется по изменению состава оборотного католита.
Пример 1. Электрохимическое получение бромида калия с применением экстракции брома
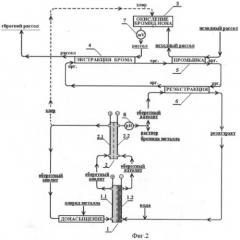
Общая схема установки для проведения процесса приведена на фиг.2. Она включает два проточных двухкамерных электролизера - основной (1) и компенсирующий (2), смеситель хлора с природной водой для окисления брома (3), лабораторные экстракторы типа «смеситель-отстойник» для проведения процессов экстракции брома (4), промывки (5) и реэкстракции (6), дозирующие лабораторные насосы.
В качестве анода электролизеров используют титановую пластину толщиной 3 мм с нанесенным покрытием ОРТА (поз. 1.1 и поз. 2.1), площадь электродов 10 см2, в основном электролизере (1) используют углеграфитовый пористый катод (поз. 1.2) (ватин, толщина электрода 5 мм, площадь контакта с мембраной 10 см2), а во вспомогательном электролизере (2) - углеродный гладкий катод (поз. 2.2). Катодные и анодные пространства электролизеров разделяют катионообменной мембраной МК-40 (площадями, соответственно, по 10 см2). Расстояние между электродами составляет 3-4 мм.
Объем камеры смешения экстракторов составляет 60 мл, камеры отстоя - 300 мл. В качестве экстрагента используют промышленный растворитель РЭД-2, представляющий собой смесь предельных углеводородов.
Процесс извлечения брома и получения бромида калия проводят в непрерывном режиме. С этой целью в анодное пространство электролизера (1) и далее электролизера (2) подают раствор хлорида калия с концентрацией 3,5-3,7 М и добавкой 0,2 М НСl со скоростью 700 мл/ч. Выделившийся хлор направляют на окисление брома (3), а раствор донасыщают хлоридом калия и вновь направляют на электролитическое разложение. Исходный хлоридный рассол Сухотунгусского месторождения (Красноярский край), состава: Na+ - 63 г/л; К+ - 15 г/л; Са2+ - 56 г/л; Mg2+ - 7 г/л; Вr- - 4,3 г/л, подкисляют соляной кислотой до концентрации 0,1 М и подают со скоростью 700 мл/ч на стадию промывки бромного экстракта (5) (двухступенчатая очистка экстракта от примесей хлора) и далее смешивают с хлором в смесителе (3). После окисления бромид-иона хлором бром экстрагируют из рассола в трехступенчатом аппарате. После промывки экстракта исходным рассолом бром реэкстрагируют из органической фазы оборотным католитом, содержащим 5 М бромида калия и 0,1 М НBr. Процесс проводят в пятиступенчатом противоточном аппарате. Глубину окисления бромид-иона контролируют по величине окислительно-восстановительного потенциала рассола (7) увеличивая или уменьшая величину тока на электролизере (1). Скорость выделения водорода на электролизере (2) регулируют величиной тока при условии, что I1+I2=const. Контроль за стехиометрией выделения кислорода и водорода на катоде и аноде осуществляют по величине рН раствора католита (8). Повышение рН раствора свидетельствует о более интенсивном выделением водорода, чем кислорода, и, наоборот, рост кислотности - о пониженной интенсивности катодного выделения водорода. Соответственно, в первом случае - уменьшают ток I2 компенсационного электролизера, а во втором случае - ток увеличивают.
Показана возможность устойчивой работы системы с поддержанием постоянного значения рН католита и глубокого восстановления брома.
Получены следующие показатели по данному способу извлечения брома с получением бромидов металлов (бромида калия).
Извлечение брома - 90%.
Напряжение на основном электролизере U(1) - 1,6 В.
Ток на основном электролизере I(1) - 1,35 А.
Напряжение на компенсирующем электролизере U(2) - 3,0 В.
Ток на компенсирующем электролизере I(2) - 0,05 А.
Удельные затраты электроэнергии - 385 кВт·ч/т бромида калия.
Удельный расход хлорида калия - 0,63 т/т бромида калия.
Пример 2. Электрохимическое получение бромидов натрия и лития с применением экстракции брома и его реэкстракции оборотным католитом, содержащим соли железа
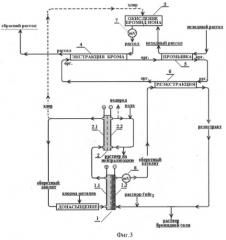
Процесс проводили по схеме, представленной на фиг.3. Применение добавок железа в оборотном католите позволяет снизить число ступеней реэкстракции брома с пяти до одной. Для предотвращения возможного выделения гидроксидов железа на пористом катоде изменяют схему циркуляции оборотного католита в основном и компенсирующем электролизерах: оборотный бромидный железосодержащий католит после восстановления в основном электролизере (1) сразу направляют на реэкстракцию брома, а щелочной католит компенсирующего электролизера (2) - в оборот, в катодное пространство того же аппарата. По мере накопления щелочи в оборотном католите компенсирующего электролизера (2), обусловленного выделением водорода, часть оборотного щелочного католита выводят из оборота и заменяют водой. Контроль за процессом окисления бромид-иона осуществляют поддержанием необходимого окислительно-восстановительного потенциала рассола на выходе его со стадии окисления брома (7), посредством изменения суммарной величины тока на двух электролизерах (общего потока хлора). Регулирование процесса восстановления обеспечивают поддержанием постоянства окислительно-восстановительного потенциала католита на выходе из основного электролизера (постоянства соотношения концентраций Fe3+/Fe2+) за счет изменения величины тока на основном электролизере (1). При работе установки в стационарном режиме в электролизере (1) восстанавливают катионы железа(III) в количестве, эквивалентном поступающему брому, а процесс попутного разложения воды с выходом водорода 5-8% от общего тока реализуют в компенсирующем электролизере (2). В остальном процесс проводят, как и ранее (пример 1): бром экстрагируют за 3 ступени растворителем РЭД-2, промывку экстракта осуществляют исходным рассолом на 2-х ступенях, при равном соотношении величин потоков водного и органического растворов.
Проведены лабораторные испытания процессов получения бромидов натрия и лития при извлечении брома из хлоридно-кальциевых рассолов Якутии (карьерная вода кимберлитовой тр. «Удачная»), состава: Na+ - 25 г/л; К+ - 12,9 г/л; Са2+ - 67 г/л; Mg2+ - 15,8 г/л; Br- - 3,2 г/л, хлоридно-кальциевых рассолов Якутии, содержащих 3,2 г/л брома. При получении этих продуктов установка работала в непрерывном режиме. Производительность по рассолу составляла 700 мл/ч.
В качестве исходного оборотного католита используют растворы состава:
для электролизера (1) - 0,1 М FeBr3; 0,1 M HBr,
для электролизера (2) - 0,2 М НВr.
В качестве анолита используют:
при получении бромида натрия - раствор 5-5,3 М NaCl,
при получении бромида лития - раствор 5-6 М LiCl.
На заключительной стадии бромиды очищают от примесей железа экстракцией 80% раствором трибутилфосфата в керосине за три ступени. Бромид железа реэкстрагируют из органической фазы за 1 ступень. Процесс проводят при O:В=1:1.
Для получения бромидов металлов (натрия и лития) по предлагаемому варианту получены следующие показатели процесса.
Показатели процессов получения:
бромида натрия:
| Содержание основных примесей в безводном бромиде натрия (%) | ||||
| хлор | калий | магний | кальций | барий |
| 0,35 | 0,0075 | 0,004 | 0,02 | 0,004 |
Извлечение брома - 91%.
Конечная концентрация бромида натрия в продукте (католите) - 5 М (520 г/л), содержание Fe3+<5 мг/л.
Напряжение на основном электролизере U(1) - 2,1 В.
Ток на основном электролизере I(1) - 0,9-1,05 А.
Напряжение на компенсирующем электролизере U(2) - 3,5 В.
Ток на компенсирующем электролизере I(2) - 0,1-0,12 А.
Удельные затраты электроэнергии - 650 кВт·ч/т бромида натрия.
Удельный расход хлорида натрия - 0,64 т/т бромида натрия.
бромида лития:
| Содержание основных примесей в безводном бромиде лития(%) | |||
| хлор | калий | магний | кальций |
| 0,8 | 0,0335 | 0,033 | 0,088 |
Извлечение брома - 90%.
Концентрация бромида лития в продукте до упарки и кристаллизации - 4 M (350 г/л), содержание Fe3+<5 мг/л.
Напряжение на основном электролизере U(1) - 3,6 В.
Ток на основном электролизере I(1) - 0,99 А.
Напряжение на компенсирующем электролизере U(2) - 3 В.
Ток на компенсирующем электролизере I(2) - 0,1-0,12 А.
Удельные затраты электроэнергии - 1200 кВт·ч/т бромида лития.
Удельный расход хлорида лития - 0,48 т/т бромида лития.
Проведенные испытания по получению бромида натрия показали, что процесс протекает с высокой стабильностью и легко управляется путем изменения общей величины тока электролиза и соотношения токов на электролизерах в зависимости от величин окислительно-восстановительных потенциалов рассола и оборотного католита.
Пример 3. Электрохимическое получение бромида кальция с применением отдувки брома и его поглощения оборотным католитом, содержащим соли железа
Принципиальная схема проведения процесса (фиг.4) аналогична примеру 2. Однако в этом случае вместо экстракции брома используют отдувку брома воздухом (6) в вертикальной стеклянной колонне высотой 1,5 м, снабженной 5 тарелками. Процесс проводят при 50-60°С. Далее парогазовую фазу, также как и органический экстракт, очищают от примесей хлора промывкой исходным рассолом (7). Бром адсорбируют католитом, содержащим катионы железа(2+) в колонне высотой 1 м, снабженной 3 тарелками. В отличие от получения бромидов щелочных металлов в катодную камеру компенсирующего электролизера (2) подают раствор соляной кислоты, для предотвращения образования осадков гидроокиси кальция.
Проведены лабораторные испытания процессов получения бромида кальция при извлечении брома из хлоридно-кальциевых рассолов Якутии, содержащих 3,2 г/л брома. Производительность по рассолу, а также потоки католитов в электролизерах (1) и (2) составляли по 700 мл/ч.
В качестве исходного оборотного католита используют растворы состава:
для электролизера (1) - 0,1 М FeBr3; 0,1 M HBr,
для электролизера (2) - 2 М НСl.
В качестве анолита используют раствор хлорида кальция с концентрацией 3 М (330 г/л).
Полученный бромид кальция очищают от примесей железа трехступенчатой экстракцией 80% раствором трибутилфосфата в керосине, как и ранее (пример 2).
Показатели процесса получения бромида кальция
Извлечение брома - 89%.
Содержание бромида кальция в растворе (католит электролизера-1) - 400 г/л, содержание Fe3+<5 мг/л, остальных примесей - не более 2%.
Напряжение на основном электролизере U(1) - 3,2 В.
Ток на основном электролизере I(1) - 0,99 А.
Напряжение на компенсирующем электролизере U(2) - 3 В.
Ток на компенсирующем электролизере I(2) - 0,1-0,12 А.
Удельные затраты электроэнергии - 950 кВт·ч/т бромида кальция.
Удельный расход хлорида кальция - 0,56 т/т бромида кальция.
Удельный расход соляной кислоты (31%) - 0,1 т/т бромида кальция.
Таким образом, предлагаемый способ позволяет извлечь бром из природных хлоридных вод не менее чем на 89-91% и получить индивидуальные бромиды (лития, натрия, калия, кальция) с использованием в качестве основных реагентов хлоридов соответствующих металлов, расходуемых в количестве 0,48-0,64 т на 1 т бромидов.
При получении хлора традиционным электрохимическим методом расход электроэнергии на 1 т хлора составляет 2800-2900 кВт·ч или в пересчете на 1 т брома 1240-1290 кВт·ч, что определяется напряжением на электролизере около 3,6 В. Получение хлора и далее бромидов по предлагаемому способу при одновременном катодном восстановлении брома требует расхода электроэнергии на получение хлора от 1290 до 2900 кВт·ч или 570-1290 кВт·ч при пересчете на бром в солях, т.е для ряда солей почти в 2 раза ниже, чем по традиционному способу. Это обусловлено снижением напряжения при электролитическом разложении хлоридов за счет замены катодного разложения воды (получение хлора по традиционному способу) на катодное восстановление элементного брома или катионов железа(III) (предлагаемый способ). При этом перевод брома до его солей осуществляется без применения реагентов-восстановителей.
Перечень чертежей
Фиг.1 Принципиальная схема получения индивидуальных бромидов металлов при переработке бромсодержащих природных вод.
Фиг.2 Схема электрохимического получения бромидов металлов с применением экстракции брома и прямого восстановления брома на катоде (к примеру 1).
Фиг.3 Схема электрохимического получения бромидов металлов с применением экстракции брома и катодного восстановления катионов железа(III) (к примеру 2).
Фиг.4 Схема электрохимического получения бромидов металлов с применением воздушной отдувки брома и катодного восстановления катионов железа(III) (к примеру 3).
1. Способ извлечения брома из природных вод с получением бромидов металлов, включающий окисление бромида до элементного брома хлором, отделение брома от исходного раствора, отличающийся тем, что хлор, используемый для окисления бромид-иона, получают анодным разложением хлоридной соли в двух двухкамерных электролизерах, разделенных катионообменной мембраной, бром отделяют от исходного раствора отдувкой, экстракцией, сорбцией, извлекают бром из фазы носителя ее контактом с оборотным католитом, который затем подают в первый - основной электролизер, где восстанавливают на катоде бром с выделением бромида металла одноименной хлоридной соли, а катод второго - вспомогательного электролизера, используют для разложения воды с выделением водорода в количестве, эквивалентном количеству кислорода, образующегося при анодном получении хлора.
2. Способ по п.1, отличающийся тем, что в католит добавляют галогенид железа до общей концентрации железа 5-10 г/л.
3. Способ по п.2, отличающийся тем, что галогенид железа регенерируют и возвращают в процесс путем извлечения из бромидного раствора экстракцией трибутилфосфатом и реэкстракцией водой.
4. Способ по п.1, отличающийся тем, что для компенсации части католита, выводимого из оборота вспомогательного электролизера, в его катодное пространство подают воду или соляную кислоту.